Psoríase, doença crônica e inflamatória cutânea, requer terapia de longo prazo. Risanquizumabe é anticorpo monoclonal de imunoglobulina G1 humanizado que inibe especificamente a interleucina 23 ao se ligar à sua subunidade p19.
ObjetivoForam avaliadas a eficácia e a segurança do risanquizumabe em comparação com o metotrexato em adultos com psoríase em placas de grau moderado a acentuado.
MétodosO IMMbrace foi um estudo de fase 3, multicêntrico, randomizado, duplo‐cego, duplo‐dummy e controlado ativamente. Os pacientes receberam risanquizumabe subcutâneo 150mg nas semanas 0, 4 e 16 mais placebo oral semanalmente, ou metotrexato oral 5mg semanalmente (com aumento de dose até 25mg com base na resposta e tolerabilidade) mais placebo subcutâneo nas semanas 0, 4 e 16. Os endpoints primários de eficácia foram as proporções de pacientes que atingiram ≥ 90% de melhora no Psoriasis Area and Severity Index (PASI90) e na static Physician's Global Assessment de eliminação total/quase total da doença na pele (sPGA 0/1) na semana 28. A segurança também foi avaliada.
ResultadosEntre 98 pacientes randomizados (risanquizumabe, n=50; metotrexato, n=48), 95 completaram o período duplo‐cego. Na semana 28, proporções significantemente maiores de pacientes tratados com risanquizumabe versus metotrexato atingiram PASI90 (84,0% vs. 35,4%; p <0,001); sPGA 0/1 foi alcançado por 90,0% e 64,6% dos pacientes nos grupos risanquizumabe e metotrexato (p ≤ 0,001), respectivamente. A eficácia do risanquizumabe foi mantida até a semana 112. As taxas de eventos adversos foram semelhantes nos dois grupos.
Limitações do estudoO tamanho da amostra foi pequeno em virtude da dificuldade de recrutar pacientes sem uso de metotrexato.
ConclusõesO risanquizumabe demonstrou eficácia superior ao metotrexato na semana 28. A eficácia foi mantida e nenhum novo achado de segurança foi observado até a semana 112.
A psoríase é doença inflamatória crônica da pele, imunomediada, que causa placas eritematosas e descamativas com redução da qualidade de vida.1,2 A prevalência estimada no Brasil varia de 1,1% a 1,5%, com os maiores indicadores sendo encontrados nas regiões Sul e Sudeste.3 O manejo da psoríase moderada a grave inclui o controle da atividade da doença, minimizando os efeitos colaterais relacionados ao tratamento. O metotrexato tem sido amplamente utilizado como terapia sistêmica e tem sido o padrão de tratamento para o manejo da psoríase no Brasil por décadas; entretanto, o metotrexato está associado a várias complicações, incluindo anormalidades gastrintestinais, hepáticas, renais e hematopoiéticas.4–6 A crescente compreensão da patogênese da doença levou a novos agentes biológicos alvo‐específicos, incluindo antagonistas da interleucina 23 (IL‐23).7
Risanquizumabe, anticorpo monoclonal de imunoglobulina G1 humanizado que se liga à subunidade p19 para inibir especificamente a IL‐23,8 demonstrou eficácia clínica superior em comparação ao placebo na semana 169–11 e em comparação com outros tratamentos para psoríase, incluindo ustequinumabe,10 adalimumabe12 e secuquinumabe.13 Risanquizumabe é aprovado no Brasil (desde setembro de 2020) e em muitos outros países para tratar pacientes adultos com psoríase em placas moderada a grave.14 Entretanto, até o momento, nenhum estudo clínico comparou risanquizumabe com agentes sistêmicos tradicionais, como o metotrexato. O presente estudo relata os resultados do primeiro ensaio clínico de fase 3b comparando a segurança clínica e a eficácia de risanquizumabe com metotrexato em adultos com psoríase em placas moderada a grave após a aprovação do risanquizumabe no Brasil.
MétodosPacientesOs pacientes elegíveis eram adultos com idade ≥ 18 anos com histórico ≥ seis meses de psoríase em placas moderada a grave, definida como envolvimento ≥ 10% da área de superfície corporal; Psoriasis Activity and Severity Index (PASI) ≥ 12; e escore no static Physician Global Assessment (sPGA) ≥ 3. Os pacientes eram candidatos ao tratamento com metotrexato de acordo com a classificação local e não apresentavam achados clinicamente significantes na radiografia de tórax. Os pacientes não eram elegíveis para o estudo se tivessem outras formas de psoríase diferentes de placas (incluindo gutata, eritrodérmica ou pustulosa), psoríase induzida por medicamentos, evidência de infecções crônicas ou agudas relevantes (incluindo HIV, hepatite viral e/ou tuberculose), neoplasia maligna em atividade ou suspeita ou histórico de neoplasia maligna em até cinco anos antes da triagem, quaisquer outras condições médicas relevantes (p. ex., abuso crônico de álcool ou drogas, transplante de órgãos, valores laboratoriais clínicos anormais, histórico de hipersensibilidade à terapia com biológicos administrada sistemicamente) ou doenças inflamatórias ativas em atividade que pudessem confundir as avaliações do estudo de acordo com o julgamento dos investigadores. Mulheres em idade fértil e todos os homens foram obrigados a usar contraceptivos durante o estudo e por pelo menos 20 semanas (para mulheres) ou três meses (para homens) após a última dose de metotrexato/placebo de metotrexato.
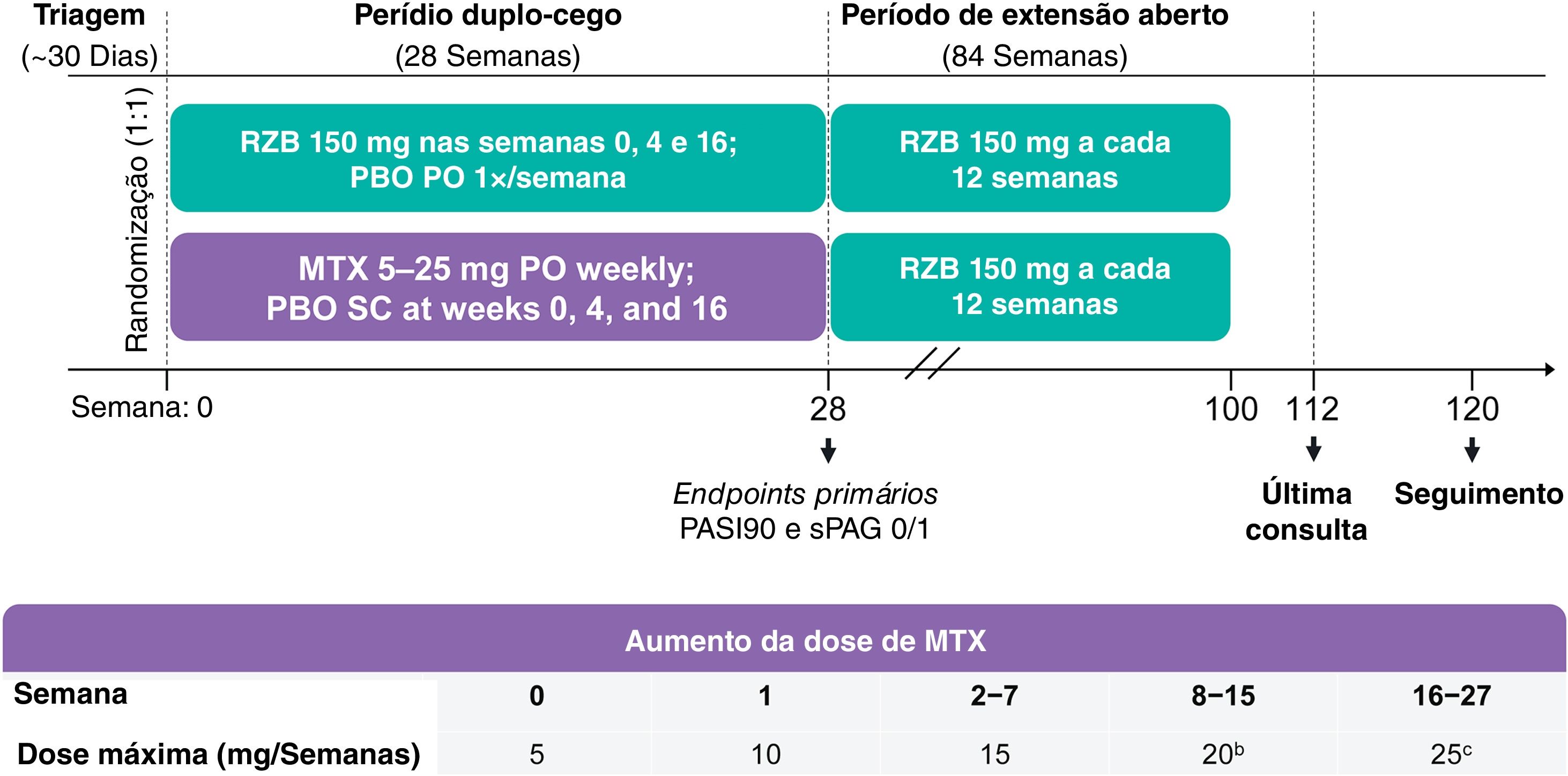
Desenho do estudo e tratamentoO estudo IMMbrace (ClinicalTrials.gov; NCT03219437) foi um ensaio clínico de fase 3b, multicêntrico, randomizado, duplo‐cego, duplo‐dummy, controlado ativamente que comparou a eficácia e a segurança do risanquizumabe subcutâneo com o metotrexato oral em pacientes com psoríase em placas moderada a grave. O estudo foi conduzido em 11 locais diferentes no Brasil. O desenho do estudo incluiu período de triagem de 30 dias, período de tratamento duplo‐cego de 28 semanas e período de tratamento aberto de 84 semanas (fig. 1). No período duplo‐cego, os pacientes foram randomizados 1:1 em dois grupos de tratamento para receber (em desenho duplo‐dummy) risanquizumabe 150mg como injeções subcutâneas nas semanas 0, 4 e 16 mais cápsulas de placebo por via oral semanalmente, ou cápsulas de metotrexato por via oral uma vez por semana mais injeções de placebo nas semanas 0, 4 e 16 (fig. 1). A dosagem de metotrexato começou com 5mg e podia ser aumentada até 25mg com base na resposta clínica e tolerabilidade. Os pesquisadores determinaram todos os ajustes de dosagem de metotrexato (suspensão, redução ou aumento) com base nos sintomas relatados pelo paciente, achados no exame físico, eventos adversos (EA) e/ou alterações nos perfis laboratoriais clínicos. A partir da semana 28, os pacientes que continuaram no estudo receberam risanquizumabe 150mg abertamente a cada 12 semanas até a semana 100 (período de extensão aberto [OLE, do inglês open‐label extension]). A última consulta do estudo foi na semana 112; ligação telefônica de seguimento ocorreu 20 semanas após a injeção subcutânea final ou quatro semanas após a administração oral final, o que fosse posterior.
Desenho do estudo. MTX, metotrexato; PASI90; ≥ 90% de melhora no Psoriasis Area and Severity Index; PBO, placebo; VO, via oral; q12semanas, a cada 12 semanas; RZB, risanquizumabe; SC, subcutâneo; sPGA 0/1, static Physician's Global Assessment de eliminação total/quase total da doença na pele. aAs doses orais de MTX também foram ajustadas em virtude de sintomas relatados pelo paciente, achados no exame físico, eventos adversos relatados e/ou alterações nos perfis clínicos laboratoriais, conforme considerado apropriado pelos investigadores do estudo. bA partir da semana 8, os pacientes que não atingiram PASI90 ou sPGA 0/1 tiveram sua dose de MTX aumentada em 5mg (até 20mg por semana) até a semana 15. cA partir da semana 16, os pacientes que não atingiram PASI90 ou sPGA 0/1 tiveram sua dose de MTX aumentada em 5mg (até 25g por semana) até a semana 27.
O estudo foi conduzido de acordo com as Diretrizes de Boas Práticas Clínicas, como definido pelas diretrizes do International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, a Declaração de Helsinque e todas as diretrizes e regulamentos aplicáveis que regem a conduta de estudos clínicos; todos os pacientes forneceram consentimento informado por escrito. Um comitê de ética/conselho de revisão institucional independente garantiu a adequação ética, científica e médica do estudo antes que o estudo fosse conduzido e aprovou toda a documentação relevante.
AvaliaçõesEficáciaOs endpoints primários de eficácia categorizados foram a obtenção de ≥ 90% de melhora em relação à linha basal no PASI (PASI90) e sPGA mostrando eliminação total/quase total da doença na pele (sPGA 0/1) na semana 28. Os endpoints secundários de eficácia categorizados (todos avaliados na semana 28) foram obtenção de 100% de melhora em relação à linha basal no PASI (PASI100), sPGA de eliminação total da doença na pele (sPGA0), melhora ≥ 75% em relação à linha basal no PASI (PASI75), alteração em relação à linha basal no escore do índice European Quality of Life 5 Dimensions (EQ‐5D‐5L) e obtenção de aumento ≥ 0,1 ponto (diferença mínima clinicamente importante [MCID, do inglês minimal clinically important difference]) em relação à linha basal no escore do índice EQ‐5D‐5L. Usando análises post hoc, foram avaliadas a mudança da linha basal no escore do índice EQ‐5D‐5L e a obtenção de MCID da linha basal no escore do índice EQ‐5D‐5L em pacientes com escore do índice EQ‐5D‐5L de linha basal ≤ 0,9 na semana 28. Um endpoint adicional foi a proporção de pacientes que alcançaram o escore do Dermatology Life Quality Index de 0 (DLQI 0 – sem efeito na vida do paciente) na semana 28.
SegurançaAvaliações de segurança, incluindo monitoramento de EA emergentes do tratamento (TEAE, do inglês treatment‐emergent adverse events), análise de resultados de testes laboratoriais padrão, realização de exames físicos e de medidas de sinais vitais, foram realizadas ao longo do estudo. Os achados foram tabulados utilizando o sistema de classes de órgãos e os termos preferenciais do Medical Dictionary for Regulatory Activities (versão 24.0).
Análise estatísticaFoi necessário tamanho amostral de 100 pacientes para atingir mais de 95% de poder para detectar a diferença de 40% entre risanquizumabe e metotrexato. Os dados foram analisados utilizando o software estatístico SAS versão 9.4 (SAS Institute Inc., Cary, NC, EUA). Todas as análises de eficácia foram realizadas na população a ser tratada, que incluiu todos os pacientes randomizados. Os endpoints primários e secundários de eficácia categorizados foram analisados em ordem hierárquica usando testes bilaterais com erro tipo 1 de 0,05. Os endpoints categóricos foram analisados usando o teste Cochran‐Mantel‐Haenszel estratificado pelo centro do estudo; os dados ausentes foram imputados utilizando imputação de não respondedores para a análise primária e imputação de não respondedores incorporando imputação múltipla para lidar com dados ausentes em virtude da COVID‐19 para a análise de longo prazo. Os endpoints contínuos foram analisados utilizando análise unidirecional de covariância com tratamento, local do estudo e valor basal no modelo; o método da última observação realizada foi usado para imputar dados ausentes. A segurança foi analisada em todos os pacientes randomizados na linha basal que receberam pelo menos uma dose do medicamento do estudo.
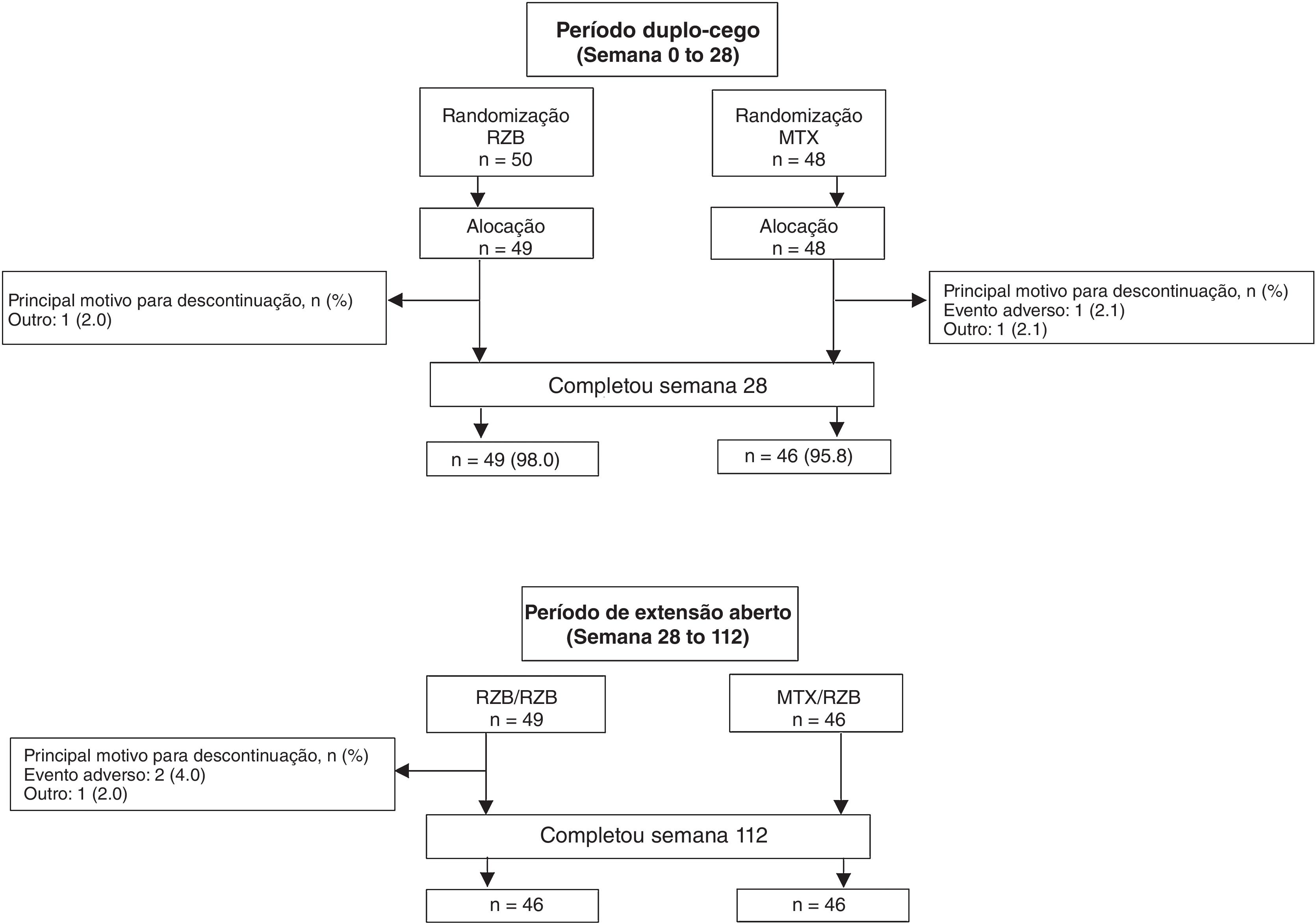
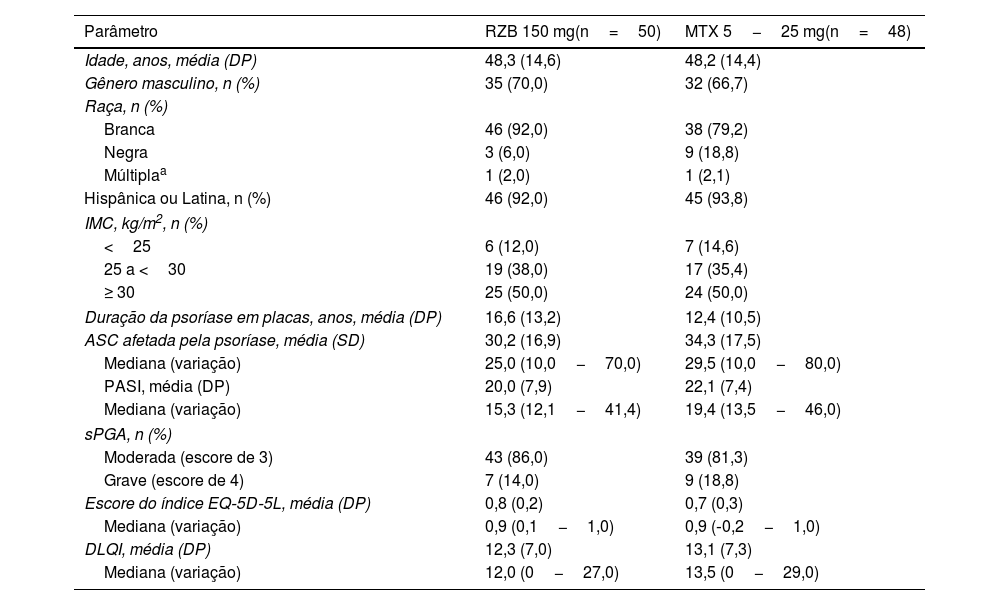
ResultadosPacientesEste estudo foi conduzido de julho de 2018 a novembro de 2021. Um total de 11 locais inscreveram 104 pacientes neste estudo; entretanto, um dos locais do estudo foi fechado por não conformidade com o protocolo, e todos os pacientes inscritos ali foram excluídos das análises de eficácia e segurança. Dos 98 pacientes randomizados para receber risanquizumabe (n=50) ou metotrexato (n=48) em locais em conformidade, 95 (96,9%) concluíram o período duplo‐cego e 92 (95,8%) concluíram o período OLE (fig. 2). Seis pacientes descontinuaram o estudo, incluindo quatro no grupo risanquizumabe (dois em decorrência de EA e dois por outros motivos) e dois no grupo metotrexato (um em virtude de EA e um por outros motivos). As características demográficas e basais da doença foram geralmente semelhantes entre os grupos de tratamento (tabela 1). A média de idade (DP) dos pacientes foi de 48,2 (14,4) anos; 68,4% dos pacientes eram do gênero masculino. Na linha basal, os pacientes tinham PASI médio de 21,0 e escore médio do índice EQ‐5D‐5L de 0,8%; 83,7% e 16,3% dos pacientes tinham escores sPGA moderadas e graves, respectivamente.
Dados demográficos e características basais
| Parâmetro | RZB 150 mg(n=50) | MTX 5−25 mg(n=48) |
|---|---|---|
| Idade, anos, média (DP) | 48,3 (14,6) | 48,2 (14,4) |
| Gênero masculino, n (%) | 35 (70,0) | 32 (66,7) |
| Raça, n (%) | ||
| Branca | 46 (92,0) | 38 (79,2) |
| Negra | 3 (6,0) | 9 (18,8) |
| Múltiplaa | 1 (2,0) | 1 (2,1) |
| Hispânica ou Latina, n (%) | 46 (92,0) | 45 (93,8) |
| IMC, kg/m2, n (%) | ||
| <25 | 6 (12,0) | 7 (14,6) |
| 25 a <30 | 19 (38,0) | 17 (35,4) |
| ≥ 30 | 25 (50,0) | 24 (50,0) |
| Duração da psoríase em placas, anos, média (DP) | 16,6 (13,2) | 12,4 (10,5) |
| ASC afetada pela psoríase, média (SD) | 30,2 (16,9) | 34,3 (17,5) |
| Mediana (variação) | 25,0 (10,0−70,0) | 29,5 (10,0−80,0) |
| PASI, média (DP) | 20,0 (7,9) | 22,1 (7,4) |
| Mediana (variação) | 15,3 (12,1−41,4) | 19,4 (13,5−46,0) |
| sPGA, n (%) | ||
| Moderada (escore de 3) | 43 (86,0) | 39 (81,3) |
| Grave (escore de 4) | 7 (14,0) | 9 (18,8) |
| Escore do índice EQ‐5D‐5L, média (DP) | 0,8 (0,2) | 0,7 (0,3) |
| Mediana (variação) | 0,9 (0,1−1,0) | 0,9 (‐0,2−1,0) |
| DLQI, média (DP) | 12,3 (7,0) | 13,1 (7,3) |
| Mediana (variação) | 12,0 (0−27,0) | 13,5 (0−29,0) |
IMC, índice de massa corporal; ASC, área de superfície corporal; DLQI, Dermatology Life Quality Index; EQ‐5D‐5L, European Quality of Life 5 Dimensions; MTX, metotrexato; PASI, Psoriasis Area and Severity Index; RZB, risanquizumabe; sPGA, Static Physician's Global Assessment.
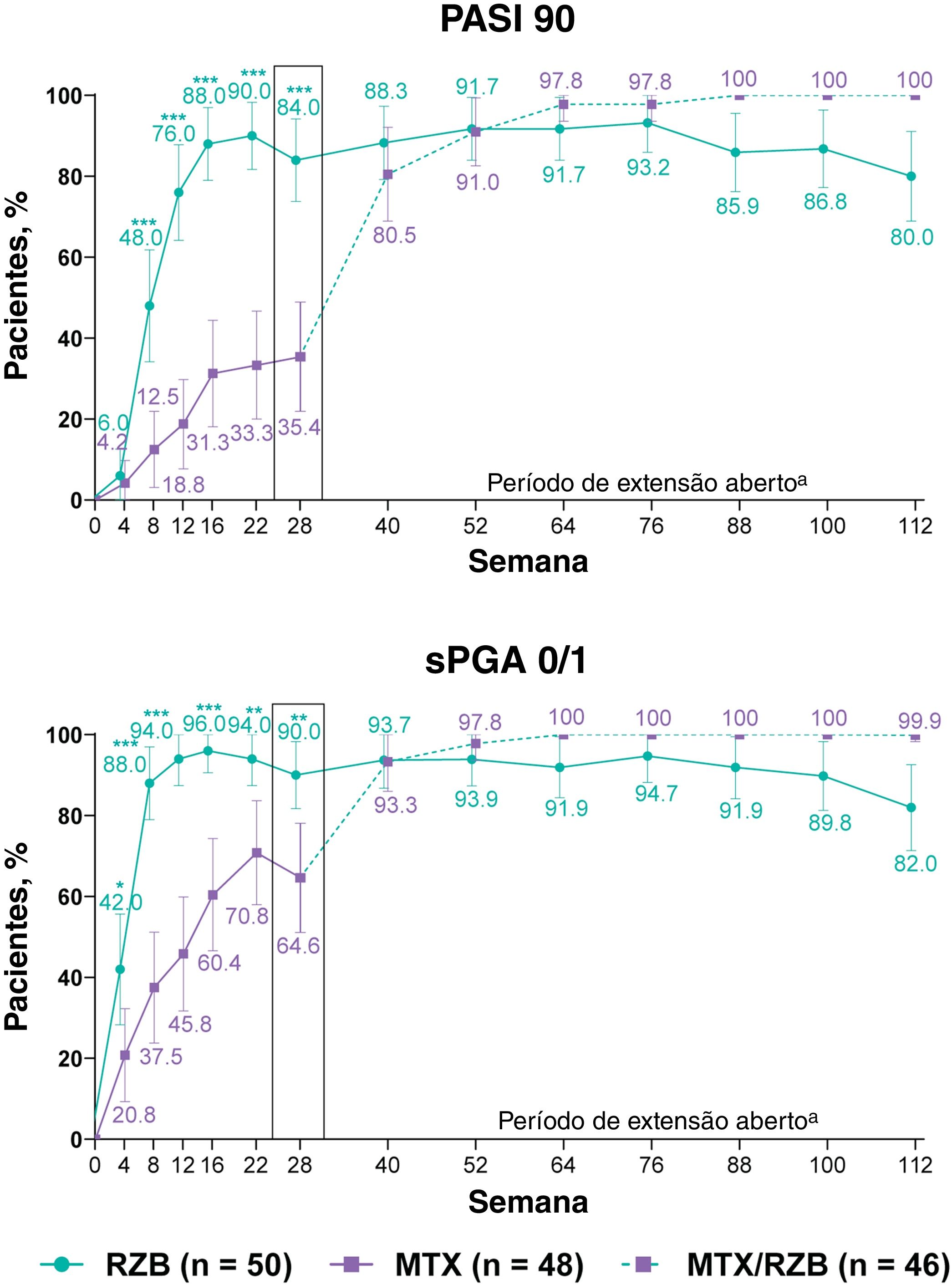
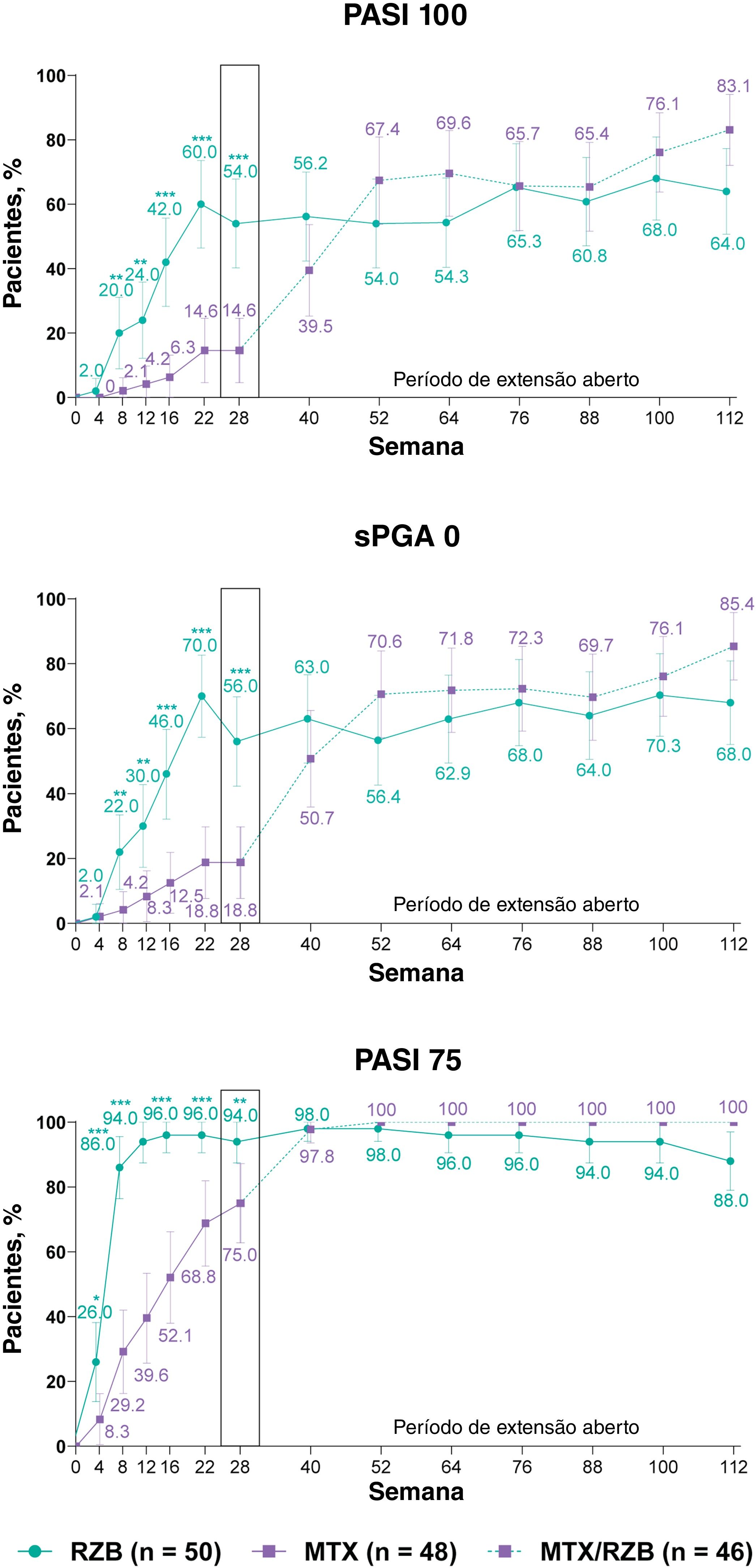
Após 28 semanas de tratamento, proporções significantemente maiores de pacientes tratados com risanquizumabe atingiram os endpoints primários de eficácia em comparação com pacientes tratados com metotrexato (fig. 3). PASI90 foi alcançado por 84,0% e 35,4% dos pacientes nos grupos risanquizumabe e metotrexato na semana 28 (p ≤ 0,001), e sPGA 0/1 foi alcançado em 90,0% e 64,6% dos pacientes nos grupos risanquizumabe e metotrexato (p ≤ 0,001). Proporção significantemente maior de pacientes recebendo risanquizumabe também atingiu endpoints secundários de PASI100, sPGA0 e PASI75 na semana 28 em comparação com pacientes recebendo metotrexato (fig. 4).
Resultados primários de eficácia clínica. Os dados destacados na semana 28 denotam os endpoints primários de eficácia. A imputação de não respondedores foi usada até a semana 28; a imputação de não respondedores incorporando múltiplas imputações para dados ausentes em virtude da COVID‐19 foi usada após a semana 28. MTX, metotrexato; PASI90, ≥ 90% de melhora no Psoriasis Area and Severity Index; RZB, risanquizumabe; sPGA 0/1, static Physician's Global Assessment de eliminação total/quase total da doença na pele. *p ≤ 0,05, **p ≤ 0,01, ***p <0,001 versus MTX. aAs taxas de resposta em momentos posteriores (após a semana 40) podem ter sido parcialmente impactadas pela maior frequência de dados ausentes no grupo RZB versus grupo MTX/RZB.
Resultados de eficácia clínica secundária categorizados. Os dados destacados na semana 28 denotam endpoints de eficácia secundária categorizados. A imputação de não respondedores foi usada até a semana 28; a imputação de não respondedores incorporando imputação múltipla para dados ausentes em virtude da COVID‐19 foi usada após a semana 28. MTX, metotrexato; PASI75/100, ≥ 75%/ ≥ 100% de melhora no Psoriasis Area and Severity Index; RZB, risanquizumabe; sPGA0, static Physician's Global Assessment de eliminação total da doença na pele. *p ≤ 0,05, **p ≤ 0,01, ***p <0,001 versus MTX.
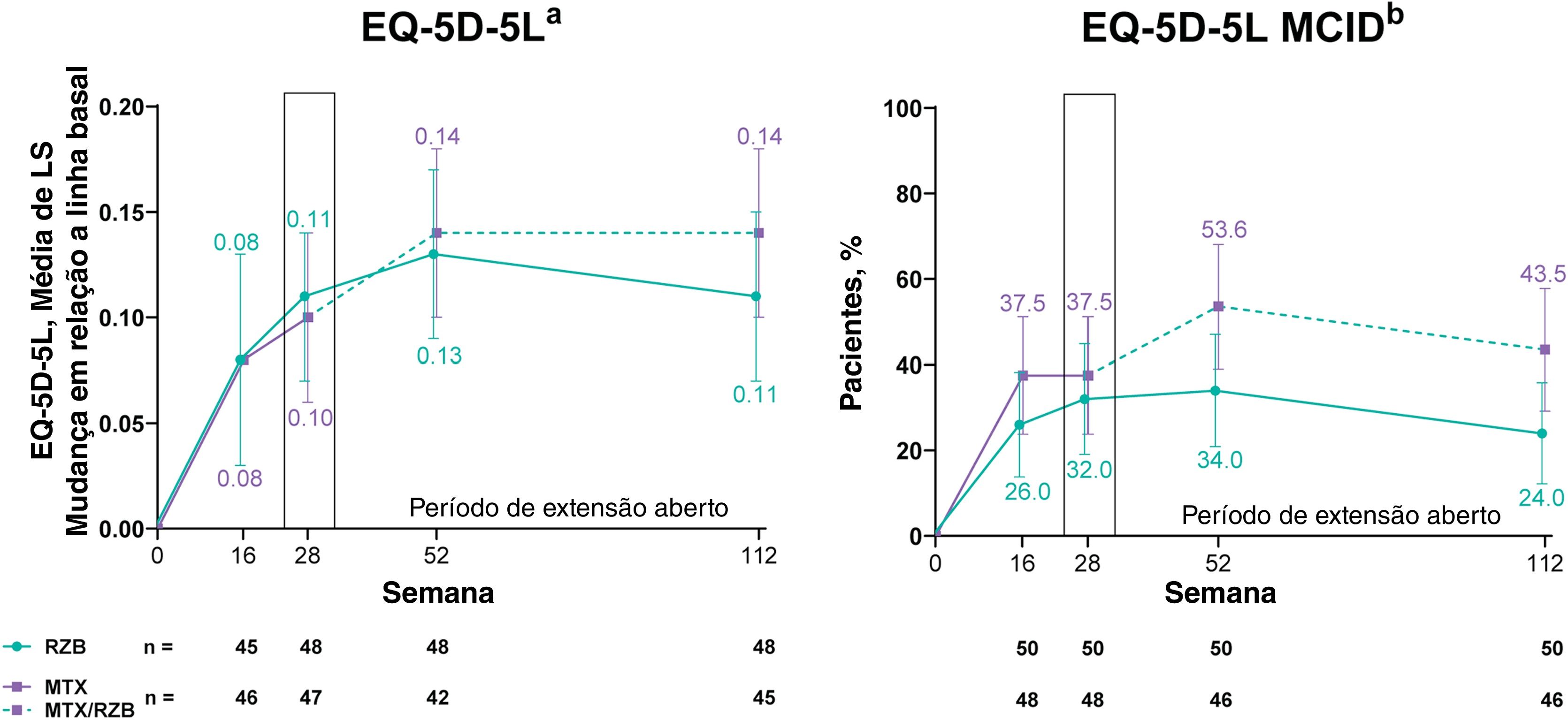
Melhoras nos resultados relatados pelos pacientes que medem a qualidade de vida relacionada à saúde (QVRS) foram observadas em ambos os grupos, risanquizumabe e metotrexato. Na semana 28 de tratamento, as alterações nos escores do índice EQ‐5D‐5L e a proporção de pacientes que atingiram o MCID nos escores do índice EQ‐5D‐5L aumentaram numericamente em relação à linha basal em ambos os grupos, sem diferenças significantes nos resultados entre os pacientes tratados com risanquizumabe versus metotrexato (fig. 5). Entre os pacientes com escores do índice EQ‐5D‐5L na linha basal ≤ 0,9, a alteração média dos mínimos quadrados em relação à linha basal (IC de 95%) no escore do índice EQ‐5D‐5L na semana 28 foi semelhante nos dois grupos – 0,16 (0,10, 0,23) com risanquizumabe e 0,17 (0,11, 0,23) com metotrexato. Na análise post hoc avaliando pacientes com escores do índice EQ‐5D‐5L basais ≤ 0,9, observou‐se que a proporção de pacientes que atingiram o MCID nos escores do índice EQ‐5D‐5L na semana 28 foi numericamente maior, mas não significantemente diferente, no grupo risanquizumabe versus o grupo metotrexato (61,5% vs. 54,5%). Na semana 28, proporção significantemente maior de pacientes atingiu DLQI 0 no grupo risanquizumabe versus pacientes no grupo metotrexato (fig. S1 Suplementar).
Resultados de eficácia de qualidade de vida secundária categorizados. Os dados destacados na semana 28 denotam endpoints de eficácia secundária categorizados. MCID foi definido como aumento ≥ 0,1 no EQ‐5D‐5L em relação à linha basal. EQ‐5D‐5L, European Quality of Life 5 Dimensions; LS, mínimos quadrados; MCID, diferença clinicamente importante mínima; MTX, metotrexato; RZB, risanquizumabe. aImputação da última observação realizada foi usada. bImputação de não respondedores foi usada até a semana 28; a imputação de não respondedores incorporando imputação múltipla para dados ausentes em virtude da COVID‐19 foi usada após a semana 28.
As respostas PASI e sPGA foram geralmente sustentadas até a semana 112 entre os pacientes que continuaram o tratamento com risanquizumabe no período OLE; os pacientes com dados ausentes durante o período OLE são mostrados na tabela S1 suplementar. Melhoras nos resultados do PASI e sPGA foram observadas das semanas 28 a 112 entre os pacientes inicialmente randomizados para receber metotrexato no período duplo‐cego e que depois mudaram para risanquizumabe no período OLE. As taxas de resposta do escore do índice EQ‐5D‐5L, em geral, permaneceram estáveis durante as 112 semanas de terapia, independentemente do grupo de tratamento. No período entre as semanas 28 a 112, as taxas de resposta do DLQI 0 permaneceram estáveis entre os pacientes que receberam risanquizumabe contínuo e aumentaram entre os pacientes que mudaram de metotrexato para risanquizumabe.
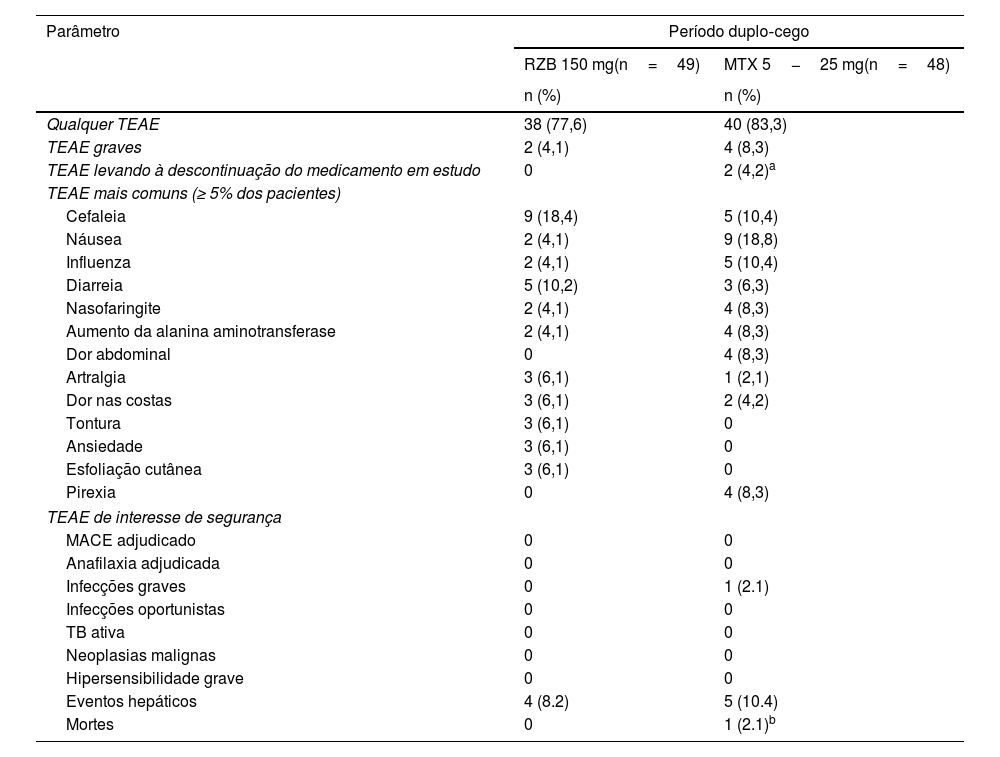
SegurançaDurante o período duplo‐cego, a proporção de pacientes com TEAE foi ligeiramente maior no grupo de tratamento com metotrexato (83,3%) do que no grupo risanquizumabe (77,6%; tabela 2). Entretanto, os perfis de TEAE foram geralmente semelhantes entre os grupos de tratamento, e as taxas de EA importantes, EA graves e TEAE de interesse de segurança foram geralmente baixas em ambos os grupos, sem diferenças significantes entre os grupos metotrexato e risanquizumabe. As taxas de EA importantes foram <5% no grupo risanquizumabe, e nenhum dos EA importantes em nenhum dos grupos foi considerado relacionado ao medicamento do estudo pelo investigador. Os TEAE mais frequentemente relatados (≥ 5% dos pacientes) no grupo risanquizumabe foram cefaleia, diarreia, artralgia e ansiedade. Os TEAE mais frequentemente relatados (≥ 5% dos pacientes) no grupo metotrexato foram náusea, cefaleia, gripe e aumento dos níveis de alanina aminotransferase. Nenhum paciente interrompeu o estudo em virtude de TEAE no grupo risanquizumabe. Não houve casos de tuberculose, neoplasia maligna, hipersensibilidade grave ou eventos adversos cardiovasculares importantes em nenhum dos grupos. Embora elevações numericamente maiores de transaminase em comparação com a linha basal tenham sido observadas com metotrexato (alanina transaminase, 8,0 U/L; aspartato aminotransferase, 5,0 U/L) versus risanquizumabe (alteração ≤ 1,1 U/L nos níveis de aspartato aminotransferase ou alanina transaminase), os níveis médios permaneceram dentro da faixa normal em ambos os grupos.
Visão geral dos eventos adversos decorrentes do tratamento (período de análise primária duplo‐cego: semanas 0 a 28)
| Parâmetro | Período duplo‐cego | |
|---|---|---|
| RZB 150 mg(n=49) | MTX 5−25 mg(n=48) | |
| n (%) | n (%) | |
| Qualquer TEAE | 38 (77,6) | 40 (83,3) |
| TEAE graves | 2 (4,1) | 4 (8,3) |
| TEAE levando à descontinuação do medicamento em estudo | 0 | 2 (4,2)a |
| TEAE mais comuns (≥ 5% dos pacientes) | ||
| Cefaleia | 9 (18,4) | 5 (10,4) |
| Náusea | 2 (4,1) | 9 (18,8) |
| Influenza | 2 (4,1) | 5 (10,4) |
| Diarreia | 5 (10,2) | 3 (6,3) |
| Nasofaringite | 2 (4,1) | 4 (8,3) |
| Aumento da alanina aminotransferase | 2 (4,1) | 4 (8,3) |
| Dor abdominal | 0 | 4 (8,3) |
| Artralgia | 3 (6,1) | 1 (2,1) |
| Dor nas costas | 3 (6,1) | 2 (4,2) |
| Tontura | 3 (6,1) | 0 |
| Ansiedade | 3 (6,1) | 0 |
| Esfoliação cutânea | 3 (6,1) | 0 |
| Pirexia | 0 | 4 (8,3) |
| TEAE de interesse de segurança | ||
| MACE adjudicado | 0 | 0 |
| Anafilaxia adjudicada | 0 | 0 |
| Infecções graves | 0 | 1 (2.1) |
| Infecções oportunistas | 0 | 0 |
| TB ativa | 0 | 0 |
| Neoplasias malignas | 0 | 0 |
| Hipersensibilidade grave | 0 | 0 |
| Eventos hepáticos | 4 (8.2) | 5 (10.4) |
| Mortes | 0 | 1 (2.1)b |
MACE, eventos cardiovasculares adversos importantes; MTX, metotrexato; RZB, risanquizumabe; TB, tuberculose; TEAE, eventos adversos decorrentes do tratamento.
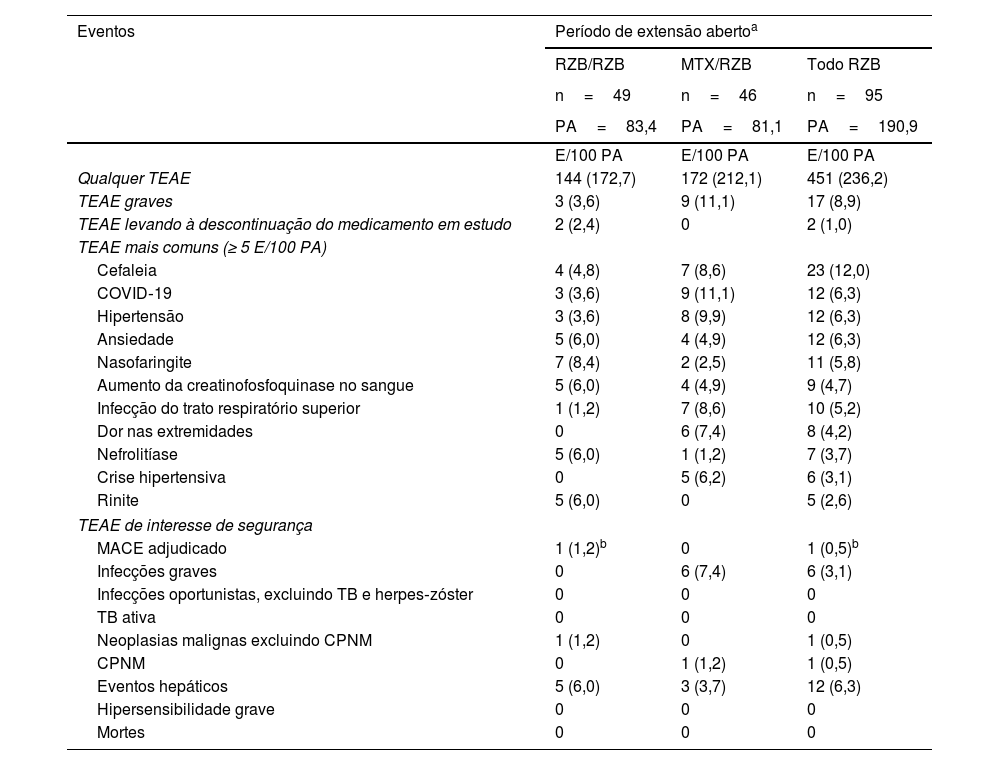
No período de extensão de longo prazo, as taxas de TEAE permaneceram semelhantes entre os pacientes que continuaram com o risanquizumabe aberto ou mudaram de metotrexato para o risanquizumabe aberto (tabela 3). A incidência de EA importantes, TEAE que levaram à descontinuação do tratamento e TEAE de interesse de segurança permaneceram baixos. Após os pacientes mudarem de metotrexato para risanquizumabe, o perfil de segurança do risanquizumabe permaneceu consistente, e as taxas de TEAE se mantiveram estáveis com o tratamento de longo prazo com risanquizumabe. As taxas de TEAE de interesse de segurança foram geralmente baixas nos dois grupos, e não houve reações de hipersensibilidade graves. No grupo que recebeu risanquizumabe contínuo, foi relatado um evento adverso cardiovascular importante maior adjudicado em um paciente com múltiplos fatores de risco cardiovascular. Todas as infecções fúngicas foram relacionadas à candidíase cutânea ou vaginal. Entre os pacientes que receberam risanquizumabe contínuo, foi relatado câncer de pâncreas em um paciente que era ex‐fumante. Em geral, as alterações médias da linha basal nos parâmetros laboratoriais foram geralmente pequenas entre os pacientes que mudaram de metotrexato para risanquizumabe e nos pacientes que continuaram o tratamento com risanquizumabe; os valores laboratoriais permaneceram dentro das faixas normais durante todo o período OLE.
Visão geral dos eventos adversos decorrentes do tratamento (análise de longo prazo: semanas 28–112)
| Eventos | Período de extensão abertoa | ||
|---|---|---|---|
| RZB/RZB | MTX/RZB | Todo RZB | |
| n=49 | n=46 | n=95 | |
| PA=83,4 | PA=81,1 | PA=190,9 | |
| E/100 PA | E/100 PA | E/100 PA | |
| Qualquer TEAE | 144 (172,7) | 172 (212,1) | 451 (236,2) |
| TEAE graves | 3 (3,6) | 9 (11,1) | 17 (8,9) |
| TEAE levando à descontinuação do medicamento em estudo | 2 (2,4) | 0 | 2 (1,0) |
| TEAE mais comuns (≥ 5 E/100 PA) | |||
| Cefaleia | 4 (4,8) | 7 (8,6) | 23 (12,0) |
| COVID‐19 | 3 (3,6) | 9 (11,1) | 12 (6,3) |
| Hipertensão | 3 (3,6) | 8 (9,9) | 12 (6,3) |
| Ansiedade | 5 (6,0) | 4 (4,9) | 12 (6,3) |
| Nasofaringite | 7 (8,4) | 2 (2,5) | 11 (5,8) |
| Aumento da creatinofosfoquinase no sangue | 5 (6,0) | 4 (4,9) | 9 (4,7) |
| Infecção do trato respiratório superior | 1 (1,2) | 7 (8,6) | 10 (5,2) |
| Dor nas extremidades | 0 | 6 (7,4) | 8 (4,2) |
| Nefrolitíase | 5 (6,0) | 1 (1,2) | 7 (3,7) |
| Crise hipertensiva | 0 | 5 (6,2) | 6 (3,1) |
| Rinite | 5 (6,0) | 0 | 5 (2,6) |
| TEAE de interesse de segurança | |||
| MACE adjudicado | 1 (1,2)b | 0 | 1 (0,5)b |
| Infecções graves | 0 | 6 (7,4) | 6 (3,1) |
| Infecções oportunistas, excluindo TB e herpes‐zóster | 0 | 0 | 0 |
| TB ativa | 0 | 0 | 0 |
| Neoplasias malignas excluindo CPNM | 1 (1,2) | 0 | 1 (0,5) |
| CPNM | 0 | 1 (1,2) | 1 (0,5) |
| Eventos hepáticos | 5 (6,0) | 3 (3,7) | 12 (6,3) |
| Hipersensibilidade grave | 0 | 0 | 0 |
| Mortes | 0 | 0 | 0 |
E, eventos; MACE, eventos cardiovasculares adversos importantes; MTX, metotrexato; CPNM, câncer de pele não melanoma; PA, pacientes‐anos; RZB, risanquizumabe; TB, tuberculose; TEAE, eventos adversos decorrentes do tratamento.
Neste estudo de fase 3, o risanquizumabe demonstrou superioridade em relação ao metotrexato na proporção de pacientes que atingiram PASI90 e sPGA0/1. As taxas de resposta para PASI90 e obtenção de sPGA0/1 foram consistentes com aquelas relatadas para os estudos globais fundamentais para o emprego do risanquizumabe em psoríase.10 Além disso, melhorias significantes foram demonstradas com o tratamento com risanquizumabe nos endpoints de eficácia secundários categorizados, incluindo a eliminação total da doença na pele (sPGA0 e PASI100). A eficácia foi mantida até a semana 112 para pacientes que inicialmente receberam risanquizumabe, e os resultados melhoraram até a semana 112 para pacientes que começaram com metotrexato e depois mudaram para risanquizumabe na semana 28.
Melhoras na HRQoL são importantes na avaliação dos benefícios gerais de novas terapias. Neste estudo, as alterações no escore do índice EQ‐5D‐5L e as taxas de resposta MCID não foram diferentes entre os grupos risanquizumabe e metotrexato. Notavelmente, o EQ‐5D‐5L é uma medida curta, genérica e não doença‐específica do estado de saúde, e pode ser menos sensível para detectar melhoras na qualidade de vida relacionada à saúde (QVRS) experimentadas por pessoas com psoríase quando seus sintomas melhoram. Quase o dobro de pacientes tratados com risanquizumabe versus metotrexato atingiram o endpoint exploratório de DLQI0 na semana 28. As respostas de DLQI0 foram mantidas durante 112 semanas de terapia para pacientes que continuaram o tratamento com risanquizumabe, e os resultados melhoraram até a semana 112 para pacientes que mudaram de metotrexato para risanquizumabe na semana 28. Os resultados de estudos anteriores também mostraram que os pacientes tratados com risanquizumabe apresentam melhoras significantes e clinicamente importantes em sua QVRS quando avaliados por instrumentos de QVRS mais abrangentes e/ou doença‐específicos e resultados relatados pelo paciente (p. ex., ferramentas como o DLQI, Psoriasis Symptom Scale, e 36‐Item Short Form Health Survey).9–12,15
O risanquizumabe foi bem tolerado e nenhuma nova preocupação com a segurança foi identificada. Os TEAE de ansiedade e tontura (relatados por três pacientes cada no grupo risanquizumabe durante o período duplo‐cego) não foram identificados como EA comuns em análise integrada da segurança do risanquizumabe em pacientes com psoríase em 17 ensaios clínicos globais.16 O perfil de segurança do risanquizumabe observado durante 112 semanas de terapia foi consistente com o perfil de segurança do tratamento de longo prazo com risanquizumabe em pacientes com psoríase.
Uma limitação do presente estudo é o pequeno tamanho da amostra em virtude da dificuldade de recrutar pacientes com psoríase moderada a grave que não tenham usado metotrexato anteriormente.
O metotrexato tem sido amplamente utilizado como tratamento de primeira linha para psoríase no Brasil. A diretriz brasileira mais recentemente publicada para psoríase moderada a grave (2019) sugere que os biológicos devem ser reservados para pacientes sem resposta ao tratamento, que apresentem contraindicações para o uso de um medicamento específico ou intolerância a pelo menos um medicamento sistêmico ou fototerapia.17 A relutância dos médicos em escolher um biológico como terapia de primeira linha pode estar ligada a restrições de acesso associadas ao custo ou, em parte, pela falta de dados de estudos clínicos comparando a terapia tradicional com metotrexato à terapia com biológicos. Os resultados do presente estudo demonstram que o risanquizumabe é mais eficaz que o metotrexato em pacientes com psoríase em placas moderada a grave, sem riscos adicionais de segurança.
ConclusõesRisanquizumabe demonstrou melhoras significantes nos sintomas de psoríase e eficácia superior em comparação com o metotrexato na semana 28. Além disso, a eficácia do risanquizumabe foi mantida ao longo do tempo até a semana 112, possibilitando que a durabilidade e as melhoras na eficácia fossem comprovadas em pacientes que mudaram de metotrexato para risanquizumabe no período OLE de longo prazo. O perfil de segurança do risanquizumabe foi consistente com o perfil de segurança relatado em outros estudos de risanquizumabe na psoríase. Em geral, esses resultados confirmam o risanquizumabe como opção de tratamento viável em pacientes com psoríase em placas moderada a grave.
Declaração de disponibilidade de dadosA AbbVie está comprometida com o compartilhamento responsável de dados em relação aos ensaios clínicos que patrocinamos. Isso inclui acesso a dados individuais e de nível de ensaio anônimos (conjuntos de dados de análise), bem como outras informações (p. ex., protocolos, relatórios de estudos clínicos ou planos de análise), desde que os ensaios não façam parte de uma submissão regulatória em andamento ou planejada. Isso inclui solicitações de dados de ensaios clínicos para produtos e indicações não licenciados.
Esses dados de ensaios clínicos podem ser solicitados por qualquer pesquisador qualificado envolvido em pesquisa científica rigorosa e independente, e serão fornecidos após a revisão e aprovação de proposta de pesquisa, plano de análise estatística e execução de acordo de compartilhamento de dados. As solicitações de dados podem ser enviadas a qualquer momento após a aprovação nos EUA e na Europa e após a aceitação deste manuscrito para publicação. Os dados ficarão acessíveis por 12 meses, com possíveis extensões consideradas. Para obter mais informações sobre o processo ou para enviar uma solicitação, visite o link: https://vivli.org/ourmember/abbvie/, depois selecione “Home”.
Suporte financeiroA AbbVie financiou este estudo e participou do desenho do estudo, pesquisa, análise, obtenção dos dados, interpretação dos dados, revisão e aprovação da publicação. Todos os autores tiveram acesso a dados relevantes e participaram da elaboração, revisão e aprovação desta publicação. Nenhum honorário ou pagamento foi feito pela autoria. O suporte à redação médica foi fornecido por Melissa Julyanti, PharmD, da JB Ashtin, e financiado pela AbbVie.
Contribuição dos autoresTania F. Cestari: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Cacilda da Silva Souza: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Luna Azulay‐Abulafia: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; preparação e redação do manuscrito.
Ricardo Romiti: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
André V.E. Carvalho: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Caio César Silva de Castro: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Silvio Alencar Marques: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
João Roberto Antonio: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Lincoln Fabrício: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Ahmed M. Soliman: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Tianshuang Wu: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Ranjeeta Sinvhal: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Vassilis Stakias: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Alexandra P. Song: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Jasmina Kalabic: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Naomi Martin: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Luiza Keiko Matsuoka Oyafuco: aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Conflito de interessesDra. Cestari atuou como palestrante, consultora e/ou pesquisadora para a AbbVie, Janssen‐Cilag, La Roche‐Posay, LEO Pharma, Novartis, Pierre‐Fabre e Vichy.
Dra. da Silva Souza atuou como consultora e/ou pesquisadora para a AbbVie, Boehringer Ingelheim, Janssen‐Cilag, LEO Pharma e Novartis.
Dra. Azulay‐Abulafia atuou como consultora e/ou pesquisadora para a AbbVie, Janssen‐Cilag, LEO Pharma, Lilly, Novartis e Pfizer.
Dr. Romiti atuou como consultor, palestrante e/ou pesquisador para a AbbVie, Bioderma, Boehringer Ingelheim, Galderma, Janssen‐Cilag, LEO Pharma, Lilly, Novartis, Pfizer e UCB.
Dr. Carvalho atuou como consultor, palestrante e/ou pesquisador para AbbVie, AMGEN, Boehringer Ingelheim, GSK, Janssen‐Cilag, LEO Pharma, Lilly e Novartis.
Dr. de Castro atuou como consultor, palestrante e/ou pesquisador para AbbVie, Janssen, Novartis e Pfizer.
Dr. Marques atuou como pesquisador local e recebeu bolsas/financiamento de pesquisa da Janssen.
Dr. Antonio atuou como palestrante e pesquisador principal para AbbVie, Janssen e Novartis.
Dr. Fabrício atuou como palestrante para Abbott, AbbVie, Bayer, Bioderma, Biolab, Boticário, Galderma, Hypermarcas, Isdin, Janssen, La Roche‐Posay, LEO Pharma, Pfizer e Stiefel/GSK, e recebeu patrocínio para eventos científicos da Abbott, AbbVie, Bayer, Bioderma, Galderma, Isdin, Janssen, La Roche‐Posay, LEO Pharma, MSD, Novartis e Pfizer. Além disso, participou de conselhos consultivos da Bayer, Janssen, La Roche‐Posay, LEO Pharma e MSD.
Dr. Soliman, Dr. Wu, Dra. Sinvhal, Dr. Stakias, Dra. Song e Dra. Kalabic são funcionários da AbbVie e podem deter ações, opções de ações e/ou patentes da AbbVie.
Dra. Martin é ex‐funcionária da AbbVie.
Dra. Oyafuso atuou como consultora e/ou pesquisadora para AbbVie, Janssen‐Cilag e Novartis.
A AbbVie e os autores agradecem a todos os investigadores do ensaio e aos pacientes que participaram deste ensaio clínico. O suporte para redação médica foi fornecido por Melissa Julyanti, PharmD, da JB Ashtin, e financiado pela AbbVie.
Como citar este artigo: TF Cestari, Souza CS, Azulay‐Abulafia L, Romiti R, Carvalho AVE, Silva de Castro CC, et al. Efficacy and safety of risankizumab versus methotrexate in patients with moderate‐to‐severe plaque psoriasis: results from IMMbrace, a randomized, double‐blind, phase 3 study with an open‐label extension period in Brazil. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.08.002
Trabalho realizado no Instituto de Dermatologia e Estética do Brasil, Rio de Janeiro, RJ, Brasil; Fundação Faculdade Regional de Medicina de São Jose do Rio Preto, São Jose do Rio Preto, SP, Brasil; Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, Ribeirão Preto, SP, Brasil; Hospital Moinhos de Vento, Porto Alegre, RS, Brasil; Hospital de Clínicas de Porto Alegre, Porto Alegre, RS, Brasil; Hospital de Clínicas, Universidade Estadual de Campinas, Campinas, SP, Brasil; Unidade de Pesquisa Clínica, Faculdade de Medicina de Botucatu, Botucatu, SP, Brasil; Faculdade de Medicina do ABC, Santo André, SP, Brasil; Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil; PUC Trials‐Núcleo de Pesquisa Clínica, Escola de Medicina, Pontifícia Universidade Católica do Paraná, Curitiba, PR, Brasil; CETI – Centro de Estudos em Terapias Inovadoras, Curitiba, PR, Brasil.