O hemangioma infantil (HI) afeta cerca de 5% dos bebês, e é o tumor mais comum durante a infância.1,2 Ao nascimento, as lesões geralmente são imperceptíveis e se desenvolvem por meio de uma fase proliferativa precoce nos primeiros meses de vida, seguida por uma fase de involução mais lenta durante anos.2,3
Apesar de ser condição autolimitada na maioria dos casos, o tratamento sistêmico é indicado para HI se houver ulceração, sangramento e dano funcional, estético ou mesmo dano vital potencial.1,3
O tratamento de primeira linha é o propranolol; entretanto, algumas condições podem inviabilizar seu uso, como broncoespasmo.4,5 O atenolol, um betabloqueador seletivo do receptor beta‐adrenérgico cardíaco hidrofílico, com menos efeitos colaterais potenciais, foi estudado para esses casos.5
Dezesseis pacientes com hemangiomas infantis tratados com atenolol oral no Departamento de Dermatologia do Hospital das Clínicas da Universidade de São Paulo são apresentados, exibindo resultados eficazes, resposta rápida e bom perfil de segurança. Todos os pacientes apresentaram indicações objetivas para tratamento sistêmico e foram avaliados previamente por cardiologistas para ingestão segura do medicamento.
Os critérios de inclusão considerados para tratamento sistêmico foram comprometimento funcional, presença ou alto risco de ulceração, complicações potencialmente fatais ou lesão inestética.
O atenolol foi escolhido por sua posologia mais fácil (administração única diária), risco reduzido de cruzar a barreira hematoencefálica e menos efeitos colaterais em comparação ao propranolol, visto que algumas crianças apresentavam sibilo.
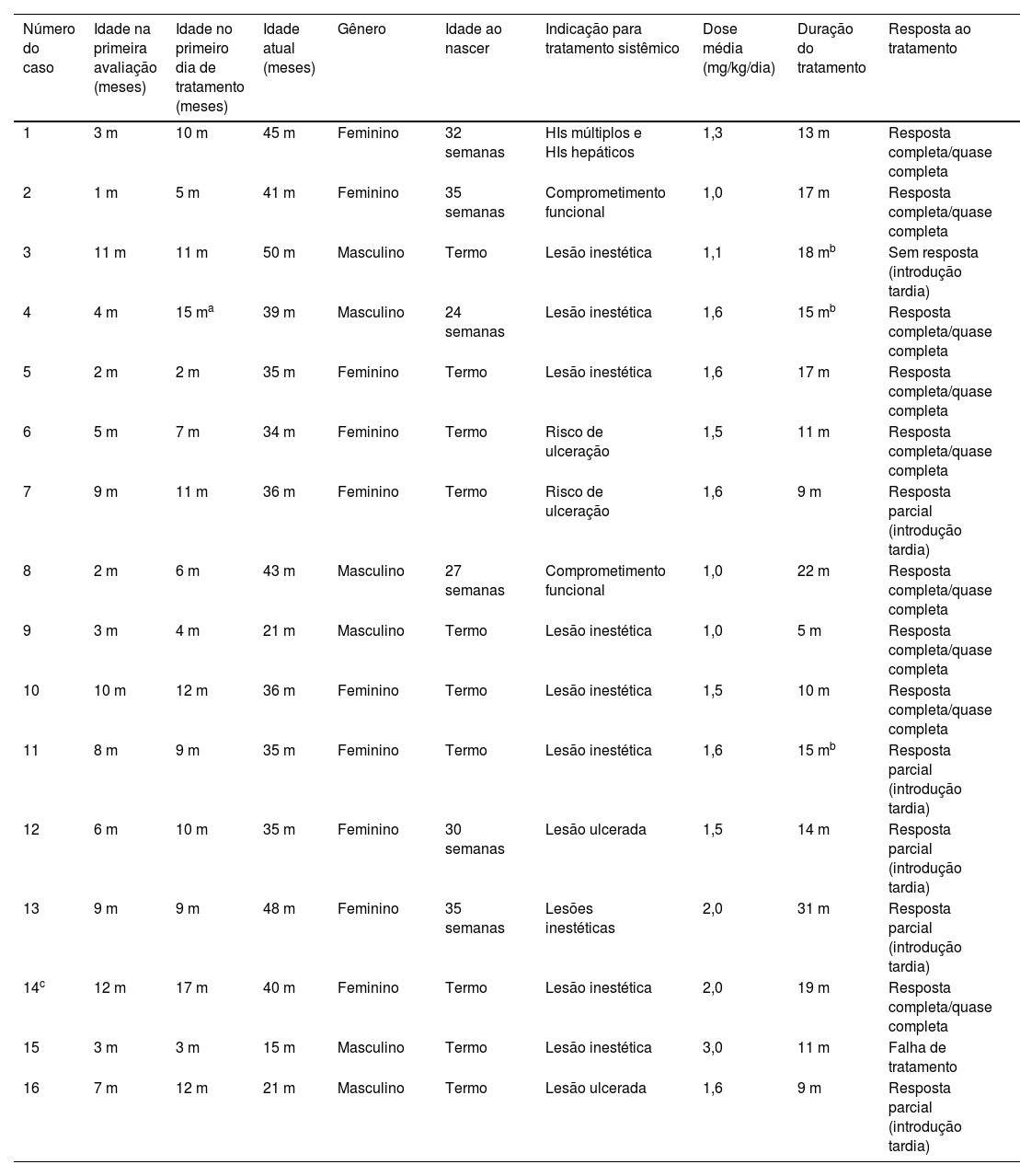
Os dados sobre gênero, prematuridade, idade na primeira avaliação e no início da prescrição do atenolol, profundidade do hemangioma, indicação para terapia sistêmica, dosagem média utilizada e duração do tratamento são mostrados na tabela 1.
Hemangiomas infantis tratados com atenolol oral
| Número do caso | Idade na primeira avaliação (meses) | Idade no primeiro dia de tratamento (meses) | Idade atual (meses) | Gênero | Idade ao nascer | Indicação para tratamento sistêmico | Dose média (mg/kg/dia) | Duração do tratamento | Resposta ao tratamento |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 3 m | 10 m | 45 m | Feminino | 32 semanas | HIs múltiplos e HIs hepáticos | 1,3 | 13 m | Resposta completa/quase completa |
| 2 | 1 m | 5 m | 41 m | Feminino | 35 semanas | Comprometimento funcional | 1,0 | 17 m | Resposta completa/quase completa |
| 3 | 11 m | 11 m | 50 m | Masculino | Termo | Lesão inestética | 1,1 | 18 mb | Sem resposta (introdução tardia) |
| 4 | 4 m | 15 ma | 39 m | Masculino | 24 semanas | Lesão inestética | 1,6 | 15 mb | Resposta completa/quase completa |
| 5 | 2 m | 2 m | 35 m | Feminino | Termo | Lesão inestética | 1,6 | 17 m | Resposta completa/quase completa |
| 6 | 5 m | 7 m | 34 m | Feminino | Termo | Risco de ulceração | 1,5 | 11 m | Resposta completa/quase completa |
| 7 | 9 m | 11 m | 36 m | Feminino | Termo | Risco de ulceração | 1,6 | 9 m | Resposta parcial (introdução tardia) |
| 8 | 2 m | 6 m | 43 m | Masculino | 27 semanas | Comprometimento funcional | 1,0 | 22 m | Resposta completa/quase completa |
| 9 | 3 m | 4 m | 21 m | Masculino | Termo | Lesão inestética | 1,0 | 5 m | Resposta completa/quase completa |
| 10 | 10 m | 12 m | 36 m | Feminino | Termo | Lesão inestética | 1,5 | 10 m | Resposta completa/quase completa |
| 11 | 8 m | 9 m | 35 m | Feminino | Termo | Lesão inestética | 1,6 | 15 mb | Resposta parcial (introdução tardia) |
| 12 | 6 m | 10 m | 35 m | Feminino | 30 semanas | Lesão ulcerada | 1,5 | 14 m | Resposta parcial (introdução tardia) |
| 13 | 9 m | 9 m | 48 m | Feminino | 35 semanas | Lesões inestéticas | 2,0 | 31 m | Resposta parcial (introdução tardia) |
| 14c | 12 m | 17 m | 40 m | Feminino | Termo | Lesão inestética | 2,0 | 19 m | Resposta completa/quase completa |
| 15 | 3 m | 3 m | 15 m | Masculino | Termo | Lesão inestética | 3,0 | 11 m | Falha de tratamento |
| 16 | 7 m | 12 m | 21 m | Masculino | Termo | Lesão ulcerada | 1,6 | 9 m | Resposta parcial (introdução tardia) |
HI, hemangioma infantil.
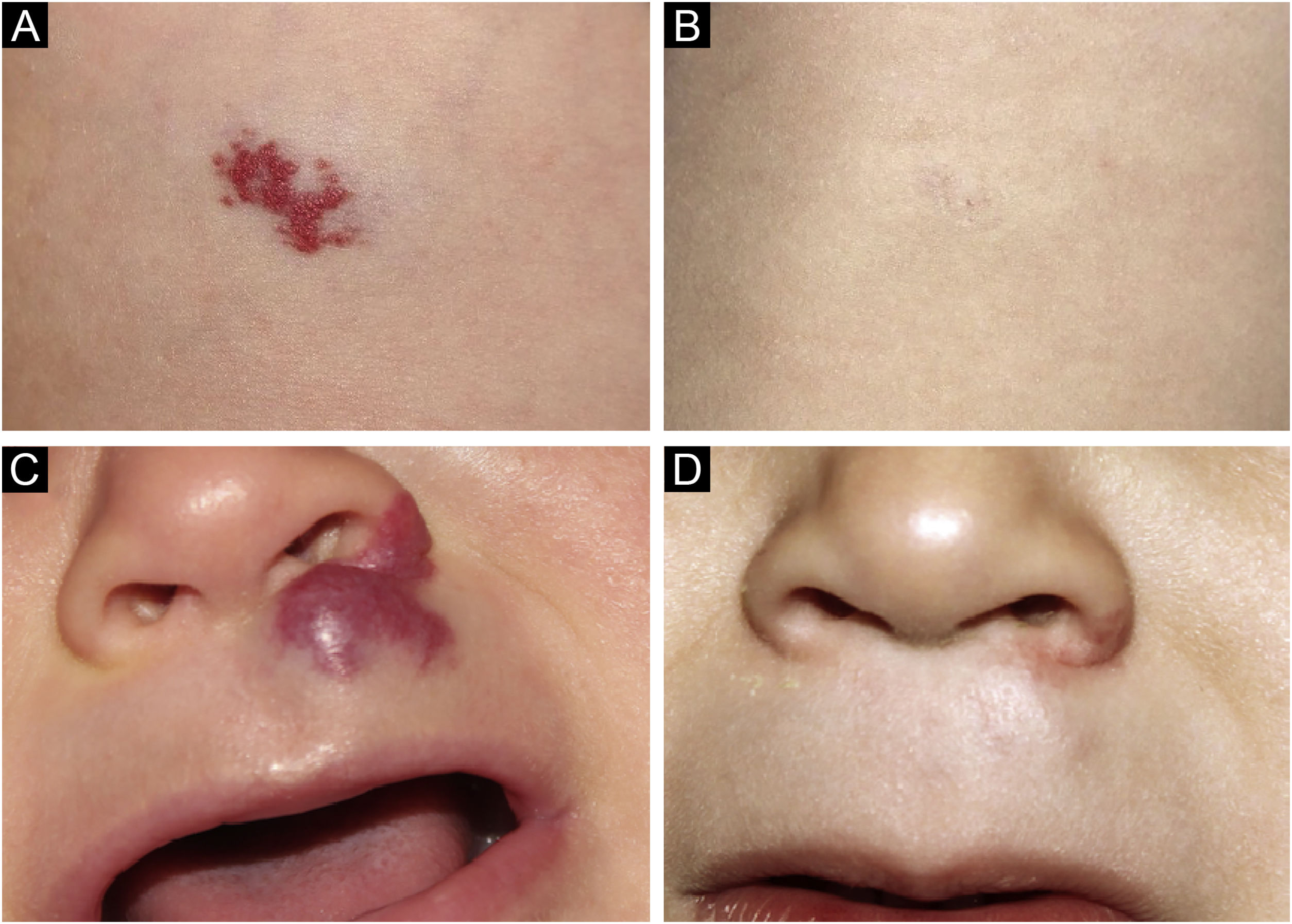
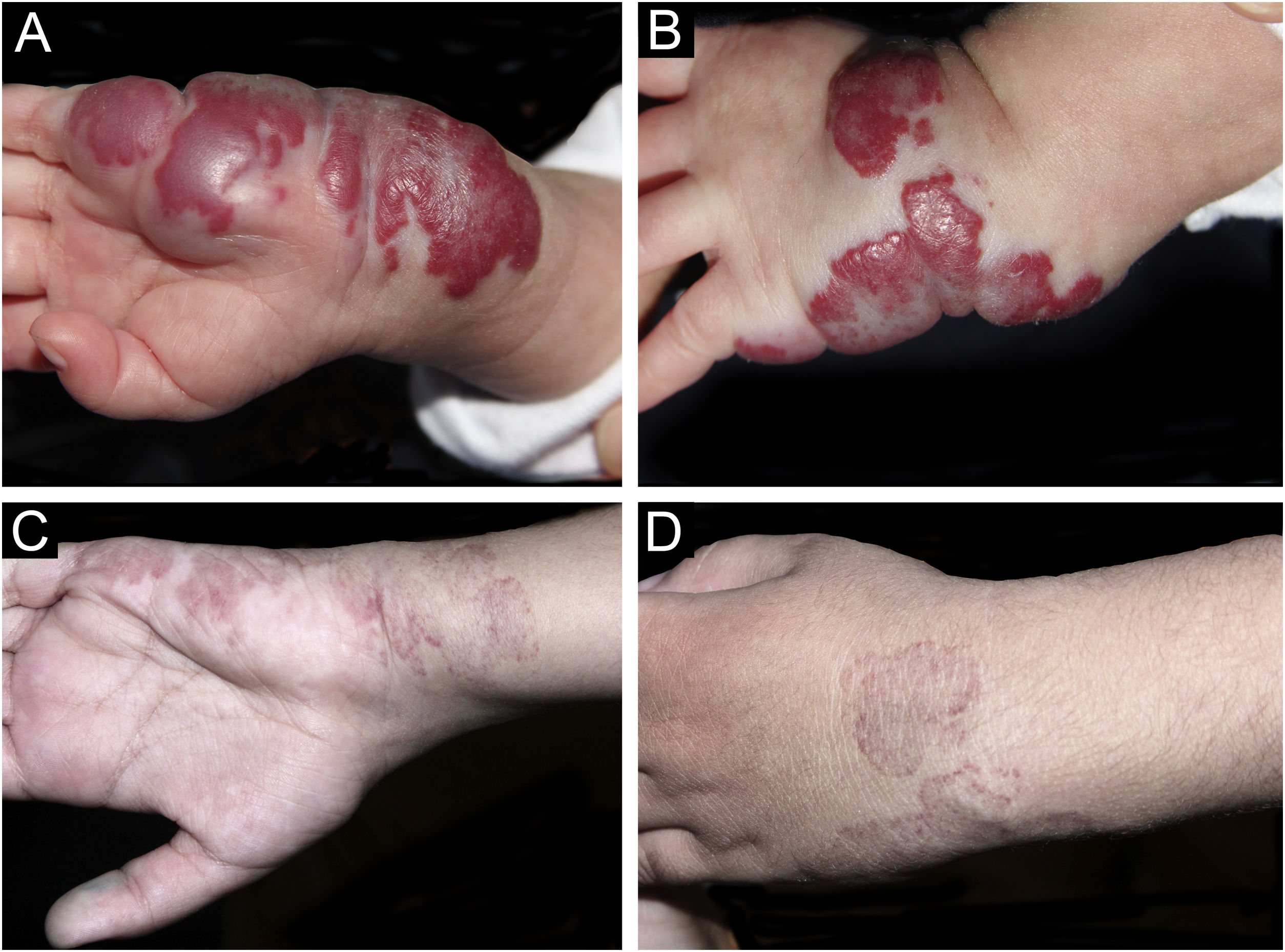
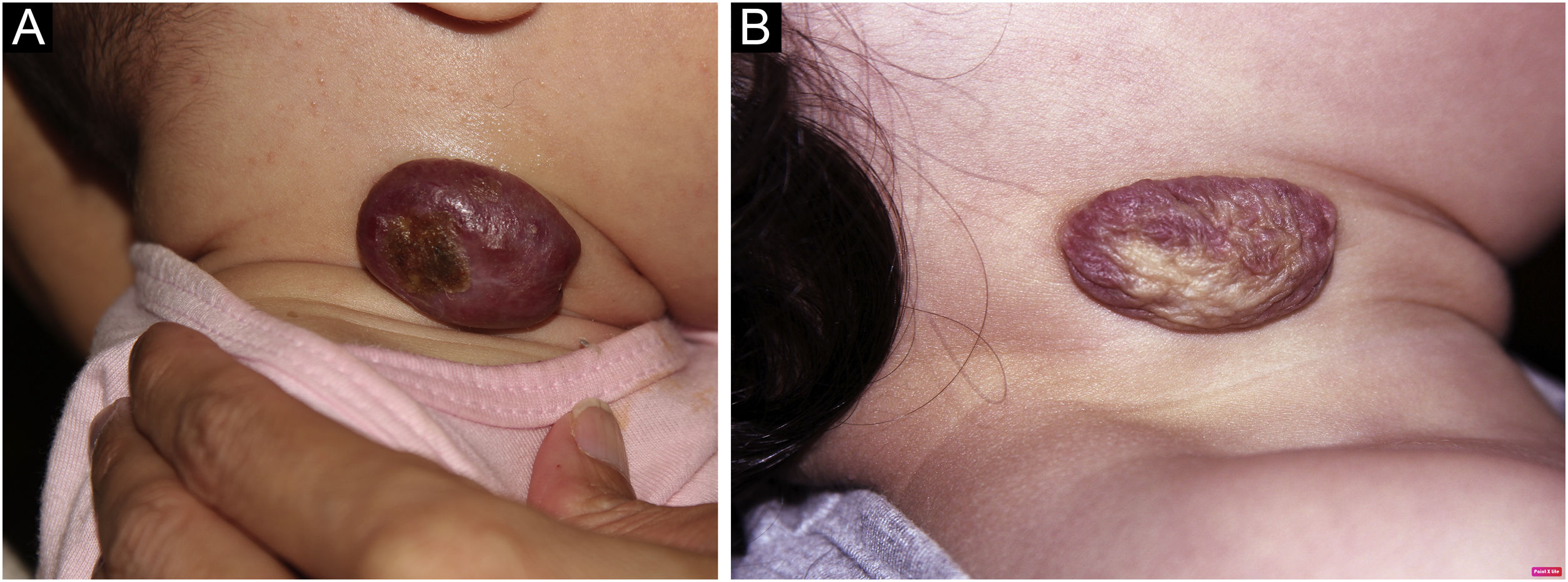
A documentação fotográfica foi registrada a cada consulta, então analisada e avaliada seguindo os critérios publicados por Pattanshetti et al.6 A redução de mais de 90% da lesão foi considerada resposta completa/quase completa, mesmo com presença de telangiectasias ou tecido redundante (figs. 1‐2). Resposta parcial foi considerada quando houve alguma redução de tamanho e alterações de cor ou consistência que não atenderam aos critérios acima (fig. 3).
Dezesseis pacientes foram monitorados, dez meninas e seis meninos; seis pacientes tinham sido bebês prematuros. A idade dos pacientes na primeira avaliação variou entre 1 e 12 meses (média de 5,9 meses), enquanto a idade no início do tratamento variou de 2 a 17 meses (média de 8,9 meses). Vinte e duas lesões em 16 pacientes foram avaliadas; três hemangiomas profundos (13,6%), nove superficiais (40,9%) e dez mistos (45,4%). Um caso apresentava múltiplos hemangiomas infantis cutâneos associados a hemangiomas hepáticos.
O tratamento sistêmico foi empregado devido a desfiguração estética em dez pacientes (62%), nove com lesões na face e um no pescoço, seguidos de hemangioma ulcerado ou com alto risco de ulceração em quatro pacientes (25%) e risco de comprometimento funcional em dois casos (12,5%). A dosagem variou de 1,0 a 3,0mg/kg/dia e doses acima da média de 1,5mg/kg/dia foram indicadas para aqueles sem resposta inicial ou HI com potencial para complicações graves.
O tratamento durou entre cinco e 31 meses. O tratamento mais curto foi relacionado a resposta clínica e ultrassonográfica completa. Por outro lado, o tratamento mais longo teve introdução tardia do medicamento, aos 9 meses de idade, e o atenolol foi suspenso aos 24 meses, mas a recorrência com aumento do HI levou à reintrodução da medicação ao longo de sete meses, levando a uma resposta parcial.
A paciente com múltiplos hemangiomas infantis cutâneos associados a lesões hepáticas teve as lesões completamente resolvidas em 18 meses, com regressão das lesões hepáticas mais rapidamente do que as cutâneas.
Não foram observados efeitos colaterais.
O HI é o tumor vascular mais comum durante a infância, com maior prevalência no gênero feminino e caucasianos.7 O propranolol, um betabloqueador lipofílico não seletivo, tem sido a terapia de primeira linha. Embora apresente bom perfil de segurança, efeitos colaterais como distúrbios do sono, bradicardia, reatividade brônquica e hipoglicemia podem ser fatores limitantes para alguns pacientes.5
O atenolol, um agente bloqueador seletivo do receptor β1‐adrenérgico, tem sido usado como alternativa ao propranolol. Por sua seletividade, o risco de hipoglicemia e broncoespasmo é reduzido; é menos lipofílico que o propranolol, não atravessa a barreira hematoencefálica, tornando os distúrbios do sono improváveis.5 O atenolol pode ser tomado em dose única diária, o que melhora a adesão ao tratamento.8 A dose alvo é de 1mg/kg/dia, mas, em casos de resposta parcial ou introdução tardia, dose de até 3mg/kg/dia pode ser utilizada.4,5
Em 2014, Ábarzúa‐Araya et al.9 relataram o primeiro ensaio clínico randomizado comparando a eficácia do propranolol e do atenolol para HI; entretanto, o tamanho da amostra do estudo não foi suficiente para estabelecer o poder estatístico. Em 2021, Yi Ji et al.10 conduziram um novo ensaio clínico multicêntrico randomizado comparando esses dois betabloqueadores, demonstrando taxas de resposta semelhantes: 93,7% no grupo propranolol e 92,5% no grupo atenolol.
No presente estudo, boa resposta foi observada em 14 casos (87,5%); houve regressão completa em nove casos (56,25%) e parcial em cinco (31,25%); nenhuma melhora foi observada em dois casos (12,5%). A resposta parcial pode ser atribuída à introdução tardia do atenolol, após a fase proliferativa. Isso ocorreu em um dos casos não respondedores. O outro pode ser considerado falha no tratamento, pois o atenolol foi introduzido em tempo hábil e doses mais altas foram utilizados (3mg/kg/dia).
Este é o primeiro relato brasileiro sobre o uso de atenolol para tratar HI problemáticos em um serviço terciário. A maioria dos casos (87,5%) respondeu ao tratamento. Melhor resposta foi observada quando o tratamento começou na fase proliferativa. Houve uma falha primária (12,5%), e nenhum efeito colateral foi observado.
É importante notar que o tratamento foi frequentemente iniciado após a fase proliferativa do HI em virtude do acesso tardio ao diagnóstico e tratamento adequados; mesmo assim, esses casos responderam bem, outra evidência da eficácia do medicamento. O tratamento foi bem tolerado, inclusive por lactentes sibilantes. Em conclusão, o atenolol foi considerado alternativa segura, eficaz e bem tolerada para o tratamento de hemangiomas infantis.
Suporte financeiroNenhum.
Contribuição dos autoresTauana Ogata Coelho da Rocha: Concepção e desenho do estudo; redação do artigo; revisão crítica da literatura.
Zilda Najjar Prado de Oliveira: Aprovação final da versão a ser enviada.
Luciana Paula Samorano: Revisão crítica do conteúdo intelectual; participação efetiva na orientação da pesquisa.
Maria Cecília Rivitti‐Machado: Revisão crítica do conteúdo intelectual; participação efetiva na orientação da pesquisa.
Camila Barreto Vianna Martins: Levantamento dos dados; revisão crítica da literatura.
Vanessa Rolim Bessa: Levantamento dos dados; revisão crítica do conteúdo intelectual.
Conflito de interessesNenhum.
Como citar este artigo: Rocha TO, Berenguer BN, Martins CB, Bessa VR, Samorano LP, Rivitti‐Machado MC, et al. Brazilian experience with oral atenolol in the treatment of infantile hemangiomas. An Bras Dermatol. 2025;100:141–5.
Trabalho realizado no Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, SP, Brasil.