O tratamento da dermatite atópica (DA) ainda apresenta desafio terapêutico. A recente aprovação de terapias direcionadas abriu novos caminhos para o tratamento, com upadacitinibe, um inibidor seletivo da Janus quinase (JAK) 1,1 destacando‐se como sólida opção. Ensaios clínicos1 e estudos da prática clínica2–7 demonstraram a eficácia e a segurança do upadacitinibe no tratamento de DA moderada a grave. Esses estudos destacam seu potencial em alcançar melhoras significantes na gravidade da doença e nos resultados relatados pelos pacientes.2–7 Entretanto, a variabilidade na resposta dos pacientes requer mais investigação sobre os preditores de sucesso terapêutico e o impacto potencial da intervenção precoce na modificação da doença em longo prazo. O presente estudo tem como objetivo avaliar a eficácia e a segurança em médio prazo do upadacitinibe na prática clínica e identificar potenciais preditores de resposta em pacientes com DA moderada a grave.
Foi realizado estudo multicêntrico retrospectivo não intervencionista nos Departamentos de Dermatologia de nove hospitais espanhóis de junho de 2023 a junho de 2024. Os pacientes descritos neste manuscrito deram consentimento informado para a publicação dos detalhes de seus casos. O estudo incluiu adolescentes e adultos com DA moderada a grave tratados com 15 ou 30mg de upadacitinibe em ambiente de prática clínica diária. Nenhuma medicação sistêmica concomitante foi prescrita. Os dados basais dos pacientes incluíram idade, gênero, comorbidades, duração da doença e tratamentos anteriores. A gravidade da doença foi avaliada usando o Eczema Area and Severity Index (EASI), Área de Superfície Corporal (ASC), Avaliação Global do Investigador (IGA, do inglês Investigator Global Assessment) para DA e a escala Numerical Rating Scale (NRS) de prurido nas semanas 4, 16 e 24. A qualidade de vida foi avaliada pelo Dermatology Life Quality Index (DLQI). A resposta da Minimal Disease Activity (MDA)8, (EASI ≤ 3 e pico de prurido NRS ≤ 1) foi avaliada na semana 24. Eventos adversos relacionados ao medicamento foram registrados ao longo do estudo. O desfecho primário foi analisar a influência das variáveis (gênero, IMC, anos de atraso no diagnóstico, presença de comorbidades atópicas, fatores de risco cardiovascular, envolvimento de áreas especiais, número de tratamentos anteriores e exposição ao dupilumabe) na resposta terapêutica na semana 24. O desfecho secundário foi analisar a evolução da resposta em termos de escores absolutos de EASI, ASC, IGA, DLQI e NRS de prurido nas semanas 4, 16 e 24 e o perfil de segurança do medicamento. Estatísticas descritivas foram usadas para avaliar as características da amostra. O teste de Shapiro‐Wilk foi usado para avaliar a normalidade das variáveis. Variáveis contínuas foram expressas como média e desvio‐padrão (DP). Variáveis qualitativas foram expressas como distribuições de frequência relativa. Regressão linear múltipla foi usada para explorar potenciais fatores associados, considerando a redução absoluta nos escores EASI e NRS como variáveis dependentes. A significância estatística foi considerada se os valores de p fossem <0,05.
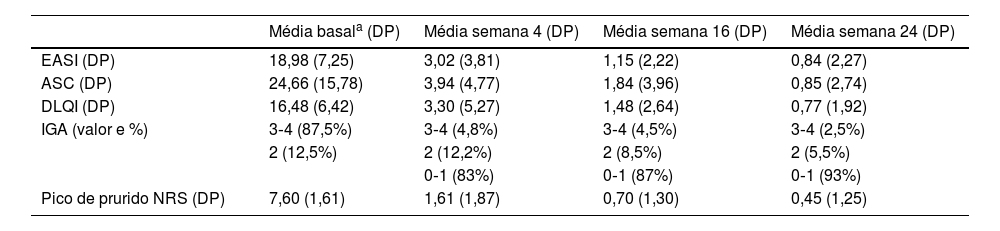
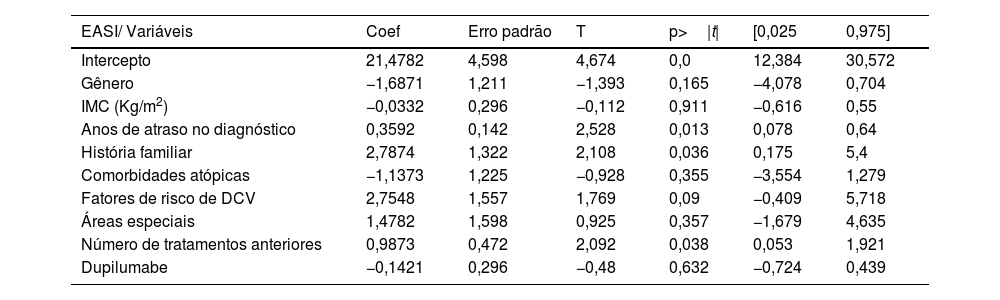
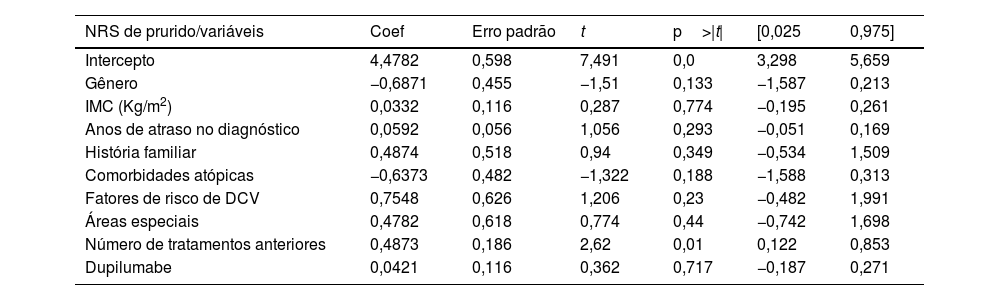
Foram incluídos 63 pacientes, com média de idade de 42,65 anos (DP=18,42). As características dos pacientes são detalhadas na tabela 1. Upadacitinibe foi o primeiro tratamento sistêmico para 16,1% dos pacientes. A maioria dos pacientes (60,5%) recebeu uma dose diária de upadacitinibe de 30mg. Apenas 5,5% dos pacientes mudaram de 30mg para 15mg após atingir a resposta ideal. A exposição média ao upadacitinibe 15 ou 30mg foi de 11,9 meses (DP=8,38). A resposta ao tratamento em termos de escores EASI, IGA, ASC, DLQI e pico de prurido NRS são detalhadas na tabela 2. Não foram observadas diferenças significantes entre os pacientes tratados com doses de 15 vs. 30mg e aqueles anteriormente tratados com dupilumabe vs. não tratados. Não foram observadas diferenças na eficácia do upadacitinibe entre diferentes fenótipos de DA. Os critérios MDA8 na semana 24 foram alcançados por 55,5% (IC 95% 42,72‐67,28) dos pacientes. Entre as variáveis analisadas, o número de anos de atraso no diagnóstico (p=0,013) e o número de tratamentos anteriores (p=0,038) mostraram associação estatisticamente significante com a resposta EASI, e o número de tratamentos anteriores (p=0,010) mostrou associação estatisticamente significante com o escore NRS de prurido na semana 24, respectivamente. A presença de histórico familiar de DA foi associada a aumento estatisticamente significante no escore EASI (p=0,036; tabela 3 e tabela 4). Vinte pacientes foram seguidos até a semana 52 e apresentaram escore EASI absoluto médio de 2,57 (DP=5,21), 90% de IGA 0‐1 e NRS de prurido de 0,89 (DP=1,94); 75% (IC 95% 64,31‐85,69) deles atingiram MDA,8 definido por EASI ≤ 3 e NRS de prurido ≤ 1. O perfil de segurança do upadacitinibe foi favorável. Infecções ou eventos cardiovasculares adversos maiores (MACE, do inglês major adverse cardiovascular events) não foram relatados. Cinco pacientes apresentaram linfopenia transitória e isolada (750–1000mm3), que se resolveu espontaneamente. Nenhum paciente interrompeu o medicamento durante o seguimento.
Características basais dos pacientes
| n=63 | |
|---|---|
| Idade (anos) (DP) | 42,65 anos (18,42) |
| Gênero (feminino) | 43,64% |
| História familiar de DA | 29,27% |
| IMC (kg/m2) (DP) | 24,11 (8,05) |
| Anos de atraso no diagnóstico (DP) | 4,56 (6,16) |
| Comorbidades atópicas | 69,09% |
| Alergia alimentar | 25,93% |
| Rinite | 50,91% |
| Asma | 41,82% |
| Fatores de risco cardiovascular | 30,91% |
| Áreas especiais | 85,45% |
| Eczema das mãos | 56,36% |
| Facial/pescoço | 74,55% |
| Genital | 20,00% |
| EASI basal (DP) | 18,98 (7,25) |
| Pico de prurido NRS basal (DP) | 7,60 (1,61) |
| IGA basal (DP) | 3,10 (0,62) |
| Número de tratamentos anteriores (DP) | 1,35 (0,95) |
| Tratamentos clássicos anteriores ou fototerapia | |
| Ciclosporina | 43,64% |
| Metotrexato | 9,09% |
| Azatioprina | 9,09% |
| Micofenolato | 3,29% |
| Fototerapia | 12,73% |
| Tratamentos avançados anteriores | |
| Dupilumabe | 44,3% |
| Traloquinumabe | 3,64% |
| Baricitinibe | 1,82% |
| Abrocitinibe | 1,82% |
| Tempo de exposição (meses) ao upadacitinibe (DP) | 11,92 (8,38) |
IMC: índice de massa corpórea; EASI: Eczema Area and Severity Index; NRS: Numerical Rating Scale; IGA: Investigator Global Assessment.
Resposta ao tratamento com upadacitinibe durante o período de seguimento
| Média basala (DP) | Média semana 4 (DP) | Média semana 16 (DP) | Média semana 24 (DP) | |
|---|---|---|---|---|
| EASI (DP) | 18,98 (7,25) | 3,02 (3,81) | 1,15 (2,22) | 0,84 (2,27) |
| ASC (DP) | 24,66 (15,78) | 3,94 (4,77) | 1,84 (3,96) | 0,85 (2,74) |
| DLQI (DP) | 16,48 (6,42) | 3,30 (5,27) | 1,48 (2,64) | 0,77 (1,92) |
| IGA (valor e %) | 3‐4 (87,5%) | 3‐4 (4,8%) | 3‐4 (4,5%) | 3‐4 (2,5%) |
| 2 (12,5%) | 2 (12,2%) | 2 (8,5%) | 2 (5,5%) | |
| 0‐1 (83%) | 0‐1 (87%) | 0‐1 (93%) | ||
| Pico de prurido NRS (DP) | 7,60 (1,61) | 1,61 (1,87) | 0,70 (1,30) | 0,45 (1,25) |
EASI, Eczema Area and Severity Index; ASC, área de superfície corporal; DLQI, Dermatology Life Quality Index; IGA, Investigator Global Assessment; NRS pruritus, Numeric Rating Scale para prurido.
Modelo de regressão linear múltipla explorando a influência de variáveis (gênero, IMC, anos de atraso no diagnóstico, presença de comorbidades atópicas, fatores de risco cardiovascular, envolvimento de áreas especiais, número de tratamentos anteriores e exposição ao dupilumabe) na resposta terapêutica em relação ao escore EASI na semana 24
| EASI/ Variáveis | Coef | Erro padrão | T | p>|t| | [0,025 | 0,975] |
|---|---|---|---|---|---|---|
| Intercepto | 21,4782 | 4,598 | 4,674 | 0,0 | 12,384 | 30,572 |
| Gênero | −1,6871 | 1,211 | −1,393 | 0,165 | −4,078 | 0,704 |
| IMC (Kg/m2) | −0,0332 | 0,296 | −0,112 | 0,911 | −0,616 | 0,55 |
| Anos de atraso no diagnóstico | 0,3592 | 0,142 | 2,528 | 0,013 | 0,078 | 0,64 |
| História familiar | 2,7874 | 1,322 | 2,108 | 0,036 | 0,175 | 5,4 |
| Comorbidades atópicas | −1,1373 | 1,225 | −0,928 | 0,355 | −3,554 | 1,279 |
| Fatores de risco de DCV | 2,7548 | 1,557 | 1,769 | 0,09 | −0,409 | 5,718 |
| Áreas especiais | 1,4782 | 1,598 | 0,925 | 0,357 | −1,679 | 4,635 |
| Número de tratamentos anteriores | 0,9873 | 0,472 | 2,092 | 0,038 | 0,053 | 1,921 |
| Dupilumabe | −0,1421 | 0,296 | −0,48 | 0,632 | −0,724 | 0,439 |
IMC, índice de massa corporal, DCV, doença cardiovascular.
Modelo de regressão linear múltipla explorando a influência de variáveis (gênero, IMC, anos de atraso no diagnóstico, presença de comorbidades atópicas, fatores de risco cardiovascular, envolvimento de áreas especiais, número de tratamentos anteriores e exposição ao dupilumabe) na resposta terapêutica em relação ao NRS de prurido na semana 24
| NRS de prurido/variáveis | Coef | Erro padrão | t | p>|t| | [0,025 | 0,975] |
|---|---|---|---|---|---|---|
| Intercepto | 4,4782 | 0,598 | 7,491 | 0,0 | 3,298 | 5,659 |
| Gênero | −0,6871 | 0,455 | −1,51 | 0,133 | −1,587 | 0,213 |
| IMC (Kg/m2) | 0,0332 | 0,116 | 0,287 | 0,774 | −0,195 | 0,261 |
| Anos de atraso no diagnóstico | 0,0592 | 0,056 | 1,056 | 0,293 | −0,051 | 0,169 |
| História familiar | 0,4874 | 0,518 | 0,94 | 0,349 | −0,534 | 1,509 |
| Comorbidades atópicas | −0,6373 | 0,482 | −1,322 | 0,188 | −1,588 | 0,313 |
| Fatores de risco de DCV | 0,7548 | 0,626 | 1,206 | 0,23 | −0,482 | 1,991 |
| Áreas especiais | 0,4782 | 0,618 | 0,774 | 0,44 | −0,742 | 1,698 |
| Número de tratamentos anteriores | 0,4873 | 0,186 | 2,62 | 0,01 | 0,122 | 0,853 |
| Dupilumabe | 0,0421 | 0,116 | 0,362 | 0,717 | −0,187 | 0,271 |
IMC, índice de massa corporal, DCV, doença cardiovascular.
Na presente série, o tratamento com upadacitinibe em pacientes com DA moderada a grave mostrou eficácia significante em médio e longo prazo. Esses resultados são semelhantes aos já relatados em ensaios clínicos e grandes séries da prática clínica.1–8 Os pacientes da presente série exibiram perfis de doença grave e resistência a múltiplas terapias sistêmicas, incluindo biológicos, o que contrasta com os perfis tipicamente vistos em ensaios clínicos.1 Além disso, na semana 16, mais de 50% dos pacientes atingiram MDA (definido na presente série como EASI ≤ 3 e pico de prurido NRS ≤ 1), um critério de resposta mais rigoroso recentemente proposto por Silverberg JI et al.,8 que abrange resposta clínica e resultados relatados pelo paciente (PROs, do inglês patient‐reported outcomes). A porcentagem de MDA aumentou para 75% na semana 52. É digno de nota que, apesar da alta proporção de pacientes que alcançaram melhoras substanciais no escore EASI, pico de prurido NRS e índice IGA, o número de anos de atraso no diagnóstico e o número de tratamentos anteriores podem influenciar negativamente a resposta terapêutica, destacando a importância do tratamento precoce.9 Isso reforça a hipótese recente em relação a casos avançados e de longa data, de que as principais citocinas envolvidas na inflamação cutânea, particularmente as citocinas Th2 (Interleucina [IL]‐4, IL‐5, IL‐13, IL‐31)/via JAK‐1 também podem estar implicadas na promoção do prurido a nível neuronal (neuroinflamação), cronificando assim o processo.10 Isso levanta a questão de se a intervenção precoce para DA poderia levar à modificação da doença, seja em gravidade ou em persistência futura.9 Este estudo tem algumas limitações, das quais a principal deriva de sua natureza observacional e retrospectiva, que não permite que dados ausentes sejam recuperados. Além disso, apenas pacientes que utilizaram upadacitinibe por pelo menos 24 semanas foram analisados, e aqueles que descontinuaram o medicamento não foram avaliados. Isso pode superestimar as taxas de sucesso e segurança na atual amostra. Outras limitações incluíram o pequeno tamanho amostral e os ajustes estatísticos realizados, o que pode impactar a precisão e generalização dos resultados. Em conclusão, o upadacitinibe é apresentado como alternativa eficaz no tratamento da DA moderada a grave, com melhora significante observada no seguimento em médio e longo prazo. Apesar dos resultados promissores, a intervenção precoce continua crucial em virtude do potencial impacto negativo de atrasos no diagnóstico e múltiplos tratamentos anteriores na resposta terapêutica.
Suporte financeiroNenhum.
Contribuição dos autoresFrancisco Javier Melgosa Ramos: Contribuiu para a concepção e planejamento do estudo, obtenção e interpretação dos dados, elaboração e redação do manuscrito e revisão do presente trabalho.
Carlos Abril Pérez: Contribuiu para a concepção do estudo, obtenção e interpretação dos dados e revisão do presente trabalho.
Santiago Guillén Climent: Contribuiu para obtenção e interpretação dos dados, e revisão do presente trabalho.
María Matellanes Palacios: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Juncal Roca Ginés: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Javier Sabater Abad: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Eduardo Bernia Petit: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Andrés Casanova Esquembre: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Andrea Estébanez Corrales: Contribuiu para a obtenção e interpretação dos dados e revisão do presente trabalho.
Victor González Delgado: Contribuiu para a concepção e planejamento do estudo, obtenção e interpretação dos dados, elaboração e redação do manuscrito e revisão do presente trabalho.
Conflito de interessesNenhum.
Os pacientes descritos neste manuscrito deram consentimento informado para a publicação dos detalhes de seus casos.
Como citar este artigo: Ramos FJM, Pérez CA, Climent SG, Palacios MM, Ginés JR, Abad JS, et al. Mid‐term effectiveness, safety, and potential predictors of response of upadacitinib in patients with moderate‐to‐severe atopic dermatitis: a multicenter observational retrospective study (63‐patients). An Bras Dermatol. 2025;100:566–9.
Trabalho realizado nos seguintes hospitais da Comunidade Valenciana, Espanha: Hospital Universitario Doctor Peset, Hospital Lluís Alcanyís, Hospital Universitario y Politécnico La Fe, Hospital Universitario Virgen de los Lirios, Hospital Arnau de Vilanova, Hospital General Universitario de Castellón, Hospital de la Ribera, Hospital Frances de Borja, Hospital Clínico Universitario de Valencia.