Pioderma gangrenoso (PG) é dermatose autoinflamatória neutrofílica ligada a respostas imunes desreguladas em indivíduos geneticamente predispostos. O PG envolve citocinas elevadas como TNF‐α e interleucinas (IL‐1α, IL‐17, IL‐23), levando a úlceras cutâneas,1,2 e é frequentemente associado a condições sistêmicas como artrite reumatoide, doença inflamatória intestinal e síndrome/neoplasia mielodisplásica (SMD), particularmente em casos com trissomia do cromossomo 8.3 Essa anormalidade genética pode aumentar as vias inflamatórias, contribuindo para a gravidade do PG.4 O PG frequentemente precede o início da SMD, sugerindo seu potencial como preditor de distúrbios hematológicos subjacentes, embora nenhum caso tenha sido encontrado ligando SMD de alto risco com trissomia 8 e PG.5,6
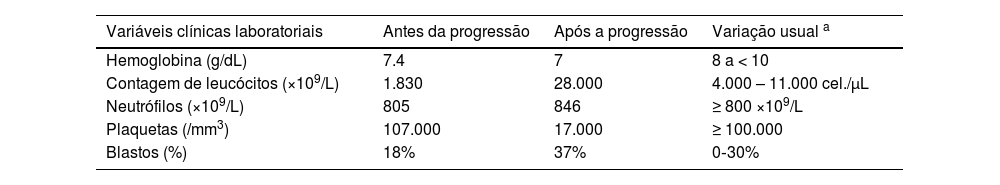
Neste estudo, uma paciente de 69 anos foi admitida no pronto‐socorro de um hospital terciário brasileiro com histórico de fadiga, dor nos membros inferiores, febre e pancitopenia com um mês de duração, apresentando nível de hemoglobina de 7,4g/dL, contagem de leucócitos de 1.830 e contagem de plaquetas de 107.000 (tabela 1). Inicialmente, o exame de aspirado de medula óssea foi realizado para explorar a causa da pancitopenia. Os resultados revelaram contagem de blastos de 18% (tabela 1), indicando a possibilidade de SMD, especificamente classificada como subtipo anemia refratária com excesso de blastos‐2 (AREB‐2). Foi realizada análise de cariótipo, que mostrou 47,XX,+8[11]/46,XX[1] (fig. 1), classificando a paciente como de risco muito alto segundo o Revised International Prognostic Scoring System (IPSS‐R).
Variáveis clínicas e laboratoriais antes e depois da progressão para leucemia mieloide aguda (LMA) em paciente com síndrome/neoplasia mielodisplásica (SMD) e pioderma gangrenoso (PG)
| Variáveis clínicas laboratoriais | Antes da progressão | Após a progressão | Variação usual a |
|---|---|---|---|
| Hemoglobina (g/dL) | 7.4 | 7 | 8 a < 10 |
| Contagem de leucócitos (×109/L) | 1.830 | 28.000 | 4.000 – 11.000 cel./μL |
| Neutrófilos (×109/L) | 805 | 846 | ≥ 800 ×109/L |
| Plaquetas (/mm3) | 107.000 | 17.000 | ≥ 100.000 |
| Blastos (%) | 18% | 37% | 0‐30% |
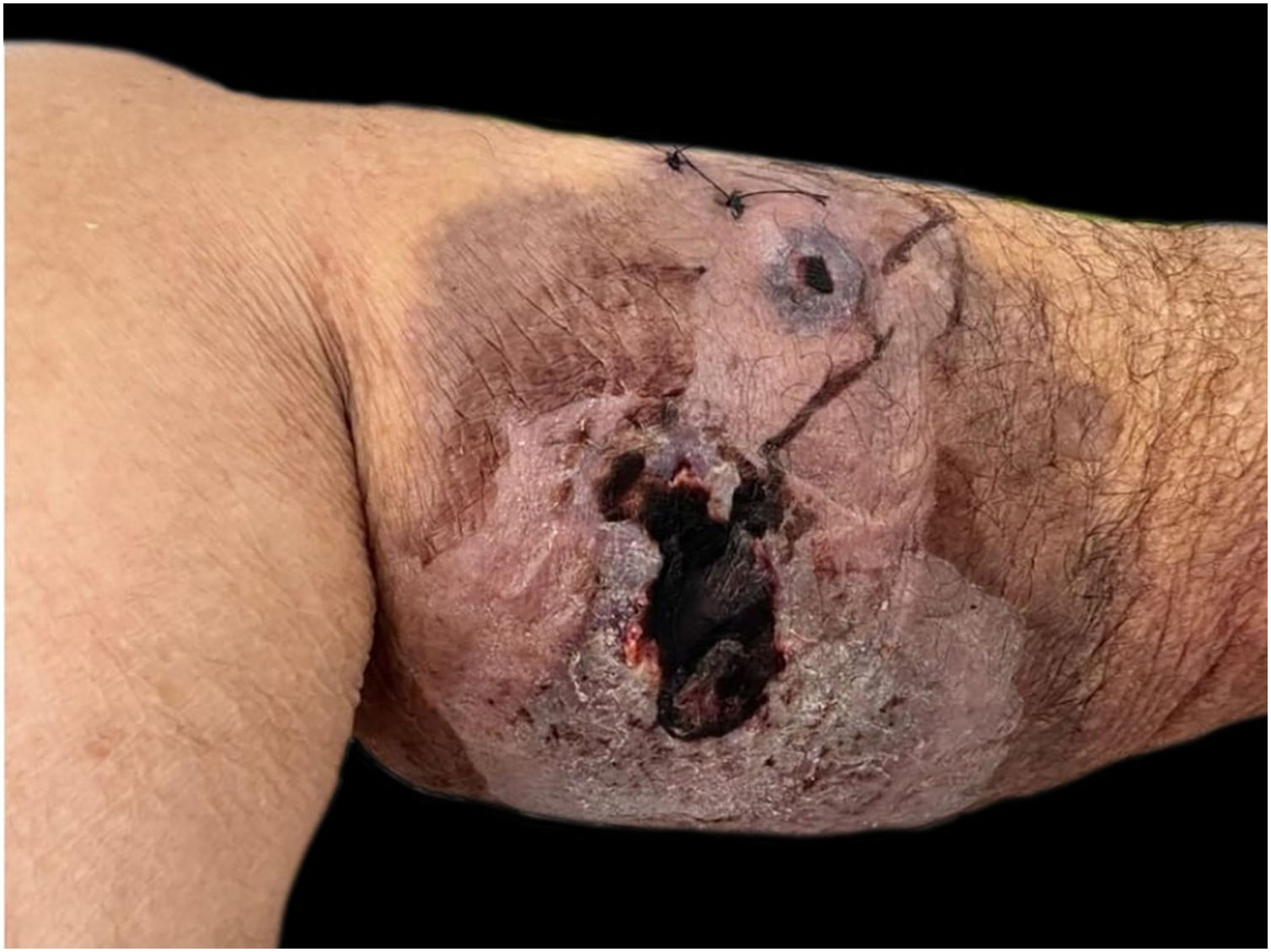
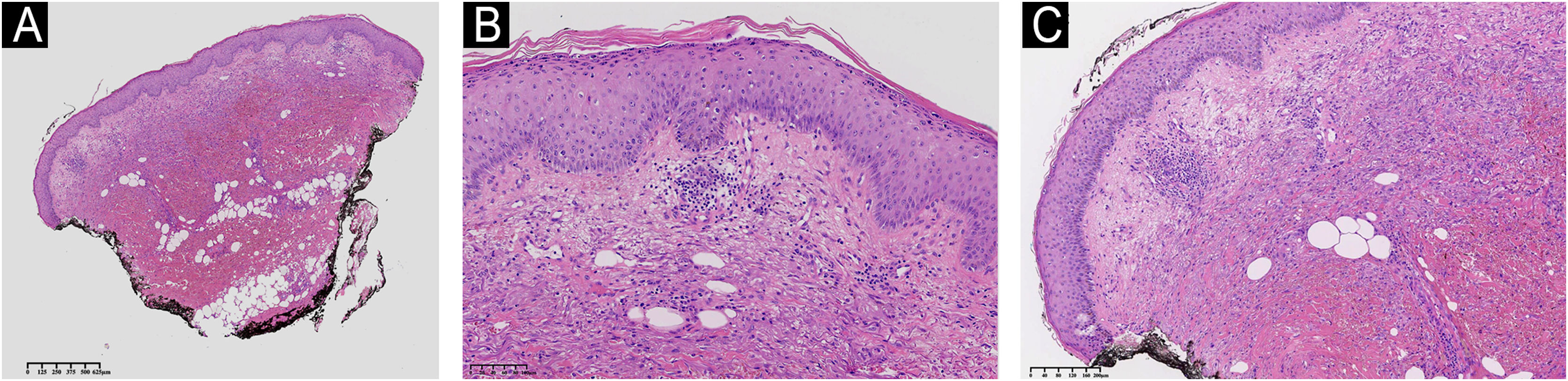
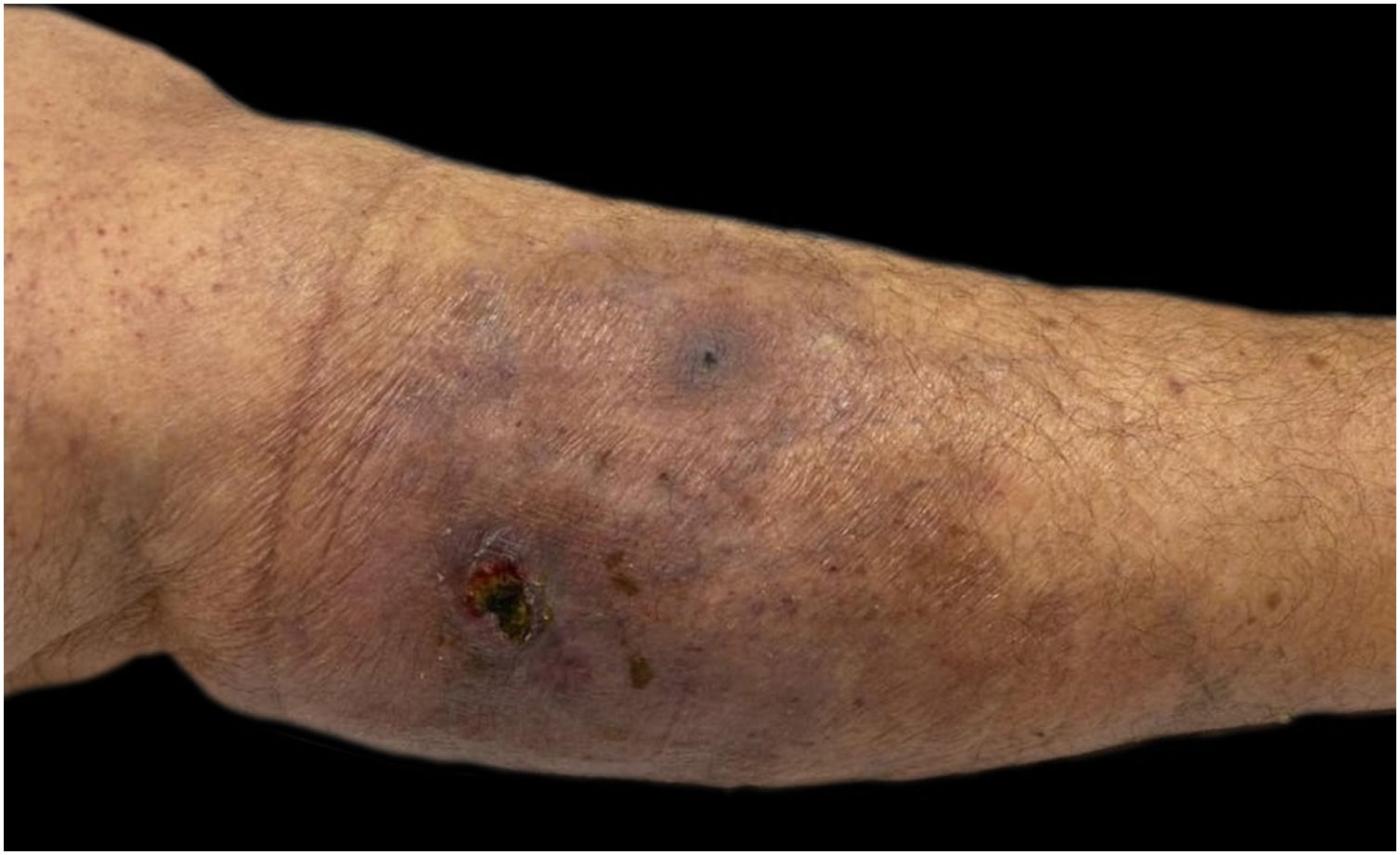
A paciente apresentava placa cutânea na panturrilha esquerda que evoluiu para bolha hemorrágica, depois úlcera com bordas irregulares (fig. 2). Os tratamentos iniciais com piperacilina/tazobactam e vancomicina para suspeita de infecção não levaram à melhora da lesão. A histopatologia de biopsia de lesão da perna revelou infiltrado de neutrófilos maduros e ulceração epidérmica consistente com PG (fig. 3). A paciente recebeu prescrição de dapsona 100mg/dia por 45 dias para tratar a lesão, com seguimento ambulatorial programado. Após a conclusão do tratamento, as lesões regrediram, como mostrado na figura 4, e a administração de dapsona foi descontinuada.
Histopatologia da pele mostrando hiperceratose e acantose de pequeno grau. A derme mostra infiltrado inflamatório moderado de leucócitos linfoplasmocitários, e hemorragia tecidual extensa. Não há evidência de vasculite nem de edema na derme papilar. (A) Histopatologia da pele em pequeno aumento demonstrando hiperceratose, inflamação de pequeno grau e hemorragia. (B) Hiperceratose e acantose de pequeno grau. (C) Infiltrado inflamatório moderado com acentuação perivascular e hemorragia tecidual na derme profunda e hipoderme. Coloração de Hematoxilina & eosina.
Entretanto, após duas semanas, a condição hematológica da paciente deteriorou, apresentando nível de hemoglobina de 7g/dL, contagem de glóbulos brancos de 28.000 (incluindo 846 neutrófilos e 26.000 blastos) e contagem de plaquetas de 17.000 (tabela 1). Mielograma subsequente revelou porcentagem de blastos de 37% (tabela 1), levando ao diagnóstico de leucemia mieloide aguda (LMA) secundária (tabela 1). A paciente recebeu prescrição de venetoclax 100mg e azacitidina 100mg durante cinco dias, com intervalo de 21 dias entre as aplicações para o tratamento de LMA. Infelizmente, a paciente veio a óbito após dois meses de tratamento em virtude de acidente vascular encefálico hemorrágico, que foi atribuído à trombocitopenia grave. O estudo foi realizado de acordo com as diretrizes CARE.
Os resultados do presente estudo demonstraram que a associação de PG com distúrbios hematológicos, particularmente SMD de alto risco e a presença de trissomia 8, sugere conexão genética e imunológica mais profunda que pode influenciar tanto a apresentação quanto os resultados do tratamento dos pacientes afetados. A terapia de primeira linha para PG é feita com glicocorticoides, tipicamente iniciados em altas doses (1–2mg/kg) durante a fase aguda.7 Entretanto, esse protocolo não foi seguido em virtude da falta de seguimento ambulatorial viável. Outra opção terapêutica possível é a imunossupressão; entretanto, a neutropenia foi considerada contraindicação pelo alto risco de infecção, uma das principais causas de morte na LMA.8
A dapsona, além de seu uso para infecções bacterianas como inibidor da síntese bacteriana de ácido fólico, atua na citotoxicidade do peróxido de mieloperoxidase mediada por haleto ‐ um componente da explosão respiratória de neutrófilos. Também inibe a síntese de lipídios quimiotáticos e interfere na quimiotaxia, reduzindo a migração de neutrófilos para as lesões. Esse medicamento foi selecionado para tratamento por sua ampla disponibilidade e baixo custo se autoadquirido, e seus efeitos colaterais controláveis em baixas doses, como áreas de hiperpigmentação ‐ o que é aceitável em comparação ao risco de osteoporose induzida por glicocorticoides ou ao alto risco de infecção com imunossupressores. Além disso, a paciente não tinha interações medicamentosas conhecidas, e o prescritor tinha experiência anterior com sucesso no uso de dapsona para PG, obtendo remissão da lesão. O médico prescritor deve adaptar as abordagens terapêuticas individualmente, considerando as necessidades de cada paciente, potencial de adesão, riscos e circunstâncias sociais para otimizar a recuperação.
Além disso, de modo semelhante ao presente caso, Haga et al.9 discutem PG mucocutâneo decorrente de infiltrados neutrofílicos com trissomia 8 em um paciente japonês, masculino, de 87 anos com SMD, ilustrando a complexa fisiopatologia que fundamenta essa associação e potencialmente orientando decisões terapêuticas. O presente caso reforça a hipótese clínica de que PG pode ser considerado manifestação externa da complexidade e gravidade da doença hematológica subjacente. A natureza agressiva das lesões cutâneas no PG, caracterizada por seu rápido início e resistência aos tratamentos convencionais, pode ser paralela à progressão de neoplasias malignas hematológicas de um estado mais indolente para uma fase agressiva e aguda. Assim, o PG pode não apenas servir como marcador para a presença de uma doença hematológica subjacente, mas também pode indicar um ponto de virada na trajetória da doença em direção a um estado mais agressivo e menos responsivo.
Essa hipótese é apoiada pela noção de que tanto o PG quanto a progressão da SMD para LMA envolvem respostas imunológicas desreguladas e vias inflamatórias. As anormalidades genéticas associadas à SMD, como a trissomia 8, podem exacerbar ainda mais essa desregulação, levando à manifestação do PG como consequência direta da progressão da doença subjacente. Além disso, a evolução da SMD para LMA, marcada pelo aumento nas células blásticas e piora da citopenia, pode manifestar‐se na pele pelo agravamento ou progressão descontrolada das lesões do PG.
Em resumo, relata‐se pela primeira vez uma resposta rápida de regressão de lesão de PG em paciente brasileira com SMD‐AREB‐2 com trissomia 8 tratada com dapsona. Até o momento, dados sobre pacientes com SMD de alto risco com trissomia 8 são raros em estudos de coorte e seguimento clínico. Este relato de caso destaca a associação do comprometimento imunológico da paciente com SMD, provavelmente causado pela presença de trissomia 8, que pode ter desencadeado PG como manifestação dermatológica. Por fim, essa associação ressalta a intrincada interação entre anormalidades genéticas e desregulação imunológica na patogênese de distúrbios hematológicos com manifestações cutâneas, indicando a necessidade de maior investigação e considerações adicionais nas estratégias de manejo clínico de pacientes com SMD.
Suporte financeiroEsta pesquisa foi financiada pelo Ministério da Ciência e Tecnologia do Brasil com apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) intitulada: “UNIVERSAL CNPq/MCTI/FNDCT n° 18/2021 ‐ Faixa B ‐ Grupos Consolidados ‐ #422726/2021‐4 ‐ Análise da via STING de pacientes com síndrome mielodisplásica primária e de modelos de lesão de fita dupla de DNA secundária a quimioterápicos em pacientes oncológicos e camundongos C57BL/6”. Esta pesquisa foi financiada pelo Ministério da Ciência e Tecnologia do Brasil com apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) intitulada: “CHAMADA CNPQ/MCTI/CT‐BIOTEC n° 30/2022 ‐ Linha 2: Novas tecnologias em Biotecnologia ‐ #440389/2022‐4 ‐ Desenvolvimento de linhagens geneticamente modificadas por crispr/cas9 com perda de função do gene TP53: induzindo o fenótipo de instabilidade genômica da neoplasia mielodisplásica (SMD)”. Esta pesquisa foi financiada pelo Instituto Nacional de Ciência e Tecnologia do Sangue (INCT do Sangue) / #405918/2022‐4). Howard Lopes Ribeiro Junior é bolsista de Produtividade em Pesquisa do CNPq ‐ Nível 2 (Projeto: Chamada CNPq n° 09/2023 ‐ Bolsas de Produtividade em Pesquisa ‐ PQ #305659/2023‐5). Esta pesquisa foi financiada pela Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP) (UNI‐0210‐00007.01.00/23) intitulada: “Estabelecimento de um escore de risco poligênico (PRS) para a neoplasia mielodisplásica no idoso: uma coorte brasileira”.
Contribuição dos autoresRenato Mendes Martins: Concepção e planejamento do estudo; obtenção ou processamento dos dados; análise ou interpretação dos dados; busca bibliográfica; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Howard Lopes Ribeiro Junior: Concepção e planejamento do estudo; análise ou interpretação dos dados; busca bibliográfica; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Natália Feitosa Arrais Minete Mendonça: Concepção e planejamento do estudo; obtenção ou processamento dos dados; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Fábio Rocha Fernandes Távora: Obtenção ou processamento dos dados; análise ou interpretação dos dados; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Ronald Feitosa Pinheiro: Concepção e planejamento do estudo; obtenção ou processamento dos dados; análise ou interpretação dos dados; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Este trabalho recebeu apoio da CAPES, CNPq e FUNCAP.
Como citar este artigo: Martins RM, Ribeiro HL Jr, Mendonça NFAM, Távora FRF, Pinheiro RF. Pyoderma Gangrenosum diagnosed in a high‐risk Myelodysplastic Neoplasm patient with trisomy 8: a rare case report. An Bras Dermatol. 2025;100:602–5.
Trabalho realizado na Universidade Federal do Ceará, Fortaleza, CE, Brasil.


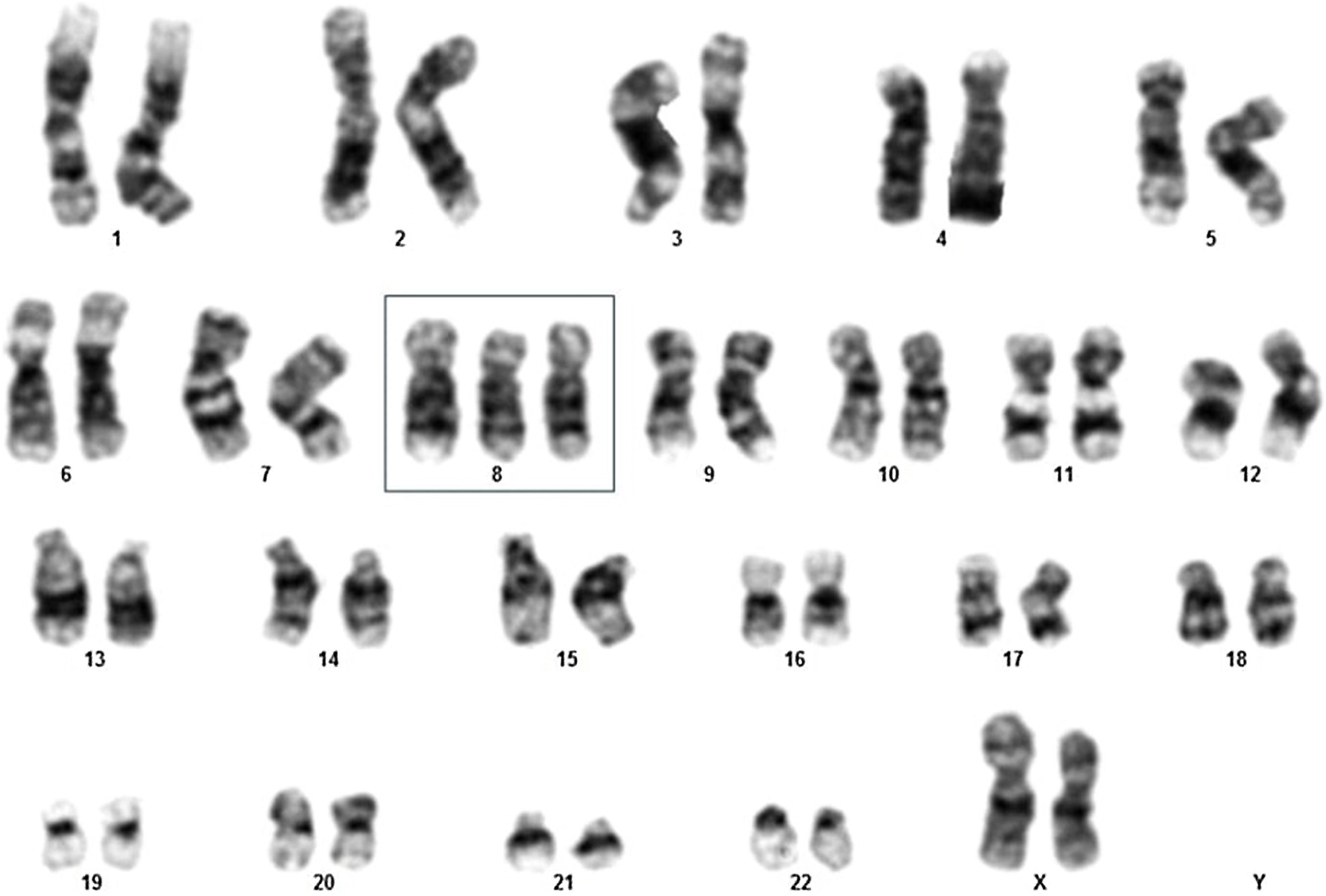
![Análise do cariótipo de paciente idosa portadora de neoplasia mielodisplásica demonstrando 47,XX,+8[11]/46,XX [1]. Análise do cariótipo de paciente idosa portadora de neoplasia mielodisplásica demonstrando 47,XX,+8[11]/46,XX [1].](https://static.elsevier.es/multimedia/26662752/0000010000000003/v2_202506100719/S2666275225000608/v2_202506100719/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)



