A psoríase é doença cutânea imunomediada comum que pode afetar outros órgãos e tecidos, incluindo a mucosa oral. Alguns estudos encontraram proporção aumentada de língua geográfica (LG) e língua fissurada (LF) em pacientes com psoríase, o que parece ser específico da região.
ObjetivosA associação da psoríase com LG/LF em populações do Leste Asiático permanece desconhecida. Assim, objetivou‐se investigar a associação da psoríase com LG/LF na população Han no sudoeste da China.
MétodosO presente estudo foi realizado em 230 casos de psoríase e 230 controles saudáveis no West China Hospital. Foi comparada a proporção de indivíduos com LG/LF nos dois grupos e também idade, gênero, tabagismo, etilismo, idade de início da psoríase, duração da psoríase, envolvimento ungueal e articular, índice PASI, área de superfície corporal, índice de qualidade de vida em dermatologia e proporção de uso de produtos biológicos em pacientes com psoríase com ou sem LG/LF.
ResultadosFoi encontrada forte associação entre psoríase e LF (p <0,001) e associação não significante entre psoríase e LG (p=0,760). Comparando pacientes com psoríase sem LF, foi observado que os pacientes com psoríase e LF eram mais velhos (p=0,021) e tinham frequência aumentada de psoríase de início tardio (p=0,014), também psoríase mais grave (p=0,047) e pior qualidade de vida (p=0,045).
Limitações do estudoA LG tem períodos de exacerbação e remissão; portanto, não é possível evitar o desvio da prevalência de LG nesse estudo da verdadeira taxa de prevalência. Além disso, descobriu‐se que os produtos biológicos levam à remissão de LG e LF, o que pode ter influenciado a relação LG/LF no grupo de casos desse estudo.
ConclusõesA psoríase foi associada à LF na população Han do sudoeste da China; é necessário prestar atenção ao tratamento de indivíduos com psoríase e LF e à observação de doenças cutâneas em pacientes com LF.
Psoríase é doença inflamatória crônica da pele, imunomediada, comum, na qual fatores genéticos desempenham papel fundamental. Entretanto, a importância de fatores ambientais, como o tabagismo e o etilismo, está aumentando.1,2 Sua prevalência é de aproximadamente 2%.3 Placas eritematosas com descamação, localizadas ou disseminadas, são sua manifestação típica, podendo ser classificada como comum, pustulosa, eritrodérmica ou artrítica, dependendo das lesões clínicas. Além da pele, a doença também pode afetar as unhas das mãos/pés e articulações, afetando gravemente a qualidade de vida dos pacientes. A psoríase pode afetar a mucosa oral e é conhecida como “psoríase oral”, com muitos estudos nos últimos anos concentrando‐se em suas lesões orais inespecíficas: língua geográfica (LG) e língua fissurada (LF).4
A LG é doença inflamatória benigna, crônica e recorrente da língua, caracterizada por lesões eritematosas multifocais formadas por atrofia das papilas filiformes, circundadas por borda branca ou amarela levemente elevada, correspondendo a hiperplasia das papilas filiformes, com aspecto semelhante a um mapa. As lesões variam em padrão e localização, são conhecidas como “glossite migratória” e sua prevalência é de 0,28% a 14,4%. É mais comum em crianças e diminui com a idade; as mulheres são afetadas com maior frequência que os homens.5 Os fatores de risco para LG incluem fatores imunológicos, genéticos, alérgicos e psicológicos. Ela pode ser acompanhada por outras doenças, como psoríase, LF, síndrome de ardência bucal, diabetes mellitus e síndrome de Down.6 A LG é geralmente assintomática, mas os pacientes frequentemente desenvolvem ansiedade grave e medo de câncer; portanto, é necessária explicação detalhada dessa doença. Alguns pacientes apresentam sensações de ardência e desconforto. O tratamento sintomático pode ser eficaz, com o emprego de anti‐histamínicos, ansiolíticos e esteroides.5
A LF é geralmente considerada anomalia congênita, caracterizada por fissuras nas faces dorsal e/ou dorsolateral da língua em diferentes arranjos e profundidades.7 A incidência é de 0,6% a 29,2%,8 e sua frequência aumenta com a idade. A etiologia da LF também é desconhecida; fatores genéticos podem ser importante fator de risco para essa condição. A LF frequentemente coexiste com a LG, síndrome de Down, acromegalia, síndrome de Sjögren e síndrome de Melkersson‐Rosenthal.7
As prevalências de psoríase, LG e LF são todas específicas regionalmente.8 A associação de psoríase com LG/LF em populações do Leste Asiático permanece desconhecida. Portanto, o presente estudo teve como objetivo determinar a associação da psoríase com LG/LF na população Han do sudoeste da China e caracterizar essas associações em relação ao estado geral dos pacientes, condição da psoríase e modalidade de tratamento.
MétodosA presente investigação é um estudo transversal, caso‐controle, planejado e conduzido de acordo com a Declaração de Helsinque da World Medical Association. Este estudo foi aprovado pelo comitê de ética local e todos os 460 indivíduos deram o consentimento informado. Duzentos e trinta pacientes com psoríase tratados no Departamento de Dermatologia do West China Hospital, Sichuan University, de outubro de 2022 a fevereiro de 2023, foram incluídos no grupo de casos. O presente estudo não excluiu pacientes com psoríase em uso de qualquer tratamento, incluindo produtos biológicos. Duzentos e trinta indivíduos saudáveis acompanhantes de outros pacientes, nunca diagnosticados com psoríase e pareados por idade e gênero ao grupo de casos, foram incluídos no grupo controle.
O diagnóstico de psoríase foi realizado por dermatologista e estabelecido com base em manifestações clínicas típicas: placas eritematosas descamativas, ou confirmada por exame histopatológico se as lesões fossem atípicas. Todos os indivíduos foram submetidos a exame bucal detalhado. O exame bucal foi realizado por dentistas qualificados e com experiência no diagnóstico e tratamento de doenças bucais utilizando estomatoscópios e swabs sob luz artificial. A LG foi diagnosticada por sua apresentação clínica típica: atrofia das papilas filiformes como lesão semelhante a placa vermelha com hiperplasia das papilas filiformes circundantes. A LG é doença crônica recidivante‐remitente com períodos de exacerbação e remissão, então foram preparadas fotografias clínicas típicas da LG para determinar se cada indivíduo havia apresentado lesão semelhante anteriormente. A LF também é diagnosticada por meio de suas manifestações clínicas típicas: fissuras na face dorsal e/ou dorsolateral da língua em diferentes arranjos e profundidades.
As informações gerais, incluindo idade, gênero, tabagismo, etilismo, idade no início da psoríase (início precoce: início até os 40 anos; início tardio: início após 40 anos), duração da psoríase, envolvimento ungueal e articular, índice PASI (Psoriasis Area and Severity Index), área de superfície corporal (ASC), Índice de Qualidade de Vida em Dermatologia (DLQI, Dermatology Life Quality Index) e tipo de tratamento recebido foram registrados.
Foi comparada a proporção de indivíduos com LG e LF nos grupos caso e controle e foram comparados os seguintes dados: idade, gênero, tabagismo, etilismo, idade no início da psoríase, duração da psoríase, envolvimento ungueal e articular, PASI, ASC, DLQI e proporção de pacientes psoriásicos, com ou sem LG/LF, em uso de produtos biológicos.
Os dados foram analisados utilizando o software IBM SPSS Statistics versão 26. De acordo com os resultados do teste de Kolmogorov‐Smirnov, as variáveis contínuas deste estudo foram apresentadas como mediana (intervalo interquartil) e comparadas pelo teste U de Mann‐Whitney. As variáveis categóricas foram apresentadas como número (porcentagem) e comparadas pelo teste Qui‐Quadrado de Pearson ou teste exato de Fisher. Valor de p bilateral <0,05 foi considerado estatisticamente significante.
ResultadosUm total de 460 indivíduos foi incluído neste estudo: 230 pacientes com psoríase e 230 controles saudáveis. O grupo caso consistiu em 136 homens e 94 mulheres, com mediana de idade de 36 (29‐49) anos. O grupo controle consistiu em 123 homens e 107 mulheres, com mediana de idade de 39 (31‐51) anos (tabela 1). Os grupos caso e controle foram pareados por idade e gênero (idade: p=0,130; sexo: p=0,222).
Características gerais dos grupos caso e controle
| Total (n=460) | Número de pacientes (%)/mediana (IIQ) | Valor de Z/χ2 | p‐valor | |
|---|---|---|---|---|
| Psoríase (n=230) | Controles (n=230) | |||
| Idade, anos | 36 (29–49) | 39 (31–51) | −1,513 | 0,130 |
| Gênero | ||||
| Masculino | 136 (59,1) | 123 (53,5) | 1,493 | 0,222 |
| Feminino | 94 (40,9) | 107 (46,5) | ||
IIQ, intervalo interquartil.
Foi encontrada associação não significante entre psoríase e LG (p=0,760) e forte associação entre psoríase e LF (p <0,001; tabela 2).
Língua geográfica e língua fissurada no grupos caso (n=230) e controle (n=230)
| Número de pacientes (%) | χ2 valor | p‐valor | ||
|---|---|---|---|---|
| Psoríase (n=230) | Controles(n=230) | |||
| LG | ||||
| Sim | 5 (2,2) | 6 (2,6) | 0,093 | 0,760 |
| Não | 225 (97,8) | 224 (97,4) | ||
| LF | ||||
| Sim | 37 (16,1) | 5 (2,2) | 26,831 | <0,001a |
| Não | 193 (83,9) | 225 (97,8) | ||
LF, língua fissurada; LG, língua geográfica.
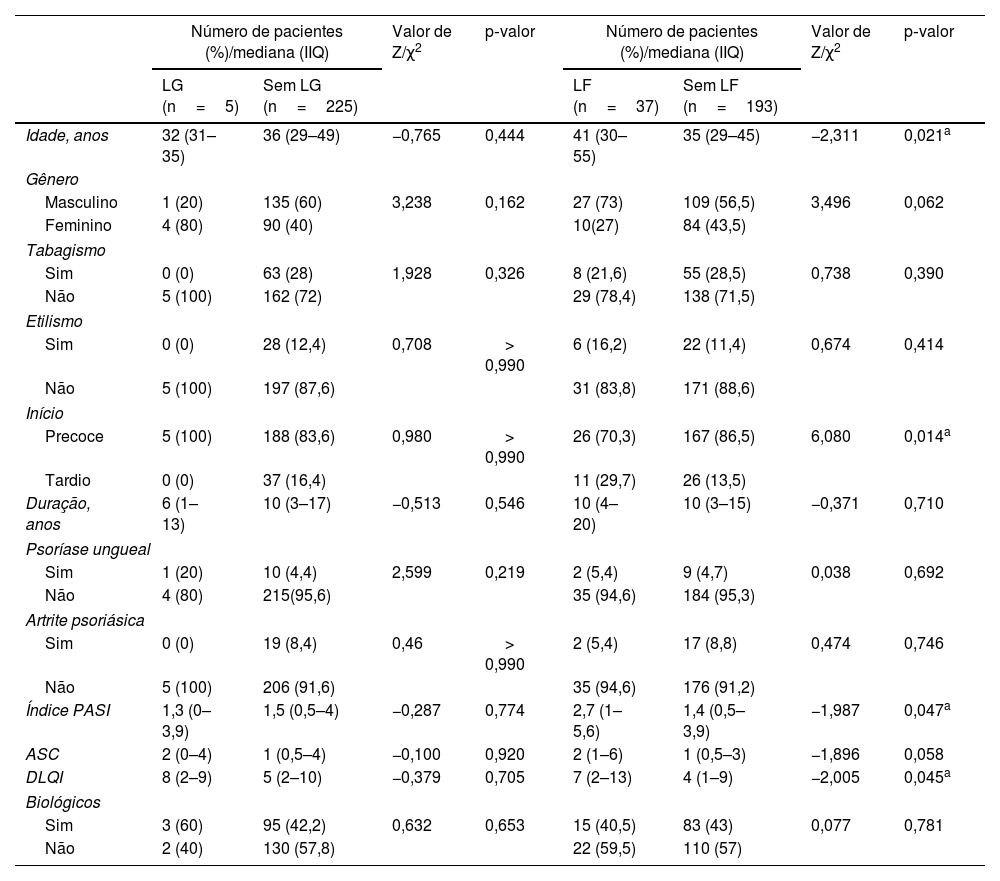
Não foram observadas diferenças entre pacientes com psoríase com LG e aqueles sem LG em relação a idade, gênero, tabagismo, etilismo, idade no início da psoríase, duração da psoríase, envolvimento ungueal e articular, PASI, ASC, DLQI e proporção de indivíduos utilizando produtos biológicos. Em comparação com pacientes com psoríase sem LF, observou‐se que os pacientes com psoríase e LF eram mais velhos (p=0,021), tinham frequência aumentada de psoríase de início tardio (p=0,014) e também apresentavam psoríase mais grave (p=0,047) e pior qualidade de vida (p=0,045). Não foram observadas associações de LF com outras características, incluindo gênero, tabagismo, etilismo, duração da psoríase, envolvimento ungueal e articular, ASC ou proporção de uso de produtos biológicos no grupo de casos (tabela 3).
Associações de língua geográfica/língua fissurada com características clínicas em 230 pacientes com psoríase
| Número de pacientes (%)/mediana (IIQ) | Valor de Z/χ2 | p‐valor | Número de pacientes (%)/mediana (IIQ) | Valor de Z/χ2 | p‐valor | |||
|---|---|---|---|---|---|---|---|---|
| LG (n=5) | Sem LG (n=225) | LF (n=37) | Sem LF (n=193) | |||||
| Idade, anos | 32 (31–35) | 36 (29–49) | −0,765 | 0,444 | 41 (30–55) | 35 (29–45) | −2,311 | 0,021a |
| Gênero | ||||||||
| Masculino | 1 (20) | 135 (60) | 3,238 | 0,162 | 27 (73) | 109 (56,5) | 3,496 | 0,062 |
| Feminino | 4 (80) | 90 (40) | 10(27) | 84 (43,5) | ||||
| Tabagismo | ||||||||
| Sim | 0 (0) | 63 (28) | 1,928 | 0,326 | 8 (21,6) | 55 (28,5) | 0,738 | 0,390 |
| Não | 5 (100) | 162 (72) | 29 (78,4) | 138 (71,5) | ||||
| Etilismo | ||||||||
| Sim | 0 (0) | 28 (12,4) | 0,708 | > 0,990 | 6 (16,2) | 22 (11,4) | 0,674 | 0,414 |
| Não | 5 (100) | 197 (87,6) | 31 (83,8) | 171 (88,6) | ||||
| Início | ||||||||
| Precoce | 5 (100) | 188 (83,6) | 0,980 | > 0,990 | 26 (70,3) | 167 (86,5) | 6,080 | 0,014a |
| Tardio | 0 (0) | 37 (16,4) | 11 (29,7) | 26 (13,5) | ||||
| Duração, anos | 6 (1–13) | 10 (3–17) | −0,513 | 0,546 | 10 (4–20) | 10 (3–15) | −0,371 | 0,710 |
| Psoríase ungueal | ||||||||
| Sim | 1 (20) | 10 (4,4) | 2,599 | 0,219 | 2 (5,4) | 9 (4,7) | 0,038 | 0,692 |
| Não | 4 (80) | 215(95,6) | 35 (94,6) | 184 (95,3) | ||||
| Artrite psoriásica | ||||||||
| Sim | 0 (0) | 19 (8,4) | 0,46 | > 0,990 | 2 (5,4) | 17 (8,8) | 0,474 | 0,746 |
| Não | 5 (100) | 206 (91,6) | 35 (94,6) | 176 (91,2) | ||||
| Índice PASI | 1,3 (0–3,9) | 1,5 (0,5–4) | −0,287 | 0,774 | 2,7 (1–5,6) | 1,4 (0,5–3,9) | −1,987 | 0,047a |
| ASC | 2 (0–4) | 1 (0,5–4) | −0,100 | 0,920 | 2 (1–6) | 1 (0,5–3) | −1,896 | 0,058 |
| DLQI | 8 (2–9) | 5 (2–10) | −0,379 | 0,705 | 7 (2–13) | 4 (1–9) | −2,005 | 0,045a |
| Biológicos | ||||||||
| Sim | 3 (60) | 95 (42,2) | 0,632 | 0,653 | 15 (40,5) | 83 (43) | 0,077 | 0,781 |
| Não | 2 (40) | 130 (57,8) | 22 (59,5) | 110 (57) | ||||
IIQ, intervalo interquartil; LF, língua fissurada; LG, língua geográfica.
A psoríase é doença comum, crônica e imunomediada; não é doença cutânea isolada e está associada a risco aumentado de comorbidades, incluindo artrite psoriásica, doença cardiovascular, diabetes mellitus e distúrbios gastrintestinais.9 Acredita‐se também que afete a mucosa oral, conhecida como “psoríase oral”. O primeiro caso de psoríase oral foi relatado em 1903;10 posteriormente, vários casos foram relatados.11–13 Nesses artigos, as manifestações da psoríase oral podem ser divididas em dois grupos: 1) lesões específicas da psoríase e 2) lesões não específicas.14 As lesões específicas da psoríase são altamente heterogêneas e podem se apresentar como eritema difuso do palato; o exame histopatológico mostra padrão psoriásico (hiperceratose, acantose com alongamento dos cones epidérmicos, infiltrado inflamatório misto com neutrófilos e linfócitos, vasos sanguíneos congestos, microabscessos de Munro).12 Também pode se manifestar como placas/pápulas esbranquiçadas e eritematosas na mucosa bucal.13 Quando ocorre no lábio, pode aparecer como lábios secos com descamação, semelhante à queilite.11 A apresentação na gengiva é semelhante à gengivite descamativa.12 Lesões orais não específicas na psoríase incluem LG e LF, que ocorrem não apenas na psoríase, mas também em outras doenças. Nos últimos anos, muitos estudos de caso‐controle encontraram aumento na proporção de LG e LF em pacientes com psoríase, mas ainda assim alguns estudos não observaram diferenças estatisticamente significantes. A associação entre LG/LF e psoríase permanece controversa.
Muitos relatos de estudos epidemiológicos encontraram correlação entre psoríase e LG.15–22 A psoríase e a LG compartilham um marcador genético comum: o antígeno leucocitário humano (HLA‐Cw6).23 Além disso, a psoríase e a LG apresentam características histopatológicas semelhantes: paraceratose, acantose, pústulas espongiformes de Kogoj, microabscessos de Munro, ectasia vascular e infiltração de células inflamatórias (particularmente linfócitos T e neutrófilos) na submucosa.24 Entretanto, não foi encontrada associação estatisticamente significante entre LG e psoríase neste estudo (p=0,760), provavelmente em virtude da especificidade regional da prevalência de LG, que foi baixa tanto no grupo caso (2,2%) quanto no grupo controle (2,6%), abaixo dos níveis já relatados.15,16 A LG é mais prevalente em mulheres e crianças. No entanto, em pacientes com psoríase, alguns estudos descobriram que a LG ocorre com maior frequência em homens15 e em indivíduos mais velhos,18 o que não foi encontrado neste estudo (idade: p=0,444; gênero: p=0,162). Alguns estudos demonstraram maior frequência de etilismo em pacientes com psoríase ou LG,14 e estudos também demonstraram que fumantes apresentam menor frequência de LG, o que pode ser atribuído ao fato de a nicotina ativar os receptores nicotínicos de acetilcolina nos macrófagos, levando à redução na síntese de TNF‐α, IL‐1 e IL‐6;25 essas células imunológicas e citocinas também são importantes na psoríase. Portanto, fatores ambientais como tabagismo e etilismo podem estar envolvidos no desenvolvimento de LG na psoríase. Curiosamente, nenhum dos cinco pacientes com psoríase e LG neste estudo era tabagista ou etilista, embora as diferenças também não tenham sido estatisticamente significantes (tabagismo: p=0,326; etilismo: p >0,990). Picciani et al. descobriram que a LG era mais frequente na psoríase de início precoce e estava associada à gravidade da doença. A psoríase de início precoce é geralmente mais grave que a psoríase de início tardio e está mais associada ao HLA‐Cw6;26 portanto, os autores sugerem que a LG pode ser indicador de gravidade da psoríase.21 Darwazeh et al. descobriram que a proporção de LG é maior em pacientes com psoríase cuja qualidade de vida esteja significantemente afetada.27 Diferentemente do artigo de Darwazeh et al, em nosso estudo a prevalência de LG no grupo caso não estava relacionada às características da psoríase, como idade de início da doença (p> 0,990), duração da psoríase (p=0,546), envolvimento ungueal (p=0,219) e articular (p> 0,990), índice PASI (p=0,774), ASC (p=0,920) e DLQI (p=0,705). No presente estudo, foi observada maior proporção de uso de produtos biológicos em pacientes com psoríase e LG em comparação com pacientes com psoríase sem LG, mas a diferença não foi estatisticamente significante (p=0,653). Um estudo encontrou remissão da LG em pacientes com psoríase tratados com secuquinumabe.28 Em geral, este estudo não encontrou nenhuma associação estatisticamente significante entre psoríase e LG.
Este estudo encontrou correlação significante entre LF e psoríase (p <0,001), consistente com vários outros estudos.15–21,29–31 A LF foi significantemente associada à idade dos pacientes com psoríase (p=0,021) e à idade no início da doença (p=0,014). Em comparação com pacientes com psoríase sem LF, descobriu‐se que os pacientes com psoríase e LF eram mais velhos e tinham frequência aumentada de psoríase de início tardio, o que está de acordo com estudos publicados.16,30 Isso pode ser explicado, em parte, pelo aumento na prevalência de LF com a idade. Gonzaga et al. encontraram ausência de associação entre LF e HLA‐Cw6, sugerindo não haver base genética comum para LF e psoríase.32 Assim, a LF é considerada uma continuação da LG por alguns autores,4,14 o que pode explicar, em parte, a associação entre psoríase e LF encontrada neste estudo. Os autores encontraram associação significante entre gravidade da psoríase e LF (PASI: p=0,047), o que está de acordo com Altemir et al. e em oposição a Picciani et al.30,31 Esses autores também relatam diferenças clínicas na LF de pacientes com e sem psoríase, e verificaram que o padrão ramificado e difuso da LF com escala moderada a grave foi mais frequente em pacientes com LF e psoríase. Os autores do presente estudo observaram que pacientes com psoríase e LF apresentaram pior qualidade de vida (p=0,045), comparados aos pacientes com psoríase sem LF, o que pode ser decorrente das manifestações mais graves da psoríase, bem como das manifestações orais da LF.
O presente estudo apresenta limitações. A LG tem períodos de exacerbação e remissão e, embora fotografias clínicas típicas da LG tenham sido preparadas para determinar se cada indivíduo havia tido lesão semelhante anteriormente, não foi possível evitar um desvio da prevalência de LG em relação à verdadeira taxa de prevalência; portanto, estudos de coorte prospectivos com tamanhos de amostra maiores são necessários. Além disso, descobriu‐se que os produtos biológicos levam à remissão de LG e LF,28,33 o que pode ter influenciado a relação LG/LF no grupo de casos do presente estudo.
A prevalência de psoríase, LG e LF são específicas da região.8 A maioria dos estudos de caso‐controle sobre a associação de psoríase com LG e LF foram realizados na Europa, sudeste da Ásia, oeste da Ásia, sul da Ásia, América do Norte e América do Sul (tabela 4), que têm composição racial diferente em comparação com o Leste Asiático. Não há evidências relevantes da associação de psoríase com LG e LF em populações do Leste Asiático; portanto, este é o primeiro estudo de caso‐controle sobre a correlação entre psoríase e LG/LF na população Han no sudoeste da China. Os achados do presente estudo são semelhantes aos de Monshi et al. e Altemir et al.,29,31 pois os autores demostraram que a psoríase está significantemente correlacionada com a LF, e a LF está associada à idade dos pacientes com psoríase, à idade de início da doença, à gravidade da psoríase e à qualidade de vida dos pacientes no grupo de casos. Nenhuma associação estatisticamente significante foi encontrada entre psoríase e LG neste estudo. Portanto, atenção deve ser dada ao tratamento de pacientes com psoríase e LF concomitante, bem como à documentação e seguimento de doenças cutâneas em pacientes com LF.
Estudos de caso‐controle investigando a associação de psoríase com língua geográfica/ fissurada em diferentes países
| País | Psoríase/controles | Psoríase com LG/controles com LG (p‐valor) | Psoríase com LF/controles com LF (p‐valor) | Referência |
|---|---|---|---|---|
| Irã | 200/200 | 28/12 (< 0,012) | 66/19 (< 0,0001) | 17 |
| México | 80/127 | 10/6 (0,0447) | 38/26 (< 0,0001) | 18 |
| Brasil | 166/166 | 30/7 (0,0001) | 57/27 (0,0002) | 16 |
| Líbano | 400/1000 | 31/10 (< 0,0001) | 133/99 (< 0,0001) | 19 |
| Itália | 535/436 | 49/23 (0,032) | 121/45 (< 0,01) | 20 |
| Jordânia | 100/100 | 17/9 (0,09) | 35/13 (0,000) | 27 |
| Índia | 600/800 | 34/7 (< 0,0001) | 272/320 (0,0456) | 15 |
| Brasil | 348/348 | 43/10 (0,002) | 125/70 (< 0,001) | 21 |
| Brasil | 129/5871 | 21/399 (< 0,05) | NDa | 22 |
| Áustria | 173/173 | 4/4 (1) | 25/13 (0,04) | 29 |
| Espanha | 100/100 | 4/2 (0,68) | 39/16 (< 0,001) | 31 |
Esse trabalho recebeu suporte financeiro do Fund of Sichuan Provincial Department of Science and Technology (2022YFS0039), do Programa de Pesquisa e Desenvolvimento, West China Hospital of Stomatology, Sichuan University (LCYJ2023‐DL‐2), por bolsas de pesquisa da National Natural Science Foundation of China (81771086), e CAMS Innovation Fund for Medical Sciences (CIFMS, 2019‐I2M‐5‐004).
Contribuição dos autoresYuting Hu: Obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Ying Li: Revisão crítica da literatura; aprovação da versão final do manuscrito.
Wei Yan: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Yu Zhou: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.