O tacrolimus é utilizado na prevenção de cicatrizes inestéticas devido à sua ação sobre a atividade de fibroblastos e modulação da produção de colágeno.
ObjetivosAvaliar as vias de atuação, do ponto de vista histopatológico e no controle de citocinas, do tacrolimus pomada, na prevenção de cicatrizes hipertróficas.
MétodosVinte e dois coelhos foram submetidos à excisão de dois fragmentos de 1cm, em cada orelha, incluindo o pericôndrio. A orelha direita recebeu tacrolimus 0,1% na ferida superior e 0,03% na inferior, em pomada, aplicados duas vezes ao dia. A orelha esquerda, controle, recebeu vaselina na mesma posologia. Após 30 dias, foram avaliadas as fibras colágenas nas cicatrizes, realizadas colorações especiais e imuno‐histoquímica para actina, TGF‐β e VEGF.
ResultadosFeridas tratadas com tacrolimus 0,1% apresentaram marcação fraca e menor percentual de marcação para actina de músculo liso, maior proporção de ausência de mucina, coloração fraca, fibras finas e organizadas na coloração pelo tricrômico de Gomori, coloração forte e fibras organizadas na coloração pelo método de Verhoeff, se comparadas ao controle. As feridas tratadas com tacrolimus 0,03% apresentaram marcação fraca para actina de músculo liso, maior proporção de ausência de mucina, coloração forte pelo Verhoeff, se comparadas ao controle.
Limitações do estudoAnálise realizada por patologista único. Microscopia por geração de segundo harmônico realizada em duas áreas amostrais da cicatriz.
ConclusõesAmbas as concentrações do medicamento se mostraram eficazes na supressão do TGF‐β e actina de músculo liso, redução de mucina, melhora da qualidade das fibras colágenas, densidade das fibras elásticas, mas apenas a maior concentração teve efeito na organização das fibras elásticas.
O mecanismo de cicatrização, independente do agente causal, é sistêmico e dinâmico, e depende das condições do indivíduo envolvido. Caracteriza‐se por um processo de reorganização e reconstituição tecidual, proveniente da interação de eventos bioquímicos, moleculares e celulares.1 Quando um agente causal, injúria, acarreta uma lesão tecidual e expõe componentes da matriz extracelular em contato com elementos sanguíneos, desencadeia todo o processo denominado de cicatrização, culminando na atração de células inflamatórias para o local do comprometimento.2
A presença de mucina na substância amorfa de uma cicatriz geralmente se associa à má qualidade da mesma. Queloides podem apresentar quantidade significativa de mucina; já em cicatrizes hipertróficas, muitas vezes tal substância não é observada.3
O tacrolimus é um imunossupressor, inicialmente sintetizado para uso sistêmico na prevenção de rejeição em transplante de órgãos sólidos, que atua ligando‐se à calmodulina e inibindo a síntese de calcineurina nos linfócitos, basófilos, células dendríticas e eosinófilos.4,5 Dessa maneira, inibe a transcrição de algumas citocinas inflamatórias, como IL‐2, IL‐3, IL‐4, TNF‐alfa, e a ativação de linfócitos T, reduz a população de células dendríticas, que são apresentadoras de antígenos e podem desencadear resposta inflamatória alérgica, reduz mediadores de mastócitos e basófilos (histamina), reduz prurido pela diminuição na produção de substância P e fator de crescimento neuronal.5,6 Apresenta menor absorção cutânea se comparado aos glicocorticoides, o que aumenta sua segurança de uso, em decorrência do menor potencial de efeitos adversos sistêmicos.7,8
Estudo utilizado por via tópica, nas cicatrizes inestéticas, promoveria a apoptose e supressão da atividade de fibroblastos.6
MétodosO estudo foi realizado de acordo com U.K. Animals (Scientific Procedures) Act, 1986, National Institutes of Health guide for the care and use of Laboratory animals (1978) e Código Brasileiro de Experimentaçao Animal (1988), e foi aprovado pela Comissão de Ética no Uso de Animais da Universidade Federal de Minas Gerais, protocolo n°74/2016.9–11
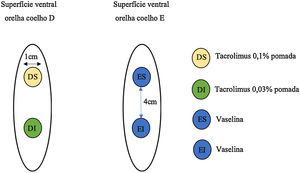
Foram utilizados 22 coelhos machos (Oryctolagus cuniculus), da raça Nova Zelândia brancos, de aproximadamente 2 meses de idade, identificados por números. Os animais foram submetidos à excisão de dois fragmentos de 1cm, na superfície ventral de cada orelha, separados 4cm entre si, até a cartilagem, envolvendo o pericôndrio. A orelha direita dos animais recebeu o tacrolimus: 0,1% em pomada na ferida superior e 0,03% em pomada na ferida inferior, aplicados duas vezes ao dia. A orelha esquerda, controle, recebeu a vaselina na mesma posologia do medicamento estudado (fig. 1).
No trigésimo dia pós‐operatório, as feridas foram excisadas e preparadas para análise histopatológica em lâminas corados por hematoxilina e eosina, alcian blue, tricrômico de Gomori e Verhoeff, e preparadas para análise imuno‐histoquímica, com os anticorpos actina de músculo liso, TGF‐β e VEGF. Foram avaliadas algumas variáveis (tabelas 1 e 2).
Avaliação microscópica das feridas, colorações especiais – critérios utilizados
| Avaliação microscópia das feridas | |||
|---|---|---|---|
| Alcian blue | Verhoeff | Tricrômico de Gomori | |
| Intensidade da coloração | 0 – Ausente | 1 – Fraca | 1 – Fraca |
| 1 – Fraca | 2 – Média | 2 – Forte | |
| 2 – Forte | 3 – Forte | ||
| Orientação das fibras | – | 1 – Organizadas | 1 – Organizadas |
| 2 – Desorganizadas | 2 – Desorganizadas | ||
| Espessura das fibras | – | – | 1 – Finas |
| 2 – Espessas | |||
Avaliação imuno‐histoquímica das feridas – critérios utilizados
| Avaliação imuno‐histoquímica das feridas | |||
|---|---|---|---|
| Actina de músculo | VEGF | TGF‐β | |
| Percentual da ferida corada | 0%‐100% | 0%‐100% | 0%‐100% |
| Intensidade da coloração | 1 – Fraca | 0 – Ausente | 0 – Ausente |
| 2 – Média | 1 – Fraca | 1 – Fraca | |
| 3 – Forte | 2 – Média | 2 – Forte | |
| 3 – Forte | 3 – Forte | ||
Lâminas coradas para hematoxilina e eosina foram enviadas para análise de imagens por microscopia por geração de segundo harmônico e microscopia de fluorescência por geração de dois fótons, para análise de fibras colágenas, a partir de duas áreas quadradas de 500μm, aleatoriamente determinadas.
O programa PyFibre foi utilizado para realizar análises de imagens e cálculos a fim de gerar algumas métricas acerca das fibras colágenas:
Anisotropia global (0‐1): Quando as fibras estão distribuídas aleatoriamente, o valor da anisotropia é igual a 0; quando as fibras estão orientadas na mesma direção, o valor da anisotropia é igual a 1.
Medida de ondulação das fibras (0‐1): Quanto mais ondulada é a fibra, mais próximo de 0 é o valor
Linearidade dos segmentos de fibras (0‐1): Fibra completamente circular igual a 0; fibra completamente linear igual a 1.
Densidade de fibras e células: intensidade da imagem pela área da imagem, tanto para fibras quanto para células.
Em todos os testes foi utilizado um nível de significância de 5%, portanto diferenças são significativas considerando p ≤ 0,05. O software utilizado para as análises foi o SPSS for Windows, versão 20 (SPSS Inc., Chicago, IL, EUA).
ResultadosNenhum animal envolvido no experimento apresentou alterações na pele à ectoscopia ao longo do experimento. Apresentaram boas condições gerais e a recuperação da intervenção cirúrgica foi favorável e espontânea, em ambiente controlado. Dois coelhos morreram na indução anestésica. Os demais animais sobreviveram aos 30 dias de experimento.
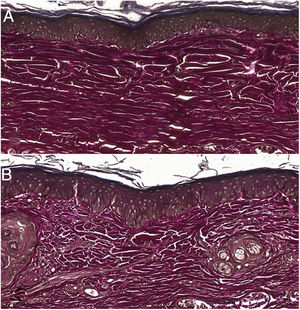
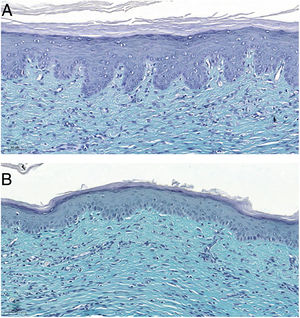
As análises microscópicas foram realizadas sem perdas de fragmentos das feridas e as lâminas foram analisadas em microscópio de luz com aumentos de 20× e 40×. Classificações foram realizadas de acordo com a padronização proposta. Considerando as variáveis para colágeno (anisotropia e densidade de fibras), o grupo que utilizou dosagem superior do tacrolimus apresentou média significativamente menor que o grupo que utilizou a dosagem inferior (p = 0,036 e p = 0,027). Feridas tratadas com tacrolimus em sua maior concentração apresentaram maior proporção de marcação fraca para actina de músculo liso e menor percentual de marcação se comparadas ao seu controle (p = 0,005 e p = 0,034). As feridas nas quais foi utilizado o tacrolimus 0,1% apresentam maior proporção de ausência de mucina (p = 0,029), intensidade de marcação fraca, fibras finas e organizadas para tricrômico de Gomori (p = 0,047, p = 0,025 e p = 0,004), intensidade de marcação forte e fibras organizadas para Verhoeff (fig. 2) (p < 0,001 e p < 0,001) se comparadas aos controles. Maior proporção de ausência de mucina (fig. 3) (p = 0,002) e intensidade de marcação mais forte para Verhoeff (p < 0,001) foram observadas nas feridas tratadas com o medicamento na concentração 0,03% se comparadas ao controle.
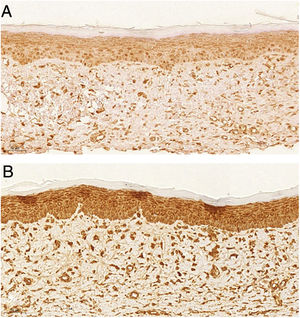
As feridas tratadas com o tacrolimus 0,03% apresentam maior proporção de marcação fraca para actina de músculo liso se comparadas ao controle (fig. 4) (p = 0,026). As feridas tratadas com tacrolimusa 0,1% apresentaram maior proporção de intensidade de marcação forte e fibras organizadas para Verhoeff se comparadas às feridas tratadas com a medicação a 0,03% (p = 0,040 e p = 0,027).
DiscussãoO tacrolimus em pomada não é um medicamento formalmente indicado para tratamento de cicatrizes queloidianas e hipertróficas, em razão da quantidade insuficiente de estudos com esse propósito.12
As cicatrizes inestéticas geralmente se apresentam um mês após a injúria causadora, e as alterações histológicas, como neovascularização, deposição aumentada de colágeno e fibroblastos, ocorrem na derme, gerando um processo inflamatório crônico, principalmente na derme reticular.13 Injúrias epidérmicas, superficiais, dificilmente culminam em cicatrizes inestéticas, e tais cicatrizes são mais observadas em áreas mais expostas e que sofrem mais tensão.14
A amostragem foi calculada com base em estudos já publicados, usando o mesmo modelo experimental e levando em conta uma perda de 25%, que é a prevista para tal modelo. Por terem sido adotadas medidas baseadas nas normas e leis de proteção em experimentação animal justifica a perda observada no presente estudo ter sido inferior a 10%.15
Em 2007, Mustoe sugeriu o modelo para reprodução de cicatrizes hipertróficas no dorso de orelhas de coelhos e um período de seguimento e observação de aproximadamente 30 dias, período esse adotado em outros experimentos, baseado na premissa de que cicatrizes inestéticas se manifestam, geralmente, um mês após a agressão.16–19 Tal modelo vem sendo utilizado desde então, inclusive para estudo do tacrolimus, mas em formulação intradérmica injetável, com resultados positivos em cicatrizes inestéticas, o que, acrescido à facilidade de acesso e custo da medicação em pomada nas concentrações 0,1% e 0,03%, impulsionou o presente estudo.15
A utilização do tacrolimus culminou em cicatrizes com maior proporção de fibras de colágeno mais finas e organizadas pela coloração de tricrômico de Gomori. As feridas tratadas com tacrolimus 0,1% apresentaram menor valor médio de densidade de fibras colágenas (p = 0,027) e de anisotropia dessas fibras (p = 0,036), se comparadas às tratadas com o tacrolimus 0,03%, o que indica que as fibras colágenas, além de menos densas, estão distribuídas de forma menos paralela nas feridas tratadas com tacrolimus 0,1%. O uso do tacrolimus a 0,1% acarretou maior proporção de marcação fraca para tricrômico de Gomori, com fibras mais finas e organizadas, se comparado ao controle, o em concordância com os achados da microscopia por geração de segundo harmônico e microscopia de fluorescência por geração de dois fótons. Tais resultados estão de acordo com a literatura, pois em cicatrizes inestéticas as fibras de colágeno se dispõem de forma mais paralela se comparadas à pele normal; os feixes de colágeno são mais grossos, espaçados e os fibroblastos produzem colágeno de maneira excessiva, principalmente colágeno tipo III.20 O queloide apresenta uma grande quantidade de colágeno desorganizado e mucopolissacarídeos na matriz extracelular. Na cicatriz hipertrófica, o colágeno se deposita mais nas camadas superficiais da derme reticular; no queloide, o colágeno se estende por toda a derme reticular.21,22
Quando analisados os resultados da imuno‐histoquímica, as feridas da orelha direita, independente da concentração do medicamento, apresentaram maior proporção de marcação fraca para actina de músculo liso e ausente para TGF‐β, (p < 0,001 e p = 0,030, respectivamente) e menor percentual da lâmina marcada para actina de músculo liso (p = 0,008). As feridas tratadas com o tacrolimus 0,1% e 0,03% também apresentaram maior proporção de marcação fraca para actina de músculo liso, quando comparadas aos respectivos controles (p = 0,005 e p = 0,026), e as tratadas com o medicamento em sua maior concentração apresentaram menor percentual da lâmina marcada para actina de músculo liso se comparadas ao seu controle (p = 0,034) – ou seja, o uso da medicação estudada, em ambas as concentrações, provavelmente causou supressão da expressão de TGF‐β e, consequentemente, da actina de músculo liso. Tais achados se justificam pelo fato de cicatrizes hipertróficas e queloidianas apresentarem um desequilíbrio na liberação de fatores de crescimento locais como o TGF‐β, que estimula a produção de matriz extracelular e tem ação fibrogênica.23–25
Os TGF‐β 1 e 2 estimulam o aparecimento de miofibroblastos ricos em alfa actina de músculo liso e exercem um estímulo poderoso à síntese da alfa actina.26 Os miofibroblastos desempenham uma atividade importante na organogênese, reparo, inflamação e fibrose, por meio da secreção de citocinas inflamatórias, quimiocinas, fatores de crescimento e mediadores inflamatórios. Quando presentes em feridas cicatriciais, os miofibroblastos expressam o fenótipo de músculo liso apenas temporariamente. Esse fenótipo persiste em cicatrizes inestéticas, assim como em doenças fibrocontrteis e condições proliferativas neoplásicas.27
Fibroblastos presentes em cicatrizes inestéticas apresentam sensibilidade aumentada e prejuízo na retroalimentação negativa em relação ao TGF‐β, acarretando maior deposição de colágeno.28,29 O uso do medicamento em sua menor concentração resultou em feridas com maior proporção de marcação forte para VEGF, se comparado ao emprego da substância em sua maior concentração; no entanto, não houve diferença entre grupos controle e tratamento.
A citocina em questão é produzida por fibroblastos e tem sua síntese aumentada no queloide.30 Estudo que utilizou o mesmo modelo de orelhas de coelhos evidenciou que atuar sobre a angiogênese de maneira preventiva em relação a excessos é efetivo para evitar cicatrizes inestéticas.31 Disfunção endotelial, com consequente aumento da permeabilidade vascular e acúmulo de células inflamatórias e fatores inflamatórios na área da injúria, promovendo um aumento de atividade dos fibroblastos, favorecem o surgimento de cicatrizes inestéticas.
A angiogênese é estimulada quando se tem tensão na cicatriz. Fatores sistêmicos que promovem vasodilatação predispõem a cicatrizes desfavoráveis, e sabe‐se que várias terapias para cicatrizes patológicas se baseiam em supressão de vasos sanguíneos.32 Os níveis de VEGF são mais elevados em injúrias mais profundas se comparadas às mais rasas e à pele normal.33 Com base no exposto, a medicação em sua maior concentração obteve feridas com menor expressão de VEGF, apesar de estudo anterior com o medicamento ter evidenciando maior concentração de capilares nas feridas tratadas com essa concentração do medicamento.15
Evidências mostram que capilares formados na fase da angiogênese são essenciais para a regeneração tecidual, mas uma exacerbação em tal fase se associa a cicatrizes fibróticas.34,35 O mais provável é que o maior número de capilares nas feridas tratadas com o tacrolimus a 0,1% não representassem angiogênese exacerbada, mas apenas variações no limite da normalidade.
A mucina é pouco vista em cicatrizes hipertróficas, mas muitas vezes é abundante na matriz extracelular de cicatrizes queloideanas.6 A substância, independente da concentração utilizada, mostrou cicatrizes com maior proporção de ausência de marcação para mucina se comparada ao controle (p = 0,001), assim como as duas concentrações, quando analisadas isoladamente, também evidenciaram maior proporção de ausência de marcação para a mucina se comparadas aos respectivos controles (p = 0,029 e p = 0,002), achados que estão de acordo com a literatura, corroborando com a hipótese de que o medicamento atua na constituição da matriz extracelular visando à prevenção das cicatrizes inestéticas.
O uso do tacrolimus, independente da concentração, mostrou acarretar maior proporção de marcação forte para Verhoeff e maior proporção de fibras elásticas mais organizadas nas cicatrizes (p < 0,001 e p < 0,001). O mesmo pode ser observado ao se analisar o emprego do tacrolimus em sua maior concentração comparado ao seu controle (p < 0,001). Já a utilização da substância em sua menor concentração apresentou feridas com maior proporção de marcação forte para Verhoeff sem alteração na organização das fibras, se comparada ao seu controle (p < 0,001) – ou seja, a utilização da substância aumentou a densidade de fibras elásticas, mas atuou sobre a organização das mesmas apenas em sua maior concentração.
Os achados descritos podem ser justificados pelo fato de as fibras elásticas, quando presentes, densas e bem distribuídas, conferirem qualidade à cicatriz e, em muitos casos, mostram‐se ausentes em queloides e presentes, mas em menor quantidade, em cicatrizes hipertróficas.3 Assim, as duas concentrações da substância estudada têm um efeito favorável sobre as fibras elásticas na cicatrização, ainda que, ao se comparar as feridas tratadas com o tacrolimus 0,1% às tratadas com o tacrolimus 0,03%, tenha havido maior proporção de marcação forte e fibras organizadas na coloração de Verhoeff nas primeiras (p = 0,040 e p = 0,027) – ou seja, a substância em sua maior concentração contribuiria mais para a qualidade das fibras elásticas nas cicatrizes.
Uma maior proporção de distribuição do processo cicatricial nas camadas mais superficiais da pele foi observada nas feridas tratadas com o tacrolimus a 0,03% se comparadas a seu controle (p = 0,007); no entanto, essa diferença ocorreu em função do grupo controle. As cicatrizes inestéticas apresentam a maioria de suas alterações histológicas, composição da matriz extracelular e processo inflamatório localizada nas camadas mais profundas da derme.13,36–39 As incisões feitas no experimento em questão foram todas de mesma dimensão e atingindo uma mesma profundidade, tendo assim um mesmo potencial de cicatrização.
ConclusõesO tacrolimus atuou na via do TGF‐β e actina de músculo liso, reduzindo a expressão de ambos nas feridas tratadas. Melhorou a qualidade das cicatrizes a partir da melhora da composição da matriz extracelular, com redução da mucina e ganho na qualidade das fibras colágenas, que se mostraram mais finas e organizadas, e das fibras elásticas, mais densas e organizadas. A concentração de 0,1% mostrou‐se mais efetiva na supressão da actina de músculo liso, resultando em feridas com colágeno menos denso, mais organizado e com fibras mais finas, assim como fibras elásticas mais organizadas. A medicação a 0,03% apresentou cicatrizes com processo inflamatório mais superficialmente distribuído.
O uso do tacrolimus em pomada na prevenção de cicatrizes hipertróficas mostrou ser uma opção promissora, em modelo experimental. Visto não haver efeitos adversos sistêmicos ou locais observados em nenhuma das duas concentrações utilizadas da medicação, e por haver benefícios comprovados, o próximo passo seria estudo em humanos.
Suporte financeiroNenhum.
Contribuição dos autoresMariana Campos Souza Menezes: Realização do experimento; desenvolvimento da estrutura da pesquisa; análise dos dados; escrita da pesquisa.
Marcelo Buzelin: Realização da imunohistoquímica e desenvolvimento da estrutura da pesquisa.
Cristiana Buzelin Nunes: Desenvolvimento da estrutura da pesquisa; revisão da escrita e análise de dados.
Luiz Ronaldo Alberti: Desenvolvimento da estrutura da pesquisa; revisão da escrita e Análise de dados.
Conflito de interessesNenhum.
Como citar este artigo: Menezes MCS, Buzelin M, Nunes CB, Alberti LR. Tacrolimus action pathways in an ointment base for hypertrophicscar prevention in a rabbit ear model. An Bras Dermatol. 2021;96:429–35.
Trabalho realizado no Biotério da Faculdade de Medicina da Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.