O carcinoma ductal écrino escamoide (CDEE) é neoplasia cutânea maligna rara que, na histologia, demonstra comportamento bifásico, com diferenciação tanto escamosa (superfície do tumor) quanto ductal écrina (profundidade do tumor), frequentemente confundido com o carcinoma espinocelular (CEC), especialmente em biopsias superficiais. O CDEE tem relevância clínica significante em virtude de seu potencial de metástase e agressividade local.1,2 Portanto, o objetivo desta série de casos é demonstrar a apresentação clínica e histopatológica de cinco casos de CDEE, a fim de aprimorar o conhecimento e o manejo dessa neoplasia rara.
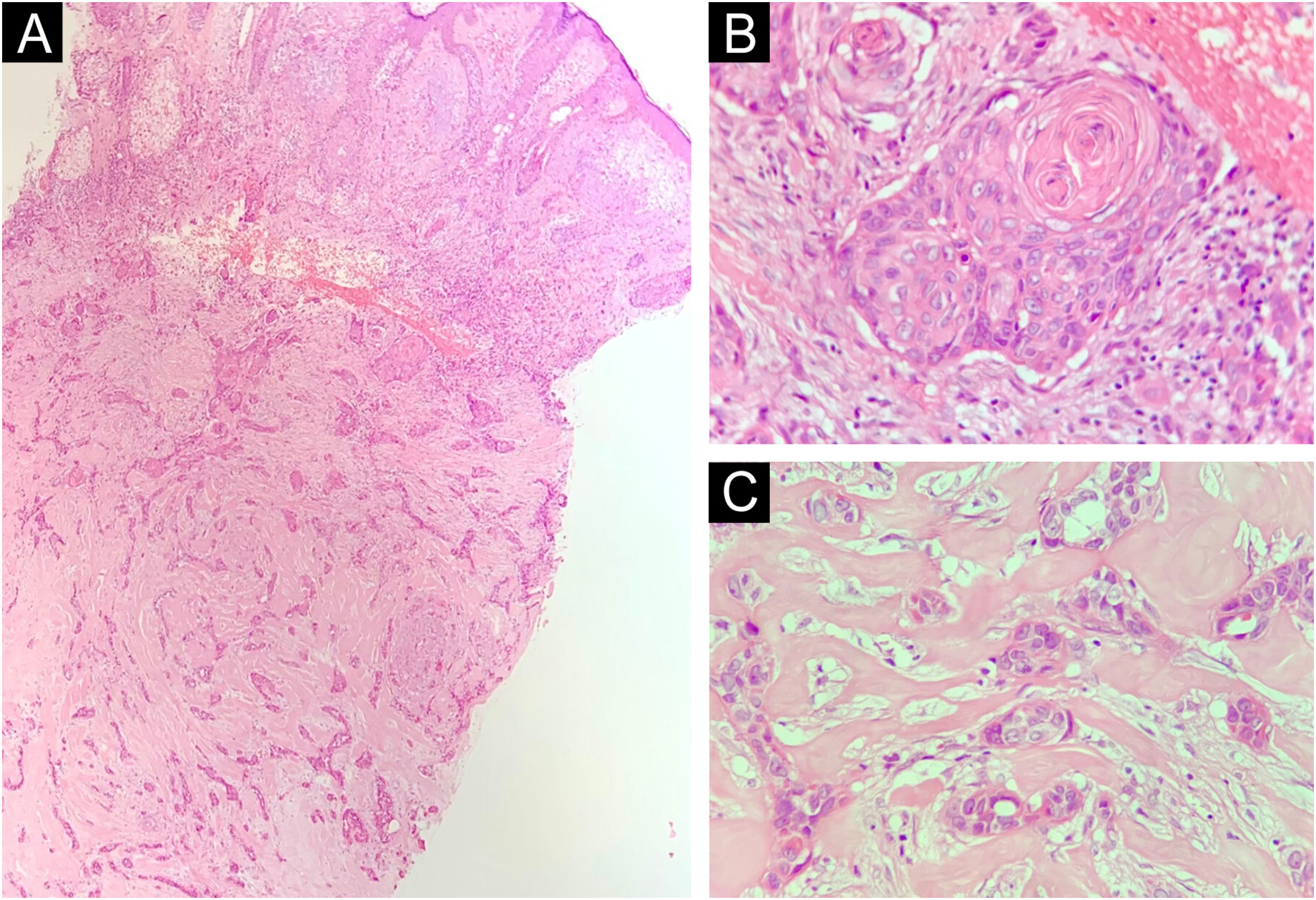
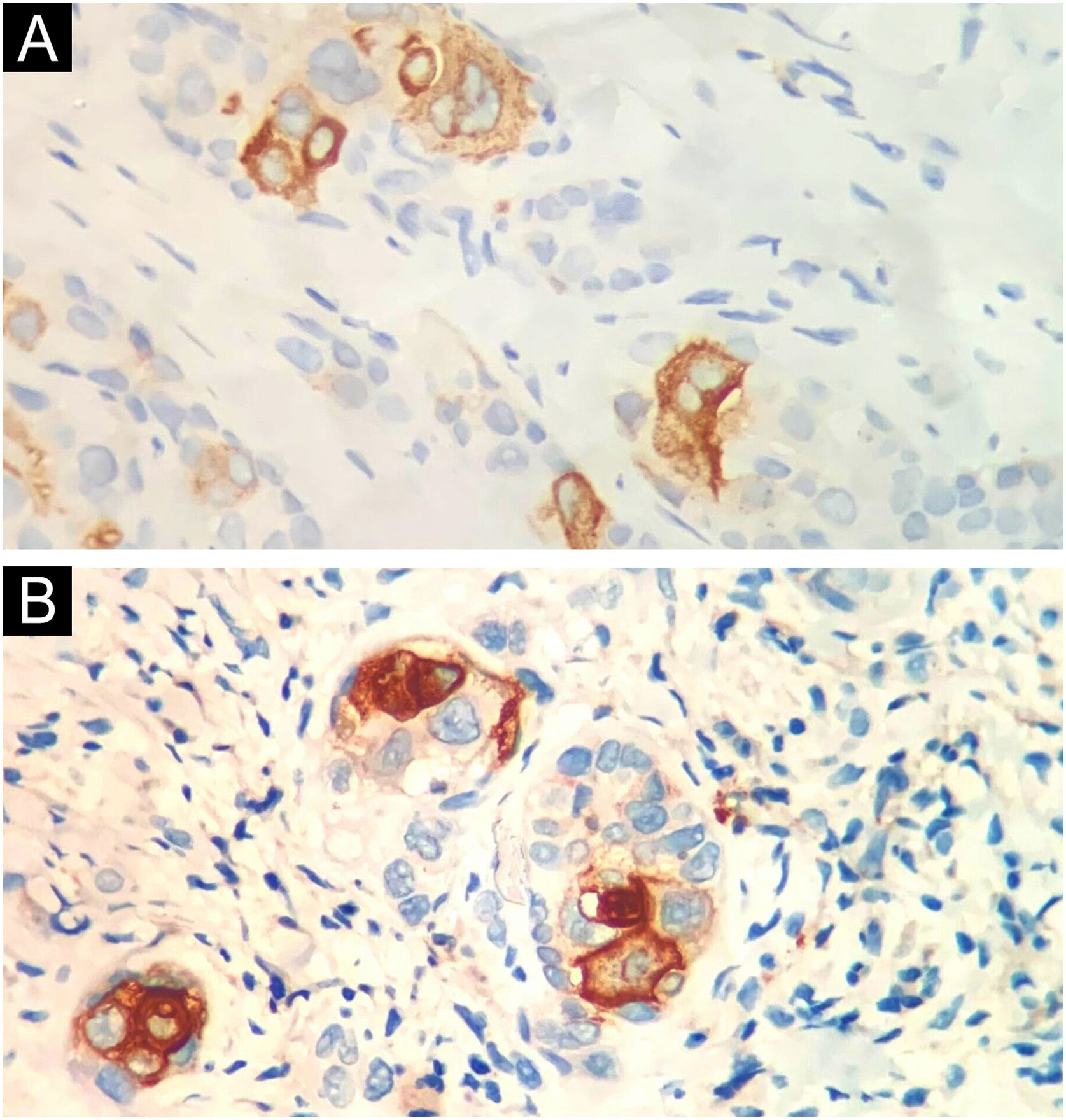
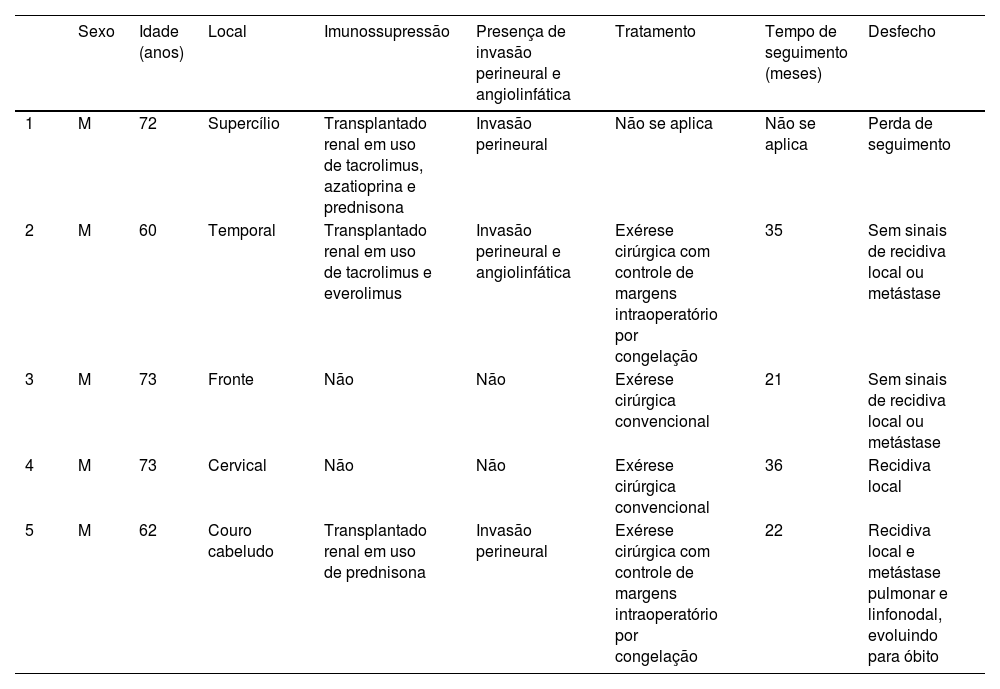
A tabela 1 resume as principais informações dos cinco casos de CDEE. A doença afetou exclusivamente adultos idosos do sexo masculino, com idade média de 68 anos. Todos os casos ocorreram na região da cabeça e pescoço, com predileção pela face (três de cinco casos). Houve antecedente de imunossupressão por transplante de órgãos em três pacientes e radioterapia prévia no local em um caso. Na histopatologia (fig. 1), os tumores apresentaram padrão de crescimento infiltrativo na derme, invadindo ocasionalmente o tecido subcutâneo e muscular. Nas regiões mais superficiais dos tumores, observou‐se diferenciação escamosa, semelhante ao CEC bem diferenciado, enquanto nas regiões mais profundas houve diferenciação ductal em diferentes graus, acompanhada por ninhos e cordões de células epiteliais com atipia moderada a grave, envolvidos por estroma desmoplásico. A presença de invasão perineural foi observada em três casos, e invasão angiolinfática em um caso. A diferenciação ductal foi confirmada pela positividade da imuno‐histoquímica para o antígeno de membrana epitelial (EMA) e o antígeno carcinoembrionário (CEA) em todos os tumores (fig. 2). As informações sobre tratamento e evolução estão disponíveis para quatro dos cinco pacientes, visto que um deles perdeu seguimento após a biopsia incisional do tumor. Todos os quatro casos foram submetidos a tratamento cirúrgico com margens cirúrgicas livres após o procedimento. Em dois dos quatro casos, as margens cirúrgicas foram avaliadas intraoperatoriamente por congelação, enquanto nos outros dois casos a análise das margens ocorreu após a cirurgia. O período médio de seguimento após a cirurgia foi de 28,5 meses, com evidência de recorrência local em dois pacientes; um deles havia sido submetido a cirurgia convencional com análise de margens após a cirurgia, e o outro fora submetido a cirurgia com análise de margens intraoperatória por congelação. Além disso, além de evoluir com recorrência local, um dos pacientes também apresentou metástases linfonodais e pulmonares, resultando em óbito.
Resumo dos casos de carcinoma ductal écrino escamoide
| Sexo | Idade (anos) | Local | Imunossupressão | Presença de invasão perineural e angiolinfática | Tratamento | Tempo de seguimento (meses) | Desfecho | |
|---|---|---|---|---|---|---|---|---|
| 1 | M | 72 | Supercílio | Transplantado renal em uso de tacrolimus, azatioprina e prednisona | Invasão perineural | Não se aplica | Não se aplica | Perda de seguimento |
| 2 | M | 60 | Temporal | Transplantado renal em uso de tacrolimus e everolimus | Invasão perineural e angiolinfática | Exérese cirúrgica com controle de margens intraoperatório por congelação | 35 | Sem sinais de recidiva local ou metástase |
| 3 | M | 73 | Fronte | Não | Não | Exérese cirúrgica convencional | 21 | Sem sinais de recidiva local ou metástase |
| 4 | M | 73 | Cervical | Não | Não | Exérese cirúrgica convencional | 36 | Recidiva local |
| 5 | M | 62 | Couro cabeludo | Transplantado renal em uso de prednisona | Invasão perineural | Exérese cirúrgica com controle de margens intraoperatório por congelação | 22 | Recidiva local e metástase pulmonar e linfonodal, evoluindo para óbito |
M, Masculino.
Histopatologia. (A) Corte histológico evidenciando tumor com crescimento infiltrativo invadindo a derme profunda (Hematoxilina & eosina, 4×). (B) Diferenciação escamosa nas porções mais superficiais (Hematoxilina & eosina, 20×). (C) Diferenciação ductal écrina na profundidade do tumor (Hematoxilina & eosina, 10×).
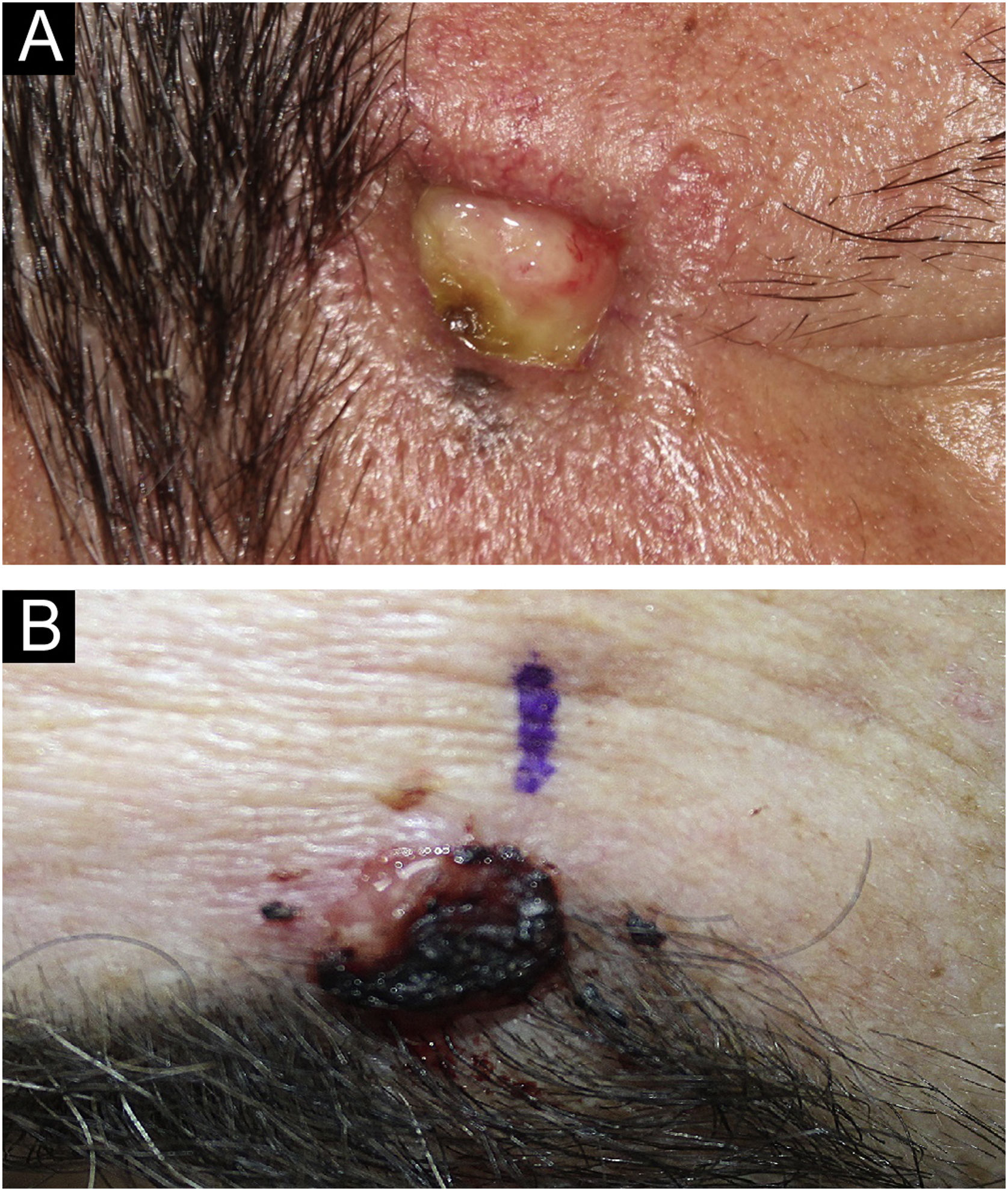
O CDEE é tradicionalmente classificado como subtipo de carcinoma écrino. No entanto, sua etiopatogenia ainda é incerta, pois não está claro se surge a partir dos ductos écrinos com subsequente diferenciação escamoide, se é um subtipo de CEC ou se é um tumor verdadeiramente híbrido. O CDEE afeta principalmente idosos, geralmente na sétima ou oitava década de vida; sugere‐se que a imunossupressão possa ser fator de risco. A maioria dos casos é observada na pele danificada pelo sol, especialmente na região da cabeça e pescoço; a face é a localização mais comum. Clinicamente, apresenta‐se como nódulos e placas, frequentemente ulcerados, com dimensões geralmente pequenas, conforme demonstra a figura 3.1–3
O diagnóstico é realizado por exame anatomopatológico, no qual o CDEE revela aparência bifásica. Nas áreas superficiais do tumor, ocorre diferenciação escamosa com conexão à epiderme, enquanto nas áreas mais profundas há clara diferenciação ductal écrina. A diferenciação escamosa é tipicamente ausente nas regiões mais profundas. Além disso, observa‐se crescimento infiltrativo com a presença de cordões de células epiteliais que exibem atipia citológica, bem como resposta estromal desmoplásica circundante.1–5 O CDEE frequentemente se estende ao tecido subcutâneo e pode estar associado à invasão perineural e angiolinfática, fatores que podem explicar sua alta taxa de recorrência local (25%), mesmo após excisão completa, e seu potencial de metástase (13%), segundo dados da literatura.1 O tratamento do CDEE envolve excisão ampla local e acompanhamento clínico regular. A cirurgia micrográfica de Mohs é opção benéfica.1
Portanto, diante da raridade e do desconhecimento associados a essa neoplasia, além de seu potencial de desfechos desfavoráveis, é imprescindível conduzir estudos adicionais para aprofundar a compreensão e o manejo do CDEE. Nossos achados sugerem a necessidade de vigilância intensificada em pacientes transplantados renais, já que três dos cinco casos ocorreram nesse grupo. A conscientização sobre essa neoplasia é fundamental, uma vez que provavelmente é subdiagnosticada, visando assegurar seu diagnóstico precoce e tratamento adequado e, consequentemente, melhorar os desfechos clínicos dos pacientes afetados.
Suporte financeiroNenhum.
Contribuição dos autoresCecília Mirelle Almeida Honorato: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Giovanna Gelli Carrascoza: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Nubia Marrer Abed: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Fernanda Gonçalves Moya: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Honorato CMA, Carrascoza GG, Abed NM, Moya FG. Squamoid eccrine ductal carcinoma: series of five cases of a rare tumor. An Bras Dermatol. 2024;99. https://doi.org/10.1016/j.abd.2023.10.006
Trabalho realizado no Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, São Paulo, Brasil.