Além das infestações e das infecções bacterianas relatadas na parte I, o estudo da entomodermatoscopia envolve também as descrições de achados dermatoscópicos de um crescente número de infecções virais e fúngicas, entre outras. No presente artigo serão descritas as principais situações clínicas em infecções virais onde a dermatoscopia pode ser útil, como na avaliação de verrugas virais, molusco contagioso e até mesmo em cenários como a infecção de magnitude pandêmica COVID‐19. Já nas infecções fúngicas, a dermatoscopia se mostra particularmente importante não somente na avaliação da superfície cutânea, mas tambem de fâneros como cabelos e unhas. O diagnóstico diferencial com tumores cutâneos, especialmente melanoma, pode ser facilitado pela dermatoscopia, notadamente na avaliação de casos de verrugas plantares, onicomicose e tinea nigra.
Além da utilidade da dermatoscopia para avaliação e detecção de dermatozoonoses e de uma série de infecções bacterianas, ela pode ser de grande auxílio na avaliaçao de distintas entidades virais, fúngicas (superficiais e profundas) e de outras doenças infecciosas. Além disso, o seguimento por dermatoscopia pode ser útil para análise de eficácia terapêutica de algumas dessas enfermidades. Na parte II desta revisão, enfatizamos as principais situações clínicas causadas por infecções virais, fúngicas e de outras origens onde a dermatoscopia pode sua útil.
Infecções viraisVerrugasAs verrugas são infecções cutâneas causadas pelo papilomavírus humano (HPV), com transmissão por contato direto com a pele ou mucosa infectada ou via fômites. De acordo com sua localização anatômica ou morfológica, podem ser classificadas em verrugas vulgares, planas, anogenitais (condilomas) ou palmoplantares. A dermatoscopia é uma ferramenta importante para o diagnóstico e o monitoramento do tratamento de verrugas.1,2
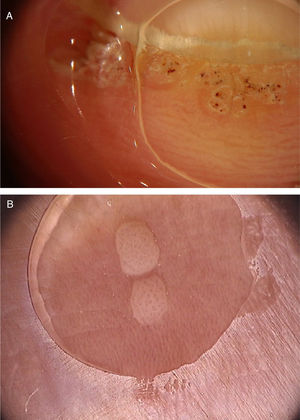
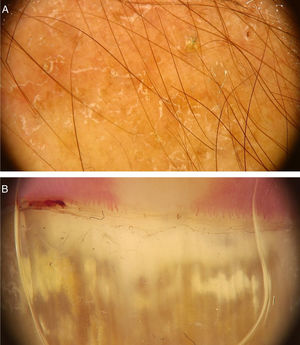
Verrugas vulgaresAs verrugas vulgares caracterizam‐se clinicamente por pápulas exofíticas, com uma superfície áspera e papilomatosa. O local de acometimento mais frequente inclui as mãos e os quirodáctilos. Além disso, lesões pedunculadas e filiformes podem ser observadas, principalmente nas regiões periorificais da face. No exame dermatoscópico, áreas papilomatosas com vasos trombosados no centro de cada papila podem ser visualizadas (fig. 1A). Esses achados já foram descritos na literatura como um padrão frogspawn, cuja tradução significa um coral com múltiplos pólipos, assemelhando‐se a uma massa de ovas de rã.3
A, Imagem dermatoscópica de verruga vulgar na região subungueal demonstrando hiperceratose e vasos em ponto ou trombosados; B, Imagem dermatoscópica de verruga plana demonstrando discretos vasos em ponto homogeneamente distribuídos (Fotofinder, magnitude original 20×). Fonte: Acervo pessoal dos autores.
As verrugas planas caracterizam‐se por pápulas normocrômicas, róseas ou acastanhadas, de superfície aplainada e lisa. Podem ser observadas mais frequentemente no dorso das mãos, dos braços ou na face. O exame dermatoscópico revela vasos em ponto ou globulares com distribuição regular, em um fundo amarelado‐acastanhado (fig. 1B).4 A correspondência histopatológica dos vasos puntiformes são os ápices dos capilares na derme papilar.3 Um dos principais diagnósticos diferenciais das verrugas planas são as ceratoses seborreicas pequenas ou iniciais. Além do padrão dermatoscópico clássico, outros fatores clínicos que auxiliam no diagnóstico de verrugas planas são a observação de lesões com distribuição linear (fenômeno de Koebner) ou agrupada e a ausência de critérios dermatoscópicos para o diagnóstico de ceratose seborreica, como o aspecto cerebriforme.4
Verrugas genitaisAs verrugas anogenitais, ou condilomas, acometem a região perineal, perianal ou inguinal. São lesões sésseis, cuja coloração pode variar de tons acastanhados ao branco (quando se encontram em áreas que favorecem a maceração). Além disso, lesões pedunculadas ou papilomatosas podem ser observadas, com padrão em “couve‐flor”.
Na dermatoscopia, alguns padrões foram descritos para verrugas genitais.5 O primeiro, em mosaico, refere‐se a estruturas arredondadas brancas, regulares e agrupadas, formando um aspecto reticular com ilhotas centrais de mucosa sã.3 Esse padrão é mais associado a lesões genitais planas. O segundo padrão, chamado de knoblike, refere‐se a projeções bulbosas agrupadas de diâmetro e comprimento semelhantes. Por fim, o terceiro padrão é chamado de fingerlike e caracteriza‐se por projeções digitiformes separadas, com comprimentos distintos. Esses dois padrões podem ser visualizados em lesões mais exofíticas e papilomatosas. As estruturas vasculares mais comuns incluem os vasos glomerulares, em ponto e em grampo. Os dois primeiros são mais comumente observados em padrões em mosaico ou knoblike, enquanto os vasos em grampo ocorrem mais frequentemente no padrão digitiforme. Outros achados dermatoscópicos incluem a presença de pigmentação e hiperceratose. A dermatoscopia também pode auxiliar no diagnóstico diferencial com achados genitais fisiológicos, como as pápulas perláceas penianas, grânulos de Fordyce e as papilas vestibulares. As pápulas perláceas penianas são angiofibromas distribuídos regularmente na coroa da glande e cuja dermatoscopia mostra pápulas branco‐róseas em padrão de cobblestone, com vasos em ponto ou vírgula no centro das pápulas. Já na genitália feminina, as papilas vestibulares apresentam múltiplas projeções cilíndricas róseas, de consistência amolecida, cujas bases de projeção permanecem separadas e de distribuição simétrica.6
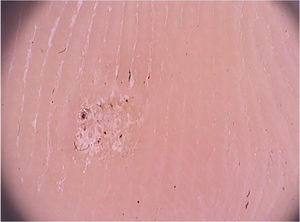
Verrugas palmoplantaresAs verrugas palmoplantares são lesões de aspecto endofítico, hiperceratóticas e frequentemente dolorosas. Quando se apresentam de forma mais superficial, com lesões coalescendo em grandes placas, são denominadas de verrugas em mosaico ou mirmécia.
Ao exame dermatoscópico, observam‐se pontos enegrecidos com distribuição irregular na superfície da verruga, que representam capilares dilatados e trombosados (fig. 2).1 Além disso, uma superfície hiperceratótica ou papilomatosa pode ser visualizada, bem como a interrupção dos dermatoglifos ou micro‐hemorragias em decorrência da pressão e da distribuição do peso corporal.
A dermatoscopia também é uma ferramenta importante para o monitoramento do tratamento de verrugas plantares, auxiliando na visualização da persistência da lesão após um tratamento parcial, mesmo quando clinicamente inaparente.1 Além disso, também auxilia no diagnóstico diferencial com calos e com o queratoma plantar, que apresentam uma opacidade homogênea ou um núcleo central translucente.1 Um aspecto importante de frisar é que já foram descritos casos de verrugas pigmentadas com padrão em cristas paralelas, cujo diagnóstico diferencial inclui o melanoma acral. O contrário também deve ser lembrado, ou seja, melanomas acrais hipopigmentados ou amelanóticos também podem simular verrugas acrais.7
Epidermoplasia verruciformeA epidermodisplasia verruciforme é uma genodermatose rara autossômica recessiva. Caracteriza‐se por uma deficiência na resposta imune celular que se manifesta por uma infecção persistente pelo HPV e com consequente propensão ao desenvolvimento de carcinomas epidermoides. Clinicamente, observam‐se o surgimento, na infância, de máculas e pápulas planas, acometendo áreas fotoexpostas. As lesões podem simular ceratoses seborreicas ou quadros de pitiríase versicolor. Ao exame dermatoscópico, observa‐se um fundo róseo‐acastanhado ou hipocrômico, com uma discreta descamação superficial, correspondendo a lesões com queratinócitos infectados pelo HPV.8 Posteriormente, outros achados descritos incluem vasos em ponto desfocados com disposição regular e a diluição do pigmento de pelos velus.9 A proliferação dos vasos, vista em outros tipos de verrugas, é característica do vírus HPV. Além disso, questiona‐se quanto à possibilidade de a infecção crônica do HPV poder interferir na melanogênese, explicando assim as lesões hipocrômicas e a diluição pigmentar dos pelos.9 Esses achados auxiliam também na diferenciação de neoplasias queratinocíticas que ocorrem em indivíduos portadores da epidermodisplasia verruciforme.
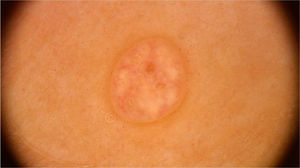
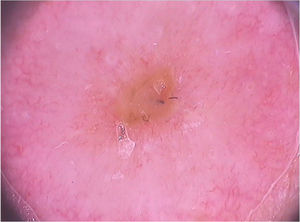
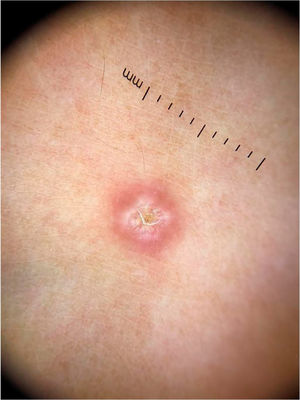
Molusco contagiosoO molusco contagioso é uma infecção cutânea causada pelo vírus Molluscum contagiosum (MCV), da família dos poxvírus. Acomete principalmente crianças, e ocasionalmente é observado em adultos sexualmente ativos e indivíduos imunocomprometidos. Sua transmissão ocorre por contato direto com a pele infectada, o que facilita também a autoinoculação. Clinicamente, caracteriza‐se por pápulas no formato de domo, de coloração branco‐rósea, com umbilicação central. Apresentações atípicas, como lesões únicas ou gigantes, também podem ser observadas, mimetizando verrugas e cistos epidérmicos. A dermatoscopia aumenta a acurácia diagnóstica quando comparada ao exame clínico e auxilia no diagnóstico diferencial do molusco contagioso com achados genitais benignos, como pápulas perláceas penianas e glândulas de Fordyce.10
Ao exame dermatoscópico, o molusco contagioso apresenta, muitas vezes, um poro ou uma umbilicação central, cercado por uma estrutura polilobular branco‐amarelada e vasos periféricos em coroa (fig. 3).11 Outros padrões vasculares que podem ser observados incluem vasos radiais, puntiformes ou uma combinação de ambos. Quando há uma associação de vasos em coroa e radiais, há o chamado padrão em flor, pela semelhança com as pétalas de uma flor. Além disso, a presença de vasos puntiformes também já foi relacionada à inflamação do molusco contagioso, como no caso de lesões escoriadas ou com eczema perilesional.10 Por sua vez, outras variantes das estruturas polilobuladas incluem estruturas arredondadas (uma área branca de aspecto discoide) e a estrutura em trevo.12 Na histopatologia, as áreas de lóbulos correspondem a queratinócitos hiperplásicos contendo as típicas inclusões intracitoplasmáticas virais que resultam no deslocamento periférico do núcleo, chamadas de corpúsculos de Henderson‐Patterson. As variantes dermatoscópicas dos lóbulos podem ser explicadas por graus variáveis da proliferação dos lóbulos invertidos da epiderme acantótica.12
Pseudoangiomatose eruptivaA pseudoangiomatose eruptiva é um quadro autolimitado caracterizado pelo aparecimento de pápulas eritematosas com um halo de vasoconstrição. Especula‐se que as lesões podem ser desencadeadas por picadas de insetos ou quadros virais, incluindo echovírus, vírus Epstein‐Barr ou citomegalovírus. Nesses casos, sintomas virais (febre, tosse, vômitos e diarreia) precedem as lesões. O exame dermatoscópico mostra vasos em ponto sobre uma trama vascular mais proeminente, que diminui significantemente com vitropressão, associado a um halo de vasoconstrição.13 Na correspondência histopatológica, há ectasia vascular, um leve infiltrado linfocítico perivascular com neutrófilos intraluminais e células endoteliais ingurgitadas.
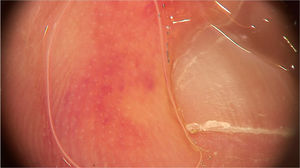
COVID‐19No final do ano de 2019, um novo coronavírus surgiu e espalhou‐se rapidamente, causando uma pandemia. Esse vírus foi chamado de síndrome respiratória aguda grave‐coronavírus‐2 (SARS‐CoV‐2) e tem sido associado a várias manifestações dermatológicas, que incluem erupções urticariformes, morbiliformes, vesiculares, livedo reticular e lesões isquêmicas acrais. Até o momento, as principais descrições dermatoscópicas são de lesões eritema pérnio‐símile.14
As lesões eritema pérnio‐símile (chilblain‐like eruption) acometem principalmente crianças, adolescentes e adultos jovens. Caracterizam‐se tipicamente por máculas ou pápulas localizadas nas regiões acrais, de coloração eritemato‐violácea ou purpúrica. Também podem se apresentar como áreas eritemato‐edematosas associadas a dor ou prurido. A distribuição das lesões costuma ser assimétrica. Elas surgem em média 14 dias após o aparecimento de um quadro sistêmico leve, e sua resolução ocorre após 7 a 10 dias; são descritas como uma manifestação tardia da doença, momento no qual o exame de PCR pode ser negativo.14 Ao exame dermatoscópico, observa‐se um fundo eritemato‐violáceo (fig. 4), vasos capilares dilatados, pontos purpúricos e, na fase tardia, pontos pigmentados. A correspondência histopatológica evidencia uma vasculopatia linfocítica e questiona‐se se esses achados cutâneos representam uma desordem na coagulação ou uma reação de hipersensibilidade. Navarro et al. avaliaram lesões em diferentes estágios de evolução.15 Inicialmente, as lesões são eritematosas pela dilatação vascular, passando por um estágio de coloração violácea pelo extravasamento de hemácias e, posteriormente, acastanhada pela deposição de hemossiderina. Áreas acinzentadas podem indicar fenômenos isquêmicos mais intensos. Além disso, glóbulos eritemato‐violáceos e áreas periféricas de retículo castanho‐acinzentado foram visualizados. Os glóbulos podem representar áreas de vasos danificados com extravasamento de hemácias, enquanto as áreas reticulares podem resultar de um dano significativo ao plexo vascular dérmico.
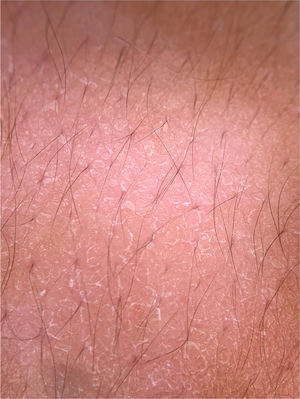
Infecções fúngicasDermatofitosesA dermatoscopia pode ser um método auxiliar no diagnóstico de dermatofitoses. A onicomicose, a Tinea capitis e a tinea corporis são algumas das dermatoses que podem se beneficiar do uso da dermatoscopia para seu diagnóstico. Na onicomicose, destaca‐se a capacidade de diferenciá‐la da onicólise traumática por meio dos achados dermatoscópicos. A possibilidade de diagnosticar casos de tinea incognita por meio de achados dermatoscópicos também é descrita (fig. 5A).16 A seguir serão apresentados os principais achados dermatoscópicos das dermatofitoses.
OnicomicoseA onicomicose representa 50% de todas as doenças das unhas, cuja prevalência no mundo varia de 2% a 8%. Pode ser causada por diferentes espécies: fungos dermatófitos, não dermatófitos e fungos leveduriformes.17 Cerca de 90% de todas as onicomicoses dos háluces são causadas por dermatófitos. A distribuição dos patógenos que causam esse tipo de infecção é variável conforme região geográfica, população avaliada e fatores climáticos. Fatores individuais que predispõem ao desenvolvimento de onicomicose incluem diabetes, imunossupressão, insuficiência venosa, doença arterial periférica, obesidade, tabagismo e idade avançada.18 Fatores adicionais incluem profissão, prática de atividades esportivas, uso de calçados inadequados, corte inadequado das unhas, tinea pedis, psoríase e história familiar de onicomicose.18 A idade mais comum para ocorrência de onicomicose varia de 40 a 60 anos.19
Os aspectos clínicos da onicomicose são principalmente onicólise, alterações da coloração ungueal e hiperqueratose subungueal.17,18 Pode ser dividida em subungueal distal‐lateral (apresentação mais comum), subungueal proximal, branca superficial e distrófica total.18
Embora o exame micológico direto e a cultura para fungos sejam o padrão‐ouro para o diagnóstico das onicomicoses, muitas vezes existem limitações à realização do exame. A dermatoscopia pode servir de auxílio para o diagnóstico e para a exclusão de outras onicopatias. Um estudo com 50 pacientes (37 com onicomicose subungueal distal e 13 com onicólise de origem traumática) observou alguns achados peculiares à onicomicose subungueal distal‐lateral e outros à onicólise traumática. Estrias longitudinais de diferentes cores observadas na placa ungueal onicolítica (de coloração que varia do branco ao amarelo, alaranjado e até acastanhado) foram associadas à onicomicose subungueal distal – presentes em 86,5% (32/37) dos pacientes com onicomicose e em nenhum paciente com onicólise traumática. Uma borda recortada com pontas (jagged edge with spikes), definida pela presença de indentações longitudinais esbranquiçadas na área de onicólise em direção à borda ungueal proximal, foi observada em todos os casos de onicomicose subungueal distal avaliados no estudo e em nenhum paciente com onicólise por trauma. Esse achado refletiria a progressão dos dermatófitos no estrato córneo do leito ungueal. Por fim, a borda linear sem indentações seria observada apenas na onicólise traumática.20 Outros achados que podem ser observados na dermatoscopia da placa ungueal com onicomicose, porém não são exclusivos dessa patologia, incluem pontos e glóbulos enegrecidos decorrentes de hemorragia subungueal e coloração homogênea sem brilho da placa ungueal descolada, cuja tonalidade pode variar do branco ao amarelo, alaranjado, marrom e preto, que reflete a cor da colônia, escamas e debris subungueais.20 Outro achado sugestivo é o denominado padrão em “aurora” (aurora pattern), que se refere à placa ungueal onicolítica com uma coloração irregular sem brilho que é distribuída em estrias, lembrando o aspecto da aurora boreal, encontrada na onicomicose subungueal distal.20 A avaliação da onicólise também deve ser feita observando a borda proximal da área de onicólise. Caso seja linear e sem indentações, diminui a possibilidade de onicomicose, enquanto a observação de uma borda recortada com pontas e de estrias longitudinais é altamente sugestiva para diagnóstico de onicomicose (fig. 5B).20
Outros achados dermatoscópicos podem ser observados nas onicomicoses, especialmente quando outras apresentações clínicas são avaliadas. Dentre elas, podemos incluir: cromoníquia, traquioníquia, estrias longitudinais branco‐amareladas e bordas proximais com indentações. Nos subtipos subungueal lateral‐distal e distrófico total, estrias longitudinais brancas e bordas proximais com indentações foram os achados mais frequentes.19 A presença de hiperqueratose subungueal parece ser mais observada na onicomicose distrófica total (p < 0,001), e a leuconíquia, na onicomicose subungueal proximal.5,21
Em relação à melanoníquia secundária à onicomicose, alguns estudos tentaram diferenciá‐la, do ponto de vista dermatoscópico, das melanoníquias por outras causas, incluindo nevos da matriz ungueal, melanomas ungueais e melanoníquia por ativação melanocítica da matriz.22 A pigmentação ungueal decorrente de infecção fúngica não é uma melanoníquia verdadeira, pois não é originada dos melanócitos, e uma característica desse tipo de pigmentação é sua localização não longitudinal.22 Ohn et al. avaliaram 80 pacientes com melanoníquias por diversas causas, dentre eles 18 pacientes com melanoníquia fúngica, e observaram que alguns achados eram preditores positivos de melanoníquia fúngica: associação com coloração amarelada, padrão homogêneo não longitudinal, padrão triangular reverso (no qual a largura da área pigmentada é maior na porção distal do que na porção proximal da unha, decorrente da maior invasão da placa ungueal pelo fungo na porção distal), queratose subungueal e estrias ou escamas brancas ou amareladas.22 Importante mencionar que o monitoramento das onicomicoses com apresentação pigmentar deve ter um seguimento frequente. A dermatoscopia é de grande auxílio para averiguar a presença de outras estruturas que sugiram a possibilidade de uma lesão melanocítica de colisão, e também a resposta ao tratamento. Nos casos associados à melanoníquia, a melhora da coloração ungueal é um dos achados mais precocemente observados.23
Tinea capitisTinea capitis é uma infecção por fungos dermatófitos que acomete a pele do couro cabeludo e as hastes capilares, podendo ser do tipo microspórica, de contágio por animais, caracterizada por apresentar placa única, do tipo tricospórica, de contágio inter‐humano, em geral com lesões múltiplas, do tipo favosa ou do tipo Kerion celsi, uma forma inflamatória, com presença de pústulas e microabscessos. A doença afeta mais comumente crianças de 3 a 7 anos, porém eventualmente pode acometer adultos. O aumento da prevalência de tinea capitis nas últimas décadas e uma modificação no padrão dos dermatófitos que as causam têm sido observados nos últimos anos.24 Os agentes etiológicos da tinea capitis variam conforme região geográfica, condições climáticas e contexto socioeconômico da população. Clinicamente, ocorrem áreas de perda de cabelos, com fios tonsurados, associados à presença de escamas, inflamação e pústulas. Embora o exame micológico direto e a cultura sejam o padrão‐ouro no diagnóstico dessa afecção, eles dependem de procedimento de coleta e equipamentos para sua realização.25 Nesse contexto, a tricoscopia pode ser útil, diferenciando infecções microspóricas de tricospóricas e monitorando a resposta ao tratamento.25
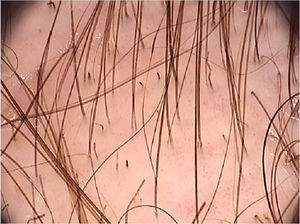
Uma revisão sistemática dos achados dermatoscópicos encontrados na tinea capitis incluiu 37 artigos sobre o tema.26 Dentre os principais achados, destacam‐se os cabelos em forma de “vírgula”, que são cabelos curtos, de pigmentação e espessura homogênea, formados pela quebra e torção da haste capilar repleta de hifas em seu interior (fig. 6).27 Sua presença variou de 13% a 100% nos casos de tinea capitis, porém eles também podem ser vistos na alopecia areata e na tricotilomania.26 Já os cabelos em forma de “saca‐rolhas” (corkscrew hair), que são cabelos retorcidos, estão presentes de 14% a 100% (média de 32%) nos casos de tinea capitis.26,27 Eles são descritos como um achado específico de tinea capitis, observados tanto em fungo endotrix quanto ectotrix, embora possam ser observados em displasias ectodérmicas e em pacientes com deficiência de vitamina C.26 Os cabelos em forma de “código Morse” representam cabelos com múltiplas finas bandas esbranquiçadas ao longo do folículo piloso. São formados pelo acúmulo de esporos circundando a haste capilar, que causam uma perfuração transversal da haste capilar, e são descritos nas infecções do tipo ectotrix, com incidência de 12% a 56% (média de 22%).26 Cabelos em forma de “zigue‐zague” são cabelos dobrados em ângulos agudos, resultado de fraturas transversais incompletas ao longo da haste capilar. São descritos em infecções fúngicas do tipo ectotrix, com incidência de 5% a 49% (média de 21%).26 Além de serem observados na tinea capitis, também podem ser vistos na alopecia areata.27 Entre outros achados que também podem ser observados na tricoscopia da tinea capitis, porém que não são característicos, podemos desctacar cabelos quebrados, pontos pretos e descamação inter e perifolicular.26
Aparentemente, casos de tinea capitis causados pelo gênero Microsporum apresentam mais frequentemente cabelos em código Morse (8/29; 28%; p < 0,001), cabelos em zigue‐zague (6/29; 21%; p < 0,01), cabelos dobrados (4/29; 14%; p < 0,05) e descamação difusa (4/29; 14%; p < 0,05). Tais achados se correlacionam com infecções ectotrix, ou seja, que ocorrem ao redor da haste folicular, promovendo perfurações transversais da haste. Já os cabelos em saca‐rolhas foram mais comuns nas infecções tricofíticas (21/38; 55% vs. 3/29; 10% nas infecções microspóricas – p < 0,001). Nesse caso, a infecção é endotrix, consequentemente com alterações da haste capilar sem alterações de cor.26
O desaparecimento de fios distróficos (cabelo em vírgula, em saca‐rolhas, em zigue‐zague, em código Morse, cabelos quebrados e pontos pretos) pode ser um importante parâmetro tricoscópico para avaliação de eficácia terapêutica. Essas alterações podem levar de 4 a 12 semanas para desaparecerem. Já as descamações inter e perifolicular levam um período de tempo maior para serem resolvidas, portanto não devem ser interpretadas como falha terapêutica.26
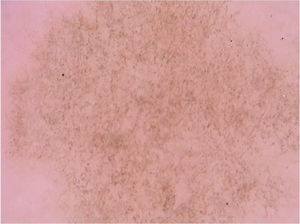
Tinea nigraA tinea nigra é uma micose superficial causada pelo fungo demáceo Hortae werneckii, que ocorre predominantemente em áreas de clima tropical e subtropical. Clinicamente, manifesta‐se como uma mácula acastanhada ou enegrecida irregularmente pigmentada que, classicamente, ocorre nas palmas das mãos e nas plantas dos pés. Costuma apresentar crescimento progressivo, que pode estar associado à descamação.28 Importante diagnóstico diferencial é feito com lesões melanocíticas, sejam elas nevos ou melanoma.28 O exame micológico direto revela hifas septadas demáceas tortuosas, e na cultura o agente etiológico é isolado, confirmando o diagnóstico. À dermatoscopia, os achados refletem a presença de hifas pigmentadas no estrato córneo, observando‐se uma pigmentação acastanhada em espículas formando um padrão reticulado que não respeita as linhas dermatoglíficas, além da ausência de uma rede pigmentar (fig. 7).29 Outros relatos posteriores demonstram, ainda, pigmento acastanhado em pequenos pontos e grânulos sobre uma área macular acastanhada de coloração mais clara e, novamente, sem respeitar as cristas e sulcos dermatoglíficos, como seria observado caso se tratasse de uma lesão de origem melânica.30 A dermatoscopia pode auxiliar ao evitar a realização de biópsias desnecessárias, uma vez que possibilita diferenciar a lesão de causas melanocíticas. Também é útil na avaliação de eficácia terapêutica, uma vez que a eliminação da lesão pigmentada pode ser monitorada pela técnica.
Pitiríase versicolorA pitiríase versicolor é uma infecção fúngica superficial causada por leveduras do gênero Malassezia, um fungo dimórfico lipofílico, que afetam as camadas superficiais da epiderme. Clinicamente, apresenta lesões descamativas hiper e hipopigmentadas, redondas ou ovais, localizadas no tronco, nos membros superiores e na face, geralmente assintomáticas, embora alguns pacientes refiram prurido leve. Há uma discreta predominância de ocorrência no sexo masculino, e a faixa etária de maior ocorrência é a de 11 a 20 anos.31 Nos adultos, acomete principalmente o tronco; nas crianças, ocorre em especial na face. Tais variações topográficas decorrem de variações da produção sebácea.31 Fungos do gênero Malassezia são parte da flora cutânea, mas em situações de desequilíbrio imunológico se tornam patogênicos. O diagnóstico de pitiríase versicolor usualmente é clínico nos casos de apresentação e localização características. O exame micológico direto pode auxiliar, principalmente em casos atípicos, evidenciado o padrão típico em “macarrão com almôndegas”, que representa as pseudo‐hifas com esporos do fungo.32 A dermatoscopia pode ser útil quando o exame micológico direto não estiver prontamente disponível. O diagnóstico diferencial de pitiríase versicolor inclui vitiligo, pitiríase alba, pitiríase rósea, dermatite seborreica, sífilis secundária, papilomatose confluente e reticulada e tinea corporis, dentre outros.
Os achados dermatoscópicos da pitiríase versicolor aparentemente podem variar de acordo com sua apresentação clínica. Nas lesões hipocrômicas, geralmente apresentam lesões bem demarcadas com finas escamas que se localizam nos sulcos da pele; já nas lesões hiperpigmentadas, um relato de caso demonstrou, além da fina descamação branca, a presença de rede pigmentar composta por linhas acastanhadas ou uma pigmentação acastanhada mais homogênea. Esses achados conjuntos podem evitar biópsias desnecessárias nos casos de lesões hipercrômicas de pitiríase versicolor.33 Outro relato isolado descreveu a diferenciação da pitiríase versicolor pela dermatoscopia em paciente com vitiligo. Os testes clínicos de Zirelli e Beznier eram negativos; no entanto, à dermatoscopia era possível observar uma descamação fina ao longo dos vincos da pele (skin creases) com um fundo das lesões de coloração hipopigmentada. Os autores denominaram esse achado dermatoscópico como em cerca de arame (wire fence) e relataram que o achado poderia servir como uma forma rápida e fácil para diagnosticar pitiríase versicolor.34
Uma série recente avaliou 178 lesões de pitiríase versicolor em 125 pacientes com dermatoscopia. Clinicamente, 164 lesões eram hipopigmentadas e 14 eram hiperpigmentadas.35 Pigmentação não homogênea foi o achado mais comumente observado em lesões hipopigmentadas (n = 152; 92,68%), mas também foi observado nas lesões hiperpigmentadas (n = 14; 100%). A figura 8 mostra escamas observadas em 142 lesões hipopigmentadas (86,56%) e em 13 hiperpigmentadas (92,86%). Placas descamativas foram mais comuns nas lesões hipopigmentadas (n = 95; 57,92%) e escamas nos sulcos foram mais comuns na dermatoscopia de lesões hiperpigmentadas (n = 5; 35,71%). Cristas e sulcos imperceptíveis e hiperpigmentação perilesional também foram achados observados no estudo.35 Outra série avaliou um total de 30 pacientes com pitiríase versicolor confirmadas por exame clínico e micológico (KOH), das quais 24 apresentaram lesões hipocrômicas, três eram hipercrômicas (10%) e os três restantes apresentavam ambas.31 A descamação sobre os dermatóglifos também foi achado relevante (83,3% dos casos). Além disso, um halo de contraste circundando a lesão, denominado sinal do halo contrastado (contrast halo sign), foi observado em 20 casos (66,7%). Nas variantes hipopigmentadas, esse halo aparecia como um aumento da pigmentação; nas lesões hiperpigmentadas havia um halo de hipopigmentação.31
Micoses subcutâneas e sistêmicasEsporotricoseA esporotricose é uma infecção cutânea causada pelo fungo Sporothrix schenckii e sua transmissão ocorre geralmente por inoculação direta na pele e no tecido subcutâneo. Em raros casos, a inalação pode resultar em quadros com acometimento pulmonar ou disseminado. A manifestação cutânea mais comum é a linfocutânea, na qual pápulas ou nódulos verrucosos se desenvolvem no local da inoculação, com posterior disseminação seguindo os trajetos linfáticos. Em relação à dermatoscopia, há apenas um relato na literatura de um paciente com um quadro disseminado caracterizado pelo acometimento ósseo e cutâneo, com pápulas e placas eritematosas confluentes e ulceradas. Nesse caso, o exame dermatoscópico mostrou eritema, áreas amareladas sem estruturas, zonas branco‐cicatriciais e telangiectasias arboriformes. Na figura 9 demonstramos um caso em que é possível observar áreas de eritema com vasos lineares e erosão central. Além disso, algumas lesões apresentavam pústulas agrupadas na periferia.36 A coloração amarelada na dermatoscopia correspondia histologicamente a áreas de inflamação granulomatosa, enquanto as pústulas representavam microabscessos neutrofílicos, e as áreas brancas, fibrose e tecido cicatricial.
CromomicoseA cromomicose, também conhecida como cromoblastomicose, é uma infecção fúngica crônica causada pela inoculação traumática de fungos demáceos, mais comumente do gênero Fonsecaea ou Cladophialophora. O quadro clínico pode variar desde lesões papulonodulares a tumorais, de aspecto verrucoso, cicatricial ou esporotricoide.
A dermatoscopia da cromomicose mostra um fundo branco‐róseo, estruturas ovoides amarelo‐alaranjadas, vasos polimórficos, escamas e crostas. Além disso, um achado frequentemente observado são pontos rubro‐enegrecidos, que representam histologicamente a eliminação transepitelial de células inflamatórias, debris fúngicos e pequenas hemorragias.37 Por sua vez, o fundo branco‐róseo representa histologicamente áreas de hiperplasia pseudoepiteliomatosa e hiperqueratose, enquanto as estruturas amarelo‐alaranjadas correspondem a áreas de inflamação granulomatosa. Um caso adicional, de uma lesão nodular, também apresentava uma zona central branca de aspecto reticular, que na histologia correspondia a hipergranulose e hiperplasia pseudoepiteliomatosa.38 Além disso, a dermatoscopia também pode ser útil para monitorar o tratamento da cromomicose, já que os pontos rubro‐enegrecidos desaparecem com o uso da terapia adequada.
CriptococcoseA criptococose é uma infecção fúngica causada pelo Cryptococcus neoformans; é mais comum em pacientes imunossuprimidos. Em geral, as manifestações cutâneas resultam de uma disseminação sistêmica, embora raramente ocorra por inoculação direta. Existe um grande espectro de manifestações clínicas, mas a apresentação mais comum é a de pápulas branco‐peroladas umbilicadas, mimetizando lesões de molusco contagioso. Na literatura, há apenas um relato da dermatoscopia de lesões de criptococose em um paciente com síndrome da imunodeficiência adquirida (AIDS), sintomas neurológicos e lesões cutâneas faciais.39 O exame dermatoscópico mostrou áreas brancas sem estrutura, vasos irregulares e ramificados, circundados por um halo amarelado. Como descrito, as áreas amareladas representam o componente granulomatoso da lesão na histologia, enquanto as áreas brancas correspondem à fibrose.
MicetomaO eumicetoma, ou micetoma micótico, é uma infecção fúngica crônica que acomete a pele e o tecido subcutâneo. Várias espécies fúngicas hialinas e demáceas podem ser os patógenos causadores; entretanto, as principais envolvidas incluem Madurella mycetomatis, Nigrograna mackinnonii, Trematosphaeria grisea, Falciformispora senegalensis, Scedosporium apiospermum e Acremonium falciforme. A infecção ocorre tipicamente por inoculação e acomete as porções distais dos membros inferiores. A tríade clínica caracteriza‐se por uma área de tumoração, tratos fistulosos e a saída de grânulos macroscópicos. Dependendo do fungo envolvido, os grânulos podem ser negros ou branco‐amarelados.
Assim como nas outras infecções fúngicas profundas, a dermatoscopia do micetoma também mostra áreas amarelo‐alaranjadas, correspondendo histologicamente à inflamação granulomatosa.40,41 Além disso, áreas brancas cicatriciais, escamas superficiais, telangiectasias, vasos em pontos e crostas hemáticas também foram descritos.41 Interessantemente, a dermatoscopia também pode ser utilizada para o diagnóstico dos grânulos e o monitoramento do tratamento. Litaiem et al. mostraram que o exame dermatoscópico propicia a visualização dos grânulos negros, que representam massas compactas de fungos demáceos. Quando os grânulos estavam localizados mais profundamente, áreas branco‐azuladas sem estrutura circundadas por um halo branco e vasos polimórficos podiam ser observados.40 Por fim, Ankad et al. mostraram alterações na dermatoscopia após a realização do tratamento do eumicetoma; foram observados a redução ou o desaparecimento das áreas amarelo‐alaranjadas, escamas e estruturas vasculares e a substituição por áreas branco‐cicatriciais.41
HistoplasmoseA histoplasmose é uma infecção causada pela inalação do fungo Histoplasma capsulatum. A maioria das infecções é assintomática ou autolimitada, mas alguns indivíduos podem apresentar quadros graves ou disseminados. As lesões cutâneas ocorrem na histoplasmose disseminada e há um grande espectro de apresentações clínicas. Na literatura há apenas uma descrição da dermatoscopia de lesões cutâneas de histoplasmose, observada em um paciente com história prévia de psoríase em uso de uma medicação biológica anti‐TNF alfa.42 Ao exame clínico, havia uma pápula eritematosa única na face, cuja dermatoscopia mostrou telangiectasias arboriformes e uma descamação superficial, simulando um carcinoma basocelular.
BlastomicoseA blastomicose é uma infecção causada pela inalação do fungo Blastomyces dermatitidis que pode resultar em um quadro assintomático ou em manifestações pulmonares e extrapulmonares; é uma infecção endêmica em localizações da América do Norte. A pele é o segundo órgão mais acometido após o pulmão e geralmente resulta da disseminação hematogênica; raramente é secundária a uma inoculação traumática. Clinicamente, a blastomicose causa uma reação granulomatosa crônica e supurativa, podendo apresentar lesões verrucosas, ulceradas ou nódulos subcutâneos.
Em relação à dermatoscopia, há apenas dois relatos na literatura. O primeiro caso apresenta uma lesão eritemato‐descamativa numular na face, cuja dermatoscopia mostrou estruturas papilomatosas, com uma tonalidade róseo‐vascular, crostas hemáticas, vasos irregulares e escamas finas.43 Assim, o padrão dermatoscópico possibilitou excluir o diagnóstico diferencial de eczema ou psoríase. O segundo caso relata uma lesão úlcero‐vegetante com evolução de 25 anos, tratada equivocadamente como um pioderma gangrenoso.44 Esse caso também apresentava estruturas papilomatosas branco‐róseas, pontos hemáticos e vasos polimórficos, incluindo vasos em ponto, em saca‐rolhas e serpiginosos.
LeishmanioseA leishmaniose é uma infecção causada por protozoários do gênero Leishmania, transmitidos pela picada de insetos flebotomídeos. Clinicamente, divide‐se em tipo cutâneo, mucocutâneo e visceral. O espectro da doença varia de acordo com interações entre o hospedeiro, o parasita, o vetor e fatores ambientais. A leishmaniose cutânea cursa com lesões úlcero‐nodulares que cicatrizam deixando áreas atróficas. O diagnóstico laboratorial muitas vezes é desafiador, e estima‐se que 350 milhões de pessoas estejam sob risco de desenvolver a infecção no mundo. A prevalência mundial da forma cutânea é de 12 milhões de pessoas, e a incidência anual é de 1,5 milhão de casos.45 Geograficamente, pode ser dividida em leishmaniose do Velho Mundo, que ocorre na Ásia, África e sudeste europeu (complexo Leishmania donovani, L. major, L. tropica e L. aethiopica) e do Novo Mundo (complexo L. braziliensis ou viannia e complexo L. donovani), que ocorrem no Brasil e em países da América Latina. Essa divisão é importante, pois há variação clínica de acordo com o complexo envolvido: no Novo Mundo, o complexo viannia é responsável por lesões clínicas mais prolongadas e severas.45
A leishmaniose cutânea costuma iniciar como uma área eritematosa no local da picada do inseto, que evolui para pápulas ou nódulos. Após um período que pode variar de duas semanas a seis meses, ocorre ulceração das lesões, as bordas tendem a ser induradas e elevadas e o centro da lesão é deprimido. Além disso, algumas lesões podem não ulcerar e permanecem como placas e nódulos. As lesões tendem a ocorrer em áreas não cobertas, principalmente na face e nos membros. Os diagnósticos diferencias são amplos, uma vez que as lesões de leishmaniose variam clinicamente, e incluem hanseníase, tuberculose cutânea, câncer de pele (incluindo ceratoacantoma, carcinoma basocelular, carcinoma espinocelular e melanoma amelanótico), nevo de Spitz, micoses superficiais, granuloma piogênico, dentre outros.46 Além da suspeita clínica, o diagnóstico de leishmaniose é realizado por meio da biópsia de pele lesional com distintos métodos complementares, desde exame anatomopatológico até análises de reação em cadeia da polimerase (PCR). A dermatoscopia pode ser de auxílio na suspeita. Os relatos iniciais de leishmaniose cutânea ao dermatoscópio foram avaliados em casos oriundos de pacientes portadores de formas do Velho Mundo.
Seu uso foi proposto por Lambrich et al., em estudo que avaliou 26 lesões de leishmaniose cutânea em pacientes da Espanha (agente causal L. infantum). O eritema generalizado foi o achado mais frequente, observado em todas as lesões, que corresponde à presença de vasos dilatados ao exame histopatológico, seguido por estruturas em “lágrimas amareladas” (53%), hiperqueratose (50%), erosão central/ulceração (46%), erosão central/ulceração com hiperqueratose (38%) e padrão em starburst esbranquiçado (38%).46,47 As estruturas em lágrima correspondem a plugs foliculares por compressão lateral das aberturas foliculares, devido ao crescimento da lesão.46 Já o padrão em starburst branco corresponde histologicamente à hiper e paraqueratose ao redor da área erosada da lesão.
Ao menos uma estrutura vascular foi observada em cada lesão: vasos em vírgula (73%), lineares irregulares (57%), em ponto (53%), polimórficos/atípicos (26%), em grampo (19%), telangiectasias arboriformes (11%), em saca‐rolhas (7%) e glomerulares (7%). A maioria das lesões (88%) apresentou ao menos dois tipos de vasos.46 Os autores referem que dois padrões principais foram identificados: lesões papulares com componente vascular e estruturas em lágrima, correspondendo às lesões iniciais (observado em 26% das lesões) e lesões tumorais com erosões e ulcerações combinadas com hiperqueratose, padrão em starburst branco e estruturas vasculares periféricas nas lesões mais avançadas (46% das lesões). Em 15% das lesões, os autores observaram a combinação desses dois padrões; no restante dos casos, observaram apenas vasos (11%).46
Posteriormente, Yücel et al. estudaram 102 pacientes com leishmaniose cutânea na Turquia confirmada por identificação do parasita no exame microscópico direto, totalizando 145 lesões (51 pápulas, 40 lesões nódulo‐ulcerativas, 31 placas e 23 nódulos). À dermatoscopia, todas as lesões apresentavam eritema, 58 apresentaram estruturas em lágrima amareladas, crostas e ulcerações foram observadas em 51 lesões, padrão em starburst enbranquiçado em 27 lesões, estruturas ovoides de cor salmão em 19 lesões e halo hipopigmentado perilesional em quatro lesões.48 A presença de estruturas vasculares foi observada em 126 lesões – a mais comum delas foi a presença de padrão linear irregular (78 lesões), seguido por padrão arboriforme (53 lesões), vasos em grampo de cabelo (25 lesões), vasos glomerulares (24 lesões), vasos em ponto (23 lesões), vasos em vírgula (6 lesões) e vasos atípicos polimórficos (4 lesões). Quando os achados dermatoscópicos foram estratificados pelo aspecto clínico, observou‐se que as estruturas em lágrimas amareladas ocorreram em 37% das pápulas, 39% das placas, 61% dos nódulos e 33% das lesões nódulo‐ulcerativas. Úlceras e crostas foram detectadas em 29% das placas e em todas as lesões nódulo‐ulcerativas. Padrão em starburst foi observado em 6% das pápulas, 19% das placas, 9% dos nódulos e 40% das lesões nódulo‐ulcerativas. Estruturas ovoides de coloração salmão foram detectadas em 14% das pápulas, 19% das placas, 17% dos nódulos e 5% das lesões nódulo‐ulcerativas.48 Em relação à duração da lesão, alguns achados foram mais frequentemente observados de acordo com o tempo de evolução da lesão: vasos lineares irregulares, arboriformes, em grampo, glomerulares, em ponto, em vírgula, polimórficos e atípicos e estruturas em lágrima amareladas, úlceras e crostas, halo de hipopigmentação perilesional e padrão em starburst foram mais observados em lesões com duração de 0‐6 e 7‐12 meses. Estruturas ovoides de coloração salmão foram mais observadas em lesões com duração de 7‐12, 19‐24 e acima de 25 meses.48 Estruturas similares a cistos de milia foram encontradas principalmente em lesões localizadas na cabeça e no pescoço.47
Embora os achados dermatoscópicos possam auxiliar no diagnóstico da leishmaniose cutânea, o exame anatomopatológico se impõe em casos nos quais não é possível excluir malignidades, como o melanoma amelanótico, especialmente pela presença de estruturas potencialmente comuns a ambos, como os vasos atípicos polimórficos. Até o presente momento, os achados de leishmaniose cutânea, como os artigos descritos, avaliaram casos da doença por espécies causadoras da leishmaniose do Velho Mundo. Entretanto, é possível que haja diferenças dermatoscópicas da leishmaniose do Novo Mundo. Na figura 10, observam‐se casos de leishmaniose tegumentar americana com ulceração central com áreas brancas homogêneas e eritema com vasos lineares na periferia.
AracnideosIndivíduos que realizam atividades recreacionais ou profissionais na natureza podem estar suscetíveis a contato com espécies de aracnídeos. Os carrapatos são pequenos representantes dessa classe, e em alguns casos são confundidos com o surgimento abrupto de lesão melanocítica por parte de alguns pacientes, quando o parasita é pequeno. De modo acidental, podem se aderir à pele humana, tornando‐se inclusive vetores de doenças sistêmicas. Com o dermatoscópio, é possivel identificar com facilidade o parasita. Em geral, é possível observar o corpo quitinoso apresentando coloração marrom acinzentada e suas patas.49 Em um caso relatado, o paciente apresentava erupção eritemato‐papular nas regiões de interdígitos das mãos, tratado com corticoides tópicos e permetrina tópica sem sucesso. A visualização das lesões pelo dermatoscópio propiciou a identificação de pequenas espículas escuras compatíveis com pelos da aranha caranguejeira (Grammostola pulchra).50 Sem a utilização do dermatoscópio, possivelmente tal identificação não seria possível, demonstrando que, mesmo em um relato isolado de caso, o padrão dermatoscópico pode ser muito útil para a elucidação diagnóstica.
Considerações finaisA dermatologia conta com um espectro enorme de entidades nosológicas e suas variantes. Como já demonstrado na parte I deste artigo, em dermatozoonoses e infeccções bacterianas, a dermatoscopia tem grande utilidade também na avaliação das infecções cutâneas virais e fúngicas, entre outras. Sempre é relevante mencionar a importância de correlacionar os achados dermatoscópicos com dados de história clínica e exame físico dos pacientes. Como todo método diagnóstico auxiliar, ela pode ser extremanente útil em diversos casos, e contribuir pouco em outros. O presente artigo traz contribuições atualizadas para melhorar a prática clínica dermatológica a partir da utilização da dematoscopia. Esta é uma área do conhecimento ainda a ser mais explorada. Novas descrições de achados dermatoscópicos em dermatoses infecciosas devem ocorrer, consolidando achados já descritos ou realizando descrições inéditas e, finalmente, contribuindo cada vez mais no dia a dia do dermatologista.
Suporte financeiroNenhum.
Contribuição dos autoresRenato Marchiori Bakos: Idealização dos artigos; organização dos artigos; redação do manuscrito; revisão e aprovação do texto final.
Leandro Linhares Leite: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Clarissa Reinehr: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Gabriela Fortes Escobar: Elaboração e redação do manuscrito; revisão e aprovação do texto final.
Conflito de interessesNenhum.
Como citar este artigo: Bakos RM, Leite LL, Reinehr C, Escobar GF. Dermoscopy of skin infestations and infections (entomodermoscopy) – Part II: viral, fungal and other infections. An Bras Dermatol. 2021;96:746–58.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.