As características clínicas e histológicas da alopecia cicatricial associada ao líquen plano pilar e ao lúpus eritematoso discoide podem se sobrepor.
ObjetivoDemonstrar a infiltração cutânea de células dendríticas plasmocitoides e comparar seu padrão de distribuição no lúpus eritematoso discoide e no líquen plano pilar.
MétodosForam imunomarcados com CD123: 24 casos de lúpus eritematoso discoide e 30 casos de líquen plano pilar. A porcentagem e o padrão de distribuição das células dendríticas plasmocitoides e a presença de aglomerados de células dendríticas plasmocitoides foram avaliados nas amostras.
ResultadosO número de células dendríticas plasmocitoides foi maior nas amostras de lúpus eritematoso discoide. Agregados de dez células ou mais (aglomerado grande) foram observados em metade das amostras de lúpus eritematoso discoide e em apenas duas amostras de líquen plano pilar, com sensibilidade de 50% e especificidade de 93% para diferenciar lúpus eritematoso discoide de líquen plano pilar.
Limitações do estudoA incidência e a prevalência de alopecia cicatricial associada ao lúpus eritematoso discoide no couro cabeludo são baixas; portanto, o tamanho amostral do presente estudo foi pequeno.
ConclusõesSugere‐se que um agregado de células dendríticas plasmocitoides de dez células ou mais seja altamente específico para distinguir lúpus eritematoso discoide de líquen plano pilar. A imunomarcação com CD123 aparenta ser útil nos estágios ativo e tardio da doença.
O termo alopecia cicatricial refere‐se a doenças caracterizadas pela destruição irreversível dos folículos pilosos e alopecia permanente.1–4 A alopecia cicatricial pode ser categorizada em primária e secundária. A alopecia cicatricial primária engloba doenças que danificam diretamente os folículos pilosos, como líquen plano pilar (LPP), lúpus eritematoso discoide (LED) e celulite dissecante. A alopecia cicatricial secundária é causada por danos indesejados aos folículos pilosos como resultado de processos inflamatórios, como tinha do couro cabeludo, sarcoidose e dermatites por radiação.2–4 LPP e LED são as causas mais comuns de alopecia cicatricial.5 Clinicamente, LPP e LED são semelhantes no couro cabeludo, dificultam o diagnóstico. Vários achados dermatoscópicos, tais como tampões foliculares, pontos cinza‐azulados e áreas brancas, têm sido relatados como característicos do LED; já o padrão em alvo de pontos cinza‐azulados e escamas perifoliculares são característicos do LPP.6 No entanto, a avaliação histopatológica pode ser necessária, devido à sobreposição dos achados.5 Às vezes, os aspectos histopatológicos também podem se sobrepor, principalmente nos estágios tardios com fibrose e pouca inflamação;5,7 consequentemente, pode ser desafiador estabelecer um diagnóstico definitivo com base apenas nas características clínicas, dermatoscópicas e histopatológicas.5 Essas preocupações enfatizam a necessidade de técnicas diagnósticas auxiliares úteis, inclusive imunofluorescência direta5 e imuno‐histoquímica (IHC).8,9
As células dendríticas plasmocitoides (CDP) são células apresentadoras de antígenos que desempenham um papel importante na resposta imune inata. Elas não são normalmente encontradas na pele,10 mas a presença dessas células em doenças inflamatórias, infecções e neoplasias é notável.11 Por exemplo, essas células foram identificadas nas lesões cutâneas de pacientes com lúpus eritematoso,12 líquen plano,13 dermatomiosite,14 síndrome de Sjogren e rosácea.15 Vários estudos demonstraram o papel significativo das CPD na patogênese do lúpus eritematoso, produz interferon tipo 1. Isso foi reconhecido com a imunomarcação com CD123, que é um marcador de superfície das CPD.12,15,16 A presença dessas células e seu padrão de distribuição específico nos tecidos podem ajudar a diferenciar o lúpus eritematoso de outras doenças inflamatórias, como o LPP.8,17,18
Dado que um diagnóstico adequado das condições inflamatórias que levam à destruição dos folículos pilosos é obrigatório para a prevenção de cicatrizes permanentes, o presente estudo teve como objetivo avaliar a presença e o padrão de distribuição de CPD por imunomarcação com CD123 em pacientes com LPP e LED, as causas mais comuns de alopecia cicatricial primária.
MétodosCasuística e coleta de dadosEste estudo retrospectivo foi baseado nos dados disponíveis no Departamento de Patologia do Hospital Shohada‐e Tajrish de janeiro de 2014 a abril de 2018. Foram incluídas apenas lesões no couro cabeludo que apresentassem critérios clínicos e histopatológicos para o diagnóstico de alopecia cicatricial consistente com LED ou LPP. Para todos os pacientes, o diagnóstico histopatológico foi baseado em cortes histológicos corados com H&E e três colorações especiais, inclusive PAS (Periodic Acid Schiff) para avaliação do espessamento da membrana basal, azul de Alcian pH 2,5 para demonstrar a presença e padrão de deposição de mucina dérmica e coloração com orceína para avaliação das fibras elásticas. Os critérios histopatológicos para o LED foram dermatite de interface na epiderme interfolicular e na região perifolicular, infiltração linfoide perivascular e perianexial densa (tanto superficial quanto profunda), aumento da deposição de mucina dérmica e espessamento da membrana basal. Os critérios histológicos para LPP foram dermatite de interface perifolicular no nível do infundíbulo e istmo e ausência de comprometimento no segmento inferior do folículo piloso e da epiderme interfolicular. Foram incluídos 24 casos de LED e 30 de LPP. Todos os casos foram categorizados em dois estágios, de acordo com a quantidade de inflamação e fibrose: o estágio inicial/ativo, caracterizado por infiltração linfocítica e ausência de fibrose, e o estágio tardio, com folículos pilosos destruídos e substituição por tratos fibrosos e infiltração linfocítica mínima ou ausente.19,20
Coloração imuno‐histoquímicaCortes histológicos de tecido fixados em formalina e emblocados em parafina de todos os casos foram imunomarcados para o marcador CD123, anticorpo monoclonal de camundongo anti‐humano CD123 (receptor da cadeia alfa da interleucina‐3; Clone 7G3; Master Diagnostica, Espanha). A partir dos blocos de parafina, cortes histológicos de tecido de 4μm foram aderidos em lâminas com carga eletrostática e depois incubados durante a noite a 37°C. Os cortes histológicos foram desparafinizados, reidratados e expostos à recuperação de epítopos induzida por calor (tecido em ebulição em tampão EDTA a pH 9 por 30 minutos a 95°C). O processo foi seguido por lavagem em água destilada por 3 a 5 trocas e resfriamento à temperatura ambiente por 20 minutos. A peroxidase endógena foi bloqueada com uma solução de peroxidase por 10 minutos à temperatura ambiente. O anticorpo primário (que estava pronto para uso) foi incubado por 30 minutos, seguido por EnVision por 30 minutos a 37° C e enxague com solução salina tamponada com fosfato e tampão de lavagem IHC. Posteriormente, o anticorpo foi detectado com DAB (3, 3’‐diaminobenzidina) por 2 minutos e foi, em seguida, lavado com água destilada. A montagem da lâmina foi feita após a contracoloração com hematoxilina.
Pontuação da imunomarcação com CD123Três parâmetros das CPD foram avaliados principalmente nos cortes histológicos submetidos a IHC (tabela 1):
- 1)
A porcentagem de CPD (CD 123+), calculada por divisão da contagem de CPD pela contagem de células mononucleares em três regiões distintas que exibiram o infiltrado mais proeminente em cortes seriados. Em seguida, a quantidade de CPD foi definida como grau 1 (CPD < 10%), grau 2 (10% ≤ CPD < 20%) e grau 3 (CPD ≥ 20%) (18).
- 2)
A localização anatômica predominante do infiltrado das CPD, inclusive as regiões perifolicular, perivascular, periécrina, subcutânea, intrafolicular, dermoepidérmica e intraepidérmica.
- 3)
A presença de aglomerados de CPD, definidos como agregados de pelo menos cinco CPD. Aglomerados de cinco a dez CPD foram considerados pequenos e agregados de mais de dez CPD foram considerados grandes.17,18 Além disso, a localização anatômica de pequenos e grandes aglomerados foi determinada com base nas localizações acima descritas.
Comparações das porcentagens, formação de aglomerados e localização anatômica das CPD entre LED e LPP
| LED | LPP | p | ||
|---|---|---|---|---|
| Porcentagem média de CPD | 25,45 ± 10,78 | 14,87 ± 7,99 | < 0,001 | |
| Grau de CPD | Grau 1 (< 10%) | 0 | 9 (30%) | < 0,001 |
| Grau 2 (10 ≤ CPD < 20%) | 6 (25%) | 14 (46,6%) | ||
| Grau 3 (≥ 20%) | 18 (75%) | 7 (23,3%) | ||
| Formação de aglomerados | Aglomerado pequeno | 4 (16,7%) | 10 (33,3%) | 0,002 |
| Aglomerado grande | 12 (50%) | 2 (6,7%) | ||
| Localização anatômica das CPD | Epidérmica | 0 | 0 | – |
| JDE | 15 (62,5%) | 2 (6,7%) | < 0,001 | |
| Intersticial | 2 (8,3%) | 14 (46,7%) | 0,020 | |
| Intrafolicular | 3 (12,5%) | 0 | 0,082 | |
| Perifolicular | 24 (100%) | 30 (100%) | – | |
| Perivascular | 22 (91,7%) | 29 (96,7%) | 0,579 | |
| Periécrina | 4 (16,7%) | 0 | 0,034 | |
| Subcutânea | 11 (45,8%) | 6 (20%) | 0,042 | |
Aglomerado grande, agregados de dez CPD ou mais; Aglomerado pequeno, agregados de cinco a dez CPD; CPD, células dendríticas plasmocitoides; JDE, junção dermoepidérmica; LED, lúpus eritematoso discoide; LPP, líquen plano pilar.
A porcentagem de CPD foi comparada entre os dois grupos com o teste t para amostras independentes. Os padrões de distribuição das CPD foram comparados entre LED e LPP com o teste exato de Fisher. A presença de aglomerados foi comparada entre os dois grupos com o teste do χ2. Um valor‐p menor do que 0,05 foi considerado estatisticamente significante.
Todos os procedimentos feitos neste estudo que envolveram participantes humanos atenderam aos padrões éticos do Comitê de Pesquisa Institucional e da Declaração de Helsinque de 1964 e suas posteriores alterações, ou padrões éticos comparáveis.
Este estudo foi aprovado pelo comitê de pesquisa institucional sob o n° IR.SBMU.SRC.REC.1395.43
ResultadosCaracterísticas iniciaisForam examinadas 54 lâminas imunomarcadas. Biópsias de pele de LED foram coletadas de 24 pacientes (sete homens e 17 mulheres) com idade média de 45,33 ± 12,47 anos, enquanto as biópsias LPP foram coletadas de 30 pacientes (12 homens e 18 mulheres) com idade média de 49,50 ± 13,52 anos. Não foi observada diferença estatisticamente significativa entre os grupos quanto à idade (p = 0,245). Nove (37,5%) casos de LED e 15 (50%) casos de LPP estavam no estágio inicial/ativo da doença e 15 (62,5%) casos de LED e 15 (50%) casos de LPP estavam na fase tardia da doença. Não houve diferença significativa entre os dois grupos quanto ao estágio da doença (p = 0,3580)
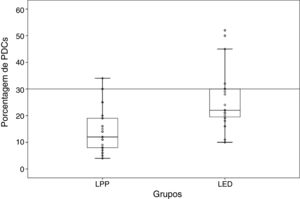
Percentual e padrão de distribuição anatômica das CPDO percentual médio de CPD foi de 14,87 ± 7,99 (variação de 4% a 34%) nos casos de LPP e de 25,45 ± 10,78 (variação de 10% a 52%) nos casos de LED, uma diferença significativa entre os dois grupos (p < 0,001; fig. 1). Nos casos de LED, zero/24 (0%), seis/24 (25%) e 18/24 (75%) amostras foram graduadas como 1, 2 e 3, respectivamente. Para os casos de LPP, nove/30 (30%), 14/30 (46,6%) e sete/30 (23,3%) amostras foram graduadas como 1, 2 e 3, respectivamente, uma diferença estatisticamente significativa (p < 0,001; tabela 1).
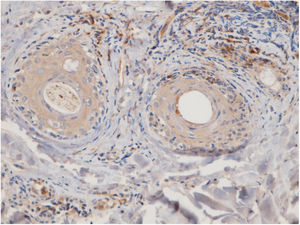
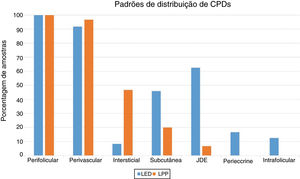
A região perifolicular foi a localização mais comumente acometida, uma vez que todos os casos de LED e LPP apresentaram infiltrados perifoliculares (fig. 2). O comprometimento perivascular foi observado em 29/30 (96,7%) dos casos de LPP e 22/24 (91,7%) dos casos de LED, mas essa diferença não foi estatisticamente significativa (p = 0,579). A infiltração da junção dermoepidérmica foi observada em 15/24 (62,5%) dos casos de LED e em dois/30 (6,7%) dos casos de LPP, uma diferença estatisticamente significativa (p < 0,001). O envolvimento subcutâneo foi identificado em 11/24 (45,8%) dos casos de LED e em seis/30 (20%) dos casos de LPP; essa diferença foi estatisticamente significativa (p = 0,042). Infiltração periécrina foi observada em quatro/24 (16,7%) dos casos de LED e em zero/30 dos casos de LPP, uma diferença estatisticamente significativa (p = 0,034). Infiltração intersticial foi observada em 14/30 (46,7%) dos casos de LPP e em dois 2/24 (8,3%) dos casos de LED, o que também foi estatisticamente significativo (p = 0,02). O comprometimento intrafolicular foi detectado em três/24 (12,5%) dos casos de LED e em zero/30 dos casos de LPP (fig. 2), mas essa diferença não foi estatisticamente significativa. Não foi observada infiltração intraepidérmica de CPD nem nos casos de LED nem nos casos de LPP. A figura 3 mostra o padrão de distribuição anatômica das CPD.
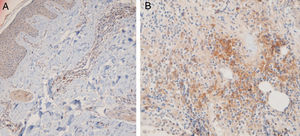
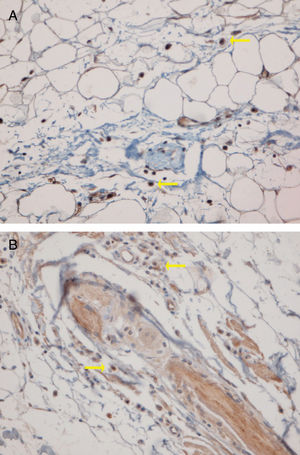
Quinze pequenos aglomerados (cinco a dez células) foram identificados. Dez desses pequenos aglomerados foram observados em dez casos de LPP (33,33%) e cinco deles foram observados em quatro casos de LED (16,7%). A localização desses aglomerados em LPP e LED era perifolicular e perivascular. Foram identificados 26 aglomerados grandes (agregados de dez células ou mais). Três desses grandes aglomerados foram detectados em dois (6,7%) casos de LPP e 23 deles foram identificados em 12 (50%) casos de LED. Observou‐se diferença significativa entre esses dois grupos quanto à formação de aglomerados (p = 0,002). A presença de grandes aglomerados apresentou sensibilidade de 50% e especificidade de 94% para a diferenciação entre LED e LPP (fig. 4 A e B).
Os sítios anatômicos dos grandes aglomerados também foram identificados. Nas amostras de LED, os grandes aglomerados foram frequentemente observados na região perifolicular (21/23 dos aglomerados). Um grande aglomerado foi observado na região da junção dérmoepidérmica e outro foi observado na região subcutânea. Nas amostras de LPP, os grandes aglomerados foram observados nas regiões perifoliculares (um), perivasculares (um) e intersticiais (um).
Metade dos casos de LPP com pequenos aglomerados encontrava‐se no estágio inicial/ativo da doença e a outra metade no estágio tardio da doença, o que não foi estatisticamente significativo (p = 1,000). Nos casos de LED com pequenos aglomerados, um estava em doença ativa e três estavam em estágio avançado da doença, o que não foi estatisticamente significativo (p = 1,000). Dois casos de LPP apresentavam grandes aglomerados, um no estágio ativo da doença e outro no estágio tardio da doença, o que não foi estatisticamente significativo (p = 1,000). Nos 12 casos de LED com grandes aglomerados, quatro casos apresentavam doença ativa e oito estavam em estágio avançado da doença, o que não foi estatisticamente significativo (p = 0,673).
DiscussãoO lúpus eritematoso é uma doença autoimune que acomete múltiplos órgãos. CPD e interferons do tipo 1 desempenham um papel importante em sua patogênese. Estudos demonstraram que, no lúpus eritematoso, as CPD migram do sangue para o local da inflamação, como a pele e os rins.16 Grande quantidade e aglomerados de CPD foram descritos em muitos tipos de lúpus cutâneo (por exemplo, lúpus agudo e LED). Demonstrou‐se que as CPD se apresentam em maior número em casos de lúpus eritematoso cutâneo do que em outras doenças inflamatórias da pele, como dermatomiosite, rosácea e líquen plano.12,14,15,21 No presente estudo, observou‐se uma alta porcentagem de CPD na alopecia cicatricial causada por LED em comparação ao LPP (aproximadamente 26% vs. 15%).
CPD foram observadas nas lesões mucosas e cutâneas do líquen plano.22,23 O número dessas células varia nos diferentes estudos feitos até agora. Em alguns estudos, uma baixa porcentagem de CPD foi relatada no LPP (< 10%) (8, 17, 18), enquanto uma porcentagem maior de CPD foi observada no líquen plano oral (20%).23 No presente estudo, o percentual de CPD no LPP foi de aproximadamente 15%, valor superior ao encontrado nos estudos de Fening e Seleimans.8,18
O local anatômico predominante da infiltração de CPD também pode variar nos tecidos cutâneos, tanto no LED quanto no LPP. Sleiman et al. relataram a presença de CPD na derme profunda, em localização periécrina e na junção dermoepidérmica em quase todas as amostras de LED; por outro lado, a infiltração dessas células na junção dermoepidérmica foi observada em apenas um pequeno número de amostras de LPP e não foram observadas infiltrações na derme profunda e na região periécrina.18 No estudo de Fening et al., observou‐se envolvimento perifolicular e perivascular em quase todas as amostras de LED e em um pequeno número de amostras de LPP, bem como envolvimento periécrino e perifolicular em muitas amostras de LED, mas não em amostras de LPP. No estudo desses autores, o envolvimento intrafolicular das CPD não foi observado nem no LED nem no LPP.8 No presente estudo, as regiões perifoliculares e perivasculares apresentaram a maior densidade de CPD no LED e no LPP. Os cortes histopatológicos verticais usados no presente estudo permitiram avaliar a epiderme e a junção dermoepidérmica, que não podem ser avaliadas quando os cortes são horizontais. Nem o LED nem o LPP mostraram infiltração intraepidérmica de CPD. No presente estudo, o envolvimento da junção dermoepidérmica e da região subcutânea foi notável nas amostras de LED. Foi detectada infiltração periécrina e intrafolicular em um pequeno número de casos de LED, porém em nenhum dos casos de LPP (fig. 2). Infiltração intersticial foi observada em muitos casos de LPP e em poucos casos de LED. O presente estudo é o primeiro desse tipo a avaliar a região subcutânea quanto à presença de CPD no LED e LPP; essas células foram detectadas no tecido subcutâneo, tanto no LED quanto no LPP. Vale ressaltar que as CPD foram observadas principalmente ao longo da parte profunda dos folículos pilosos no tecido subcutâneo das amostras de LPP, enquanto estavam mais espalhadas pelo subcutâneo nas amostras de LED (fig. 5).
Foram observados grandes aglomerados (agregados de dez células ou mais) em metade das amostras de LED, mas em apenas dois casos de LPP, com sensibilidade de 50% e especificidade de 94% para diferenciação entre LED e LPP. Esses grandes aglomerados eram frequentemente localizados na região perifolicular. Theodore et al. relataram agregados de 20 células ou mais em 60% das amostras de lúpus facial.15 Sleiman et al. detectaram agregados de dez células ou mais em 100% dos casos de LED com alopecia cicatricial.18 Outros estudos detectaram alguns ou nenhum aglomerado de CPD em alopecia cicatricial de outras causas, como LPP, alopecia frontal fibrosante e alopecia cicatricial centrífuga central.8,17,18 Koliver et al. estimaram que aglomerados de cinco células ou mais tinham 77% de sensibilidade e 89% de especificidade para distinguir LED de LPP.17 No presente estudo, os pequenos aglomerados (agregados de 5 a 10 células) não tiveram valor diagnóstico para diferenciar LPP de LED.
Fening et al. excluíram casos que não apresentavam infiltrado inflamatório significativo de células mononucleares e identificaram agregados de dez CPD ou mais e 20 CPD ou mais em 94,1% e 82,4% dos casos de LED com alopecia cicatricial, respectivamente.8 Os achados do presente estudo indicam que a formação de aglomerados pode ser observada nos estágios ativo (inflamação proeminente sem fibrose) e tardio (fibrose proeminente com inflamação mínima ou ausente) da doença.
ConclusãoO presente estudo indica que a detecção de CPD por imunomarcação com CD123 pode ser um método de diagnóstico aceitável para o diagnóstico de LED e a presença de aglomerados de dez células ou mais tem alta especificidade para o diagnóstico de alopecia cicatricial associada a LED. A imunomarcação com CD123 aparenta ser útil nos estágios ativo e tardio da doença.
Suporte financeiroNenhum.
Contribuição dos autoresAzadeh Rakhshan: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Parviz Toossi: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica do manuscrito.
Maliheh Amani: Análise estatística; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Sahar Dadkhahfar: Obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Arash Bagheri Hamidi: Análise estatística; obtenção, análise e interpretação dos dados.
Conflitos de interesseNenhum.
Como citar este artigo: Rakhshan A, Toossi P, Amani M, Dadkhahfar S, Hamidi AB. Different distribution patterns of plasmacytoid dendritic cells in discoid lupus erythematosus and lichen planopilaris demonstrated by CD123 immunostaining. An Bras Dermatol. 2020;95:307–13.
Trabalho realizado no Centro de Pesquisa da Pele, Universidade de Ciências Médicas Shahid Beheshti, Hospital Shohada‐e Tajrish, Teerã, Irã.