O uso do oleato de monoetanolamina 5% é efetivo para o tratamento de malformação vascular de baixo fluxo sanguíneo.
ObjetivosRelatar série de casos clínicos de malformações vasculares orais tratadas com oleato de monoetanolamina 5% e o resultado estético.
MétodosEstudo descritivo retrospectivo em prontuários eletrônicos pelo período de sete anos. Foram coletados dados demográficos dos pacientes, recursos diagnósticos, localização e tamanho das lesões e quantidade de aplicações do oleato de monoetanolamina 5%.
ResultadosForam localizadas 21 malformações vasculares orais, em sua maioria nos lábios inferiores (52,3%) e solucionada em uma única aplicação em 14 pacientes. Foram encontrados 19 pacientes tratados por meio de escleroterapia. Desses, 13 eram mulheres e seis homens, com média de 61 anos.
Limitações do estudoTamanho da amostra.
ConclusõesA escleroterapia é tratamento efetivo para as malformações vasculares da região de lábios e cavidade oral, com resolução em apenas uma ou duas aplicações (n=16) e satisfação estética dos pacientes.
As malformações vasculares (MVs) são lesões do sistema vascular ou linfático que podem acometer qualquer parte do corpo, mas são comuns na região de cabeça e pescoço.1 Devido a uma divergência na literatura quanto à nomenclatura correta, a International Society for the Study of Vascular Anomalies (ISSVA), em 1996, classificou as anomalias vasculares em: tumores vasculares (hemangiomas) e malformações vasculares, com base nas características biológicas e histopatológicas das lesões.2,3
O desenvolvimento dos tumores vasculares ocorre por meio do crescimento celular e da proliferação de vasos. Já as MVs são caracterizadas por um defeito na maturação dos vasos e na morfogênese vascular, causado principalmente por uma disfunção na regulação nos caminhos da embriogênese e vasculogênese.3 As MVs podem ser divididas em MVs de baixo e de alto fluxo: as de baixo fluxo são compostas por componente venoso, capilar ou linfático; e as de alto fluxo, por componente arterial ou arteriovenoso.4
Geralmente, as MVs ocorrem em crianças e adultos jovens. Na cavidade oral, são normalmente observadas nos lábios, língua, mucosa jugal e palato.5–7 As MVs não regridem espontaneamente, podem expandir‐se e podem ser únicas ou múltiplas.7 As manifestações clínicas consistem em dor, ulcerações, sangramentos, além de restrições funcionais e alterações na estética.5,8,9 A etiologia pode estar relacionada a trauma, gravidez e outros fatores hormonais que podem induzir o crescimento dessas lesões.3
A indicação terapêutica das MVs depende de um diagnóstico que a especifique quanto ao seu tipo vascular (arterial, venoso e/ou linfático) e o tipo de fluxo sanguíneo. As opções de tratamento são: laserterapia, excisão cirúrgica, embolização, eletrocirurgia e escleroterapia combinada com cirurgia.7,10,11
A escleroterapia é uma técnica conservadora que consiste em injeções intralesionais com agentes esclerosantes, os quais levarão os vasos à inflamação, seguida de oclusão e esclerose vascular, resultam em regressão da lesão.12 Entre os vários agentes esclerosantes usados para tratar as MVs, o oleato de monoetanolamina a 5% é relatado na literatura como um método seguro, eficiente e com baixa toxicidade para o tratamento dessas lesões em diversas regiões do corpo.1,13,14
O presente estudo tem como objetivo relatar 19 casos clínicos de MVs orais tratados com escleroterapia por meio da aplicação de oleato de monoetanolamina a 5% como terapia única em MVs presentes na boca, demonstrar a conduta diagnóstica e a indicação terapêutica.
MétodosCaracterização e coleta de dadosEstudo descritivo retrospectivo feito por meio da coleta de dados dos pacientes que apresentavam MVs orais tratadas com escleroterapia com oleato de monoetanolamina a 5%. Foi feita uma busca no sistema de prontuários eletrônicos, com os termos “vascular”, “malformações vasculares” e “lesão vascular”, de 2011 a 2017, resultou em 19 casos que foram usados para o presente relato. Foram coletados os dados demográficos, como idade, sexo e etnia dos pacientes submetidos à escleroterapia. Outros dados referentes aos recursos de diagnóstico usados, à localização e ao tamanho das MVs e à quantidade de aplicações do oleato de monoetanolamina também foram coletados.
Critérios diagnósticos e escleroterapiaO diagnóstico de MV iniciou‐se quando, clinicamente, foi observada a presença de vesículas ou bolhas violáceas, de consistência amolecida à palpação e indolores. Muitas vezes, foram relatados sensação pulsátil e aumento de volume durante ou após exercícios físicos. No histórico da lesão, observaram‐se relatos de trauma, puberdade, gravidez ou alterações hormonais associados previamente ao surgimento da lesão. Em todos os casos, havia registro de que, na diascopia, foram constatadas mudança de coloração, isquemia intralesional e diminuição ou alteração do formato, o que corroborou o diagnóstico presuntivo de MV.
Quando a MV apresentava tamanho igual a ou menor do que 5mm de diâmetro, e mostrava‐se bem delimitada à inspeção visual e à palpação, o tratamento de escolha foi a escleroterapia, sem exames de imagem complementares diagnósticos. Porém, nas lesões maiores do que 5mm, de limites imprecisos à inspeção visual e à palpação, ou com múltiplas lesões em uma mesma região eletiva à escleroterapia, com história da doença atual não compatível com MV e/ou aspectos clínicos sugestivos de tumores vasculares, foram feitos exames de ultrassonografia com Doppler, os quais proporcionaram um diagnóstico adequado, de acordo com o tipo do conteúdo vascular e a velocidade do fluxo sanguíneo.4 Nos casos em que o conteúdo fosse predominantemente venoso e de baixo fluxo, a escleroterapia permaneceu indicada.
A solução esclerosante foi aplicada de acordo com as recomendações do fabricante. O óleo esclerosante foi diluído em líquido anestésico em uma proporção de 7:3mL de oleato de monoetanolamina a 5% (0,7mL) para mepivacaína a 2% com epinefrina 1:100.000 (0,3mL) em uma seringa de 1mL. A primeira injeção foi aplicada na região central da MV, com introdução da agulha a uma profundidade que compreendesse metade do volume da MV. Antes da injeção com a solução esclerosante, verificou‐se aspiração positiva do vaso sanguíneo para a correta aplicação intravascular.
A isquemia e o aumento progressivo da pressão necessária para injeção provocada pelo acúmulo da solução esclerosante intralesional foram usados como critérios para cessar a aplicação do medicamento naquela região. Então, o conjunto agulha‐seringa era redirecionado para outra região da MV onde fosse observada nova aspiração positiva para aplicação de outra injeção. Por sessão, foi aplicado no máximo 1mL da solução esclerosante, devidamente diluída, e, para cada aplicação em uma única região da MV, a quantidade variou entre 0,2 e 0,4mL. Portanto, por sessão, injetava‐se a solução esclerosante em até quatro regiões de uma MV.
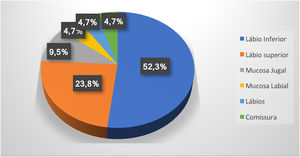
ResultadosForam encontrados 19 pacientes que fizeram escleroterapia em MV, total de 21 MVs, pois dois apresentavam duas lesões. Eles tinham média de 61 anos; 13 (68%) eram do sexo feminino e 15 (79%) eram brancos (tabela 1). Lesões maiores do que 5mm foram encontradas em seis pacientes e, nesses casos, foi feita a ultrassonografia com Doppler. Em todos os casos deste estudo, as MVs eram do tipo venosa e de baixo fluxo sanguíneo. A região mais acometida foi o lábio inferior (52,3%), seguido do lábio superior (23,8%), mucosa jugal (9,7%), mucosa labial (4,7%), ambos os lábios (4,7%) e comissura labial (4,7%) (fig. 1).
Distribuição dos pacientes tratados com oleato de monoetanolamina de acordo com a epidemiologia e as características clínicas das lesões
| Paciente | Idade | Sexo | Etnia | Sintomatologia | Tempo de evolução | Fatores associados | Localização da MV |
|---|---|---|---|---|---|---|---|
| 1 | 58 | M | Negra | Assintomático | 27 meses | Mordida de objeto | Lábio inferior |
| 2 | 63 | F | Branca | Assintomático | 10 meses | Ausente | Mucosa jugal |
| 3 | 62 | F | Branca | Assintomático | 10 anos | Histórico de varizes | Lábio superior |
| 4 | 60 | F | Branca | Assintomático | 2 meses | Histórico de varizes | Mucosa labial |
| 5 | 49 | M | Branca | Assintomático | 20 anos | Ausente | Lábio inferior |
| 6 | 74 | F | Branca | Assintomático | 15 anos | Ausente | Lábio inferior |
| 7 | 62 | M | Branca | Sim | 20 anos | Histórico de trauma | Lábio superior |
| 8 | 82 | M | Branca | Assintomático | 4 anos | TRH | Lábio superior |
| 9 | 65 | F | Não relatada | Assintomático | 10 anos | TRH | Lábios |
| 10 | 61 | F | Negra | Assintomático | 3 meses | TRH | Lábio inferior |
| 11 | 61 | F | Branca | Assintomático | 25 anos | Mordiscamento do lábio | Lábio inferior |
| 12 | 21 | F | Branca | Assintomático | 3 meses | Ausente | Lábio superior |
| 13 | 48 | F | Branca | Sim | 8 anos | Ausente | Mucosa jugal |
| 14 | 59 | F | Branca | Não relatada | 2 anos | Histórico de trauma | Lábio inferior |
| 15 | 68 | F | Parda | Assintomático | 40 anos | Associado à gestação anterior | Lábio inferior |
| Comissura labial | |||||||
| 16 | 63 | F | Branca | Assintomático | 6 anos | Histórico de trauma+TRH | Lábio inferior |
| 17 | 63 | M | Branca | Assintomático | 2 anos | TRH | Lábio inferior |
| 18 | 69 | F | Branca | Assintomático | 1 ano | TDVP | Lábio inferior |
| Lábio superior | |||||||
| 19 | 64 | M | Branca | Assintomático | Há anosa | Ausente | Lábio inferior |
MV, malformação vascular; TDVP, tratamento para doença vascular; TRH, terapia de reposição hormonal.
O número de sessões variou de acordo com a diminuição da coloração e do volume das MVs e, principalmente, mediante a satisfação estética individual de cada paciente. Os pacientes retornavam para avaliação e, caso houvesse necessidade, uma nova sessão de aplicação da solução esclerosante era feita 20 dias após a última injeção. Assim, foram feitas de uma a cinco sessões em cada lesão até a obtenção do resultado satisfatório e, na maioria dos casos, foram necessárias uma (38,1%) ou duas (38,1%) aplicações da solução esclerosante. Em três (14,3%) lesões, fizeram‐se três aplicações; em uma (4,75%), foram necessárias quatro aplicações; e, em um único caso (4,75%), cinco aplicações (tabela 1).
Durante o procedimento, todos os pacientes queixaram‐se de ardência local e foram observados edema e isquemia leve na região. Na primeira consulta pós‐operatória, todos os pacientes relataram sensação de endurecimento na região da lesão, mas somente nas primeiras 72 horas após o procedimento; apenas um paciente relatou formigamento e também um único paciente observou parestesia na região, mas, nas consultas seguintes, não havia queixa alguma. Em todos os casos houve redução do volume e esmaecimento das MVs, com relato de melhoria estética da região (fig. 2).
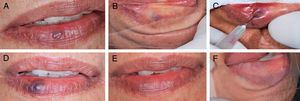
A, Aspecto clínico inicial da malformação vascular, vesícula arroxeada de 3mm em lábio inferior (paciente 16).B, Diascopia positiva para lesão vascular feita durante o exame clínico.C, Aplicação do oleato de monoetanolamina a 5% com aspiração positiva de sangue no lúmen do vaso. D, Aspecto clínico da lesão no 7° dia de pós‐operatório. E, Aspecto clínico final da lesão vascular no 28° dia pós‐operatório. F, Diascopia negativa final da região onde havia a MV.
No presente estudo, as MVs foram mais encontradas em adultos e idosos, o que diverge dos achados da literatura, em que se mostraram mais frequentes em jovens e adultos jovens.15–17 Foram prevalentes em mulheres, corroboraram outros relatos.7,17 Quanto à localização, as MVs foram encontradas com mais frequência nos lábios, também em concordância com a casuística da literatura revisada.5,6,16
As MVs podem ser classificadas de acordo com a velocidade do movimento do fluido sanguíneo, que pode ser de fluxo lento (MVs venosas, linfáticas e capilares) ou rápido (MVs arterial e arteriovenosas).2,18 As MVs venosas aparecem na ultrassonografia com Doppler como estruturas tubulares hipoecoicas, demonstram o padrão de fluxo sanguíneo lento.19 O diagnóstico correto é fundamental para o sucesso da escleroterapia, pois, para o tratamento ser eficiente, é necessário contato prolongado do agente esclerosante com a parede do vaso sanguíneo; dessa maneira, a escleroterapia é mais eficaz e segura em MVs venosas de baixo fluxo.15
Neste estudo, as MVs foram diagnosticadas por meio de um minucioso exame clínico, pela manobra semiotécnica de diascopia e pelo exame de ultrassonografia com Doppler para lesões maiores do que 5mm. Logo, em todos os casos, as MVs eram venosas, o fluxo sanguíneo lento indicava a escleroterapia. Nos casos em que a MV apresentou conteúdo arteriovenoso de grande calibre com alto fluxo sanguíneo, a escleroterapia foi contraindicada.
A escleroterapia é o tratamento de escolha para as MVs e apresenta taxa de sucesso de 70% a 100%.1,16,20–25 Para lesões menores, essa terapia pode levar à remissão completa da lesão ou à redução significativa no tamanho, sem necessidade de terapias complementares.18 Dentre vários agentes indutores de esclerose, o oleato de monoetanolamina é atualmente a melhor opção devido à baixa toxicidade em comparação a outros agentes indutores de esclerose.13,14 Além disso, esse tipo de tratamento tem menos chance de hemorragia, formação de cicatrizes e hiperpigmentação, além de ser um procedimento menos invasivo quando comparado à cirurgia.1,25
Ainda não há consenso na literatura quanto à concentração ideal desse agente esclerosante para tratamento das MVs.1,7,15,16 Um estudo anterior indicou o uso de oleato de monoetanolamina a 5% em doses menores do que 1mL por sessão.26 A Agência Nacional de Vigilância Sanitária brasileira (Anvisa) (2016) preconiza dose de 0,5 a 2mL em cada veia, não deve o total ultrapassar 6mL. Neste estudo, foi usado 0,7mL de oleato de monoetanolamina na concentração de 5% diluído em 0,3mL de anestésico, total de 1mL máximo usado por sessão em cada lesão, que é o protocolo já aplicado na instituição.27
Em 2005, Hyodoh et al. relataram que uma única aplicação seria suficiente para a resolução total em lesões vasculares menores (≤ 30mm). No entanto, no estudo, todas as lesões vasculares eram menores do que 30mm, mas apenas em oito casos (42%) fez‐se uma única aplicação do agente esclerosante.14 Em média, foi necessária 1,6 sessão para cada lesão com o oleato de monoetanolamina na concentração de 5% até a resolução das lesões, método também já usado em estudos anteriores.15,16,25 A concentração de 5% foi responsável pelo menor número de sessões quando comparada ao estudo de Johann (2005), que precisou em média de 3,7 sessões devido ao uso de concentrações menores desse agente esclerosante (1,5% e 2,5%).1
A complicação da escleroterapia é dose‐dependente e a mais comum é dano ao nervo periférico ou necrose da pele, que pode resultar em cicatrizes e levar a problemas estéticos.15,28–30 Essa condição ocorre quando há invasão de quantidade excessiva do agente esclerosante em tecido normal ou quando se usa alta pressão durante a aplicação.25,30
Além disso, pode‐se desenvolver hemoglobinúria e insuficiência renal hemolítica, mas isso é restrito a doses superiores a 9,6mL de oleato de monoetanolamina.31,32 Assim, neste estudo, a solução esclerosante foi injetada com leve pressão dentro do lúmen vascular com aspiração positiva de sangue para certificar‐se da deposição no local correto, a fim de evitar e/ou minimizar complicações.
Apenas dois pacientes apresentaram sintomatologia na região das MVs no momento da avaliação inicial e todos os indivíduos deste estudo apresentavam queixa de estética insatisfatória. Logo, a escleroterapia foi indicação estética para os casos tratados neste estudo. Todos relataram queimação durante a aplicação da solução esclerosante, condição também descrita em outros trabalhos.1,15 Além disso, em 2002, Choi et al. relataram queimação nesse momento mesmo nos casos em que houve anestesia local prévia à escleroterapia, mas não houve queixa de dor durante a infiltração do agente esclerosante.15 Para Bonan (2007), a diluição de oleato de monoetanolamina em água destilada também não reduz os sintomas; além disso, poderia ser responsável pela diminuição da ação do agente químico nas paredes do vaso.33
Também foi observado e relatado que, após a aplicação da solução esclerosante, houve edema que perdurou entre 72 horas a sete dias após o procedimento. Outros sintomas pós‐procedimento foram parestesia em um paciente (5,2%) e um caso de formigamento (5,2%). Esses sinais e sintomas resolveram‐se espontaneamente logo na primeira consulta pós‐operatória sem que houvesse necessidade de terapia adicional. Nenhum outro efeito colateral foi observado em nosso estudo e a taxa de complicação não diferiu daquela de outros estudos.1,7,15,25,34
Em todas as MVs (21 lesões), a aplicação de 0,7mL de oleato de monoetanolamina a 5% como terapia única foi um método fácil, simples, rápido e de baixa morbidade, uma vez que foi feita em nível ambulatorial com número reduzido de sessões e boa tolerabilidade pelo paciente. Apesar do tamanho da amostra e de tratar‐se de um estudo retrospectivo por meio da análise em prontuários, os dados obtidos mostraram ser esse um método eficaz em 100% dos casos, pois se observou melhoria dos sinais e sintomas clínicos, com diminuição subjetiva e objetiva do volume ou inchaço das MVs tratadas e, consequentemente, houve melhoria na estética da região.
ConclusãoA escleroterapia com oleato de monoetanolamina a 5% como terapia única é um método eficaz, seguro e de fácil aplicação, capaz de proporcionar resultados estéticos excelentes em número reduzido de sessões e com grande aceitação pelo paciente.
Suporte financeiroNenhum.
Contribuição dos autoresBrena Rodrigues Manzano: análise estatística; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Aloizio Maciel Premoli: elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Natalia Garcia Santaella: aprovação da versão final do manuscrito; elaboração e redação do manuscrito.
Carla Renata Sanomiya Ikuta: aprovação da versão final do manuscrito; elaboração e redação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Cássia Maria Fisher Rubira: aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Paulo Sérgio da Silva Santos: aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Manzano BR, Premoli AM, Santaella NG, Ikuta CRS, Rubira CMF, Santos PSS. Sclerotherapy as an esthethic indication in oral vascular malformations: a case series. An Bras Dermatol. 2019;94:521–6.
Trabalho realizado na Clínica de Pós‐graduação do Departamento de Estomatologia e Radiologia da Faculdade de Odontologia de Bauru, Universidade de São Paulo, Bauru, SP, Brasil.