O hamartoma folicular basaloide é malformação superficial benigna dos folículos pilosos que pode ser confundida clínica e histopatologicamente com carcinoma basocelular. O hamartoma folicular basaloide tem sido associado a uma mutação no gene PTCH‐1, que faz parte da mesma via envolvida na síndrome de Gorlin‐Goltz. Apresentamos aqui um paciente de 9 anos de idade com lesão congênita assintomática na fronte, que aumentou de tamanho ao longo dos anos. A histopatologia mostrou um hamartoma folicular basaloide associado a mucinose folicular e inflamação. A síndrome de Gorlin‐Goltz foi descartada pelo exame clínico.
O hamartoma folicular basaloide (HFB) é lesão benigna que deve ser avaliada cuidadosamente, pois a entidade pode ser confundida clínica e histopatologicamente com carcinoma basocelular. O desenvolvimento do HFB foi associado a uma mutação no gene Patched (PTCH‐1), que faz parte da mesma via envolvida na síndrome de Gorlin‐Goltz.
Em razão da apresentação clínica variada do HFB, é imperativo realizar biópsia da lesão para distingui‐la de outras lesões cutâneas comuns.
Atualmente, não existe tratamento‐padrão para o HFB.
A identificação correta torna possível o monitoramento periódico de uma transformação maligna, enquanto poupa os pacientes de cirurgias desnecessárias.1
Relato do casoUm menino de 9 anos veio à consulta em razão de uma lesão congênita assintomática localizada na fronte, que aumentou de tamanho com o passar dos anos. A criança nasceu com fissura labiopalatina, a qual foi corrigida cirurgicamente. Não havia história familiar relevante relacionada a essa dermatose.
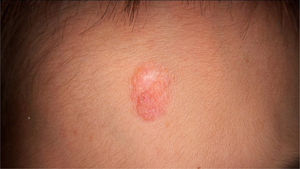
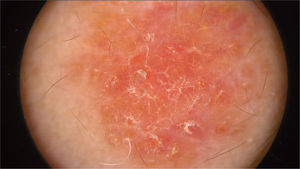
O exame físico revelou duas depressões plantares e uma placa arredondada e avermelhada com áreas verrucosas na região central da fronte (fig. 1). A dermatoscopia revelou uma lesão escamosa avermelhada, sugerindo aumento da queratinização, principalmente a nível perifolicular, sem padrão de lesão melanocítica ou vascular (fig. 2).
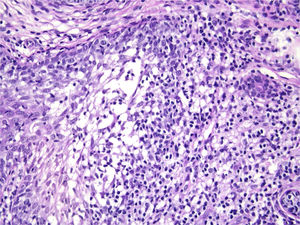
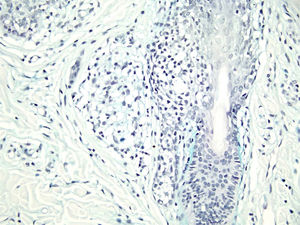
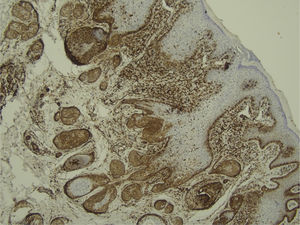
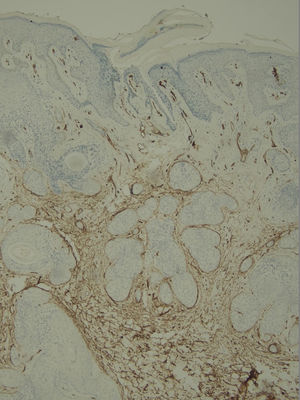
Com base na suspeita diagnóstica de nevo sebáceo de Jadassohn ou nevo epidérmico verrucoso linear, foi realizada uma biópsia. O exame histopatológico com coloração pela hematoxilina e eosina mostrou na derme uma proliferação de células basaloides formando cordões anastomosados, em continuidade com um folículo piloso e maciços lobulados com formação ocasional de cistos córneos dispostos entre as unidades pilossebáceas e o estroma fibroso. Foi observado infiltrado inflamatório denso predominantemente mononuclear (fig. 3). As células dos maciços lobulados estavam separadas por material intercelular positivo na coloração pelo Alcian blue, possivelmente correspondendo a depósitos de mucina (fig. 4). A imunomarcação com Bcl‐2 demonstrou fraca positividade citoplasmática apenas nas células tumorais mais externas (fig. 5), e foi observada positividade para CD34 nas células do estroma próximas às células tumorais (fig. 6).
A lesão foi removida cirurgicamente. Ultrassonografia abdominal e radiografias panorâmicas da região maxilar e anterolateral do crânio foram realizadas para descartar a síndrome de Gorlin‐Goltz.
DiscussãoO HFB é malformação superficial benigna rara dos folículos pilosos que apresenta‐se histopatologicamente como proliferação epitelial de células basaloides e clinicamente sob várias formas, com e sem doenças associadas.1 Estudos genéticos ligaram o HFB a uma mutação no gene PTCH‐1 na banda cromossômica 9q23. O gene faz parte da mesma via envolvida na síndrome de Gorlin‐Goltz, embora sua expressão seja menos grave.1
O gene PTCH‐1 codifica um receptor para o produto proteico do gene sonic hedgehog (SHH). A mutação do gene determina a perda de função. O receptor do PTCH‐1 forma um complexo receptor com outra proteína transmembrana conhecida como SMO (de “smoothened”). Quando a proteína SHH está ausente, o receptor do PTCH‐1 inativa a SMO e a impede de fazer a transdução de um sinal downstream. A ligação da proteína SHH ao receptor do PTCH‐1 libera a supressão da SMO, causando a regulação ascendente de genes alvo do hedgehog através de uma cascata de sinal que envolve fatores de transcrição da família Gli. A regulação ascendente da sinalização pode levar ao aumento da divisão celular, resultando em crescimento e padrão anormais.1,2
O HFB pode ser congênito ou adquirido.3 A apresentação clínica é diversa, em forma de pápulas, nódulos ou placas da cor da pele a marrom na face, no couro cabeludo e, ocasionalmente, no tronco.1,4
Cinco diferentes formas foram descritas: pápulas solitárias ou múltiplas; placa localizada linear ou unilateral, que pode ser distribuída ao longo das linhas de Blaschko; placa localizada com alopecia; tipo familiar de herança dominante generalizada sem distúrbio associado; ou pápulas generalizadas associadas a alopecia difusa e miastenia gravis, lúpus eritematoso sistêmico ou fibrose cística.5–7
O HFB pode se manifestar isoladamente ou associado a outras doenças cutâneas hereditárias, como as síndromes de Bazex‐Dupré‐Christol, de Brown‐Crounse e de Happle‐Tinschert.1,7
Apesar das manifestações clínicas variáveis, todos os tipos de HFB apresentam as mesmas características histopatológicas, incluindo principalmente múltiplos maciços e cordões ramificados de células epiteliais basaloides na derme papilar, alguns dele em continuidade com a epiderme e com os folículos pilosos dilatados. A formação de cistos córneos é comum dentro dos cordões ramificados ou trama retiforme de células basaloides. Não há atipia celular nem mitoses no HFB. A imuno‐histoquímica é positiva para CD34 no estroma e para Bcl‐2 na periferia das trabéculas. O índice Ki67 é baixo.1,6–8
O principal diagnóstico diferencial é o carcinoma basocelular (CBC), principalmente o subtipo infundibulocístico.2,4,7 Clinicamente, outros diagnósticos diferenciais da forma localizada são: tumores anexiais, nevos, tricoepitelioma, siringocistoadenoma, nevo melanocítico intradérmico, ceratose seborreica, nevo sebáceo, siringoma e angiofibroma. O HFB com distribuição linear pode mimetizar o nevo epidérmico linear, o líquen estriado e a morfeia linear. O HFB generalizado pode representar a síndrome do hamartoma folicular generalizado, esclerose tuberosa, síndrome de Cowden, tricoepiteliomas múltiplos, síndrome de Gorlin‐Goltz e síndrome de Rombo. O principal diagnóstico diferencial histopatológico inclui CBC infundibulocístico, proliferação basaloide foliculocêntrica e tricoepitelioma.1,6,7,9
O HFB deve ser monitorado com rigor, pois pode evoluir para CBC.
Diferentes tratamentos, como cirurgia, laser de dióxido de carbono e terapia fotodinâmica, foram propostos.2
Este relato de caso apresenta uma condição rara, com apresentação clínica e histopatológica incomum que pode corresponder à manifestação clínica de uma mutação no gene PTCH. Que seja de nosso conhecimento, até o momento nenhum outro caso de HFB com mucinose e inflamação foi publicado na literatura.
Suporte financeiroNenhum.
Contribuição dos autoresSolange Edelman: Elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Adriana Natalia Torres Huamani: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Adriana Natalia Torres Huamani: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados.
Andrea Bettina Cervini: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Agradecemos ao Dr. Stefano Paola.
Como citar este artigo: Edelman S, Torres Huamani AN, Centeno MV, Cervini AB. Basaloid follicular hamartoma associated with follicular mucinosis and inflammation. An Bras Dermatol. 2022;97:45–8.
Trabalho realizado no Hospital de Pediatría “Prof. Dr. Juan P. Garrahan”, Buenos Aires, Argentina.