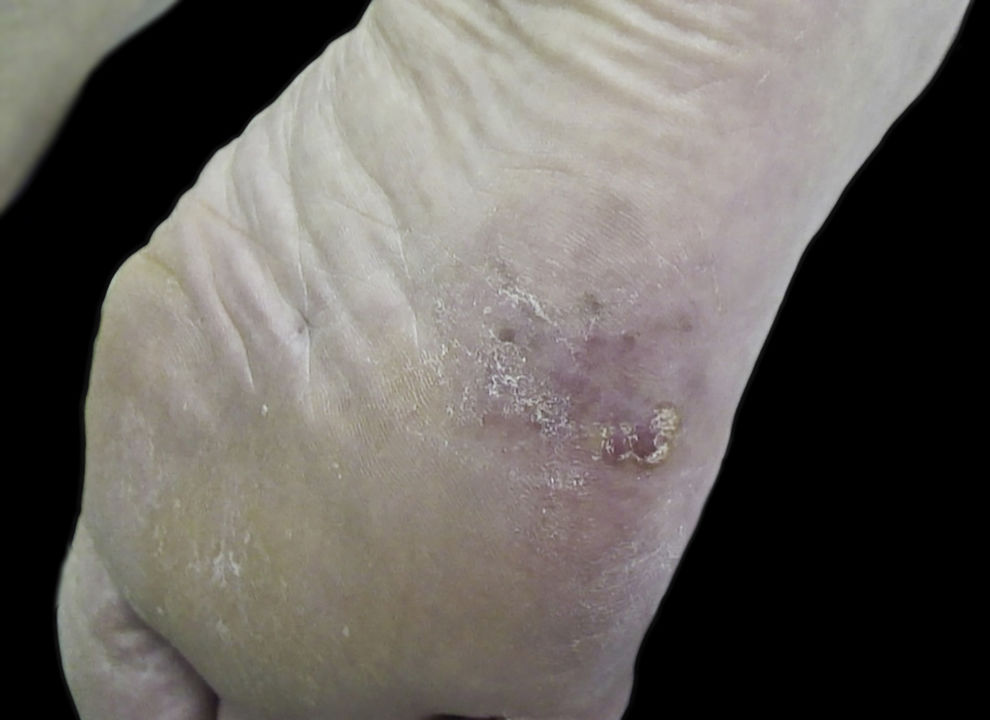
O melanoma acral é raro, cerca de dois terços ocorrem nas regiões plantares, e é mais prevalente em negros e asiáticos. Os dados sobre este subtipo de melanoma são escassos na população brasileira.
ObjetivosDescrever e correlacionar os aspectos epidemiológicos, clínicos, dermatoscópicos e histopatológicos dos melanomas acrais.
MétodosTrabalho unicêntrico, retrospectivo e transversal, avaliando dados de um período de 15 anos.
ResultadosForam incluídos 48 casos. A idade média foi de 62,54 anos com predominância em mulheres (62,5%). A porcentagem de melanomas amelanóticos foi maior entre os leucodérmicos (20%×7,7%). Policromia foi o achado mais prevalente (94,4%). O padrão de cristas paralelas (PCP) teve prevalência de 78% e o padrão serrilhado foi associado a menores índices de Breslow (p=0,041). Ulceração detectada na avaliação histopatológica (p=0,013) ou dermatoscópica (p=0,047) foi associada a maior espessura.
Limitações do estudoEstudo retrospectivo com perda de dados.
Conclusão: Tumores amelanóticos foram mais prevalentes nos fototipos mais baixos (20%×7,7%). Policromia foi o achado mais prevalente (94,4%) e a ulceração observada na avaliação clínica ou histopatológica foi associada a maior espessura de Breslow (p=0,013 e 0,047).
Os melanomas lentiginosos acrais (MLA) foram descritos por Reed et al. em 1976 como um subtipo distinto de melanoma tanto pela localização quanto por critérios histológicos: fase preliminar de crescimento radial de células lentiginosas atípicas, crescimento expansivo na derme papilar ou crescimento vertical na derme reticular, infiltrado inflamatório linfocítico, sinais de regressão e citologia aberrante (células alongadas ou epitelioides).1 Apesar dessa definição, uma grande fonte de controvérsia foi o fato de nem todos os melanomas originados nas regiões acrais apresentarem esses critérios histológicos. Uma porcentagem se apresenta histologicamente como melanoma extensivo superficial (MES) ou melanoma nodular (MN). Diante disso, foi proposta a terminologia melanoma acral (MA) para todo melanoma originado na área de pele glabra, ou seja, aquela que não contém folículos pilosos ‐ palmas, plantas e leito ungueal.2
O MA é entidade rara, com incidência estimada de 0,3/100.000 por ano.3 Representa a maior parte dos melanomas em populações sem fatores de risco clássicos para o tumor ‐ fototipo baixo, número aumentado de nevos melanocíticos, passado de queimaduras solares e história familiar de melanoma ‐ como os negros e os orientais.3,4 Os MA correspondem a cerca de 50% dos melanomas na população asiática. Estima‐se que seja ainda mais prevalente entre os negros.5 Nos caucasianos, o MA tem prevalência relativa menor, 2% a 13%.6 No Brasil, o número de estudos é escasso; a maior casuística publicada encontrou taxa de prevalência de MA de 13,2% (n=3.878) entre os casos totais de melanoma.7 Apesar das diferenças marcantes quando observadas a incidência relativa, o MA tem a característica única dentre todos os outros subtipos de melanoma de apresentar a mesma incidência absoluta em todas as etnias.8 Dentre os MA, os plantares são os mais frequentes em relação aos ungueais e palmares e podem responder por mais de dois terços dos casos.9
A patogênese dos MA permanece controversa.10 A radiação ultravioleta (UV) parece não estar implicada,11 e outros fatores de risco, como fototipo baixo e número aumentado de nevos melanocíticos, também não foram estatisticamente relacionados.12 Nenhum caso familiar de MA foi descrito até o momento.12 A etiologia pode ser multifatorial; o trauma permanece como um dos fatores de risco possíveis.8 Estudos recentes encontraram incidência significantemente maior dos MA nas áreas de apoio das plantas, fortalecendo a hipótese de que o trauma possa estar implicado em sua patogênese.13‐16
O diagnóstico precoce é chave principal para o tratamento e melhora da sobrevida em todos os pacientes com melanoma. A dificuldade em se encontrar fatores de risco consistentes que permitissem o acompanhamento mais rigoroso para subgrupos populacionais, a exemplo do que é feito para os pacientes com múltiplos nevos melanocíticos sob risco de MES, tornou‐se desafio adicional no diagnóstico precoce dos MA.
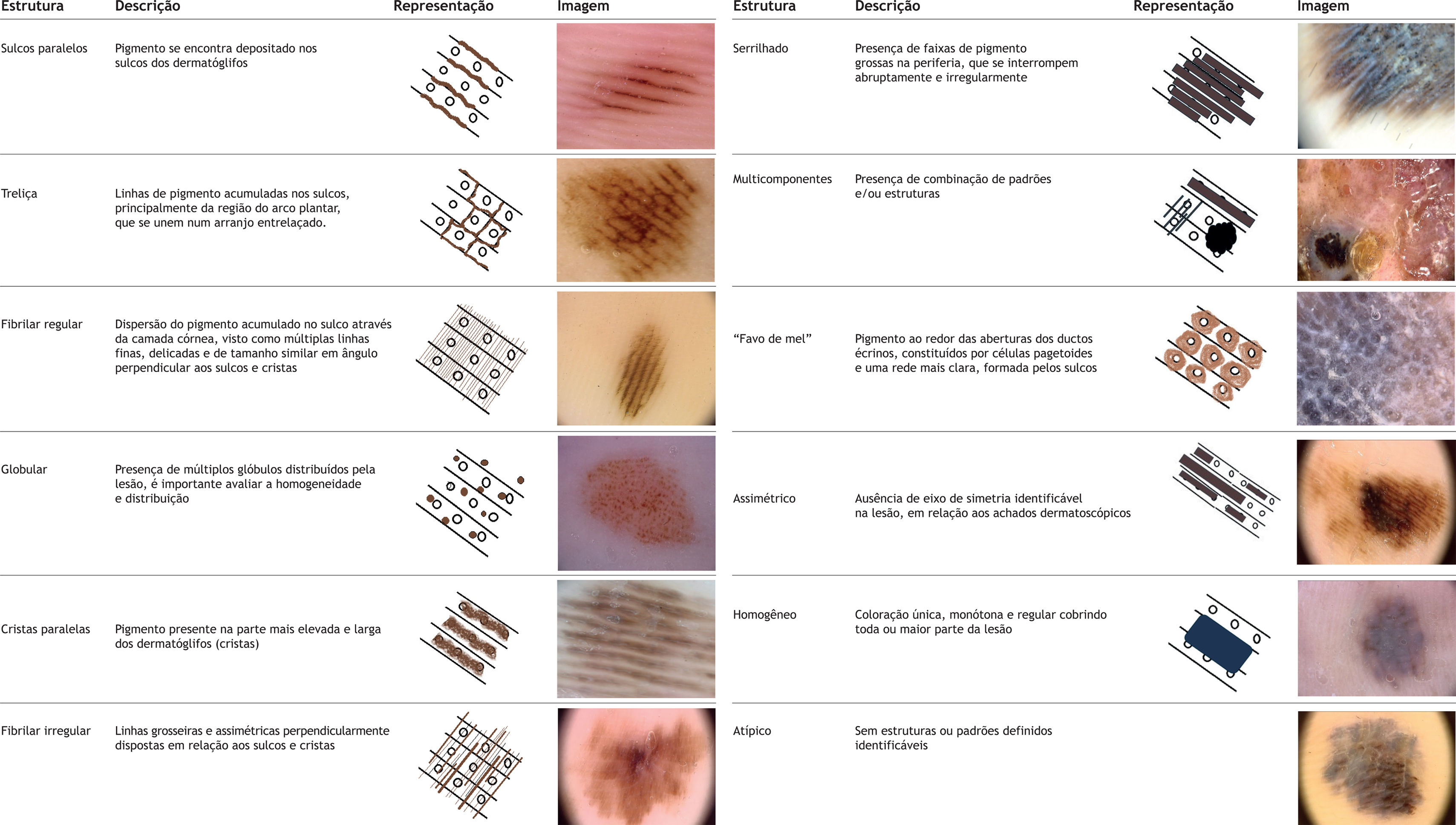
A dermatoscopia trouxe inestimável contribuição para o diagnóstico das lesões pigmentadas, incluindo as acrais.17 A pele volar é marcada por dermatóglifos (impressões digitais), compostas por sulcos e cristas. Ao exame dermatoscópico, foi identificado que os nevos tendem a acumular pigmento ao longo dos sulcos, determinando um padrão denominado sulcos paralelos (PSP), enquanto os melanomas acumulam pigmento na região correspondente às cristas ‐ padrão de cristas paralelas (PCP).17,18
A descrição desses aspectos contribuiu para a distinção precoce do melanoma; entretanto, sua sensibilidade e especificidade ainda permanecem controversas na literatura. Em algumas séries de casos, mais de 80% dos melanomas apresentavam o PCP,18,19 com sensibilidade de 86%, especificidade de 99% e valor preditivo positivo de 93% para o diagnóstico de MA. No entanto, Lallas et al. em duas séries com 118 e 131 pacientes com MA relataram a presença do PCP em 65,3% e 38,2%, respectivamente.20,21 Diante da presença de PCP, é necessário avaliar a exérese da lesão, embora esse padrão possa ser identificado também em algumas lesões benignas, como as manchas melanóticas raciais, as pigmentações acrais por para‐fenilenodiamina e da síndrome de Peutz‐Jeghers, as pigmentações secundárias ao uso de quimioterápicos, o hematoma subcórneo, as verrugas plantares e os nevos congênitos plantares.21‐23
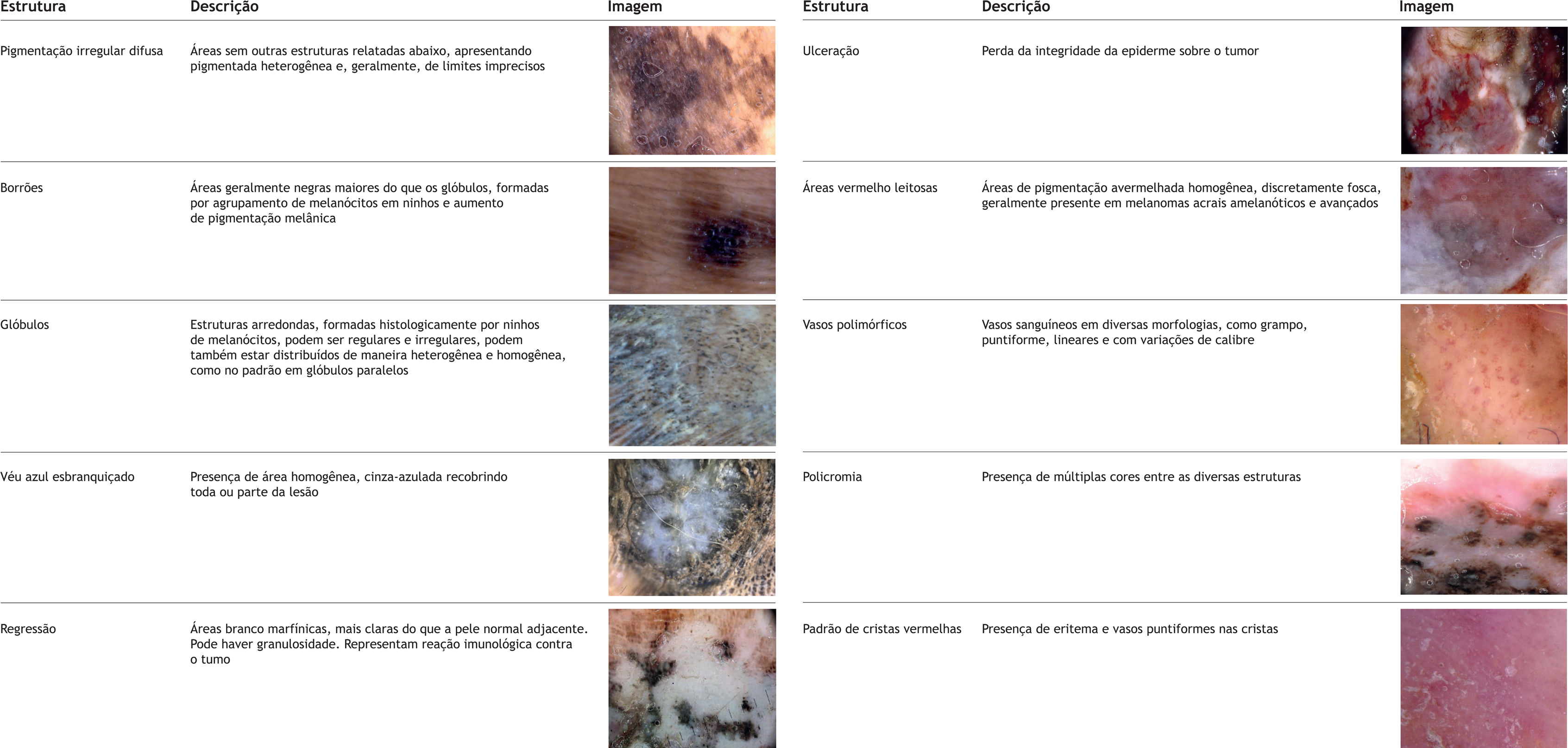
Outros padrões dermatoscópicos associados a benignidade são as variantes do PSP, como fibrilar regular, treliça, escada, dupla‐linha, ervilha, além do padrão globular regular. Outros padrões descritos na literatura como associados a melanomas são o assimétrico, cristas vermelhas, serrilhado, multicomponentes, favo de mel, globular irregular e fibrilar irregular18,21 (fig. 1). Estruturas dermatoscópicas associadas ao MA também foram descritas, como áreas vermelho leitosas, vasos polimórficos, pigmentação irregular difusa, borrões, véu cinza azulado, regressão, ulceração e policromia18,21 (fig. 2).
A histopatologia é o padrão‐ouro no diagnóstico dos melanomas. Apesar disso, nem sempre o diagnóstico histopatológico das lesões pigmentadas é fácil, pois os nevos melanocíticos e os melanomas iniciais podem compartilhar características, especialmente em sítios anatômicos como o acral.22 Os critérios clássicos podem não ser suficientes para definição diagnóstica de lesões que, clínica e dermatoscopicamente, são sugestivas de MA.24 A presença de proliferação melanocítica na crista profunda intermedia, que corresponde anatomicamente à crista dos dermatóglifos, é um critério histológico proposto para auxiliar o diagnóstico precoce.25
Em bases genéticas, os MA são amplamente distintos dos demais melanomas cutâneos. Genomicamente, uma proporção significante ‐ 38% a 55% ‐ será do tipo selvagem (wild type) para as três mutações mais frequentemente associadas a melanomas: BRAF, NRAS e NF1. Uma das primeiras diferenças identificadas nos MA em relação aos melanomas não acrais foi a prevalência aumentada das mutações de KIT: mutado entre 10% e 40% dos MA em algumas séries e em menos de 10% nos não acrais.8,10,24
O tratamento de escolha para o sítio primário é a cirurgia. Os grandes estudos para determinação das margens cirúrgicas de segurança excluíram os MA dos protocolos de pesquisa.26 A alta taxa de recorrência descrita em algumas séries levanta questionamentos sobre as margens preconizadas atualmente.26
Os desafios no diagnóstico e tratamento dos MA, especialmente plantares, refletem‐se no pior prognóstico quando comparado aos outros subtipos de melanoma.9 Embora o MA seja o responsável por mais da metade dos casos de melanoma nos negros, praticamente toda pesquisa científica disponível sobre o tema foi realizada em populações predominantemente caucasianas ou asiáticas. É preciso ressaltar que ainda são parcos e escassos os estudos em populações como a nossa, com característica de ampla miscigenação racial, quanto aos aspectos epidemiológicos, dermatoscópicos, clínicos e histopatológicos do MA. Além disso, fatores culturais, nível educacional formal e educação em saúde são outras variáveis com características muito particulares da nossa população e que podem influenciar na evolução da doença.
MétodosForam coletados retrospectivamente dados de pacientes com MA plantares. Trata‐se de estudo observacional analítico transversal, realizado no Ambulatório de Dermatologia da Universidade Federal de Minas Gerais, com dados coletados a partir de 2005.
Os critérios de inclusão foram: pacientes com diagnóstico histopatológico comprovado de MA plantar com documentação fotográfica clínica ou dermatoscópica em um período de 15 anos.
Para cada paciente foram registradas informações referentes aos aspectos epidemiológicos (idade ao diagnóstico, sexo, profissão, características fenotípicas, história pessoal e familiar de melanoma), clínicos (tamanho, localização, subunidade anatômica, delimitação), dermatoscópicos (padrões, estruturas e cores) e histopatológicos (subtipo histológico, índice de Breslow, presença de ulceração, índice mitótico). Cada melanoma foi assinalado em uma figura representando a superfície plantar, para posterior análise de quais as subunidades anatômicas foram mais acometidas.
A avaliação das imagens clínicas e dermatoscópicas foi realizada por três examinadores distintos. As fotografias foram realizadas por equipamento FotoFinder ou por câmeras fotográficas digitais Canon Power Shot 3,2® ou Nikon 1® com auxílio do dermatoscópio Dermlite DL3 e DL4.
Quanto aos aspectos clínicos, os tumores foram classificados segundo a delimitação, os limites precisos e imprecisos e o tamanho. Nas lesões que ocupavam mais de uma subunidade anatômica, foram considerados os limites que estão dentro da subunidade anatômica onde está localizada a maior área do tumor (fig. 3).
Histologicamente, os MA foram divididos pelos subtipos MLA, MES e MN. Os tumores in situ foram incluídos no trabalho e as lesões invasoras foram categorizadas em finas ‐ Índice de Breslow <1,0mm ‐ e espessas, Índice de Breslow ≥ 1,0mm. Os dados foram obtidos por meio dos laudos histopatológicos disponíveis no prontuário.
Foram realizadas análises de associações entres as características epidemiológicas, clínicas, dermatoscópicas e histopatológicas. Para as variáveis numéricas encontradas na amostra estudada, foram calculados os principais índices de estatística descritiva (média, mediana, desvio‐padrão, coeficiente de variação e quartis). Foi testada a normalidade de cada variável na sua unidade original. Para as variáveis categóricas, foram calculadas as frequências relativas e absolutas para cada classe.
As plantas foram divididas em cinco subunidades anatômicas: calcâneo, arco, meio do pé, antepé e bordas. As bordas e o arco plantar foram consideradas áreas menos expostas ao trauma crônico, enquanto as demais, como áreas expostas ao trauma crônico. Para avaliar as diferenças na ocorrência de melanoma de qualquer tipo entre as subunidades anatômicas e entre áreas de apoio, aplicou‐se o teste Qui‐Quadrado de aderência, avaliando se as proporções em cada classe eram significantemente diferentes de uma distribuição ao acaso (sem padrão).
A associação entre duas variáveis qualitativas foi verificada por meio do teste Qui‐Quadrado de independência, ou teste exato de Fisher para baixas frequências esperadas (> 5). Para avaliar a associação entre uma variável qualitativa e uma variável quantitativa foi aplicado o teste não paramétrico de Mann‐Whitney. A prevalência média do PCP foi estimada a partir da proporção entre o número de cristas paralelas observadas divididas pelo número total de lesões avaliadas. O intervalo de confiança foi construído segundo metodologia de Clopper e Pearson (1934). Todas as análises estatísticas foram realizadas pelo software R versão 3.6.1 (R Core Team, 2019). O estudo foi aprovado pelo Comitê de Ética em Pesquisa da UFMG (parecer: 4.173.035).
ResultadosForam identificados 71 casos de MA diagnosticados no período de 15 anos. Desses, 23 foram excluídos da análise estatística por dados insuficientes (prontuários sinistrados). Dos 48 casos restantes, 36 apresentavam imagem dermatoscópica. Os outros 12 casos foram admitidos após exérese da lesão primária e foram incluídos apenas nas análises quanto aos aspectos epidemiológicos, clínicos (localização) e histopatológicos.
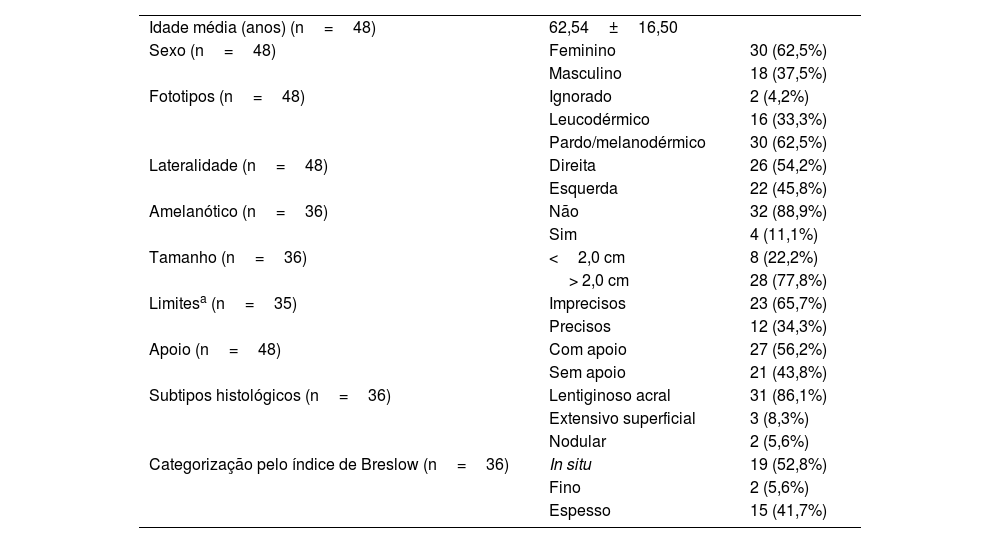
A análise dos dados demográficos mostrou que a idade média da amostra foi de 62,54 anos, a mediana de 64 anos e o desvio padrão de 16,5. Pelo teste de Shapiro‐Wilk não foi possível rejeitar a normalidade da distribuição etária. Houve predominância do sexo feminino (62,5%; n=30) em relação aos pacientes do sexo masculino (37,5%; n=18). Como características fenotípicas, a maior parte da amostra foi composta por indivíduos pardos e negros (62,5%; n=30). Em dois pacientes não havia essa informação e não houve nenhum paciente com descendência oriental. Apenas um dos participantes apresentava história prévia de melanoma, de localização vulvar. A maioria dos tumores tinha mais de 2,0cm de diâmetro (77,8%; n=26). Houve discreta predominância de tumores na planta direita (54,2%; n=28), sem relevância estatística (tabela 1).
Aspectos epidemiológicas, clínicos e histopatológicos dos pacientes com melanoma acral
| Idade média (anos) (n=48) | 62,54±16,50 | |
| Sexo (n=48) | Feminino | 30 (62,5%) |
| Masculino | 18 (37,5%) | |
| Fototipos (n=48) | Ignorado | 2 (4,2%) |
| Leucodérmico | 16 (33,3%) | |
| Pardo/melanodérmico | 30 (62,5%) | |
| Lateralidade (n=48) | Direita | 26 (54,2%) |
| Esquerda | 22 (45,8%) | |
| Amelanótico (n=36) | Não | 32 (88,9%) |
| Sim | 4 (11,1%) | |
| Tamanho (n=36) | <2,0 cm | 8 (22,2%) |
| > 2,0 cm | 28 (77,8%) | |
| Limitesa (n=35) | Imprecisos | 23 (65,7%) |
| Precisos | 12 (34,3%) | |
| Apoio (n=48) | Com apoio | 27 (56,2%) |
| Sem apoio | 21 (43,8%) | |
| Subtipos histológicos (n=36) | Lentiginoso acral | 31 (86,1%) |
| Extensivo superficial | 3 (8,3%) | |
| Nodular | 2 (5,6%) | |
| Categorização pelo índice de Breslow (n=36) | In situ | 19 (52,8%) |
| Fino | 2 (5,6%) | |
| Espesso | 15 (41,7%) | |
* Um dos tumores não pode ter a delimitação classificada (n=35).
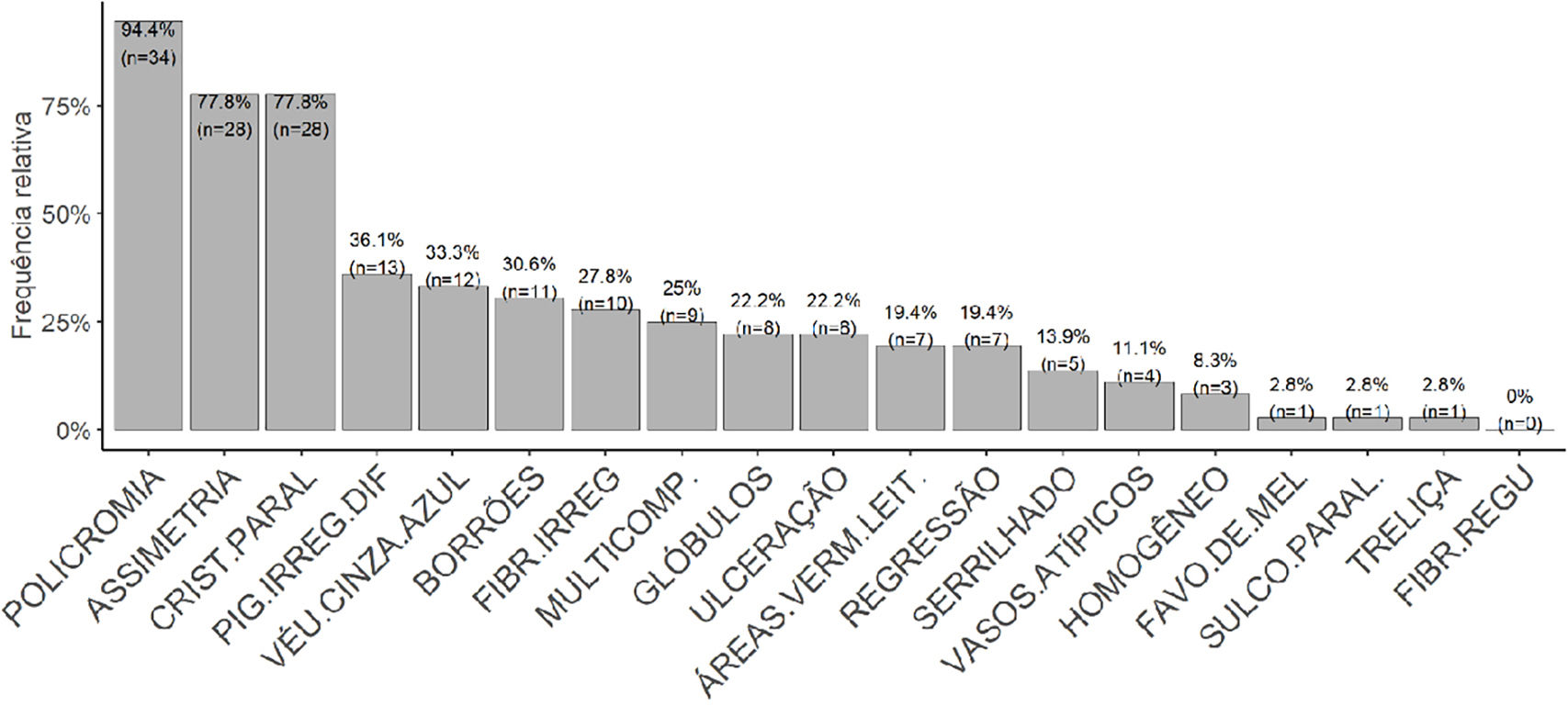
A análise dos dados dermatoscópicos encontrou a policromia como o achado mais prevalente (94,4%). O PCP teve uma prevalência de 78% com intervalo de 95% de confiança entre 61% e 90%. A assimetria foi tão prevalente quanto o PCP. Padrões classicamente relacionados à benignidade, como PSP (n=1; 2,8%), treliça (n=1; 2,8%) e fibrilar (n=0), foram os menos prevalentes. O padrão serrilhado foi encontrado em cinco tumores (13,9% da amostra). Outros padrões e estruturas classicamente relacionadas a melanoma tiveram prevalência intermediária, como pigmentação irregular difusa (PID) 36,1% (n=13), véu cinza azulado 33,3% (n=12), fibrilar irregular 27,8% (n=10), multicomponentes 25% (n=9) e ulceração 22,2% (n=8) ‐ figura 4.
O subtipo histológico mais prevalente foi o MLA (86,1%; n=31), seguido pelo MES (8,3%; n=3) e MN (5,6%; n=2). A maior parte (52,8%; n=19) foi de lesões in situ, eguido pelas lesões espessas (41,7%; n=15) e finas (5,6%; n=2) ‐ tabela 1. O índice de Breslow médio encontrado para as lesões invasoras foi de 3,84± 3,11 e a mediana de 2,9. A ulceração histopatológica foi detectada em 12,1% dos casos. Mitoses foram observadas em 24,2% dos tumores, enquanto o índice mitótico médio nos casos positivos foi de 8,3 e no geral foi de 1,63.
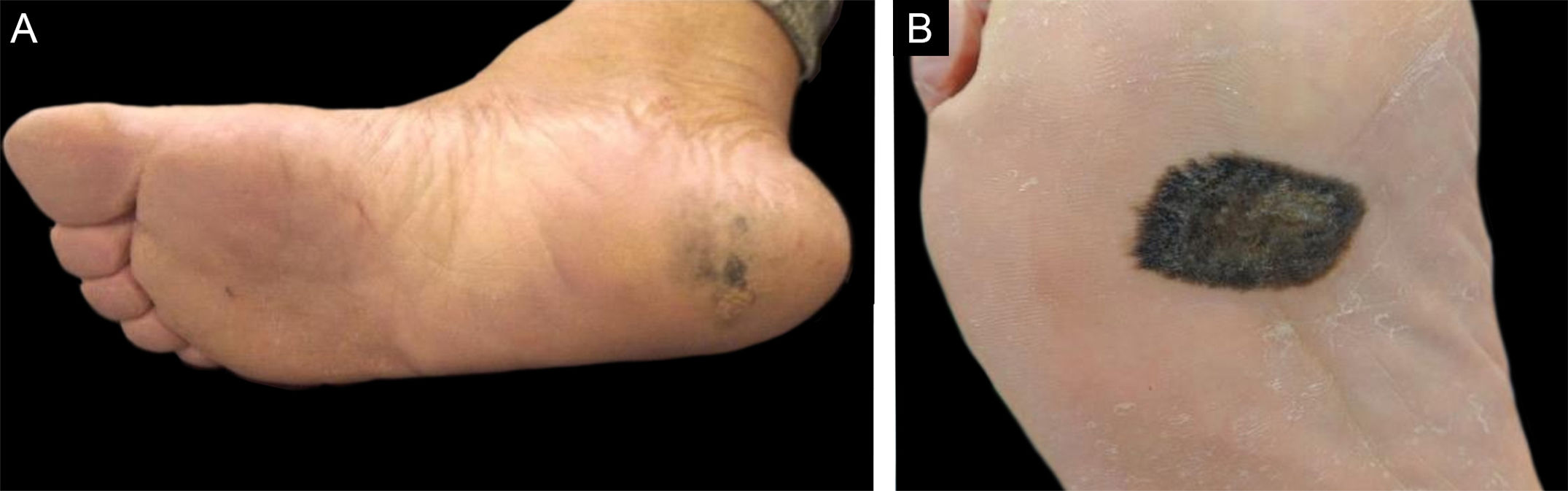
Apesar de não ter alcançado relevância estatística (p=0,305), a porcentagem de melanomas amelanóticos (fig. 5) foi maior entre os pacientes leucodérmicos em relação aos de fototipo mais alto (20%×7,7%). Não foram observadas diferenças significantes na frequência de ocorrência de tumores em áreas com 56,2% (n=27) ou sem apoio 43,8% (n=21) ‐ tabela 1). Em relação às localizações anatômicas, houve diferença marginalmente significante (p=0,076), com tendência a maior concentração no calcâneo.
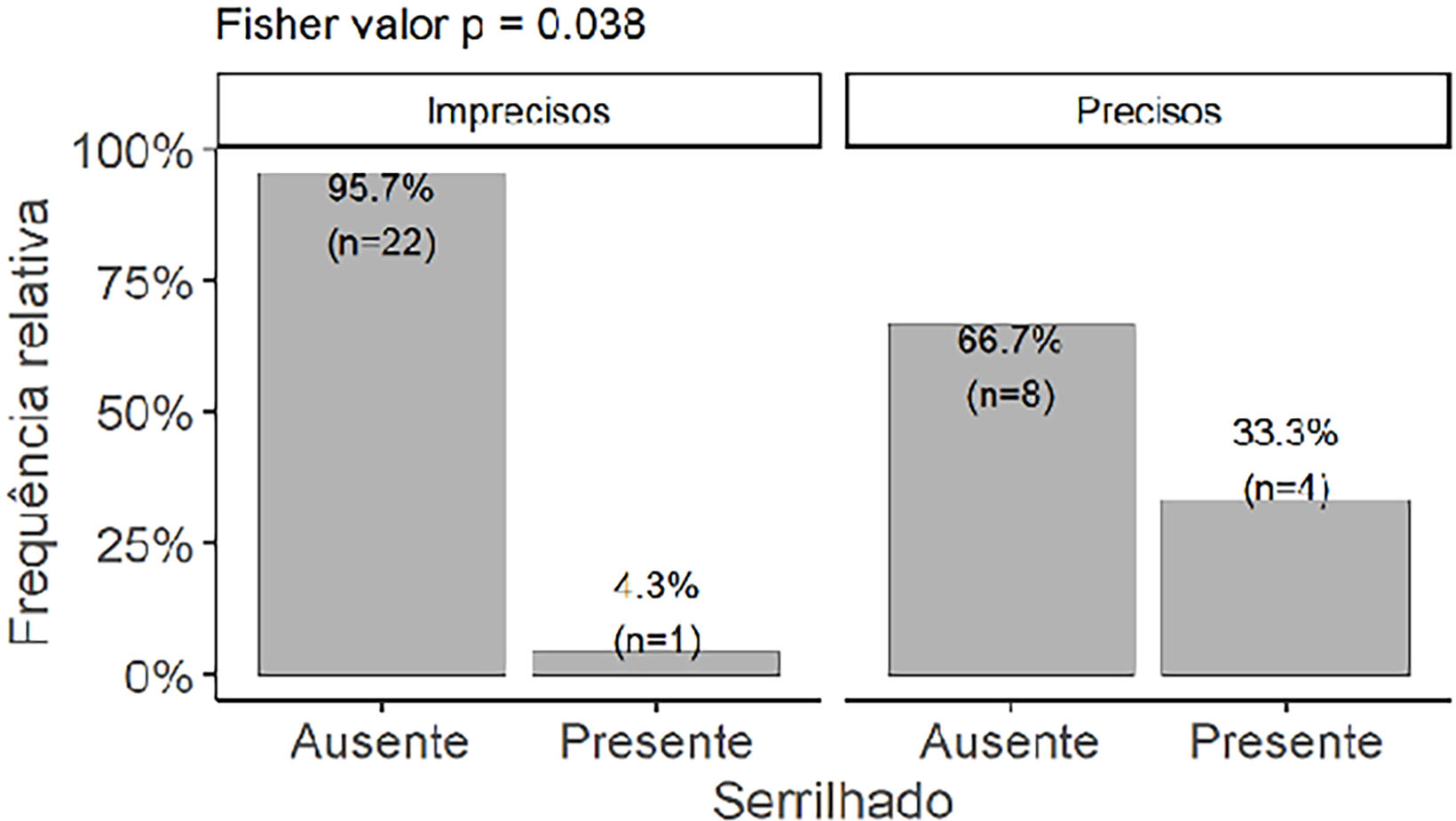
O tipo serrilhado foi associado a menores valores do índice de Breslow (p=0,041) e estava presente com frequência maior nos tumores com limites precisos (fig. 6). A presença de ulceração, seja histopatológica (p=0,013) ou dermatoscópica (p=0,047), foi associada a maiores valores do índice de Breslow. Não houve diferença estatística entre o índice de Breslow e cor da pele (p=0.82) ou sexo dos participantes (p=0,247).
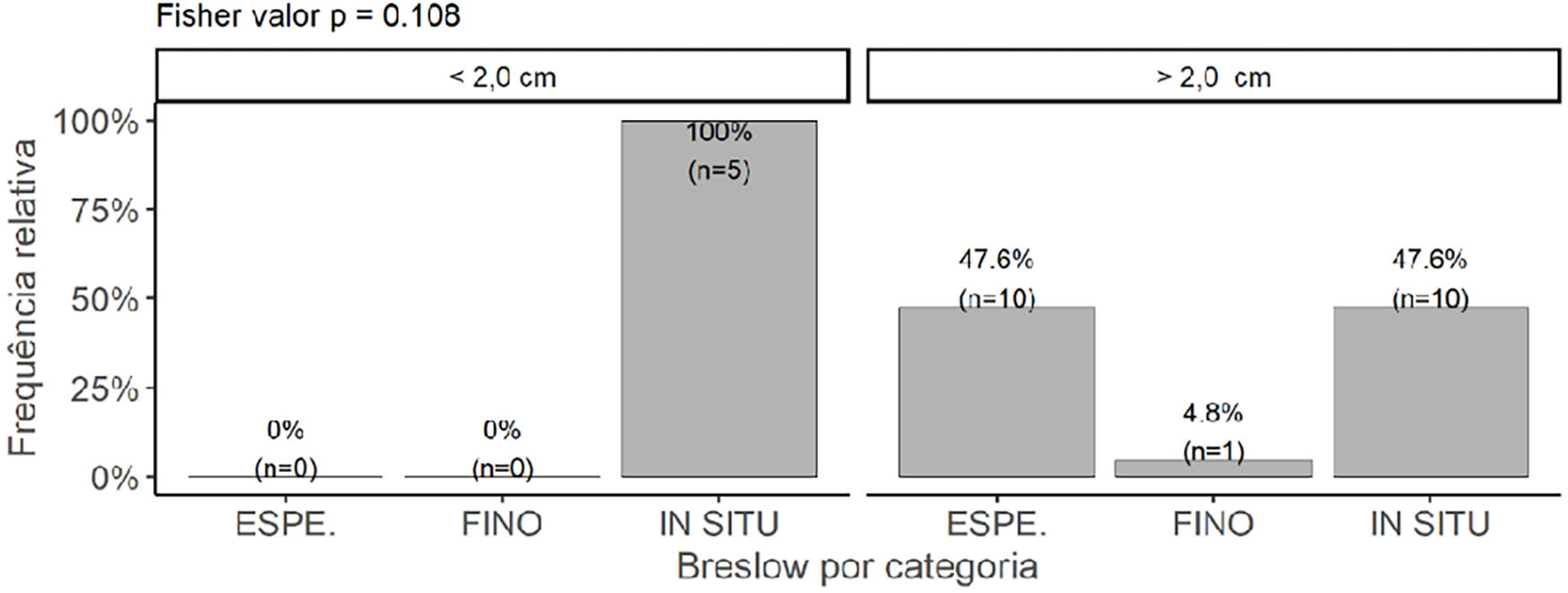
Apesar de não ter alcançado diferença estatisticamente significante, os tumores <2,0cm (n=5) apresentaram tendência a menores valores de Breslow (p=0,108). Por outro lado, uma porcentagem significante dos tumores> 2,0cm (47,6%; n=10) ainda foram diagnosticados como in situ (fig. 7). A maioria dos tumores> 2,0cm (85,7%) apresentavam o PCP, enquanto apenas 50% dos tumores <2,0cm exibiram esse achado. Não houve associação entre a presença do PCP e o estadiamento pelo índice de Breslow (p=0,678).
DiscussãoOs dados epidemiológicos encontrados na presente amostra se aproximam dos descritos por diversos grupos. A idade média dos participantes foi de 62,54 (DP±16,5), bem próxima à média de 62,9 encontrada na literatura mundial. Quando comparamos especificamente com a média da idade nos trabalhos publicados no Brasil, encontramos o número de 63,6 anos, muito próximo ao identificado no presente estudo. A discreta predominância de pacientes do sexo feminino já foi descrita na literatura, com média de 54,8% nos principais trabalhos.7,11,20 Nessa amostra, também observamos essa predominância: 62,5% (n=30), em relação aos pacientes do sexo masculino; 37,5% (n=18). A diferença não foi significante, embora já tenha havido relato de discrepância expressiva entre os sexos.27
A maior parte dos participantes (62,5%; n=30) apresentava fototipos mais altos. Nenhum paciente de descendência asiática foi identificado na presente amostra; a presença de pacientes dessa etnia na região do estudo é esparsa e pode ser o motivo para tal resultado. Um dos participantes apresentava história pregressa de melanoma em outro sítio (vulvar); associação é extremamente rara. A exemplo do que é classicamente documentado para o MA, a maioria dos participantes não apresentava história familiar de melanoma, entretanto, a filha de uma das participantes apresentou um MA ungueal no polegar. A história familiar positiva também é raríssima para o MA.
Clinicamente, a maior parte dos tumores (77,8%; n=28) apresentavam mais de 2,0cm de diâmetro. Esse dado reforça o desafio de realizar o diagnóstico precoce no MA e possibilitar melhor prognóstico. Apesar de a dermatoscopia ser ferramenta muito útil para o diagnóstico diferencial das lesões pigmentadas acrais, pacientes com lesões> 2,0cm limitam parcialmente sua utilidade, pois essas dificilmente terão outro diagnóstico que não seja MA. Outros grupos de autores já identificaram que a introdução da dermatoscopia não impactou diretamente na sobrevida dos pacientes estudados,28 provavelmente pelo mesmo motivo: a admissão majoritária de casos clinicamente avançados.
O papel do trauma crônico na patogênese do MA ainda permanece controverso. No presente estudo, os MA foram mais prevalentes nas áreas de apoio, mais expostas ao trauma crônico em relação às demais. Entretanto, a diferença (apoio 56,2%; n=27×sem apoio 43,2%; n=21) não foi significante, assim como a encontrada por Costello et al.29 Outra série recente, no entanto, encontrou associação entre áreas de estresse mecânico crônico e incidência de MA.30 Ao se avaliar a frequência dos tumores nas subunidades anatômicas, houve diferença marginalmente significante (p=0,076), com tendência a maior concentração de tumores no calcâneo.
No presente estudo, os tumores amelanóticos corresponderam a 11% do total, inferior ao descrito na literatura, que é de 24% a cerca de um terço dos casos.31 A porcentagem de melanomas amelanóticos foi superior nos fototipos mais baixos (20%; n=2). No entanto, provavelmente em virtude do tamanho da amostra, a diferença não foi estatisticamente significante (p=0,305). A hipótese que pacientes com fototipos mais baixos têm maior probabilidade de apresentar tumores amelanóticos ou hipomelanóticos acrais deve ser investigada em estudos posteriores, uma vez que essa relação está bem estabelecida na literatura para os outros subtipos de melanoma.32
O PCP teve prevalência de 77,8% (95% IC 61% e 90%) e esse dado se aproxima dos descritos nas séries de casos da Coreia do Sul publicados por Mun et al. (85.3%)19 e do Japão por Saida et al. (86%),18 mas é superior à descrita por Lallas et al. (38,2%).21 Apesar de a maioria dos trabalhos apontar esse achado como o mais específico para o diagnóstico de MA, uma prevalência tão baixa quanto a descrita por esse último grupo poderia impactar o valor preditivo negativo do teste. Não houve associação entre a presença do PCP e o estadiamento pelo índice de Breslow (p=0,678). Por outro lado, o PCP foi observado de modo mais frequente nas lesões> 2,0cm. Esse dado é, de certa maneira, conflitante com os encontrados por Saida et al, que associaram o PCP às lesões mais iniciais.22 Mas outros trabalhos já mostraram maior prevalência do PCP nas lesões maiores.33 Nessa amostra, o aumento da área do tumor aumentou a chance de encontrar, mesmo que focalmente, o PCP.
A policromia foi o achado dermatoscópico mais prevalente (94,4%; n=34), seguida pela assimetria e PCP (ambos presentes em 77,8%; n=28 das lesões). Vale ressaltar que policromia e assimetria à avaliação clínica são critérios clássicos e consagrados para o diagnóstico de melanoma. A policromia já foi identificada como achado altamente prevalente, tanto no MA34 quanto em outros subtipos de melanomas, como no MES (81%)35 e no MA ungueal (72,7%).36 Outra série já havia reportado a alta prevalência (88%) de lesões assimétricas.37 A PID foi encontrada em 36,1% (n=13) dos tumores e não foi associada a tumores com maiores índices de Breslow. Esse dado diverge dos descritos por Saida, et al., que encontraram prevalência de 90% e associação dos achados com tumores mais avançados.18 Entretanto, outras séries como as de Braun et al. e Ozdemir et al. já haviam reportado prevalências mais baixas de PID, 20,5% e 28,3%, respectivamente.4,36
Curiosamente, o padrão serrilhado foi associado a menores índices de Breslow. Não identificamos outra descrição dessa associação até o momento, e mais estudos precisam ser realizados para confirmá‐la. O mesmo padrão serrilhado foi ainda associado de maneira significante às lesões bem delimitadas, talvez por ocorrer na periferia da lesão, onde os limites precisam ser bem definidos para que ele possa ser identificado. Outras análises quanto à distribuição dos achados dermatoscópicos em relação à delimitação e tamanho do tumor, índice de Breslow, subunidade anatômica e ocorrências em áreas com e sem apoio não foram significantes. Vale a pena ressaltar que existem alguns trabalhos, todos internacionais, que estudam as associações entre dermatoscopia e histologia ou clínica, como os de Saida et al, Braun et al e Lallas et al.4,20‐22,24,38
A presença de ulceração, identificada pela histopatologia (p=0,013) ou dermatoscopia (p=0,047), foi associada à maiores índices de Breslow. Essa correlação encontra amplo respaldo nas séries previamente publicadas, nas quais a presença de ulceração aparece como preditor de lesão avançada e, consequentemente, de prognóstico reservado.11 A porcentagem de tumores ulcerados (22%; n=8) foi inferior à média dos principais trabalhos disponíveis na literatura (51,73%), dentre os quais o valor mais baixo reportado havia sido 33,3%.28
O percentual de tumores classificados como MLA (86,1%; n=31) foi superior ao da média dos principais trabalhos disponíveis na literatura (64,46%) e à média dos estudos nacionais publicados previamente (36,03%). Vale ressaltar que alguns desses trabalhos3,39 incluíram melanomas das porções dorsais das mãos e pés, o que poderia contribuir para essa discrepância. Outro grupo encontrou prevalência de MLA (85,9%) próxima à encontrada nessa amostra.40
Quanto à espessura do tumor, houve tendência à dicotomização entre lesões in situ (52,8%; n=19) e espessas (41,7%; n=15). O índice de Breslow médio das lesões invasoras foi de 3,84±3,11), bem próximo ao encontrado para a média dos principais trabalhos publicados na literatura (4,08mm) e discretamente inferior à média dos estudos nacionais publicados previamente (4,57mm). Como o índice de Breslow é o preditor prognóstico isolado mais importante, esse dado nos permite supor que não houve atraso diagnóstico significante em relação aos demais centros de pesquisa. Entretanto, o alto número de lesões in situ (52,8%; n=19), mesmo com alta prevalência de tumores> 2,0cm (77,8%; n=28), pode indicar que o MA tenha uma fase de crescimento radial relativamente longa, a exemplo do que ocorre com o lentigo maligno melanoma, e que o pior prognóstico esteja associado primordialmente ao atraso diagnóstico. Esse atraso é agravado por se tratar de lesão muitas vezes assintomática e cuja existência é praticamente desconhecida pela população geral e mesmo entre profissionais de saúde. Alguns grupos já relataram que ao se ajustar o estágio/profundidade dos tumores, não há diferença de sobrevida ‐ portanto, não haveria comportamento biológico mais agressivo, apenas atraso diagnóstico maior nos MA.6
A identificação de fatores de risco, disseminação da informação e educação sobre MA são importantes para o diagnóstico em estágios clínicos mais precoces, como priorização dessas informações nas campanhas de prevenção voltadas para a população e reforço na educação de médicos, residentes e acadêmicos com relação à importância de realizar o exame físico das plantas dos pés, preferencialmente com treinamento dermatoscópico para auxiliar na distinção dos nevos melanocíticos que são largamente prevalentes.
O presente estudo é um trabalho unicêntrico e tem diversas limitações, principalmente decorrentes do desenho retrospectivo. Dentre eles, podemos destacar os dados perdidos e qualidade de alguns registros fotográficos. A amostra foi pequena e de conveniência, e pode não representar uma população com ampla miscigenação como a nossa. Por esses motivos, são necessários mais estudos para corroborar os dados levantados no presente trabalho.
ConclusõesOs MA plantares da presente amostra apresentaram dados epidemiológicos compatíveis com os descritos na literatura, como idade média de acometimento na sexta década de vida, com discreto predomínio no sexo feminino. Os pacientes com fototipo mais alto, pardos e negros, foram mais acometidos, uma particularidade esperada pelo perfil da população brasileira.
Clinicamente, os tumores predominaram nas áreas de trauma crônico, porém a diferença não foi significante. Houve tendência marginalmente significante de concentração das lesões no calcâneo. Houve predominância de tumores grandes, com mais de 2,0cm de diâmetro.
O PCP teve prevalência de 77,8% (95% IC 61% e 90%), aproximando‐se dos valores descritos nas séries asiáticas. Entretanto, a policromia foi o achado dermatoscópico mais prevalente. Outras análises de achados dermatoscópicos não alcançaram diferença estatística, como prevalência nas subunidades, áreas de apoio, tamanho e delimitação. O padrão serrilhado teve sua presença associada à boa delimitação.
Houve dicotomização entre tumores in situ e espessos. O subtipo histopatológico mais frequente foi o MLA, com frequência acima da média dos trabalhos anteriores. Não houve atraso diagnóstico significante em relação ao índice de Breslow médio, que foi comparável ao de outros trabalhos. A ulceração histopatológica e dermatoscópica foi associada a valores de Breslow mais altos. Por outro lado, o padrão serrilhado se associou a menores valores de Breslow. O presente estudo contribui com novas informações sobre o MA plantar em nossa população e enriquece a escassa literatura, não só brasileira, mas latino‐americana sobre o tema.
Suporte financeiroNenhum.
Contribuição dos autoresLucas Campos Garcia: Redação do artigo, revisão crítica do conteúdo intelectual importante e aprovação final da versão final do manuscrito.
João Renato Vianna Gontijo: Redação do artigo, revisão crítica do conteúdo intelectual importante e aprovação final da versão final do manuscrito.
Flávia Vasques Bittencourt: Redação do artigo, revisão crítica do conteúdo intelectual importante e aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Garcia LC, Gontijo JRV, Bittencourt FV. Plantar acral melanoma: epidemiological, clinical, dermoscopic and histopathological profile. Case series from Brazil. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.03.006
Trabalho realizado no Serviço de Dermatologia do Hospital das Clínicas da Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.