As terapias biológicas, inclusive agentes anti‐TNF, são importantes no tratamento de várias doenças inflamatórias crônicas, inclusive psoríase, artrite reumatoide ou doença inflamatória intestinal. O aumento do uso desses medicamentos se traduz em conscientização crescente de seus efeitos adversos, que incluem malignidade. Neste artigo, descrevemos o caso de uma mulher de 28 anos que desenvolveu um tumor melanocítico spitzoide após iniciar o tratamento com infliximab para colite ulcerativa. A evidência de causalidade entre anti‐TNF e proliferação melanocítica ainda é escassa; entretanto, a imunossupressão associada ao tratamento parece desempenhar papel fundamental nesse fenômeno. Portanto, acompanhamento regular com rigoroso exame cutâneo é essencial nesses pacientes. Técnicas não invasivas, como dermatoscopia ou microscopia confocal de refletância, são ferramentas diagnósticas particularmente úteis nessas circunstâncias.
O fator de necrose tumoral alfa (TNF‐α) é citocina do sistema imunológico inato, com funções importantes na regulação da inflamação sistêmica e na detecção de neoplasias malignas e infecções.1,2 Portanto, sua inibição pode melhorar vários quadros inflamatórios dermatológicos, reumatológicos e gastrintestinais, destacar a importância desses agentes no tratamento de muitas doenças inflamatórias crônicas.2
Com o aumento do uso desses medicamentos, efeitos adversos têm sido cada vez mais relatados, entre os quais o aumento do risco de infecção e doenças malignas. Dados de longo prazo sobre o uso de agentes anti‐TNF e o risco de desenvolvimento de neoplasias são escassos; no entanto, recentemente foram publicados vários relatos de casos que associam terapias anti‐TNF ao melanoma.1,2
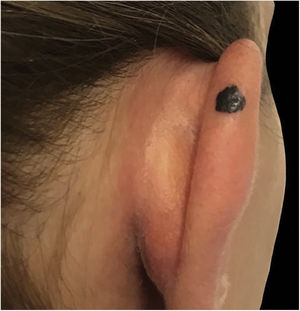
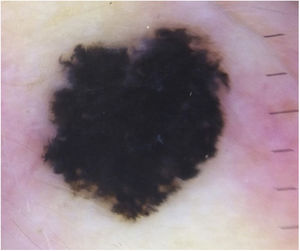
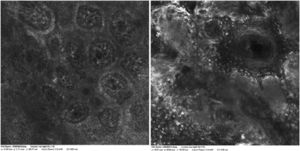
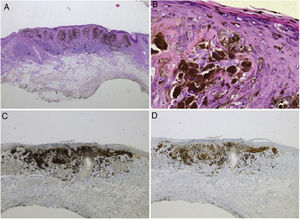
Relato do casoPaciente do sexo feminino, de 28 anos, fototipo 2 de Fitzpatrick, com três anos de história de colite ulcerativa, foi encaminhada ao departamento de dermatologia devido a uma lesão pigmentada na orelha direita. Era tratada com infliximabe nos últimos 30 meses. A lesão apareceu seis meses antes e cresceu progressivamente. O exame físico evidenciou uma mácula marrom escura na hélice, com bordas regulares e diâmetro de 6mm (fig. 1). Não foram observadas linfadenopatias palpáveis. A dermatoscopia revelou lesão melanocítica, com padrão global em “explosão de estrelas”, sugestiva de tumor melanocítico spitzoide (fig. 2). O exame com microscopia confocal de reflectância (MCR) mostrou lesão bem demarcada, com ninhos juncionais e infiltração pagetoide (fig. 3). A lesão foi excisada cirurgicamente e o exame histológico confirmou um nevo de Spitz composto (fig. 4). Foi tomada a decisão de manter o tratamento com infliximabe. As medidas de proteção solar foram enfatizadas e a paciente permanece sob seguimento clínico próximo.
(A), lesão melanocítica simétrica, composta por grandes melanócitos epitelioides e fusiformes, com muitos melanófagos; acantose e hiperplasia irregular da epiderme (Hematoxilina & eosina, 25×). (B), corpúsculos de Kamino (Hematoxilina & eosina, 100×). (C), imuno‐histoquímica positiva para HMB45 (40×). (D), imuno‐histoquímica positiva para p16 (40×).
O TNF‐α é citocina do sistema imunológico inato com função essencial no controle de doenças malignas e infecções.3 Os antagonistas do TNF‐α são um grupo de agentes biológicos que incluem infliximabe, etanercepte e adalimumabe; atualmente, são indicados no tratamento de diversas doenças inflamatórias, inclusive psoríase e doença inflamatória intestinal.3
Os efeitos adversos mais comuns desse grupo de agentes biológicos são geralmente leves. No entanto, a literatura relata complicações graves, como infecções ou neoplasias.3,4 Nas últimas duas décadas, vários relatos de casos indicaram aumento geral do risco de neoplasia maligna (especificamente, linfoma e câncer de pele não melanoma [CPNM]) em pacientes tratados com esses agentes.5 O CPNM, em particular, parece estar associado à imunossupressão crônica, responsável por até 95% das neoplasias cutâneas pós‐transplante.5 Mais recentemente, a associação entre esses antagonistas anti‐TNF e o surgimento de melanoma também foi descrita.2,5,6
O impacto potencial dos antagonistas do TNF no desenvolvimento do câncer de pele ocorre de duas maneiras. Em primeiro lugar, esses medicamentos podem afetar o surgimento do tumor, alterar a incidência de neoplasias malignas; em segundo lugar, eles podem reduzir o controle imunológico de células mutadas ou de tumores subclínicos preexistentes, permitir um rápido crescimento tumoral.6
A evidência de causalidade entre o uso de agentes anti‐TNF e o desenvolvimento de proliferações melanocíticas ainda é escassa e o possível vínculo entre o tratamento biológico e a indução da proliferação melanocítica precisa ser mais profundamente estudado.4 A proliferação melanocítica pode ser benigna, como nos nevos melanocíticos eruptivos, ou maligna, como no melanoma. Nevos eruptivos são um fenômeno raro que consiste no aparecimento abrupto de múltiplos nevos ou grandes lesões atípicas simulando melanoma. Sua ocorrência tem sido associada não apenas a doenças dermatológicas, mas também a imunossupressão.7
Acredita‐se que a imunossupressão possa induzir o hormônio estimulador de melanócitos ou a atividade estimuladora de crescimento de melanoma, dois fatores endógenos de crescimento para melanócitos.4 Portanto, o crescimento e o desenvolvimento de melanócitos são estimulados nessas circunstâncias. Fatores genéticos também podem estar envolvidos. O papel da imunovigilância na carcinogênese é, portanto, essencial; falhas na imunovigilância podem levar ao aparecimento de lesões malignas ou à transformação maligna de lesões benignas.4
Foi relatado o surgimento de nevo de Spitz em pacientes tratados com anti‐TNF. Sousa relatou o caso de uma mulher de 29 anos que desenvolveu um nevo composto displásico spitzoide em sua coxa direita após 41 meses de tratamento para psoríase com adalimumabe.8 Embora sejam tumores benignos da pele, os nevos de Spitz podem se assemelhar a melanomas malignos, tanto clínica quanto microscopicamente. Por isso, essas lesões são geralmente excisadas por precaução. No presente caso, a paciente desenvolveu um nevo de Spitz composto em uma área não exposta após 24 meses de tratamento com infliximabe. Embora o fototipo 2 de Fitzpatrick possa ter sido um fator contribuinte para o desenvolvimento dessa lesão, os efeitos imunossupressores do infliximabe também podem ter contribuído.
Os nevos de Spitz geralmente apresentam comportamento dinâmico, com variações consideráveis em suas características morfológicas, dermatoscópicas e de MCR ao longo do tempo.9 A MCR geralmente evidencia uma lesão simétrica, frequentemente com infiltração pagetoide, com células fusiformes em toda a lesão. Ninhos poligonais ovais a arredondados, com bordas bem definidas, compostas por células agrupadas, geralmente grandes e altamente refletivas, também são característicos. Quanto ao principal padrão observado na MCR, a maioria dos nevos de Spitz mostra um padrão em ninhos (clods) ou uma associação de ninhos e malha ou padrão em anel.9
Embora a dermatoscopia seja ferramenta estabelecida no diagnóstico não invasivo em dermatologia, o papel da MCR na prática clínica ainda está sendo descoberto. Nesse cenário, ela pode ser especialmente útil para a avaliação de lesões melanocíticas identificadas como “equívocas” por inspeção visual ou dermatoscopia. As evidências disponíveis sugerem que a MCR pode ser mais sensível e específica em comparação à dermatoscopia, o que destaca o potencial desse método de imagem na redução do número de excisões inadequadas.10 No entanto, deve‐se enfatizar que todas as lesões spitzoides em adultos devem ser confirmadas com a histopatologia.
Em resumo, embora estudos adicionais sejam necessários para caracterizar melhor o impacto do tratamento com biológicos na proliferação de melanócitos, evidências crescentes sugerem uma possível relação entre tratamento com biológicos e proliferação melanocítica.4 Estudos controlados com amostras maiores e períodos de acompanhamento mais longos são necessários para melhor avaliar essa associação. Até então, a literatura disponível sugere que os pacientes em tratamento com biológicos devem ser instruídos a monitorar seus nevos preexistentes, bem como o surgimento de novos.6,8 O acompanhamento regular por um dermatologista também deve ser aconselhado. No seguimento desses pacientes, técnicas de imagem não invasivas têm tido um papel especial na detecção de alterações sutis e monitoramento da evolução das lesões.
Suporte financeiroNenhum.
Contribuição dos autoresCatarina Sousa Duque Soares Queirós: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
André Laureano Oliveira: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Dolores Lopéz Presa: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Paulo Filipe: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Queirós CS, Laureano‐Oliveira A, López‐Presa D, Filipe P. Spitz nevus and infliximab: association or coincidence? An Bras Dermatol. 2020;95:615–8.
Trabalho realizado no Hospital de Santa Maria, Centro Hospitalar e Universitário de Lisboa Norte, Lisboa, Portugal.