O cabelo humano, particularmente no couro cabeludo, serve como aspecto significante da identidade social e bem‐estar. O expossoma, abrangendo fatores intrínsecos e extrínsecos, desempenha papel fundamental no desgaste do cabelo. Fatores intrínsecos incluem predisposições genéticas e mudanças fisiológicas dentro do corpo, enquanto fatores extrínsecos compreendem exposições ambientais, como radiação ultravioleta, poluição, umidade, variações de temperatura, estilo de vida e tratamentos químicos. Esses elementos contribuem coletivamente para o dano cumulativo sofrido pelo cabelo ao longo do tempo. Entender o impacto abrangente do expossoma na saúde capilar e no envelhecimento do cabelo exige exploração de várias condições ambientais, fatores de estilo de vida e artefatos técnicos. Apesar dos avanços na pesquisa, os complexos mecanismos subjacentes à influência do expossoma no cabelo permanecem incompletamente compreendidos. Por meio de uma revisão abrangente da literatura atual e achados de pesquisas emergentes, o presente estudo visa aumentar a compreensão do impacto do expossoma na saúde capilar.
O cabelo humano, particularmente no couro cabeludo, tem imensa importância nas interações sociais e na identidade pessoal, impactando profundamente a sensação de bem‐estar.1 No centro da estrutura capilar estão a haste capilar e o folículo piloso (FP). A haste capilar compreende três componentes primários: a cutícula, o córtex e a medula. A cutícula atua como escudo para o cabelo, protegendo‐o contra danos químicos e mecânicos. A cutícula consiste em escamas sobrepostas compostas por queratinócitos. Curiosamente, a espessura e o número dessas escamas variam entre diferentes etnias. Por exemplo, indivíduos de ascendência asiática geralmente têm as cutículas mais grossas, seguidos por caucasianos, enquanto aqueles de ascendência africana têm as cutículas mais finas. Essa variação afeta a suscetibilidade do cabelo à quebra – o cabelo africano é o mais quebradiço em virtude de sua camada de cutícula mais fina. Além disso, a prática comum de alisar o cabelo nessa população contribui significantemente para a quebra do cabelo.2–4 Dentro de cada célula da cutícula encontra‐se uma fina membrana proteica conhecida como epicutícula, que é crucial para manter a hidrofobicidade capilar. Abaixo da cutícula encontram‐se três camadas distintas: a camada A, a exocutícula ou camada B e a endocutícula. Essas camadas são compostas principalmente de proteínas ricas em cisteína, que fornecem força e estrutura à haste do cabelo por meio de ligações cruzadas. A camada A contém a maior concentração de cistina, contribuindo significantemente para a resiliência capilar. A camada beta, um componente primário do complexo da membrana celular (CMC), é particularmente suscetível a danos de tratamentos químicos, como procedimentos de descoloração, tingimento e alisamento.2–4 O córtex, que constitui a maior parte da haste capilar, é responsável pela resistência mecânica e resiliência capilar. Ele contém células alongadas dispostas em uma matriz fibrosa e grânulos de melanina, que determinam a cor do cabelo. Dentro da pele, o FP serve como a estrutura primária de crescimento capilar humano, compreendendo bainhas radiculares externas e internas, o bulbo capilar e o infundíbulo.5 Os FPs passam por ciclos contínuos de mudança ao longo da vida, passando pelo crescimento ativo (fase anágena), regressão (fase catágena) e uma fase de repouso (telógena). Com aproximadamente 100.000 FPs maduros no couro cabeludo, mesmo pequenas alterações em seus padrões de ciclagem podem ter implicações clínicas significantes.6
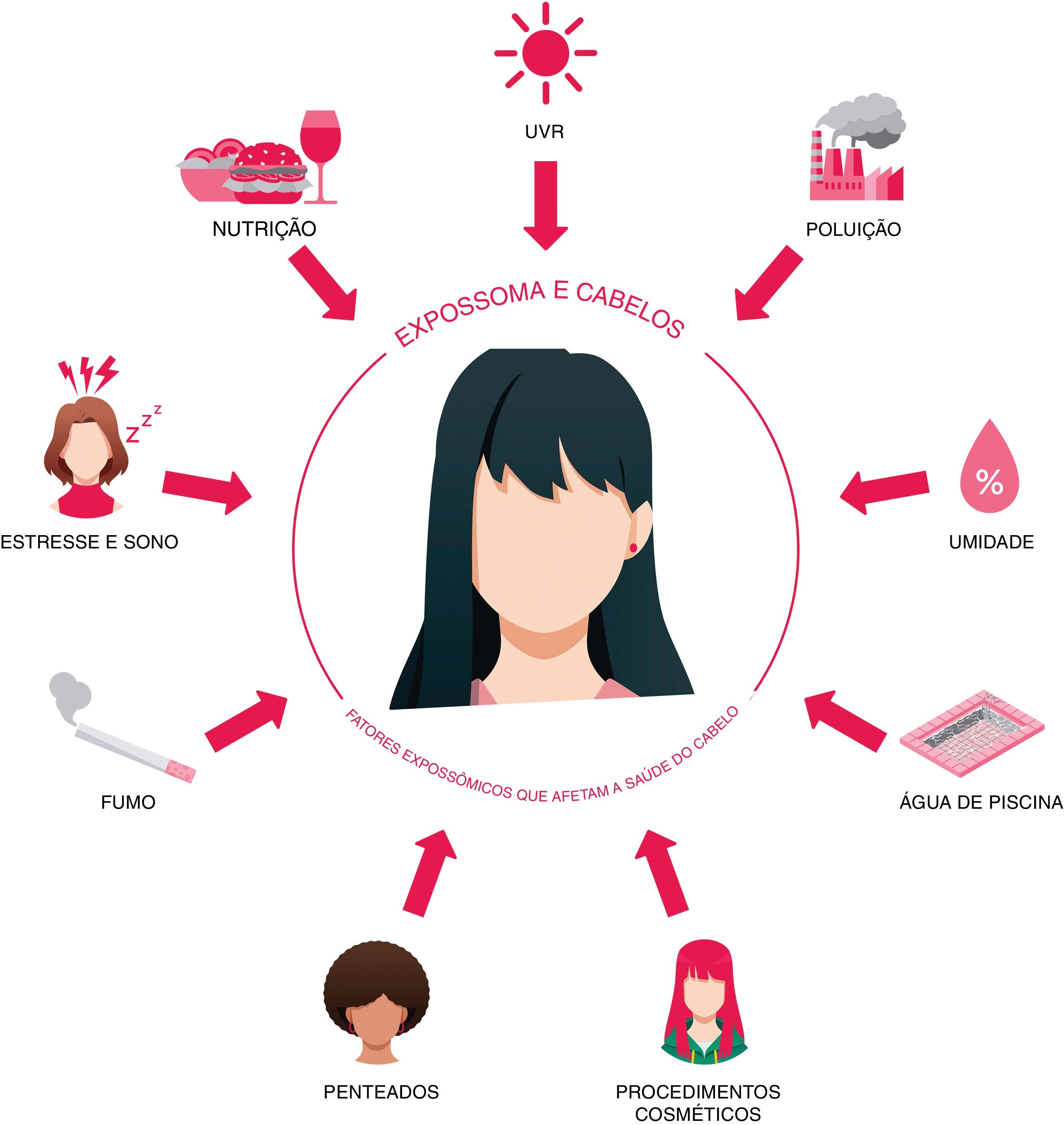
O desgaste capilar é significantemente influenciado por fatores expossômicos. O expossoma abrange todas as exposições que os indivíduos encontram do nascimento à morte, incluindo elementos externos e internos, bem como as respostas do corpo a eles.7 A exposição contínua a tais elementos pode induzir o desgaste do cabelo, levando ao afinamento, quebra, desgaste e envelhecimento prematuro geral do cabelo.8–10 Os principais elementos expossômicos que impactam o desgaste capilar incluem condições ambientais (umidade, temperatura, velocidade do vento e densidade de material particulado), variáveis espaciais, fatores de estilo de vida (altitude, densidade populacional) e artefatos técnicos (efeitos de lote), entre outros.8,9,11
Entretanto, nossa compreensão de como esses fatores influenciam o desgaste capilar permanece limitada. O presente artigo visa abordar essa limitação investigando minuciosamente a interconexão entre o expossoma e a saúde capilar, sendo o foco central do presente estudo.
Envelhecimento capilarO envelhecimento capilar é um fenômeno complexo, estritamente relacionado ao desgaste capilar, influenciado por vários fatores. Os fatores que impactam os FPs compreendem características raciais e de gênero, taxas metabólicas, estado nutricional, respostas hormonais e flutuações no ciclo de crescimento capilar.7,8,12,13 Essas mudanças abrangem não apenas alterações nos padrões de crescimento capilar e cor, mas também variações na secreção de sebo, espessura capilar e densidade capilar geral, resultando em cabelos sem brilho, grisalhos, ralos e desgastados.12–14
O envelhecimento capilar é comumente reconhecido como um dos sinais iniciais do envelhecimento. Pesquisas epidemiológicas indicam que entre 6% e 23% dos indivíduos têm cabelos 50% grisalhos quando atingem 50 anos de idade. No entanto, o aparecimento dos cabelos grisalhos é influenciado por fatores genéticos, etnia e origem geográfica. Por exemplo, asiáticos e africanos geralmente apresentam início mais tardio e presença menos pronunciada de cabelos grisalhos em comparação aos caucasianos, com respectivas idades de início em torno de 43,9±10,3 anos e 34±9,6 anos.13–15 A pigmentação dos FPs é governada por interações intrincadas entre melanócitos foliculares, queratinócitos da matriz e fibroblastos. Diferente da produção contínua de melanina na epiderme, a melanogênese folicular depende do ciclo folicular; a melanina não é produzida durante a fase telógena, que é estendida em indivíduos mais velhos. O aparecimento de cabelos grisalhos ocorre em virtude de uma redução na população de melanócitos foliculares e no conteúdo de melanina, exacerbado pela diminuição da capacidade de suportar danos oxidativos.12–15
Embora a perda de cabelos e o aparecimento de cabelos grisalhos sejam as manifestações visíveis mais comumente observadas do envelhecimento capilar, outras mudanças nas características do cabelo também foram documentadas. A redução no diâmetro do cabelo é outro aspecto significante do processo de envelhecimento, geralmente começando a partir dos 40 anos para mulheres e a partir dos 18 anos para homens. A diminuição da produção de sebo e a perda do brilho do cabelo, parcialmente atribuídas ao aumento da curvatura da fibra, também foram observadas. Nas mulheres, esse declínio geralmente começa após a menopausa, enquanto nos homens torna‐se perceptível muito mais tarde, por volta dos 80 anos.12,14
Em uma investigação recente realizada por Panhard et al., os achados revelaram que o início e o ritmo do aparecimento de cabelos grisalhos são influenciados tanto pela etnia quanto pela origem geográfica. Indivíduos de ascendência afro‐americana, tailandesa e chinesa, com tons de cabelo mais escuros, demonstram frequência e intensidade diminuídas de cabelos grisalhos em contraste com indivíduos de idades semelhantes com tons de cabelo mais claros, como caucasianos.16–19
Fatores expossômicos, desgaste do cabelo e envelhecimento do cabeloPara obter uma visão mais profunda das influências do expossoma no desgaste capilar e como ele afeta o envelhecimento do cabelo, é essencial destacar que fatores expossômicos internos e ambientais contribuem para isso (fig. 1). Na discussão a seguir, uma análise detalhada de ambas as classificações é fornecida.
Fatores expossômicos internosNutriçãoA nutrição desempenha papel crucial na manutenção do crescimento ideal do cabelo, e desequilíbrios na ingestão de nutrientes podem acelerar o processo de envelhecimento capilar. A queratina, o principal componente do cabelo, depende muito da ingestão adequada de proteínas para a produção de fios saudáveis. Por outro lado, os carboidratos servem como fonte de energia importante para o corpo, incluindo os FPs. A taxa de divisão celular em FPs é influenciada pelo valor calórico da dieta, que é amplamente derivado de carboidratos. Esses carboidratos são armazenados como glicogênio na bainha radicular externa do FP, fornecendo a energia necessária para o crescimento capilar.20–22 Condições como magreza extrema e desnutrição proteico‐calórica, que estão associadas à desnutrição proteico‐energética, podem levar o cabelo a ficar fino ou quebradiço, acompanhado de alopecia desencadeada pelo eflúvio telógeno (ET). A desnutrição proteico‐calórica, caracterizada pela ingestão inadequada de proteínas, apesar do consumo suficiente de calorias, apresenta alterações adicionais relacionadas ao cabelo, incluindo hipocromotriquia e o distinto “sinal da bandeira” nos cabelos do couro cabeludo, indicando deficiências nutricionais significantes que afetam a cor e a textura do cabelo.20–22
Em termos de vitaminas e minerais, uma ingestão adequada é essencial para a biossíntese e metabolismo energético dos FPs. Vitaminas específicas (A, E, grupo B e D) e minerais (ferro, zinco, selênio etc.) desempenham papéis essenciais na manutenção da saúde capilar, e baixas ingestões podem estar associadas ao envelhecimento do cabelo.22,23 A revisão sistemática de Chang et al. analisou os níveis séricos de ferro, zinco, cobre e cálcio na canície precoce (CP), revelando níveis mais baixos de cobre e cálcio em pacientes com CP, críticos para a melanogênese.24 O zinco é destacado como micronutriente crucial para o crescimento e a manutenção do cabelo, pois sua deficiência, seja genética ou adquirida, pode causar alopecia;22 entretanto, a causalidade permanece incerta em virtude da falta de evidências que mostrem melhora na perda de cabelo ou alopecia após a suplementação com zinco. O estudo de El‐Husseiny et al. em uma população egípcia encontrou níveis séricos ligeiramente mais baixos de vitamina D em pacientes com CP em comparação aos controles, embora não estatisticamente significantes. Entretanto, níveis baixos de ferritina sérica foram mais prevalentes em pacientes com CP, sugerindo uma ligação entre deficiência de ferro e CP.23 A deficiência de ferro, uma deficiência nutricional comum globalmente, pode levar à perda de cabelo decorrente de seu papel vital na formação de hemoglobina, que transporta oxigênio para os tecidos do corpo, incluindo os FPs. A deficiência de ferro reduz o fornecimento de oxigênio para os FPs, resultando em afinamento e perda de cabelos.22,25
A obesidade, outra condição relacionada à nutrição, influencia significantemente o envelhecimento do cabelo. Dietas ricas em gordura (DRG) e obesidade parecem acelerar a perda de cabelo ao impactar diretamente as células‐tronco dos FPs. Esse impacto está ligado à deficiência de COL17A1, componente essencial responsável pela ancoragem das células‐tronco dos FPs à membrana basal, levando à miniaturização e afinamento do FP, exacerbando o processo de envelhecimento dos FPs. Evidências experimentais de estudos em camundongos indicam que aqueles alimentados com DRG apresentam afinamento capilar perceptível e densidade capilar reduzida em comparação com aqueles recebendo dieta normal.26,27 A influência da obesidade no envelhecimento capilar se estende além da depleção das células‐tronco dos FPs. O estresse metabólico induzido pela DRG altera o microambiente do FP, afetando a duração e as fases do ciclo de crescimento capilar. O estresse metabólico relacionado à obesidade induz a entrada prematura na fase anágena e interrompe o equilíbrio do ciclo capilar, levando ao afinamento e à perda capilar acelerados.26,28 Diversas vias, incluindo a via de sinalização de citocina inflamatória e estresse oxidativo, podem contribuir para o envelhecimento capilar decorrente da obesidade; por exemplo, sinais inflamatórios como a interleucina‐1β (IL‐1β) inibem a via de sinalização Shh em células‐tronco dos FPs, exacerbando ainda mais a perda capilar.26
Estresse e sonoO FP humano surge como local inesperado para vários mediadores relacionados ao estresse, incluindo o hormônio liberador de corticotrofina (CRH, do inglês corticotropin‐releasing hormone), o hormônio adrenocorticotrófico (ACTH, do inglês adrenocorticotropic hormone), o cortisol, a noradrenalina, a substância P e a prolactina. A interação entre mediadores de estresse e receptores de FPs, localizados em diversos tipos de células dentro do FP, modula o controle do ciclo capilar e as respostas imunológicas.29,30 Especificamente, a região da protuberância no FP, que abriga células‐tronco epiteliais e melanócitos, exibe alta receptividade a sinais derivados de nervos e estimulações neuroendócrinas de tecidos vizinhos. Isso implica que as células‐tronco na protuberância têm papel fundamental na assimilação de sinais de fontes sanguíneas e nervosas para regular o crescimento e a pigmentação do cabelo.29,30
Estudos demonstraram que o estresse prolongado tem o potencial de acelerar o envelhecimento em FPs e provocar perda capilar, impactando negativamente a função e a reprodução das células‐tronco do FP. A corticosterona, um hormônio primário do estresse semelhante ao cortisol em roedores, impede o início da fase anágena em células‐tronco dos FPs principalmente por meio da via corticosterona/Gas6/AXL. De fato, o cortisol se liga aos receptores de glicocorticoides (RG), resultando na supressão de Gas6. Consequentemente, os receptores AXL não recebem estimulação adequada, dificultando a ativação das células‐tronco dos FPs e contribuindo para o envelhecimento acelerado do FP.14,31
Além disso, a pesquisa indica que as mitocôndrias desempenham papel central na resposta celular ao estresse, com implicações para o crescimento capilar e a dinâmica da pigmentação. Alterações na função e no metabolismo mitocondriais podem impactar profundamente a progressão do ciclo de crescimento capilar, potencialmente conectando o estresse psicossocial à perda capilar e CP. A disfunção mitocondrial induzida pelo estresse e a depleção do DNA mitocondrial (mtDNA) podem contribuir para ciclo capilar e pigmentação irregulares.29,30
O envelhecimento prematuro do cabelo, o desgaste capilar e as condições associadas também estão correlacionados com outra forma de estresse: a privação do sono. Xerfan et al. detalharam como o sono está interligado com a tricodínia por várias vias. A tricodínia, caracterizada por desconforto e hipersensibilidade no couro cabeludo, pode ser exacerbada pelo estresse, desencadeando a liberação da substância P, um neurotransmissor associado à percepção da dor e à inflamação.32 A substância P não apenas influencia a percepção da dor, mas também regula o ritmo circadiano e os padrões de sono. Distúrbios nos níveis de substância P ou sua interação com os receptores da neurocinina‐1 podem resultar em qualidade de sono abaixo do padrão, intensificando os sintomas da tricodínia.32 Além disso, existe uma relação bidirecional entre a tricodínia e os distúrbios do sono: a tricodínia pode perturbar os padrões de sono, e a qualidade inadequada do sono pode aumentar a sensibilidade à dor e ao desconforto, amplificando os sintomas da tricodínia. Além disso, distúrbios nos padrões de sono podem elevar os níveis de estresse oxidativo, potencialmente piorando a sensibilidade do couro cabeludo, sintomas de tricodínia e, por fim, induzindo o envelhecimento capilar.32
Consumo de tabacoO hábito de fumar tem sido associado ao desgaste do cabelo, alopecia e CP.22,33,34 Na alopecia androgenética (AAG), a forma mais prevalente de perda de cabelo, o fumo está ligado à miniaturização capilar e à conversão de fios terminais em fios velos. Esse fenômeno é parcialmente atribuído à influência sistêmica dos andrógenos, que podem ser afetados pelo fumo. Especificamente, fumar pode induzir um estado hipoestrogênico relativo em mulheres pela hidroxilação do estradiol e inibição da aromatase, potencialmente impactando os padrões capilares influenciados pelos andrógenos.33,34 Além disso, a nicotina, um constituinte da fumaça do tabaco, pode se acumular no cabelo e contribuir para danos foliculares; na verdade, pode levar à constrição da papila capilar dérmica e ao estresse oxidativo. O estresse oxidativo, por sua vez, pode induzir a liberação de citocinas pró‐inflamatórias pelos queratinócitos foliculares, que demonstraram dificultar o crescimento de FPs em cultura. Radicais livres também podem causar danos ao DNA e interromper os sistemas protease/antiprotease. Por fim, esses mecanismos resultam em inflamação folicular, fibrose e destruição de FPs.33,34 Além disso, o estresse oxidativo pode prejudicar os melanócitos, levando à redução da produção de melanina e, consequentemente, CP. Pesquisas indicam que fumantes são propensos a início mais precoce e maior incidência de cabelos grisalhos em comparação a não fumantes, com o risco de cabelos grisalhos aumentando com a duração do tabagismo.33,34
Fatores expossômicos ambientaisRadiação ultravioletaA exposição à radiação ultravioleta (UV) desencadeia uma cascata de reações químicas nas fibras capilares que podem levar ao envelhecimento capilar precoce e ao desgaste capilar.7,8,22 De fato, os raios UVA e UVB produzem danos oxidativos no DNA nos FPs, redução da proliferação de queratinócitos, aumento da apoptose, produção elevada de fator de crescimento transformador β2 (TGF‐β2, do inglês transforming growth factor‐beta 2), diminuição da expressão do fator de crescimento semelhante à insulina tipo 1 (IGF‐1, do inglês insulin‐like growth factor 1) em queratinócitos da bainha radicular externa, desenvolvimento precoce da fase catágena e degranulação de mastócitos perifoliculares. O grau de danos induzidos pela radiação UV nos FPS é mais acentuado com doses mais altas de UV, afetando não apenas os compartimentos dos FPs próximos à superfície da pele, mas também estendendo‐se para regiões mais profundas, incluindo o bulbo capilar.35,36 A radiação UVA, em particular, contribui para a formação de radicais estáveis de carbono e enxofre dentro da estrutura proteica da queratina do cabelo; esses radicais resultam da interação direta da radiação UV com resíduos de aminoácidos presentes na matriz proteica. Especificamente, a radiação UV tem como alvo aminoácidos como tirosina, triptofano e cisteína, que são particularmente suscetíveis à oxidação em virtude de sua estrutura química.37 Essas espécies também estão associadas à produção de oximelanina a partir da melanina, bem como à oxidação de pigmentos artificiais em cabelos tingidos. A melanina, o pigmento responsável pela cor do cabelo, desempenha papel duplo na proteção contra e na sucumbência aos danos causados pela radiação UV: enquanto absorve e dissipa a radiação UV, protegendo as proteínas subjacentes, a exposição prolongada pode levar à sua degradação e à formação de espécies oxidativas a partir dela.35,36 As espécies reativas de oxigênio (EROs) participam de reações oxidativas que degradam ainda mais proteínas e lipídios, acelerando o envelhecimento e a deterioração capilares. Além disso, a radiação UV penetra na haste do cabelo, causando mudanças estruturais na matriz da queratina: aminoácidos, esteróis e ácidos graxos sofrem foto‐oxidação, levando à formação de lesões micromoleculares e enfraquecimento da fibra capilar.35 Foi demonstrado que a exposição prolongada à radiação UV induz mudanças acentuadas na composição lipídica do cabelo, impactando potencialmente sua saúde e integridade geral. Entre as alterações observadas, foi documentada uma diminuição nos ésteres de ácidos graxos da vitamina A e ésteres de esterol.38 Esses lipídios, cruciais para o desenvolvimento e a manutenção do FP, sugerem possíveis interrupções no metabolismo retinoide e nas vias de síntese de lipídios em resposta à exposição aos raios UV. As ceramidas, contribuintes vitais para as funções de barreira da pele e do cabelo, apresentam redução significante após a exposição aos raios UV, o que pode contribuir para o comprometimento da integridade da barreira, potencialmente ligando a exposição aos raios UV ao aumento da fragilidade capilar. Além disso, os níveis de mono, di e triglicérides, comumente encontrados em tecidos humanos, estão diminuídos em cabelos expostos aos raios UV. Esse declínio é atribuído a processos oxidativos induzidos pela radiação UV, indicando potenciais vias de degradação de lipídios. Em geral, essas alterações estruturais se manifestam como aumento da porosidade, perda de flexibilidade e deterioração da textura capilar.38
Por fim, a exposição à radiação UV pode causar mudanças significantes na cor do cabelo. Eumelanina e feomelanina, os dois tipos de melanina presentes no cabelo, sofrem reações oxidativas sob exposição UV, resultando em desbotamento da cor, descoloração ou mudanças na tonalidade. Cores de cabelo mais claras, que contêm níveis mais altos de feomelanina, são particularmente suscetíveis a mudanças de cor induzidas pela radiacão UV.35
PoluiçãoA poluição também pode impactar as fibras capilares, causando desgaste capilar. Quando expostas à radiação UV, as fibras capilares contaminadas com hidrocarbonetos policíclicos aromáticos (HPAs) tornam‐se mais suscetíveis a danos. O processo envolve a absorção da luz UV pelos HPAs, o que desencadeia a produção de EROs dentro das fibras capilares. Essas EROs, por sua vez, contribuem para a degradação do DNA, proteínas e componentes da membrana celular.7,8,39 Esse impacto resulta na formação de vacúolos ou lacunas no córtex e na cutícula, na degradação dos queratinócitos no córtex, na diminuição das camadas da cutícula ao longo do tempo e em alterações nos melanossomas. Importante, os HPAs encontrados na melanina capilar intensificam os efeitos adversos da radiação UV, causando potencialmente o descoloramento capilar e subsequente CP. Embora o dano observado possa não comprometer significantemente a integridade geral das fibras capilares dominadas por macrofibras, a redução das camadas da cutícula pode afetar visivelmente a aparência do cabelo.39
UmidadeOs níveis de umidade desempenham papel crucial na formação e dinâmica dos radicais nas fibras capilares e podem, em última análise, levar ao desgaste capilar.7,8,40 Condições de alta umidade levam a aumento nas espécies de radicais semiquinona na melanina e influenciam a montagem molecular e a vida útil dos radicais. Esse fenômeno impacta a viscosidade local e a dinâmica molecular, afetando assim a química dos intermediários reativos dentro da estrutura do cabelo.40 De acordo com dados experimentais, os efeitos da luz solar nas proteínas capilares sob alta umidade geram aumento na degradação dos radicais, envolvendo a formação de EROs que contribuem para o aumento da degradação de proteínas e clivagem de dissulfetos. De fato, quando o cabelo é exposto à radiação UV na presença de água, ocorre uma série mais complexa de reações; a água atua como facilitador, aumentando a mobilidade molecular dentro da fibra capilar e fornecendo um meio para a formação de EROs, como radicais hidroxila.37 Em geral, o cabelo exposto à UV em altos níveis de umidade exibe maior perda de proteínas em comparação com condições de umidade mais baixa. Além disso, níveis mais altos de umidade levam ao aumento da formação de radicais à base de enxofre, o que deve resultar em mais clivagem das ligações dissulfeto nas proteínas capilares. Esse fenômeno foi observado em cabelos brancos e castanhos claros sob exposição UV em diferentes níveis de umidade.40
Água de piscinaA água com cloro representa fator expossômico externo importante que pode induzir o desgaste do cabelo. Especificamente, o cloro, frequentemente presente na forma de ácido hipocloroso usado para higienizar a água das piscinas, pode penetrar profundamente no córtex capilar. Uma vez dentro, o cloro inicia processos oxidativos que degradam a melanina, resultando na descoloração do cabelo ao longo do tempo. Além disso, a exposição ao cloro pode acelerar a quebra da queratina dentro da estrutura capilar, ao mesmo tempo em que compromete a integridade da cutícula, levando também à quebra do cabelo.7,41 Além disso, a exposição repetida à água exacerba o estresse mecânico e o atrito experimentado pelos fios de cabelo; esse atrito contínuo contribui para a erosão da cutícula, comprometendo ainda mais a saúde e a aparência geral do cabelo.41 Schwartz et al. recentemente criticaram essa teoria em seu artigo, ao propor que os compostos de cobre na água, ligando‐se à proteína na superfície da haste capilar, são a causa real do cabelo esverdeado. De fato, o sulfato de cobre é frequentemente adicionado à água das piscinas como algicida. Além disso, a coloração verde de cabelos anteriormente loiros pode ocorrer quando os canos de cobre são novos e não revestidos por calcáreo.42 Mais pesquisas são necessárias para entender de forma abrangente o papel de cada componente na coloração esverdeada do cabelo submetido à exposição contínua na água das piscinas.
Procedimentos cosméticosOs procedimentos cosméticos, sem dúvida, desempenham papel significante nas rotinas diárias de cuidados com os cabelos. No entanto, embora muitos desses procedimentos sirvam como declarações ousadas de individualidade, surgiram preocupações sobre seu potencial de causar o desgaste capilar.7,8,43,44 O cabelo pode sofrer danos por influências físicas e químicas. Os fatores físicos abrangem atrito, pentear ou escovar excessivamente, ou exposição ao calor. Os tratamentos químicos abrangem descoloração, coloração, permanente e alisamento químico. A exposição prolongada e repetida a esses elementos pode alterar a textura do cabelo, resultando em danos e, por fim, acelerando seu processo de envelhecimento.12
No que diz respeito às tinturas capilares, elas estão disponíveis em dois tipos principais: oxidativas (permanentes) e não oxidativas (semipermanentes e temporárias). As tinturas permanentes penetram na haste capilar para introduzir uma nova cor por meio da oxidação, enquanto as tinturas semipermanentes e temporárias aderem à camada externa do cabelo e podem ser lavadas facilmente. A tintura capilar pode causar danos físicos e químicos tanto na haste capilar quanto no couro cabeludo.45–48 A cutícula pode sofrer várias formas de danos, como margens serrilhadas, fissuras e descolamento das células cuticulares. O córtex pode apresentar contorno celular irregular, degeneração celular e vacúolos na endocutícula em virtude das reações químicas durante a tintura. A extensão do desgaste depende de fatores como o tipo de tintura, duração da aplicação, concentração química, nível de pH, resistência capilar e outras práticas de cuidado capilar.45–48 Além disso, também existem riscos químicos associados às tinturas capilares, como a dermatite de contato alérgica (DCA). Os corantes contêm precursores, acopladores e reveladores que podem levar à DCA. Ingredientes como peróxido de hidrogênio (H2O2) e monoetanolamina (MEA) causam estresse oxidativo e citotoxicidade, contribuindo para a perda de cabelos e DCA.45–48
O clareamento é outro procedimento importante envolvido na cosmética capilar e associado ao potencial desgaste do cabelo. Essa técnica é procedimento químico que visa clarear a cor inerente do cabelo pela oxidação da melanina. Por meio da oxidação, a melanina é esgotada, resultando em tons de cabelo mais claros. Esse processo se desenrola em vários estágios: agentes clareadores, como clareadores e descolorantes em pó, permeiam a cutícula e o córtex do cabelo para acessar os grânulos de melanina. O peróxido de hidrogênio dentro desses agentes oxida e desintegra os grânulos de melanina, desmantelando o pigmento. Durante a desintegração dos grânulos de melanina, elementos metálicos dentro dos grânulos são liberados e agem como catalisadores, acelerando o processo de descoloração.47,49–51 A descoloração excessiva ou inadequada pode produzir vários efeitos adversos no cabelo; de fato, o processo oxidativo na descoloração pode induzir a deterioração das escamas da cutícula, além de produzir quebras e buracos visíveis nas camadas da cutícula. Além disso, a descoloração desencadeia a perda de proteína dentro da haste do cabelo, pois sua natureza oxidativa pode desintegrar as queratinas, levando à fragilidade e quebra do cabelo.47,49–51
Por fim, tratamentos de alisamento e permanente também são procedimentos populares na indústria de cosmética capilares, mas podem impactar a saúde do cabelo. Os tratamentos de alisamento visam alterar as propriedades mecânicas do cabelo para uma aparência mais lisa e reta. Alisadores químicos, como aqueles que contêm formaldeído ou ácido glioxílico, relaxam as fibras capilares, tornando‐as mais flexíveis e alterando sua resistência natural à quebra e ao alisamento. Por outro lado, tratamentos físicos, como o uso de chapinhas, utilizam calor para modificar ligações de hidrogênio e reconfigurar a haste capilar. Os dois tipos de tratamento podem resultar em danos ao cabelo e ao couro cabeludo.52,53 Alisadores químicos podem causar várias anormalidades na haste capilar, incluindo aumento da distância entre as escamas, descolamento da cutícula, fissuras, bordas irregulares da cutícula e ondulações. O levantamento das escamas da cutícula pode levar a maior porosidade e suscetibilidade ao desgaste. A perda de proteína também é uma preocupação, com alisadores à base de formaldeído ou ácido glioxílico quebrando ligações essenciais que afetam a resistência e a estrutura do cabelo. Além disso, alisadores químicos podem causar inflamação do couro cabeludo, dermatite de contato irritativa e DCA.52,53
A ondulação permanente (OP) converte cabelos lisos em cachos por meio de um processo químico que envolve a quebra e a reestruturação de ligações dissulfeto. O processo inclui a quebra de ligações dissulfeto utilizando agentes redutores, modelagem do cabelo, o processo de relaxamento de estresse (PRE) e neutralização com agente oxidante como peróxido de hidrogênio. Mercaptanos como tioglicolato e monotioglicolato de glicerila são agentes redutores comumente utilizados em OP. As consequências da OP incluem redução da resistência à tração, alterações em proteínas e lipídios, aumento da fricção capilar e dificuldade de pentear, bem como potencialmente a quebra e queda de cabelos se não for utilizada corretamente.54
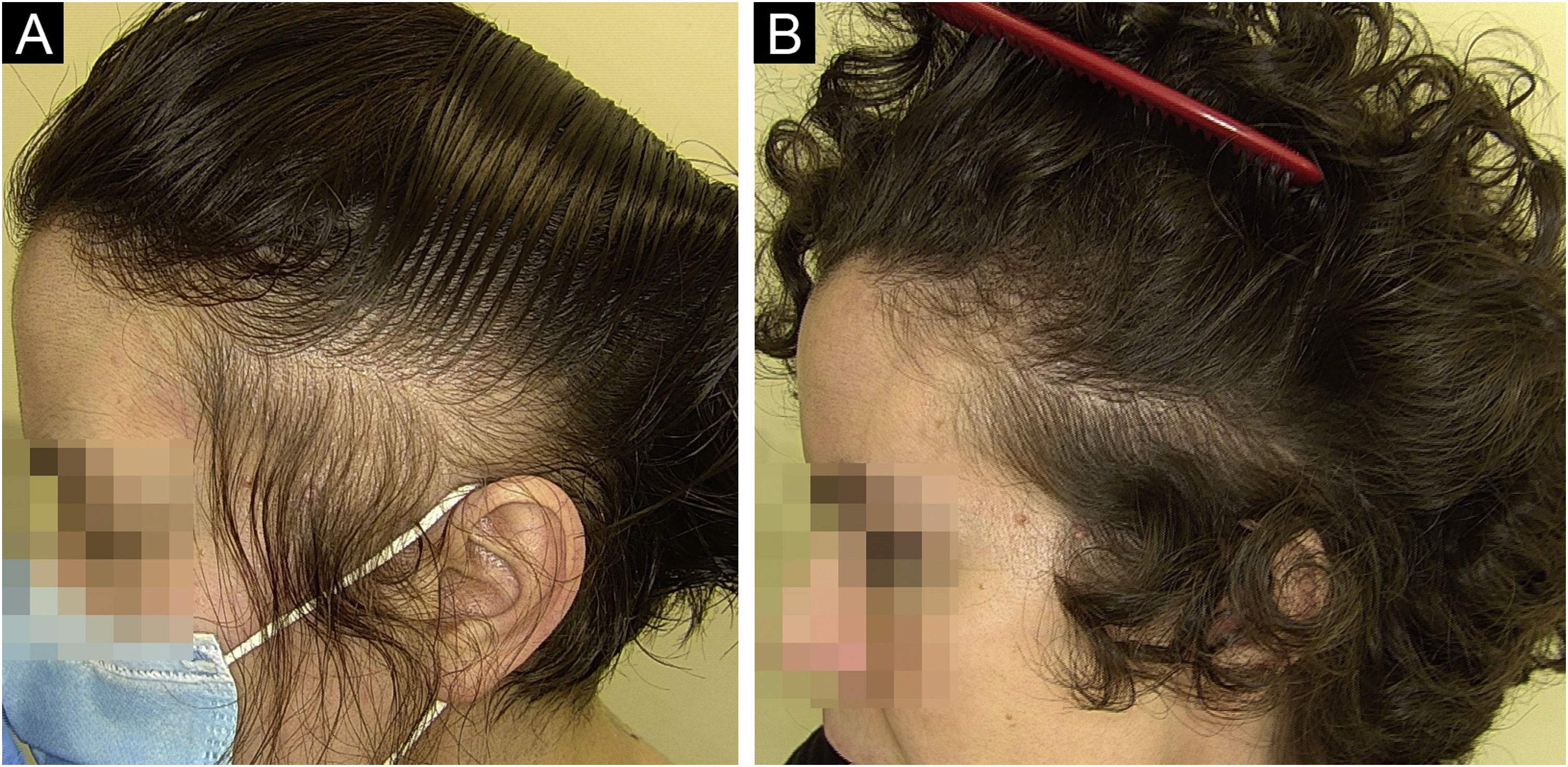
PenteadosA diversidade de estilos dos penteados modernos enriqueceu o cenário dos cuidados com os cabelos, mas também traz ameaças potenciais à saúde do cabelo. Penteados afro como tranças, trancinhas e entrelaçados têm profundo significado cultural nas comunidades africanas e afro‐americanas, servindo como símbolos potentes de identidade e orgulho. No entanto, esses estilos geralmente envolvem tranças ou entrelaçados apertados, levando a várias condições capilares, como tricorrexe nodosa proximal adquirida (TNPA), alopecia por tração (AT), foliculite por tração (FT) e alopecia cicatricial centrífuga central (ACCC).55–59 A TNPA é caracterizada por cabelos frágeis, propensos à quebra em virtude de pequenos traumas, como pentear, penteados apertados ou pressão durante o sono. Tratamentos químicos ou escovação excessiva podem agravá‐la. A tricoscopia pode revelar quebra capilar com tricorrexe nodosa, potencialmente causando alopecia. A AT, por outro lado, resulta da tração prolongada no cabelo decorrente de penteados e apliques específicos (por exemplo, entrelaçados/extensões, tranças/trancinhas apertadas e bobes), afetando principalmente indivíduos negros. Os sintomas incluem dor, eritema e foliculite. O diagnóstico depende de achados clínicos e tricoscópicos, como o sinal de flambeau, cilindros capilares e densidade capilar reduzida (fig. 2A‐B).55–59 Por fim, a ACCC está associada a entrelaçados e tranças costuradas com extensões, afetando principalmente mulheres de ascendência africana. Causa perda progressiva de cabelos, principalmente na região central do couro cabeludo, levando à destruição do folículo e desconforto no couro cabeludo. A tricoscopia pode mostrar densidade capilar reduzida, variabilidade da haste capilar, pequenos pontos brancos pontuais, fios únicos ou grupos de dois fios cercados por um halo branco‐acinzentado peripilar e máculas pigmentadas semelhantes a asteriscos com fios terminais esparsos e semelhantes a pelos velos.55–59
O backcombing, também conhecido como penteado desfiado ou de volume, é outra abordagem de penteado moderno em que o cabelo é penteado em direção ao couro cabeludo para aumentar o volume e a textura. É comumente utilizado para elevar o cabelo ou obter aparência mais cheia, particularmente para estilos como penteados no topo da cabeça ou colmeias.60 Esse penteado pode causar danos se não for realizado corretamente ou se for feito com muita frequência; na verdade, pode levar à quebra do cabelo, pois os fios podem ficar emaranhados e com nós, resultando em quebra ao tentar desembaraçar o cabelo desfiado. Além disso, essa técnica pode levantar as camadas da cutícula, expondo o córtex e tornando a haste do cabelo mais propensa a danos. Além disso, a força e a manipulação significantes envolvidas no backcombing podem, em última análise, levar à AT. Por fim, quando combinado com sprays de cabelo ou ferramentas de modelagem a quente, o backcombing pode causar desgaste do cabelo se não for feito com cuidado.7,8,43,60,61 Existe uma condição, conhecida como deformidade em bolhas do cabelo, caracterizada pela formação de cavidades de ar dentro do córtex do cabelo, afetando principalmente as mulheres, que pode estar relacionada ao backcombing, bem como a qualquer penteado que envolva ferramentas de modelagem a quente. Geralmente está associada à exposição prolongada de cabelos úmidos a altas temperaturas geradas por secadores de cabelo ou aparelhos de modelagem. A alta temperatura causa hidrólise da queratina dentro da haste capilar, levando à expansão de ar local e à formação de bolhas. Embora a maioria dos casos relatados de deformidade em bolhas do cabelo envolva pacientes caucasianos, foi sugerido que pode haver diferenças étnicas na suscetibilidade a essa condição: por exemplo, o cabelo asiático demonstrou exibir significantemente mais perda de proteína induzida pelo calor em comparação ao cabelo caucasiano, potencialmente devido a diferenças estruturais no córtex capilar.62
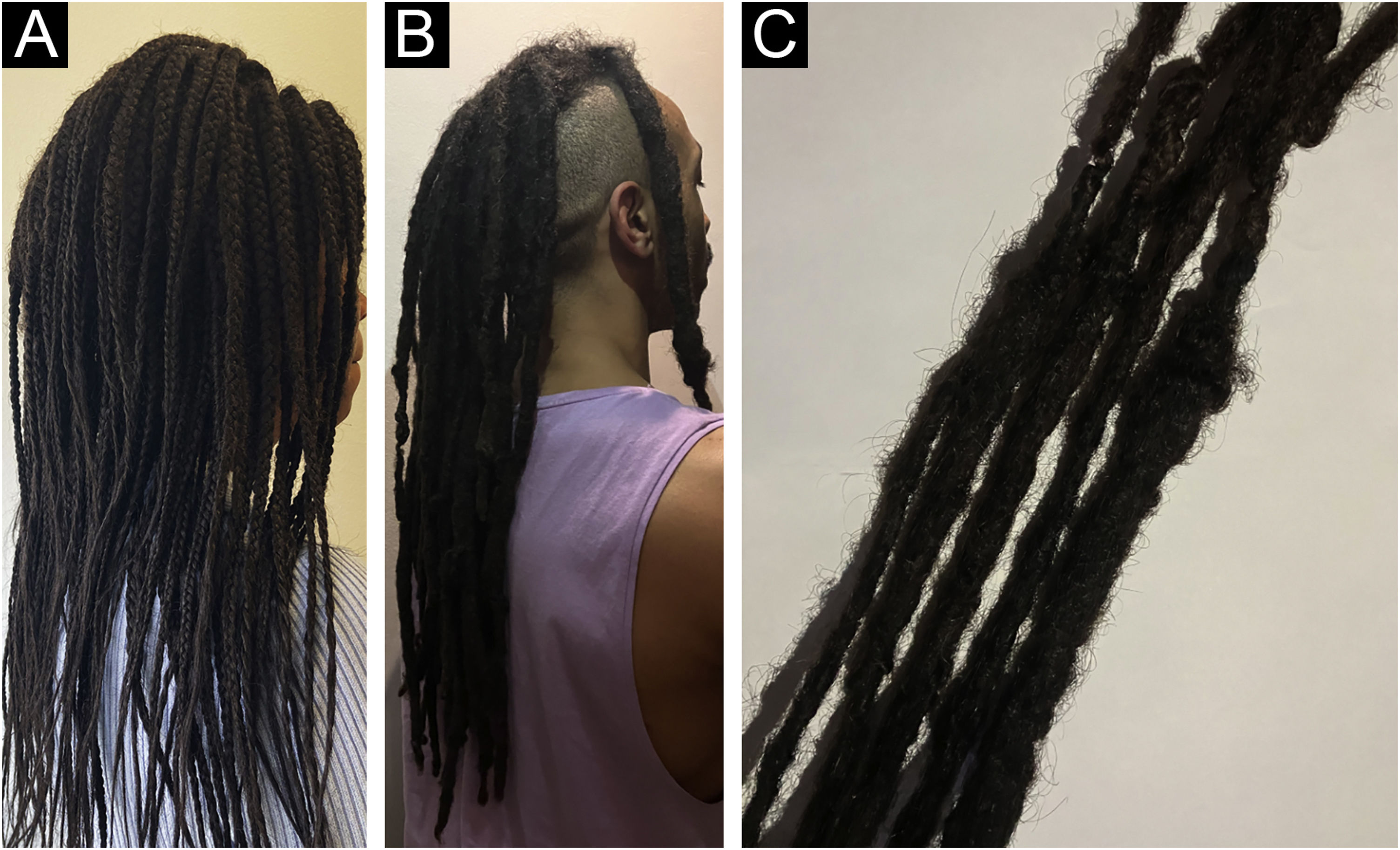
Finalmente, os dreadlocks ou trancinhas simbolizam um método prevalente de modelagem de cabelo em que o cabelo não penteado é torcido para formar cachos chamados de “locks”, que apresentam dificuldades para serem desembaraçados (fig. 3A‐B). Essa tendência é especialmente favorecida entre indivíduos mais jovens, particularmente aqueles com cabelo africano, pois representa uma opção natural e de baixa manutenção para a higiene diária sem recorrer a produtos químicos. O processo normalmente envolve dividir segmentos de cabelo em duas partes, torcê‐las e usar produtos de modelagem como gel ou cera de abelha para prendê‐las. Sem manutenção regular, os dreadlocks podem ficar permanentemente emaranhados e exercer pressão prolongada no couro cabeludo ao longo dos anos. Em relação ao impacto dos dreadlocks na saúde capilar, eles podem contribuir para a AT devido à pressão persistente no couro cabeludo, especialmente quando extensões são incorporadas, levando a uma tensão adicional nos FPs e resultando no desgaste do cabelo ao longo do tempo. Além disso, os dreadlocks apresentam desafios na manutenção da umidade em comparação com o cabelo liso porque o aperto dos locks pode impedir a distribuição natural do óleo ao longo da haste do cabelo, resultando em ressecamento e potencial fragilidade.55,57,63
ConclusãoEm resumo, o desgaste capilar é influenciado por ampla gama de fatores expossômicos, como medicamentos, estresse, radiação UV, exposição à água, traumas e práticas de modelagem capilar. Esses fatores podem levar a vários efeitos no cabelo, contribuindo para seu processo de envelhecimento. É crucial reconhecer essas influências e tomar medidas proativas para proteger e fortalecer o cabelo. A mensagem importante é que, ao compreender e abordar esses fatores, pode‐se manter a saúde ideal do cabelo e retardar seu envelhecimento. Olhando para o futuro, é fundamental conduzir mais pesquisas e promover a colaboração entre provedores de saúde, pesquisadores e a indústria da beleza para aprofundar o conhecimento e mitigar os impactos expossômicos no envelhecimento capilar. Esse conhecimento coletivo pode impulsionar o desenvolvimento de tratamentos mais avançados e estratégias preventivas para um espectro mais amplo de problemas relacionados ao envelhecimento capilar.
Suporte financeiroO presente estudo não recebeu suporte financeiro, mas os autores foram contratados pela ISDIN® para elaborar este projeto.
Contribuição dos autoresStephano Cedirian: Realizou a pesquisa, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
Ludmila Prudkin: Realizou a pesquisa, projetou o planejamento do estudo, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
Bianca Maria Piraccini: Realizou a pesquisa, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
Julia Santamaria: Realizou a pesquisa, projetou o planejamento do estudo, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
Jaime Piquero‐Casals: Realizou a pesquisa, projetou o planejamento do estudo, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
David Saceda‐Corralo: Realizou a pesquisa, analisou os dados, escreveu o manuscrito, aprovou o manuscrito final conforme submetido e concorda em ser responsável por todos os aspectos do trabalho.
Gostaríamos de agradecer à ISDIN® por ter participado do processo criativo deste projeto.
Como citar este artigo: Cedirian S, Prudkin L, Piraccini BM, Santamaria J, Piquero‐Casals J, Saceda‐Corralo D. The exposome impact on hair health: etiology, pathogenesis and clinical features ‐ Part I. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.07.003
Trabalho realizado na Unidade de Dermatologia, IRCCS Azienda Ospedaliero‐Universitaria di Bologna, Policlinico S. Orsola‐Malpighi, Bolonha, Itália.