O plasma rico em plaquetas (PRP) vem expandindo seu uso para a alopecia androgenética (AAG).
ObjetivosAvaliar a eficácia do PRP em comparação ao placebo na AAG.
MétodosFoi realizada busca abrangente em sete bases de dados, até 01/04/2023. Foram incluídos ensaios clínicos randomizados com foco no uso de PRP na AAG para aumentar a densidade capilar. Foram incluídos pacientes com idade entre 15 e 63 anos, com diagnóstico de AAG caracterizada pelas escalas Norwood I–VII e Ludwig I–III. Foram excluídos estudos com tamanho amostral <10, sem método de processamento do PRP, com foco em terapias complementares ou outras alopecias. Foram realizadas análises de subgrupos para ativador, método de centrifugação, desenho do estudo, risco de viés e gênero. A metarregressão foi conduzida para ativador, método de centrifugação, desenho e gênero. GRADEpro foi utilizado para avaliar a certeza das evidências, e a ferramenta RoB‐2 para avaliar o risco de viés. A assimetria foi medida por meio do gráfico de funil seguido do teste de Egger. O protocolo do estudo foi registrado na base de dados PROSPERO (CRD42023407334).
ResultadosForam selecionados 555 registros e incluídos 14 estudos envolvendo 431 pacientes para síntese qualitativa, com 13 estudos incluídos na metanálise. A metanálise demonstrou diferença média de 27,55 fios/cm2 e IC95% (14,04; 41,06), I2=95,99%, p<0,05. A metanálise do diâmetro do cabelo apresentou diferença média de 2,02μm, IC95% (−0,85μm; 4,88μm) e I2=77,11% (p=0,02), com evidência de baixa qualidade.
Limitações do estudoOs estudos eram altamente heterogêneos, de baixa qualidade e apresentavam evidente viés de publicação.
ConclusõesEstudos altamente heterogêneos com viés de publicação sugerem que o PRP efetivamente aumenta a densidade capilar na AAG, assim sendo são recomendados mais ensaios clínicos randomizados de alta qualidade para fortalecer as evidências.
A alopecia androgenética (AAG) é condição comum caracterizada pela perda progressiva de cabelo e diminuição da densidade capilar, afetando a cor, o diâmetro e o comprimento do cabelo. É condição poligênica que afeta uma proporção significante da população, com até 80% dos homens e 50% das mulheres experimentando‐a em algum momento da vida.1,2
Nos homens, o padrão de queda de cabelo normalmente envolve recuo nas regiões temporais e afinamento no vértice, resultando em padrão capilar característico em forma de ferradura.3,4 Em contraste, as mulheres tendem a apresentar queda de cabelo na região médio‐frontal, com início tardio e menor perda geral da densidade capilar.5,6
A importância do cabelo e seu impacto na vida dos indivíduos não devem ser subestimados. O cabelo é uma das primeiras características que notamos nos outros, e estudos demonstraram que a perda de cabelo pode ter impacto na vida social e no estilo de vida geral de um indivíduo.7,8 A condição do cabelo de um indivíduo desempenha papel crucial em sua autopercepção e atratividade, influenciando as interações e oportunidades sociais.9 Portanto, compreender a queda de cabelo e suas opções de tratamento é essencial para melhorar a qualidade de vida.
O plasma rico em plaquetas (PRP) é uma forma concentrada de plasma obtida do próprio sangue do paciente, contendo níveis mais elevados de plaquetas em comparação aos níveis basais.10 Existem várias técnicas para preparar o PRP, pois ainda não foi alcançado um consenso.11 O PRP tem sido utilizado há muitos anos na medicina regenerativa, particularmente no tratamento de lesões osteoartríticas e danos no manguito rotador. Recentemente, seu uso se expandiu, e o PRP agora é amplamente utilizado mundialmente por dermatologistas para diversas indicações, como rejuvenescimento da pele e tratamento de AAG.12–15A ação do PRP no couro cabeludo está relacionada aos fatores de crescimento presentes nas plaquetas concentradas.16 Por exemplo, o fator de crescimento endotelial vascular (VEGF, do inglês vascular endothelial growth factor) estimula as células da papila dérmica por meio da via VEGFR‐2/ERK.17 O fator de crescimento semelhante à insulina 1 (IGF‐1, do inglês insulin‐like growth factor 1) e o fator de crescimento de fibroblastos (FGF, do inglês fibroblast growth factor) promovem a fase anágena dos folículos pilosos e inibem a transição para a fase catágena.18–20 Além disso, o fator de crescimento epidérmico (EGF, do inglês epidermal growth factor) induz a proliferação das células da papila dérmica pela via de sinalização Notch e demonstrou promover o crescimento dos cabelos em estudos experimentais.21,22 O fator de crescimento derivado de plaquetas (PDGF, do inglês platelet‐derived growth factor) também induz e mantém os folículos pilosos na fase anágena em modelos animais.23,24
Revisões sistemáticas sugerem que o PRP aumenta a densidade capilar média na queda de cabelo de padrão masculino e feminino e na alopecia areata.25,26 Embora algumas tenham sido exclusivamente realizadas em ensaios clínicos, a qualidade da evidência é persistentemente baixa.27–29 Ensaios clínicos não randomizados são, de fato, inferiores aos ensaios clínicos randomizados. Como tal, são considerados fornecedores de qualidade de evidência de alto nível e, se avaliados separadamente, podem fornecer melhores informações sobre a qualidade da evidência existente.
Apesar do aumento na pesquisa e no uso do PRP para a alopecia androgenética, atualmente não há consenso baseado em evidências substanciais de ensaios clínicos randomizados. Dessa maneira, o objetivo do presente estudo é avaliar as evidências existentes sobre a aplicação de injeções de PRP para aumentar a densidade capilar em pacientes com AAG, especificamente através de revisão de ensaios clínicos randomizados.
MétodosDesenho do estudoO presente estudo empregou metodologia de revisão sistemática e metanálise, seguindo as diretrizes descritas na lista de verificação PRISMA (Preferred Reporting Items for Systematic Reviews and Meta‐Analyses).
Critérios de eligibilidadeA pergunta do estudo foi criada no formato PICOs: em pacientes com AAG, o plasma autólogo rico em plaquetas, quando comparado a um placebo, resulta em aumento da densidade capilar em ensaios clínicos randomizados?
Para serem incluídos na análise, os estudos precisavam atender os critérios de elegibilidade. Primeiramente, foram considerados apenas artigos originais completos que relatassem ensaios clínicos randomizados. A intervenção de interesse foi a administração de injeções de PRP, que pode ser ativado ou não ativado. O uso de PRP em combinação com o ativador/agonista plaquetário permite a liberação de múltiplos fatores de crescimento e fatores de diferenciação após a ativação plaquetária, o que pode melhorar o processo.30 A ativação pode ser realizada adicionando‐se um ativador/agonista plaquetário como trombina bovina tópica ou cloreto de cálcio a 10% à solução de PRP logo antes da injeção. O grupo controle foi composto por indivíduos que receberam placebo, com o objetivo de controlar a eficácia do PRP. A comparação com outras terapias padrão, como minoxidil ou inibidores da 5‐alfa‐redutase, pode contaminar os dados e fornecer resultados não representativos. Se o PRP não apresentar benefício em relação ao placebo, não faz sentido compará‐lo com outras terapias. O principal resultado de interesse foram as mudanças, positivas ou negativas, na densidade capilar. Isso refere‐se a alterações no número de fios de cabelo por unidade de área (cm2) na superfície da pele. Mudanças no diâmetro dos fios de cabelo foram resultados secundários.
A população‐alvo incluiu pacientes com idade entre 15 e 63 anos com diagnóstico de AAG, pois é a população com maior probabilidade de ser afetada pela AAG, que potencialmente procuraria e se beneficiaria de intervenções de PRP. Em segundo lugar, mulheres e homens podem ser incluídos, uma vez que a AAG pode afetar ambos os gêneros. Embora seja mais prevalente em homens, as mulheres também podem apresentar essa condição. A caracterização foi realizada pelas classificações Norwood I–VII e Ludwig I–III. Alguns estudos utilizam comparação entre pacientes e outros utilizam comparação intrapaciente; essa revisão incluiu ambos os tipos. Foram excluídos estudos com amostra <10 pacientes, aqueles sem informações sobre o método de processamento do PRP ou estudos que avaliaram subjetivamente o aumento da densidade capilar.
Além disso, também foram excluídos pacientes com doenças crônicas, indivíduos em terapia anticoagulante, gestantes, pacientes com neoplasias malignas e aqueles em uso de terapias complementares. Não foram considerados estudos com foco em outros tipos de alopecia, como alopecia areata, alopecia cicatricial ou líquen plano pilar. Não houve limitações quanto ao método de processamento do PRP.
Fontes de dadosFoi realizada busca abrangente até 1° de abril de 2023, em sete bases de dados. Essas bases de dados incluíam MEDLINE (através do PubMed), Biblioteca Virtual em Saúde (BVS), EMBASE, Biblioteca Cochrane, Web of Science, Scopus e MedRxiv (uma fonte de literatura cinzenta, abrangendo estudos pré‐impressos). A seleção dessas bases de dados teve como objetivo capturar ampla gama de estudos relevantes para inclusão na revisão e metanálise. As referências dos estudos citados nesse processo de redação da revisão também foram avaliadas e consideradas elegíveis para inclusão.
Estratégia de buscaPara a busca nas bases de dados eletrônicas, foram utilizados termos e palavras‐chave relevantes do Medical Subject Headings (MeSH). Esses termos foram adaptados de acordo com a base de dados específica. Os seguintes termos foram empregados para garantir uma pesquisa abrangente: “Hair regrowth”, “Hair restoration”, “Hair regeneration”, “Hair Growth”, “Alopecia”, “Baldness”, “Hair Loss”, “Hair Losses”, “Loss, Hair”, “Losses, Hair”, “Alopecia, Male Pattern”, “Male Pattern Alopecia”, “Baldness, Male Pattern”, “Male Pattern Baldness”, “Female Pattern Baldness”, “Baldness, Female Pattern”, “Androgenetic Alopecia”, “Pattern Baldness”, “Baldness”, “Pattern”, “Androgenic Alopecia”, “Alopecia, Androgenic”, “Alopecias, Androgenic”, “Pseudopelade”, “Alopecia Cicatrisata”, “Alopecia Cicatrisatas”, “Platelet‐Rich Plasma”, “Plasma, Platelet‐Rich”, “PRP”, “thrombocyte rich plasma”, e “Randomized Clinical Trial (Publication Type)”. Com o objetivo de melhorar a sensibilidade para identificar ensaios clínicos randomizados, foram seguidas as recomendações da McGill University31 Estratégias de busca específicas para cada base de dados utilizada neste estudo podem ser encontradas no arquivo suplementar.
Seleção de estudosDois revisores independentes conduziram a avaliação dos títulos e resumos de todos os relatos de ensaios clínicos identificados. O estudo cego foi garantido, com cada revisor desconhecendo as decisões tomadas pelo outro. Quando possível, os estudos que atendiam os critérios de inclusão foram selecionados para avaliação posterior. Nos casos de divergência entre os revisores, um terceiro revisor foi chamado para tomar a decisão final quanto à inclusão ou exclusão do estudo. O software Rayyan foi utilizado para facilitar o processo de seleção, principalmente para leitura e avaliação dos títulos e resumos.
Extração de dadosCada revisor realizou a extração dos dados de forma independente, sem acesso à extração do outro revisor. Os seguintes dados foram extraídos dos estudos selecionados: autor, ano, local, comparador, desenho do estudo, tamanho da amostra, tempo de seguimento, método de preparo do PRP, medidas de densidade e diâmetro dos cabelos e fontes de financiamento. Uma planilha Excel predefinida foi utilizada para registrar os dados extraídos por cada revisor.
Avaliação da qualidade metodológica dos artigos selecionados para revisão sistemáticaA avaliação do risco de viés foi realizada utilizando a ferramenta RoB‐2 fornecida pela Cochrane. Essa ferramenta avalia possíveis vieses em cinco domínios, incluindo randomização, intervenção pretendida, dados ausentes, medidas de desfecho e relato de resultados.32 O método GRADE foi empregado para avaliar a força da recomendação para a intervenção.33
Análise de dadosOs estudos incluídos foram agrupados com base nas características fornecidas na tabela 1. Os dados extraídos foram sintetizados qualitativamente e registrados em planilha dedicada. Para os estudos que forneceram a média e o desvio padrão (DP) dos desfechos de interesse, foi realizada uma metanálise de efeitos aleatórios utilizando o método de máxima verossimilhança restrita. Quando esses dados estavam ausentes, os autores foram contatados. Se os autores não respondessem, mas houvesse dados suficientes para estimar a média e o DP, o estudo era incluído na metanálise. O tamanho do efeito e o intervalo de confiança de 95% (IC95%) foram calculados pela diferença média. A heterogeneidade estatística foi avaliada pela estatística I2, com valores abaixo de 25% considerados baixos, entre 25% e 50% moderados, e acima de 50% altos. A análise de subgrupos e a metarregressão foram realizadas com base no uso de ativador pré‐aplicação, gênero, desenho do estudo, risco de viés e método de centrifugação seguindo o modelo metanalítico mencionado anteriormente. O pacote estatístico STATA® versão 16 foi utilizado para análise dos dados. O gráfico de funil seguido do teste de Egger foi elaborado para avaliar assimetria e viés de publicação.
Características dos estudos
| Características | Amostra (n) | % |
|---|---|---|
| Desenho | ||
| Grupo de comparação entre sujeitos | 8 | 57,14% |
| Grupo de comparação intra‐sujeitos | 6 | 42,86% |
| Uso de ativador | ||
| PRP ativado | 7 | 50,00% |
| PRP não ativado | 7 | 50,00% |
| Localização geográfica | ||
| América | 5 | 35,71% |
| Ásia | 4 | 28,57% |
| África | 2 | 14,29% |
| Oceania | 0 | |
| Europa | 3 | 21,43% |
| Aumento da densidade capilar | ||
| Sim | 13 | 92,86% |
| Não | 1 | 7,14% |
| Aumento do diâmetro capilar | ||
| Sim | 5 | 35,71% |
| Não | 2 | 14,29% |
| Não medido | 7 | 50,00% |
| Ano de publicação | ||
| Antes de 2019 | 5 | 35,71% |
| 2019‐2023 | 9 | 64,29% |
| Alopecia de alto grau (Estágio > IV NH e > II Ludwig) | ||
| Incluído | 9 | 64,29% |
| Excluído | 5 | 35,71% |
Gressenberger P:34 O intervalo interquartil (IIQ) foi calculado a partir do intervalo relatado como intervalo/4. Esse valor do IIQ foi então utilizado para estimar o DP de acordo com a relação da regra empírica do IIQ/1,349. A mediana foi usada como estimativa pontual inicial da média. A partir dessas estimativas, a variância foi determinada como o quadrado do DP. Por fim, IC de 95% foi colocado em torno da média estimada utilizando uma distribuição t, com graus de liberdade com base no tamanho da amostra. Esse processo possibilita a quantificação aproximada da média e da variação com base em estatísticas resumidas limitadas quando o conjunto de dados completo não está disponível para cálculo direto.
Chuah SY:35 Os valores de densidade capilar aos seis meses foram calculados tomando os valores basais e adicionando ou subtraindo os valores relatados para as diferença. Os DP também foram ajustados para acomodar a variabilidade das diferenças entre os grupos. Especificamente, as médias da linha basal e o DP foram utilizados como ponto de partida. Em seguida, a diferença nas médias foi adicionada ou subtraída com base no fato de a diferença ser positiva ou negativa. O DP da diferença também foi adicionado ao DP basal ou subtraído do mesmo. Isso permitiu determinar toda a gama de valores, incorporando ao mesmo tempo a variabilidade representada pelo IC. O DP foi calculado por: DP=√(DP basal+DP da diferença).
Dubin DP:36 O intervalo basal foi usado para estimar o DP para cada grupo de acordo com a fórmula do intervalo/4 * (tamanho da amostra/(tamanho da amostra−1)). A diferença média basal foi então adicionada à média da linha de base original para calcular a média estimada pós‐tratamento. Considerou‐se que o DP da linha de base se aplicava após o tratamento. Finalmente, um IC de 95% foi colocado em torno de cada média estimada pós‐tratamento usando a distribuição t, com graus de liberdade com base no tamanho da amostra e no DP estimado. Esse processo permitiu a estimativa das principais métricas após a intervenção com base apenas nos dados basais resumidos e nas diferenças médias de tratamento relatadas para cada condição experimental.
Rodrigues BL:37 Os dados da figura 1 foram extraídos com WebPlotDigitizer (Ankit Rohatgi, versão 4.6, 2022). Em seguida, a média e o DP foram calculados com base nos trabalhos de Luo et al. e Shi et al. para estimar a média e o DP do tamanho da amostra, valor mínimo, primeiro interquartil, mediana, terceiro interquartil e valor máximo.38,39
Não foi possível estimar ou recuperar dados de Siah et al.; portanto, esse relato foi incluído apenas na síntese qualitativa, sem participação no modelo de metanálise.40
Protocolo de pesquisaO protocolo de pesquisa foi registrado na base de dados PROSPERO (International Prospective Register of Systematic Reviews) sob número de registro CRD42023407334.
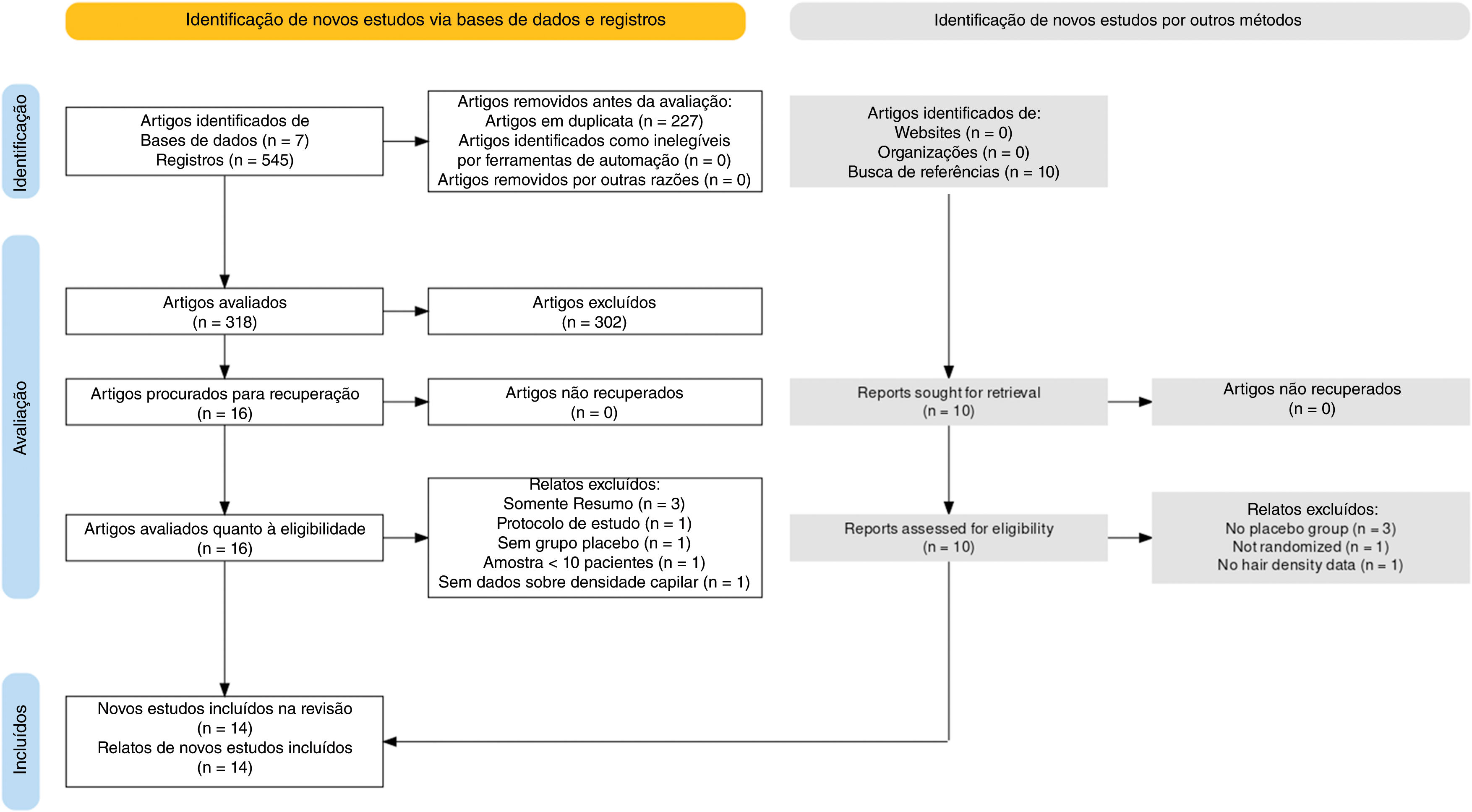
ResultadosEstudos selecionadosApós uma pesquisa abrangente nas bases de dados, foram identificados 545 artigos. Desses, foram removidos 227 estudos em duplicata, restando 318 artigos para avaliação de texto completo. Após cuidadosa triagem das referências, dez artigos também foram adicionados. Desses, 26 artigos eram potencialmente elegíveis para inclusão. Todos os relatos foram recuperados. Por fim, 14 artigos foram incluídos na síntese qualitativa.34–37,40–49 Entre os estudos incluídos, 13 forneceram dados suficientes para síntese quantitativa por meio de metanálise. É importante observar que alguns estudos tiveram média e DP estimados como explicado na seção de métodos. O Material Suplementar contém a lista dos artigos excluídos. A figura 1 apresenta o fluxograma PRISMA.
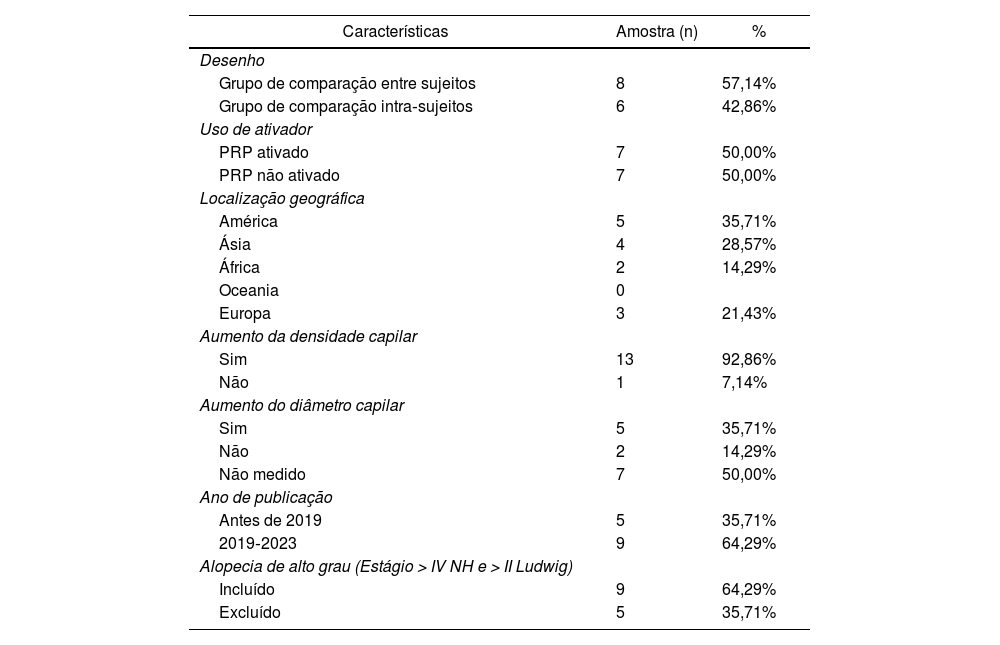
A revisão incluiu 431 participantes, dos quais 319 sujeitos foram submetidos à intervenção PRP e 310 indivíduos receberam placebo. Participantes intra‐sujeitos foram considerados em ambos os grupos. A maioria dos ensaios clínicos randomizados foi realizada após 2019 e utilizou comparações entre indivíduos. Metade utilizou ativadores de pré‐aplicação e os estudos incluíram pacientes com todos os graus de alopecia. A tabela 1 resume as características dos estudos incluídos.
A maioria dos estudos utilizou o dispositivo Trichoscan e fotos dos pacientes para auxiliar na análise e medida da densidade capilar como desfecho. Em relação à aplicação do PRP, a maioria dos estudos administrou injeções mensais a uma taxa de 0,1–0,2mL/cm2, embora Tawfik et al. tenham obtido melhores resultados com injeções semanais.41 O método de obtenção e aplicação do PPR é apresentado para cada estudo na tabela 2.
Resumo dos estudos
| Autor e Ano | Financiamento | Desenho do estudo | Comparador | Amostra | Tempo de seguimento | Método de aplicação do PRP | Resultados |
|---|---|---|---|---|---|---|---|
| Shapiro, 2020 | Regen Labs SA (Le Mont‐sur‐Lausanne, Suíça) | Ensaio clínico randomizado, metade do couro cabeludo, intra‐sujeito | Controlado por placebo (solução salina) | 35, 17 mulheres e 18 homens | Uma aplicação por mês durante 3 meses, os resultados foram medidos um mês após o término do tratamento. 0,1–0,2 mL/cm2 de PRP utilizado | 10 mL de sangue centrifugado a 1.500 g, utilizando gel tixotrópico para preparar aproximadamente 5 mL de PRP | ↑ Densidade capilar (DNSEG); ↑ diâmetro capilar (DNSEG) |
| Gressenberger, 2020 | Estudo piloto unicêntrico, randomizado e cego entre sujeitos | Controlado por placebo (solução salina) | 30 homens. 20 PRP e 10 placebo | Foram realizados cinco tratamentos com 0,1 mL/cm2 de PRP, em intervalos de quatro a seis semanas. Densidade capilar medida no início do estudo, quatro semanas e seis meses após o tratamento | 20 mL de sangue coletado em tubo contendo citrato de sódio, utilizando um único procedimento de rotação (2.800 rpm por 9 minutos) | ↓ Densidade capilar (DNSEG); ↓ diâmetro capilar | |
| Siah, 2020 | Recebeu financiamento irrestrito de RepliCel Life Sciences Inc, Vancouver, Canadá | Randomizado, intra‐sujeito | Controlado por placebo (solução salina) | 10, 9 mulheres e 1 homem | Foram utilizadas cinco injeções com intervalo de duas semanas cada, 0,1 mL/cm2 de PRP. Medida no início do estudo, após quatro semanas (antes da 3ª aplicação) e oito semanas após o final do tratamento | 20 mL de sangue venoso foram centrifugados a 300 g a 18°C por cinco minutos, o PRP1 foi transferido e centrifugado a 700 g a 18°C por 17 minutos, e subsequentemente, o plasma pobre em plaquetas (PPP) foi removido e ressuspenso para formar PRP2 | ↑ Densidade capilar (DNSEG) |
| Singh, 2020 | Bolsa de pesquisa institucional | Ensaio de controle unicêntrico, prospectivo, randomizado, duplo‐cego, entre sujeitos | Minoxidil 5%, placebo (solução salina), minoxidil + PRP | 80. todos homens. 20 minoxidil 5%+PRP, 20 minoxidil 5%, 20 PRP, e 20 solução salina | 0,05–0,1 mL/cm2 de PRP foi injetado, tratamento realizado três vezes com intervalo de um mês entre cada um. Medida realizada antes do tratamento e documentada todos os meses durante cinco meses | 18 mL de sangue coletados em tubo de 2 mL com 2,8% de citrato de sódio. Centrifugação a 2.200 rpm por 12 minutos, separação da camada leucoplaquetária e do plasma para 2ª centrifugação a 3.000 rpm por seis minutos. Foram obtidos 3–3,5 mL de PRP que foi adicionado a uma seringa com gluconato de cálcio (1:9) como ativador | ↑ Densidade capilar (DNSEG) |
| Dicle, 2018 | Akdeniz University, Scientific Research Projects Coordination Unit, Antalya, Turquia | Estudo randomizado, controlado por placebo, cruzado entre sujeitos | Controlado por placebo (solução salina) | 25 homens G1=10, G2=15 | Aplicação mensal durante três meses, e posterior pausa de três meses. Então aconteceu o crossover e o grupo placebo recebeu PRP. Os pacientes foram avaliados três vezes: no início do estudo (M0), no 4° mês (M4) e no 9° mês (M9) | Uma amostra de 28 cc de sangue foi coletada e misturada com citrato dextrose A (ACD‐A). 30 cc foram transferidos para um tubo PRP e centrifugados a 1.700 g por 5 minutos. 5 mL de PRP foram colocados em uma seringa e ativados utilizando um bioativador antes da aplicação | ↑ Densidade capilar (DSEG) |
| Rodrigues, 2019 | Apoiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico | Estudo prospectivo piloto investigativo duplo‐cego, randomizado, entre sujeitos | Controlado por placebo (solução salina) | 26 homens. Grupo PRP (n=15) e grupo controle (n=11) | Quatro aplicações a cada 15 dias, totalizando 20 injeções. 100 uL de PRP ou solução salina por injeção, total de 2 mL. Densidade capilar medida antes do tratamento, 15 dias e três meses após o final do tratamento | O sangue foi coletado em seis tubos de citrato ácido dextrose de 8,5 mL, um tubo de ácido etilenodiaminotetracético de 4 mL e um tubo sem anticoagulante. Centrifugação a 300 g por cinco minutos a 18°C, e a fração superior (PRP1) foi separada sem perturbar a camada leucoplaquetária.O PRP1 foi centrifugado a 700×g por 17 minutos a 18°C. O pellet de plaquetas do PRP1 foi ressuspenso em 300μL de PPP (PRP2). Foram utilizados 20 mM de CaCl2 e 25 UI/mL de trombina humana ou apenas CaCl2 para ativar. Incubação a 37°C durante uma hora e a 4°C durante 16 horas. O PRP2 ativado foi recuperado por centrifugação a 3.000×g por 20 minutos a 18°C. O soro autólogo foi utilizado como ativador e preparado a partir do tubo sem anticoagulante: após centrifugação a 1.258 g por 15 minutos; 1 mL foi separado e adicionado ao PRP | ↑ Densidade capilar (Grupo 1 DNSEG; Grupo 2 DSEG) |
| Gentile, 2015 | Randomizado, cego para avaliador, intra‐sujeito | Controlado por placebo (solução salina) | 23 homens | 0,1 mL/cm2 de PRP foi aplicado mensalmente durante três meses (três injeções). A avaliação aconteceu antes do tratamento (T0), e após 2 (T1), 6 (T2), 12 (T3), 16 (T4) e 24 (T5) meses | Foram coletados 18 mL de sangue e centrifugados em dois tubos contendo citrato de sódio a 1.100 g por 10 minutos. Em seguida, o PRP autólogo que não foi ativado após a centrifugação (9 mL) foi colocado em tubos de 10 mL contendo Ca2+extraído pelo sistema Cascade‐Selphyl‐ Esforax | ↑ Densidade capilar (DSEG); | |
| Tawfik, 2018 | Randomizado, duplo‐cego, intra‐sujeito | Controlado por placebo (solução salina) | 30 mulheres | Foram realizados quatro tratamentos em cada paciente, em semanas consecutivas. As pacientes foram acompanhadas por seis meses após a última sessão | Foram coletados 10 mL de sangue, com 1,5 mL de citrato de sódio como anticoagulante. Em seguida, centrifugou‐se a 1.200 g por 15 minutos. A camada leucoplaquetária foi separada juntamente com o plasma pobre em plaquetas e centrifugada a 2.000 g por 10 minutos. O PPP foi descartado e o concentrado de plaquetas foi colocado em seringas de insulina de 1 mL contendo gluconato de cálcio na proporção de 1:9 (0,1 mL de gluconato de cálcio para 0,9 mL de PRP) | ↑ Densidade capilar (DSEG); ↑ diâmetro capilar (DSEG); | |
| Alves, 2016 | Randomizado, duplo‐cego, intra‐sujeito | Controlado por placebo (solução salina) | 25, 12 homens e 13 mulheres. 22 pacientes completaram o tratamento (11:11) | Aplicação mensal de 0,15 mL/cm2 durante três meses; os pacientes foram avaliados antes, após o segundo e terceiro tratamentos e seis meses após o término do tratamento | 18 mL de sangue foram transferidos para um tubo com 2 mL de citrato de sódio a 3,8%. Em seguida, centrifugou‐se a 460 g por oito minutos. O PPP foi descartado e foram obtidos 3 mL de PRP. O PRP foi ativado com 0,15 mL de cloreto de cálcio a 10% | ↑ Densidade capilar (DSEG) | |
| Qu, 2021 | National Natural Science Foundation of China | Randomizado, duplo‐cego, intra‐sujeito | Controlado por placebo (solução salina) | 32 homens; 20 mulheres | O PRP foi injetado em metade do couro cabeludo nas áreas de alopecia, com aplicação de 0,05 a 0,1 mL em sessão mensal ao longo de 3 m; seguimento 0, 3 m e 6 m | 40 mL de sangue no kit Tricell. centrifugação a 310 g por quatro min e adicionalmente a 300 g por 3 minutos | ↑ Densidade capilar (DSEG); ↑ diâmetro capilar (DSEG); |
| Chuah, 2021 | Randomizado, duplo‐cego, intra‐sujeito | Controlado por placebo (solução salina) | 32 homens, 18 mulheres | Quatro sessões, com intervalo de três semanas e avaliação aos 0, 3 m e 6 m | Centrifugação por cinco min a 1.500 g, tubo contendo solução de citrato de sódio como anticoagulante. Remoção do PPP. Ativação com gluconato de cálcio 1:9 | ↑ Densidade capilar (DNSEG); ↑ diâmetro capilar (DSEG); | |
| Toama, 2017 | Randomizado, entre sujeitos | Controlado por placebo (solução salina) | 40 (PRP (11 homens e 9 mulheres) (Solução salina 8 homens e 12 mulheres) | Cinco sessões (uma sessão a cada duas semanas). Avaliação em 0; 3 m e 6 m | Tubos com anticoagulante citrato de Na 3,8%. Centrifugação a 1.700 rpm por 15 minutos; nova centrifugação a 3.000 rpm por 10 minutos; PPP foi descartado e feita ativação por cloreto de cálcio 1:9 | ↑ Densidade capilar (DSEG); | |
| Dubin, 2020 | Eclipse Aesthetics, LLC | Randomizado, duplo‐cego, entre sujeitos | Controlado por placebo (solução salina) | 30 mulheres (15 PRP) | Três injeções mensais; avaliação aos seis meses | Centrifugação a 3.500 rpm durante 10 minutos e remoção do PPP. Os 4,0 mL restantes de sobrenadante foram suavemente invertidos no vacutainer sete vezes para ressuspender as plaquetas no plasma. | ↑ Densidade capilar (DSEG); ↑ diâmetro capilar (DSEG); |
| Gentile, 2017 | Randomizado, duplo‐cego, intra‐sujeito | Controlado por placebo (solução salina) | 18 homens (9 PRP) | Três injeções mensais; avaliação aos três meses | Centrifugação (1.200 rpm por 10 minutos) | ↑ Densidade capilar (DSEG); |
DNSEG, diferença não significante entre os grupos; DSEG, diferença significante entre os grupos.
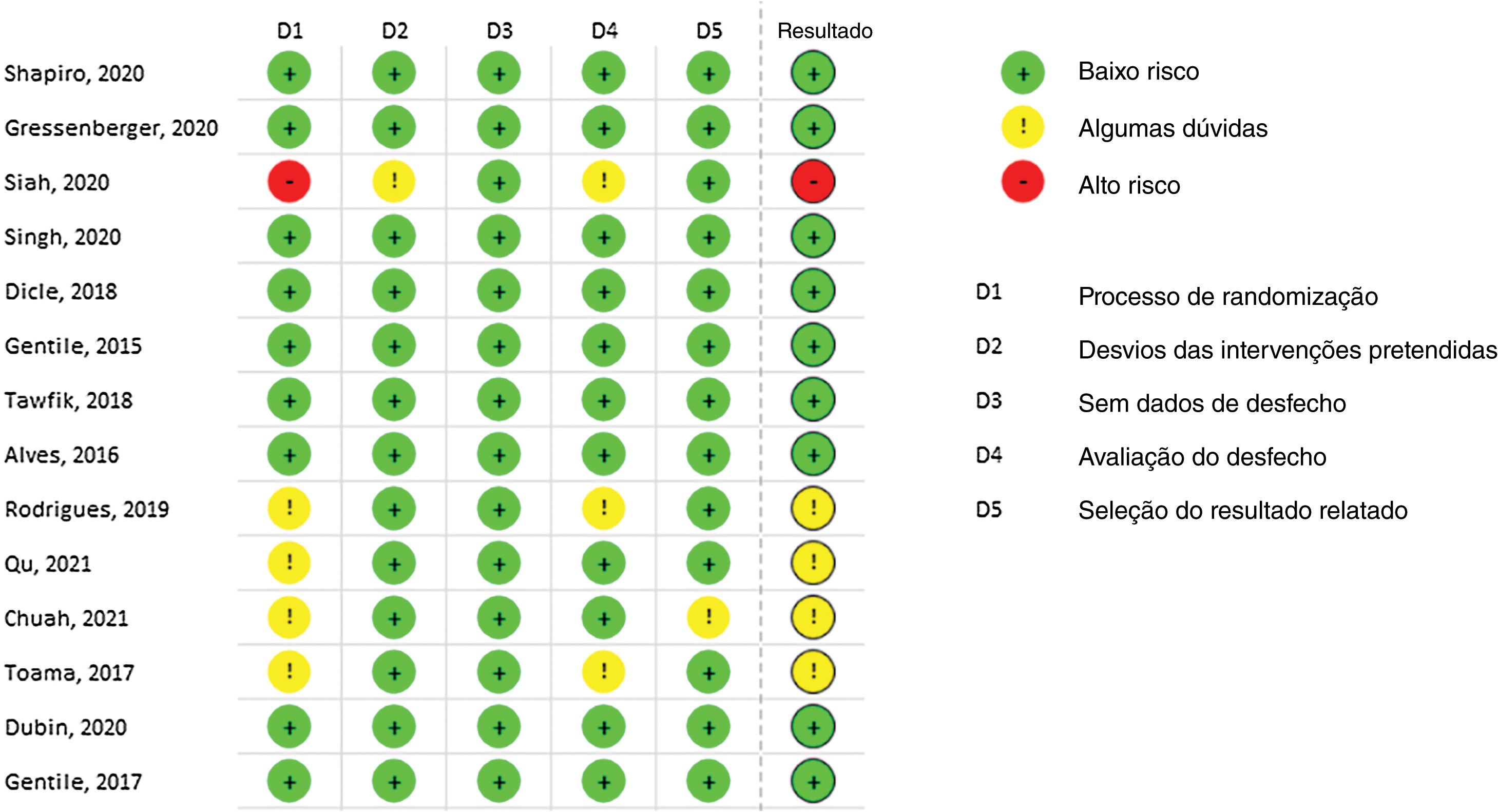
A maioria dos estudos incluídos demonstrou baixo risco de viés. No entanto, Siah et al. exibiram alto risco de viés em virtude da falta de explicação sobre o processo de randomização.40 Da mesma maneira, Rodrigues et al. apresentaram alguns riscos nos domínios 1 e 4 relacionados à randomização e medida de resultados, respectivamente.37 Qu Q, Chuah SY e Toama MA também apresentaram algumas dúvidas relacionadas à randomização, pois nenhuma informação de ocultação foi fornecida.35,48,49 A figura 2 demonstra todos os resultados do risco de viés utilizando a ferramenta RoB‐2.
Densidade capilarDos 14 estudos incluídos na síntese, 13 demonstraram melhora na densidade capilar em comparação com a linha de base pré‐tratamento. Entretanto, Gressenberger et al. relataram piora na condição dos cabelos sem diferença significante entre os grupos.34 Cerca de 57% dos estudos mostraram diferença estatisticamente significante na densidade capilar entre o grupo tratado e o grupo placebo.
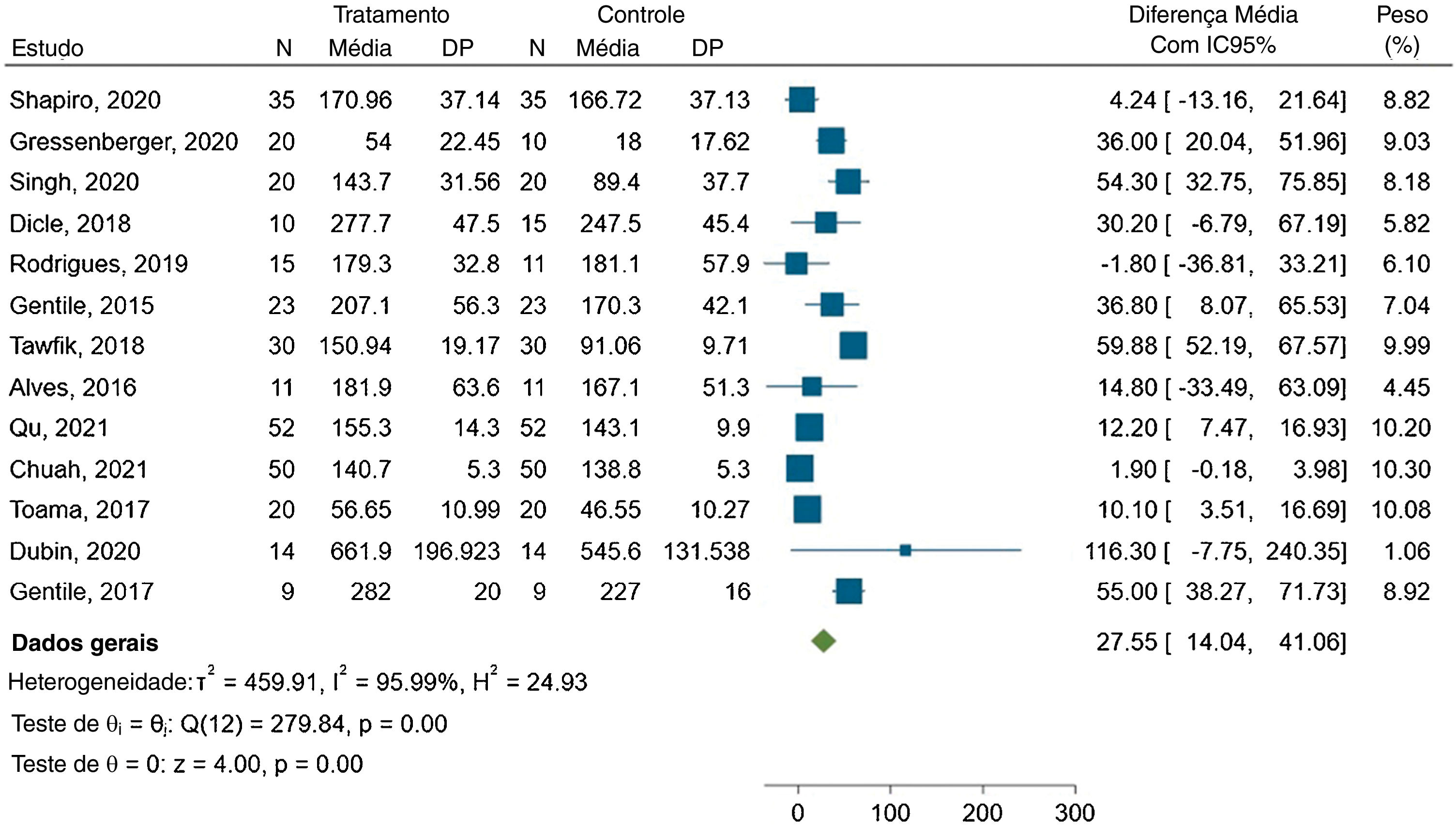
A metanálise mostrou diferença média de 27,55 fios/cm2 entre os grupos, com IC95% variando de 14,04 a 41,06. O gráfico forest plot é apresentado na figura 3.
A estatística I2 indicou alta heterogeneidade entre os estudos, com valor de 95,99% e Q(12)=279,84. Esse resultado foi estatisticamente significante (p<0,00).
Na análise de subgrupos, os relatos que utilizaram PRP ativado demonstraram diferença média ligeiramente inferior de 25,25 fios/cm2, com IC95% variando de 4,89 a 45,61, I2 de 96,78%, p<0,05 e Q(6)=225,89. Ao mesmo tempo, estudos que utilizaram PRP inativado mostraram diferença média semelhante de 29,79 fios/cm2, com IC95% variando de 11,16 a 48,41, I2 de 85,98%, p<0,05 e Q(5)=35,55.
Também foi realizada análise de subgrupo da preparação do PRP relacionada ao método de centrifugação. Ambas as preparações de centrifugação simples e dupla foram eficazes no aumento da densidade capilar (p<0,05). A análise de subgrupos também foi realizada considerando o desenho do estudo, entre ou intra‐sujeitos. As comparações entre sujeitos apresentaram diferença média de 33,72 fios/cm2, I2=78,19, IC95% de 14,04 a 49,68 (p<0,05) e Q(7)=44,20. A comparação intra‐sujeitos apresentou piores resultados, com diferença média de 19,20 fios/cm2, I2=98,46%, IC95% de−4,02 a 42,43 (p=0,10) e Q(4)=209,61. O último subgrupo foi de estudos relacionados ao gênero. Apenas dois estudos somente com mulheres apresentaram dados suficientes para metanálise, o que limita o agrupamento de dados. Estudos exclusivamente com indivíduos masculinos mostraram diferença média de 39,12, I2=53,65%, IC95% de 24,94 a 53,30 (p=0,06) e Q(5)=10,64. Os estudos mistos mostraram diferença média de 7,39, I2=73,01%, IC95% de 1,57 a 13,22 (p<0,05) e Q(4)=18,96. Alto risco de viés apresentou aumento médio da densidade capilar=7,34 n/cm2, I2=79,77%, IC95% de 0,96 a 13,73 e Q(3)=18,87. Baixo risco de viés apresentou aumento médio da densidade capilar de 39,98, I2=77,49%, IC95% de 25,09 para 54,87 e Q(8)=41,08, ambos com p<0,00. Gráficos forest plot exclusivos dos subgrupos estão disponíveis no Material Suplementar.
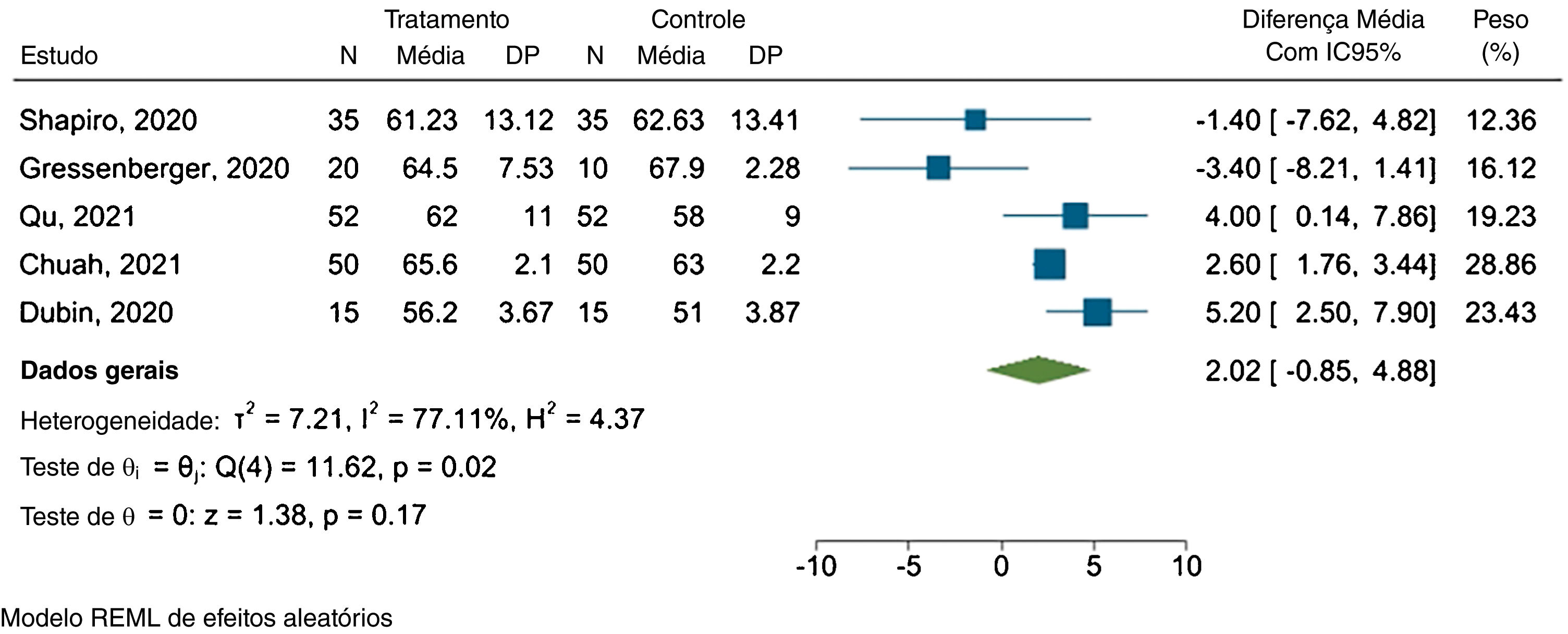
Diâmetro capilarCinco estudos forneceram dados suficientes para a metanálise. A figura 4 apresenta o gráfico forest plot.
Os resultados revelaram diferença média de 2,02μm entre os grupos tratado e placebo, com IC95% variando de −0,85μm a 4,88μm e I2=77,11% (p=0,02).
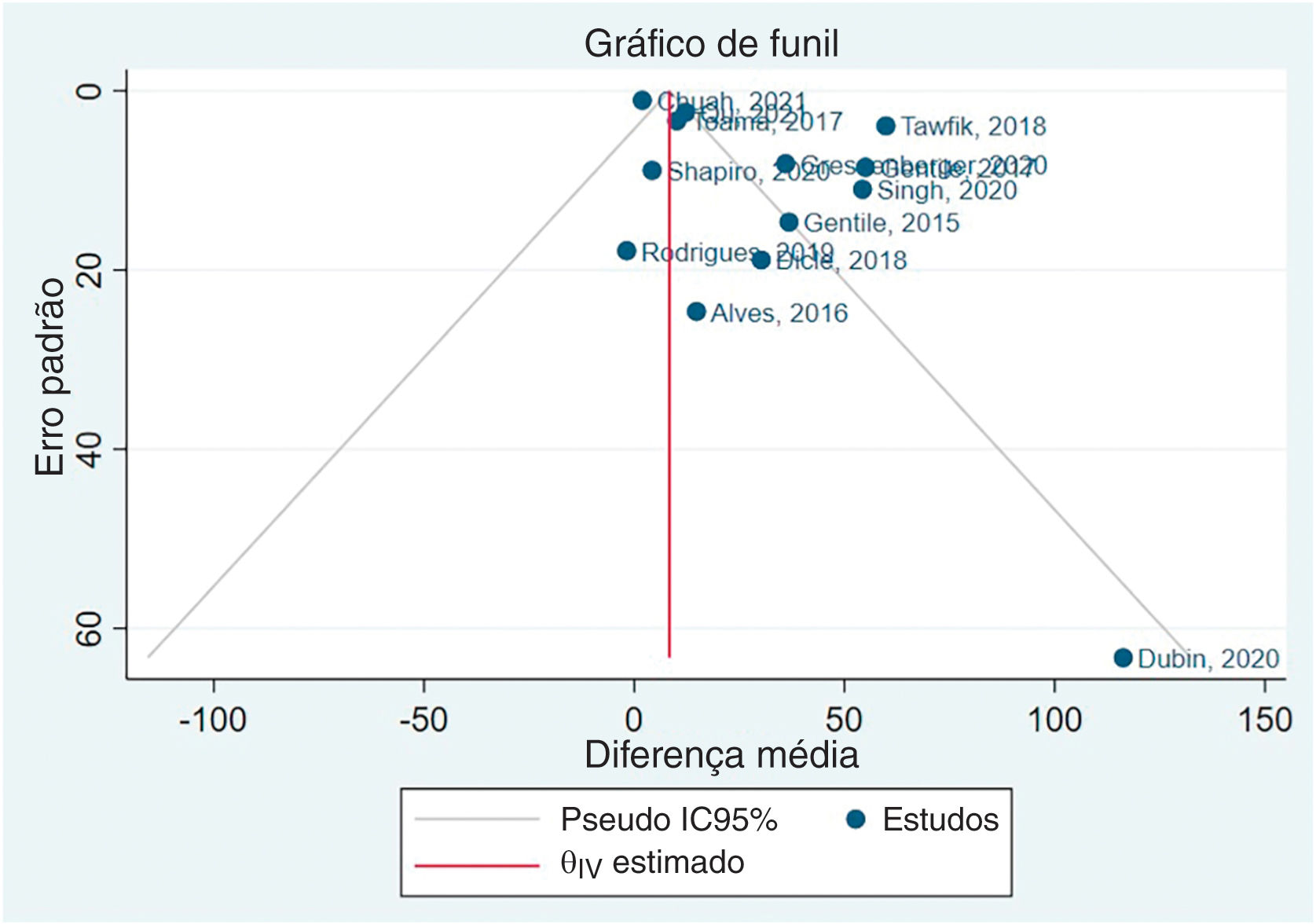
Assimetria e viés de publicaçãoO viés de publicação não foi avaliado em relação ao diâmetro capilar, pois havia apenas cinco estudos, e o Cochrane Handbook sugere um mínimo de dez estudos.50 O gráfico de funil gerado após a metanálise da densidade capilar está disponível na figura 5. A seguir, foi realizado o teste de Egger, beta1=0,83, EP de beta1=0,816, z=1,01, Prob > |z|=0,3115.
Com base nesses resultados, o coeficiente beta1 não é estatisticamente significante ao nível de 5%, uma vez que o valor de p é superior a 0,05. O erro padrão de beta1 também é bastante elevado em relação ao valor do coeficiente. Embora o teste de Egger não tenha identificado viés de publicação, os resultados de assimetria do gráfico de funil indicam clara presença de viés de publicação. O Material Suplementar apresenta gráficos de funil de subgrupos específicos.
Avaliação GradeProA análise GRADEPro GDT classificou a evidência do PRP na densidade capilar como evidência de baixa qualidade (++). Essa classificação foi baseada em um baixo risco geral de viés, alta heterogeneidade, desfechos diretos, viés de publicação e alta precisão nos resultados. Quanto ao diâmetro capilar, foi atribuída classificação de evidência de qualidade muito baixa (++). Essa classificação baseou‐se em vários fatores, incluindo um risco global grave de viés, elevada heterogeneidade, inconsistência grave, falta de desfechos diretos e imprecisão nos resultados. A avaliação pode ser vista na tabela 3.
Avaliação com GradePro
| Na alopecia androgenética, o plasma autólogo rico em plaquetas, comparado ao placebo, aumenta a densidade e a espessura capilar, em ensaios clínicos randomizados? |
| Paciente ou população: Alopecia androgenéticaSituação:Intervenção: Plasma rico em plaquetasComparação: Placebo |
| Resultados | № de participantes (estudos) Seguimento | Qualidade da evidência (GRADE) | Efeito relativo (IC95%) | Efeitos absolutos esperados | |
|---|---|---|---|---|---|
| Risco com placebo | Diferença de risco com plasma rico em plaquetas | ||||
| Aumento da densidade do cabeloavaliado com: n/cm2 | 609 (13 ECRs) | ⊕⊕◯◯ Baixoa | ‐ | MD 27,55 fios de cabelo/cm2maior (14,04 maior até 41,06 maior) | |
| Espessura capilar | 294 (5 ECRs) | ⊕⊕◯◯ Muito baixob | ‐ | MD 2,02μm maior (0,85 menor a 4,88 maior) | |
| *O risco no grupo de intervenção (e o seu intervalo de confiança de 95%) baseia‐se no risco assumido no grupo de comparação e no efeito relativo da intervenção (e no seu IC de 95%).CI, intervalo de confiança; MD, média de diferença. | |||||
| GRADE Working Group grades of evidenceQualidade alta: os autores tem muita confiança de que o verdadeiro efeito está próximo daquele da estimativa do efeito. Qualidade moderada: os autores tem confiança moderada na estimativa do efeito: é provável que o efeito verdadeiro esteja próximo da estimativa do efeito, mas existe a possibilidade de que seja substancialmente diferente. Qualidade baixa: a confiança dos autores na estimativa do efeito é limitada: o efeito verdadeiro pode ser substancialmente diferente da estimativa do efeito. Qualidade muito baixa: os autores têm muito pouca confiança na estimativa do efeito: é provável que o efeito verdadeiro seja substancialmente diferente da estimativa do efeito. | |||||
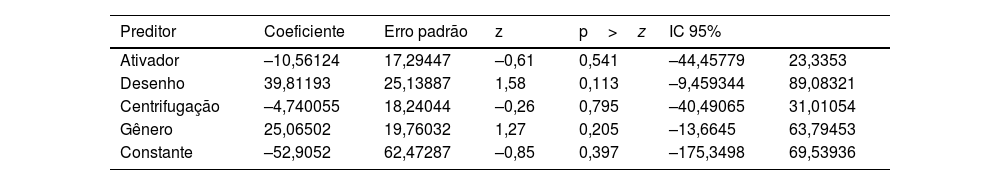
Os resultados da metarregressão podem ser encontrados na tabela 4.
Metarregressão
| Preditor | Coeficiente | Erro padrão | z | p>z | IC 95% | |
|---|---|---|---|---|---|---|
| Ativador | –10,56124 | 17,29447 | –0,61 | 0,541 | –44,45779 | 23,3353 |
| Desenho | 39,81193 | 25,13887 | 1,58 | 0,113 | –9,459344 | 89,08321 |
| Centrifugação | –4,740055 | 18,24044 | –0,26 | 0,795 | –40,49065 | 31,01054 |
| Gênero | 25,06502 | 19,76032 | 1,27 | 0,205 | –13,6645 | 63,79453 |
| Constante | –52,9052 | 62,47287 | –0,85 | 0,397 | –175,3498 | 69,53936 |
O R‐quadrado mede a proporção da variação total na variável de desfecho que é explicada pelos preditores do modelo. Nesse caso, o valor de 0,00% sugere que os preditores incluídos no modelo explicam muito pouco da variação total.
O teste Qui‐Quadrado de Wald é usado para avaliar a significância geral do modelo de metarregressão. Nesse caso, a estatística Qui‐Quadrado é 2,68 e o valor de p é 0,6134. Como o valor de p é maior que o nível de significância típico de 0,05, não houve rejeição da hipótese nula, indicando que o modelo geral não é estatisticamente significante.
DiscussãoApesar da elevada heterogeneidade, que limita o agrupamento de dados por metanálise, os resultados do presente estudo indicam que a terapia com PRP pode aumentar significantemente a densidade capilar em comparação com o placebo. As evidências obtidas dos estudos incluídos são de baixa qualidade e os estudos foram realizados em vários locais, aumentando a validade externa dos achados.
Um aspecto importante a destacar é o perfil de segurança da terapia com PRP. Nenhum efeito adverso intolerável ou de alto risco foi relatado nos pacientes incluídos nessa pesquisa. O efeito adverso mais comum observado foi dor local de curta duração, o que é consistente com estudos anteriores. Roohaninasab et al., em uma revisão que avaliou a eficácia, a segurança e os efeitos adversos da terapia com PRP, também relataram alta eficácia e baixos riscos associados à intervenção.51
Essas descobertas são encorajadoras, pois sugerem que a terapia com PRP para AAG não é apenas eficaz, mas também segura. Contudo, é essencial notar que a ausência de efeitos adversos relatados nos estudos incluídos não garante a ausência de riscos potenciais.
Mecanismo do plasma rico em plaquetasA ação do PRP no tratamento da AAG é atribuída principalmente aos fatores de crescimento e às citocinas presentes no concentrado de plaquetas. Essas substâncias bioativas desempenham papel crucial na estimulação das vias anti‐inflamatórias, angiogênicas e proliferativas.52 Os principais fatores associados ao crescimento capilar incluem o fator de crescimento endotelial vascular (VEGF), que é regulado positivamente durante a fase anágena e desempenha papel na determinação do tamanho folicular e na indução da angiogênese perifolicular; o fator neurotrófico derivado da linhagem celular glial (GDNF, do inglês glial cell line‐derived neurotrophic factor), que suprime a transição para a fase catágena e exibe um declínio na expressão ao longo do tempo durante a fase anágena; o fator de crescimento semelhante à insulina 1 (IGF‐1), que atua sinergisticamente com o GDNF para promover a proliferação de queratinócitos Ki67+ basais e prolongar a fase anágena; e fator de crescimento de fibroblastos 2 (FGF‐2), que promove a proliferação da papila dérmica e pode ser potencializado pela aplicação de adenosina ou em conjunto com nanopartículas.53–58Considerando a importância destes fatores, a regulação pré‐aplicação dos mesmos pode ser crucial para alcançar excelentes resultados. Dois estudos incluídos nesta revisão examinaram o papel dos fatores de crescimento no crescimento capilar. Siah et al. demonstraram associação significante entre GDNF e densidade capilar. Além disso, observaram tendência a correlação entre VEGF e FGF‐2, embora esse achado possa ter sido limitado pelo tamanho da amostra.40 Rodrigues et al., embora não tenham estabelecido correlação explícita entre fator de crescimento epidérmico (EGF), fator de crescimento derivado de plaquetas (PDGF), VEGF e resultados estéticos, demonstraram aumento na densidade capilar e presença de folículos em fase anágena, o que não foi observado no grupo tratado apenas com injeção de solução salina.37
Essas descobertas apoiam ainda mais a hipótese da eficácia do concentrado de plaquetas na promoção do crescimento capilar. Além disso, Gentile et al., embora não tenham estudado diretamente os fatores de crescimento, também observaram efeitos benéficos após a aplicação do PRP, incluindo espessamento epidérmico, aumento da vascularização perifolicular e aumento de queratinócitos ki67+, reforçando assim a ação do PRP.46
Qu Q, em sua análise, forneceu informações importantes sobre rotas alternativas após estudar a pelagem de ratos. Ele sugere que o tratamento com PRP pode ativar as vias de sinalização de β‐catenina, PDGF e AKT, juntamente com a supressão dos níveis de p53 para induzir o crescimento capilar.48 Isso fornece novas informações para direcionar pesquisas futuras que podem levar à melhor compreensão do crescimento capilar com PRP.
Métodos de preparaçãoA técnica ideal para preparar o PRP continua a ser um assunto de debate e investigação contínuos. Em um esforço para identificar o método de preparação mais eficaz, Stevens et al. conduziram uma revisão da literatura disponível.59 Seus achados sugeriram diversas recomendações, incluindo o uso de injeções subdérmicas em bólus para minimizar o desconforto, a incorporação de um ativador, intervalos mensais de tratamento e preparação usando o método de centrifugação única. Essas sugestões tinham como objetivo melhorar os resultados do tratamento, ao otimizar o processo de preparação do PRP.
Em contraste, a presente metanálise revelou que o uso de um ativador pré‐aplicação proporcionou aumentos ligeiramente menores na densidade capilar quando comparado ao não ativado. Esses achados indicam que a pré‐ativação do PRP antes da aplicação pode diminuir a sua eficácia na promoção do crescimento capilar. Apesar disso, a diferença encontrada é muito pequena. Portanto, recomenda‐se que estudos futuros explorem a dualidade entre pré‐ativação ou não do PRP como método de preparo.
Em contraste, o estudo de Tawfik AA utilizou abordagem diferente, com injeções mais frequentes em intervalos semanais usando o método de centrifugação dupla em mulheres com alopecia.41 Notavelmente, esse estudo demonstrou resultados excepcionais, mostrando crescimento capilar sustentado mesmo após seis meses de tratamento. Da mesma maneira, Singh et al. obtiveram resultados significantes utilizando o método de centrifugação dupla, excluindo o plasma pobre em plaquetas (PPP) e adotando aplicações mensais menos frequentes.43 Esses achados sugerem que intervalos mais curtos entre as injeções e a utilização do método de centrifugação dupla podem contribuir para melhora mais eficaz da densidade capilar. Apesar desses dados, a metanálise de subgrupos do método de centrifugação revelou maiores diferenças com a centrifugação dupla. Entretanto, a diferença foi pequena entre as duas preparações.
O desenho do estudo é de extrema importância. É interessante notar que a metanálise de subgrupos considerando comparações intra/entre sujeitos apresentou melhores resultados com desenhos entre sujeitos. Isso pode estar relacionado à disseminação do PRP no couro cabeludo, afetando áreas de aplicação de placebo em comparações intra‐sujeitos. Consequentemente, pesquisas conduzidas com esse desenho podem sugerir efeitos menores.
A última metanálise de subgrupos foi relacionada ao gênero, para explicar a alta heterogeneidade presente. Embora tenha sido capaz de reduzir a heterogeneidade, os resultados não foram estatisticamente significantes. Além disso, não foi possível verificar as alterações de indivíduo para indivíduo, limitando a capacidade de análise. Mais estudos devem ser realizados exclusivamente em cada gênero para que essa questão seja respondida.
Considerando esses achados, é evidente que vários métodos de preparação do PRP podem produzir resultados positivos. Mais pesquisas são necessárias para determinar a técnica de preparação ideal para o PRP em tratamentos de crescimento capilar. Fatores como frequência da injeção, protocolos de ativação e método específico de centrifugação empregado podem influenciar a eficácia do tratamento com PRP. Estudos futuros devem ter como objetivo comparar diferentes métodos de preparação e avaliar seu impacto nos resultados do crescimento capilar para estabelecer diretrizes mais precisas para a prática clínica.
Comparação de terapias atuaisGlobalmente, a abordagem de tratamento para AAG geralmente envolve o uso de inibidores da 5‐alfa redutase, como finasterida e dutasterida, bem como soluções tópicas contendo minoxidil, um abridor de canais de potássio sensível à adenosina 5’‐trifosfato.4,60–62 Adil A e Godwin M conduziram uma revisão sistemática e metanálise comparando os efeitos desses medicamentos com os de um placebo.63 A análise revelou diferenças médias na densidade capilar em comparação com o placebo, como mostrado a seguir: finasterida 1mg=18,37 fios/cm2, minoxidil 5%=14,94 fios/cm2 e minoxidil 2%=8,11 fios/cm2. Notavelmente, a finasterida exibiu alta heterogeneidade (I2=91%), enquanto o minoxidil demonstrou heterogeneidade não significante (I2=0%).
Na presente revisão, a terapia com PRP apresentou diferença média de 27,55 fios de cabelo/cm2 em relação ao placebo, valor superior à melhora observada com finasterida. No entanto, tanto o PRP quanto a finasterida exibiram alta heterogeneidade. Essa melhora é clinicamente relevante, pois o PRP proporciona aumento notável na densidade capilar sem a necessidade de uso diário e sem risco de efeitos colaterais indesejados. Além disso, o mecanismo de ação do PRP difere de outros tratamentos capilares, ou seja, pode ser utilizado em terapia combinada, potencializando ainda mais os resultados de crescimento capilar. Esses achados são consistentes com os resultados relatados por Gentile et al., que conduziram revisão sistemática comparando a terapia com PRP aos tratamentos convencionais, bem como com os achados de Singh et al. e Pakhomova EE, que compararam o PRP ao minoxidil e às terapias combinadas.43,64,65 As evidências sugerem que a terapia com PRP é mais eficaz do que o minoxidil isoladamente, e a terapia combinada pode oferecer eficácia ainda maior. Isso sugere que o PRP poderia ser opção de tratamento viável para AAG.
Em resumo, a terapia com PRP mostrou resultados promissores no aumento da densidade capilar em pacientes com AAG. Parece ser melhor opção de tratamento quando comparada à finasterida e pode proporcionar maior eficácia quando usada em combinação com outras terapias. Esses achados apoiam o crescente conjunto de evidências que destacam o potencial do PRP como abordagem terapêutica valiosa para o tratamento da AAG.
LimitaçõesA presente metanálise engloba os estudos mais atualizados acessíveis nesse tema. Ao incorporar as mais recentes descobertas das pesquisas, foi garantido que a presente análise reflita o estado atual do conhecimento sobre o assunto. Essa faceta tem significado substancial, especialmente em domínios em rápido desenvolvimento, no qual novas evidências podem influenciar consideravelmente as sugestões de tratamento. Foram empregados métodos estatísticos sofisticados e abordagens metodológicas para aumentar a exatidão e a confiabilidade das presentes descobertas. Por meio de técnicas de metanálise e estimativas de última geração, potenciais vieses foram mitigados e a precisão das estimativas foi aumentada.
Foi realizada investigação completa de diferentes subcategorias dentro da pesquisa abrangida. Por meio do processo de categorização dos dados de acordo com variáveis pertinentes, incluindo idade, gênero, método de centrifugação e ativador, foi possível investigar com sucesso possíveis disparidades no impacto do tratamento em diversas populações. Essa análise de subgrupos produz perspectivas valiosas sobre a diversidade dos achados e auxilia na identificação de atributos específicos dos pacientes que podem impactar os resultados do tratamento.
Há uma enorme heterogeneidade evidente na gravidade da AAG entre os estudos. Como mostrado na tabela 1, nove artigos incluíram AAG de alto grau e cinco incluíram apenas pacientes com situações menos graves. A heterogeneidade pode ser atribuída tanto à seleção dos pacientes quanto ao método de medida, nos quais não há especificação nos estudos se a densidade capilar total ou a densidade capilar terminal foi medida. É importante notar que alguns dos estudos relatados, como o de Rodrigues et al., apresentaram diferenças na densidade basal do cabelo entre os grupos. Isso certamente influenciou nos resultados finais, pois o grupo PRP de fato apresentou aumento maior, mas não conseguiu impactar o suficiente para superar a diferença anterior entre os grupos. Portanto, pesquisas futuras devem se concentrar na estratificação dos grupos de gravidade da AAG para obter mais evidências sobre a eficácia do PRP.
Apesar do rigoroso processo de pesquisa realizado em múltiplas bases de dados e da inclusão de literatura cinzenta, é possível que alguns estudos relevantes tenham sido perdidos, o que poderia introduzir potenciais vieses nos resultados.
Outra limitação importante a considerar é a inclusão de estudos intra‐sujeitos, que podem introduzir fatores de confusão. O efeito de disseminação sistêmica local da dispersão do PRP e o impacto potencial do agulhamento regional nas vias de regeneração celular poderiam influenciar os resultados observados, como sugerido pela metanálise de subgrupos. Esses fatores devem ser levados em consideração na interpretação dos resultados.42,66
Além disso, vale ressaltar que a heterogeneidade observada entre os estudos incluídos, indicada pelos elevados valores de I2, também pode contribuir para limitações na obtenção de conclusões definitivas. Apesar dos esforços dos autores em agrupar estudos para minimizar a heterogeneidade e possibilitar explorações adicionais, os estudos incluídos têm amostras pequenas, diferem nos protocolos de PRP e apresentam diferentes tempos de seguimento. As variações na contagem final de plaquetas após a centrifugação são outro tema de destaque, já que a maioria dos métodos de centrifugação não coincide nos estudos, com inúmeras variações no tempo e nas rotações por minuto. A gravidade da AAG nos estudos variou até dentro dos mesmos grupos, promovendo maior variabilidade. A abordagem de dados no presente estudo também pode ter sido influenciada pelas diferenças anteriores presentes nos grupos em relação à gravidade da AAG, pois estudos como o de Rodrigues et al. apresentaram evidente crescimento de cabelos no grupo PRP, mas não grande o suficiente para suprimir a diferença em relação ao grupo controle, que não apresentou evidente crescimento de cabelos. Essas variações no desenho dos estudos, nas características dos pacientes e nos métodos de preparação do PRP certamente influenciam os resultados do tratamento e introduzem fontes potenciais de viés. Além disso, há evidências claras de viés de publicação, como demonstrado pela assimetria no gráfico de funil.
Para mitigar essas limitações, pesquisas futuras nessa área devem buscar amostras maiores, protocolos padronizados e períodos de seguimento mais longos. Além disso, a realização de mais estudos com desenho de ensaio clínico randomizado melhoraria a qualidade da evidência e permitiria avaliação mais abrangente da eficácia e segurança da terapia com PRP para AAG.
De maneira geral, embora esta revisão sistemática forneça informações valiosas sobre as evidências atuais sobre a terapia com PRP para AAG, é importante considerar suas limitações e interpretar os resultados com cautela.
ConclusãoCom base nas evidências disponíveis em ensaios clínicos randomizados, o uso de injeções de PRP para o tratamento da AAG demonstrou eficácia no aumento da densidade capilar. No entanto, é importante notar que a qualidade das evidências está atualmente em nível baixo, e são necessários mais estudos robustos para fortalecer os resultados. Por fim, o presente estudo destaca a falta de ensaios clínicos randomizados de alta qualidade. Além disso, a alta heterogeneidade e estudos com pequeno tamanho amostral ressaltam a necessidade de ensaios bem conduzidos sobre a eficácia do PRP na AAG.
As recomendações para pesquisas futuras incluem o uso de preparações de PRP que excluam PPP, pré‐ativação do PRP antes da aplicação e consideração cuidadosa de fatores de confusão, como microagulhamento ou difusão de PRP, ao comparar resultados entre indivíduos. Além disso, estudos futuros devem investigar a frequência ideal dos intervalos de tratamento com PRP, explorar a eficácia do método de dupla centrifugação para preparação do PRP e avaliar os benefícios potenciais da combinação da terapia de PRP com outras modalidades de tratamento.
De maneira geral, embora as evidências atuais apoiem o uso de injeções de PRP para AAG, são necessárias mais pesquisas para melhorar a compreensão do seu uso ideal, melhorar a qualidade das evidências e expandir o conhecimento sobre potenciais terapias combinadas.
Suporte financeiroNenhum.
Contribuição dos autoresLucas Kieling: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do artigo ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Ana Terezinha Konzen: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do artigo ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Rafaela Koehler Zanella: Elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Denis Souto Valente: Elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Kieling L, Konzen AT, Zanella RK, Valente DS. Is autologous platelet‐rich plasma capable of increasing hair density in patients with androgenic alopecia? a systematic review and meta‐analysis of randomized clinical trials. An Bras Dermatol. 2024;99. https://doi.org/10.1016/j.abd.2024.01.002
Trabalho realizado na Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, RS, Brasil.