A estreita relação entre psoríase e doenças concomitantes é amplamente aceita. No entanto, ainda falta uma análise abrangente das comorbidades em órgãos internos na psoríase.
ObjetivoO objetivo foi apresentar o risco de comorbidades em órgãos internos na psoríase comparando‐o ao da população geral.
MétodosUma busca foi realizada nas bases de dados Pubmed, EMBASE e Cochrane para estudos que relatam comorbidades em órgãos internos na psoríase vs. na população geral. Foram avaliados estudos observacionais que atenderam aos seguintes critérios: 1) diagnóstico de psoríase; 2) desfechos cardiovasculares ou renais ou hepáticos ou respiratórios ou cerebrovasculares; 3) grupo de comparação de indivíduos sem psoríase. Riscos relativos agrupados (RRa) e intervalos de confiança de 95% (IC95%) foram calculados utilizando o modelo de efeito aleatório.
ResultadosQuinze estudos observacionais com 216.348 pacientes com psoríase e 9.896.962 indivíduos da população geral foram incluídos. A população com psoríase apresentou maior risco de comorbidades em órgãos do que a geral. Comparando‐se com a população geral, o RRa para todas as comorbidades em órgãos internos foi de 1,20 (IC 95% 1,11‐1,31) na psoríase, e o RRa foi menor em pacientes leves 0,61 (IC 95% 0,46‐0,81) do que em pacientes moderados/graves. O RRa foi de 1,20 (IC 95% 1,11‐1,30) para doenças cardiovasculares, 1,56 (IC 95% 1,20‐2,04) e 1,75 (IC 95% 1,33‐2,29) para doenças cerebrovasculares e hepáticas, respectivamente. O RRa para eventos renais e cardiovasculares coexistentes foi de 1,09 (IC 95% 1,01‐1,18). O RRa para eventos renais e cerebrovasculares coexistentes foi de 1,28 (IC 95% 0,99‐1,66). O RRa para doenças renais e hepáticas coexistentes foi de 1,46 (IC 95% 1,10‐1,94). O RRa para doenças cardiovasculares e hepáticas coexistentes foi de 1,41 (IC 95% 1,11‐1,80).
Limitações do estudoHá heterogeneidade.
ConclusãoA psoríase apresenta maior risco de comorbidades de órgãos internos únicos e múltiplos do que a população geral. O presente estudo desperta a atenção para a psoríase como uma doença inflamatória sistêmica.
A psoríase é uma doença inflamatória crônica que afeta aproximadamente 2 a 3% da população global.1–8 Acredita‐se que sua patogênese seja o resultado da interação de fatores genéticos, ambientais e imunológicos.9–11 A psoríase tem sido considerada uma doença sistêmica que pode aumentar o risco de doença cardiovascular, síndrome metabólica e outras comorbidades.12–14 O mecanismo de comorbidade da psoríase pode estar relacionado à liberação de moléculas pró‐inflamatórias durante a inflamação crônica.3,15–17 Um número cada vez maior de evidências sugere que a psoríase grave ou recidivante tende a ser uma doença inflamatória sistêmica.18,19 Estudos mostraram que 13% dos pacientes com psoríase tem cardiopatia isquêmica, 12% tem diabetes mellitus e 36% tem hipertensão arterial.20 Existem metanálises sobre a associação da psoríase com doenças únicas, por exemplo, doença pulmonar obstrutiva crônica (DPOC)21 e diabetes.22 Entretanto, não há dados de comorbidades em relação a órgãos internos, embora a estreita relação entre psoríase e doenças concomitantes seja comumente aceita, e o risco de uma única doença específica na psoríase tenha sido amplamente estudado.21,23,24 No entanto, uma análise abrangente das comorbidades em relação a órgãos internos na psoríase ainda está faltando. O objetivo do presente estudo foi investigar as diferenças entre a população com psoríase e a população geral em termos de diferentes comorbidades em órgãos internos. A análise não se limitou a valores puramente de fusão e procurou encontrar padrões de associação entre eles.
Material e métodosRevisão de literatura e estratégia de buscaEssa metanálise foi registrada no registro PROSPERO (CRD 42020211821), de acordo com as recomendações do PRISMA 2020.25 Os bancos de dados Pubmed, EMBASE e Cochrane Library foram utilizados na busca, incluindo todos os estudos desde o início desses bancos de dados até 14 de outubro de 2020. Os pesquisadores realizaram a obtenção da literatura, a seleção dos artigos, a extração de dados e a avaliação da qualidade do estudo.
A estratégia de busca incluiu uma variedade de termos relacionados à psoríase e comorbidades em órgãos internos. Os detalhes da estratégia de busca nos bancos de dados Pubmed, Embase e Cochrane Library são mostradas no material suplementar.
Seleção de estudosDe acordo com a estratégia PECO, foram incluídos artigos que atenderam aos seguintes critérios. População: incluímos estudos que continham tanto a população com psoríase quanto a população geral. Exposição: psoríase com diagnóstico regular (sem limite de idade). Comparação: pessoas sem psoríase e do mesmo ambiente de pesquisa que aquelas com psoríase. Desfecho: os resultados do registro foram comorbidades em órgãos internos (doenças cardiovasculares, doenças renais, doenças hepáticas, doenças respiratórias, doenças do baço e doenças relacionadas ao sistema cerebrovascular). Foram excluídas as publicações com dados insuficientes e reduplicados. Restrições de tipo de estudo e idioma não foram consideradas na busca inicial.
Extração de dados e avaliação da qualidade do estudoO texto completo dos artigos que atenderam aos critérios de elegibilidade foi selecionado para extração de dados. Os dados extraídos incluíram primeiro autor, ano de publicação, país, dados demográficos, número de pacientes e tempo de seguimento. Por exemplo, a intenção era incluir estudos em que os pacientes claramente apresentavam doenças renais, como doença renal crônica etc. Além disso, estudos que não tinham nada além de dados laboratoriais anormais foram excluídos. Se um estudo fornecesse dados com diferentes tipos de psoríase (leve, moderada e grave), os mesmos eram combinados para obter uma estimativa de todos os pacientes com psoríase. Para garantir a precisão da extração de dados, qualquer diferença encontrada nos dados poderia ser abordada consultando o artigo original. A escala Newcastle‐Ottawa Quality Assessment Scale foi utilizada para avaliar a qualidade dos estudos incluídos, com escore máximo de 9 pontos, representando a mais alta qualidade. A escala avaliou a qualidade de cada estudo em três áreas, incluindo (1) recrutamento de sujeitos de caso e controle; (2) comparabilidade entre os dois grupos; e (3) identificação dos resultados de interesse. As características dos estudos e os resultados da avaliação são apresentados na tabela 1.
Análise estatísticaAs análises estatísticas foram realizadas por RevMan 5.4 (colaboração Cochrane) e Stata versão 12.0 (StataCorp LP, College Station, TX77845). Os resultados foram refletidos em risco relativo agrupado (RRa) e IC de 95%. Todos os testes estatísticos foram bilaterais. Os valores de p<0,05 foram considerados significativos. O teste de inconsistência estatística (I2) foi utilizado para avaliar a heterogeneidade. O valor de I2 igual a 0%, 25%, 50% e 75% indicou nenhuma, baixa, média e alta heterogeneidade, respectivamente. As análises de sensibilidade, análises de subgrupos e metarregressão foram realizadas para identificar fontes potenciais de heterogeneidade. Além disso, os gráficos de funil e a regressão ponderada de Egger foram usados para avaliar o potencial viés de publicação.
Os RRa e os ICs de 95% correspondentes foram estimados por meio de uma metanálise de efeito aleatório. Uma transformação logarítmica foi realizada para os RRa estimados de tamanho de efeito máximo ajustado e os ICs. Os RRa foram submetidos ao teste Z e à análise de sensibilidade e utilizados para avaliar o efeito de estabilidade combinado. O viés de publicação foi avaliado por meio de gráficos de funil. Um funil invertido simétrico indicou que não havia uma alta probabilidade de viés de publicação. Por fim, um estudo foi retirado para avaliar seu impacto na síntese. A semelhança dos RRa combinados antes e após a remoção do estudo indicou que havia um alto grau de confiança nos resultados. Quando havia heterogeneidade entre os estudos, foi aplicado o modelo de efeito aleatório e o método de análise de Mantel‐Haenszel foi utilizado.
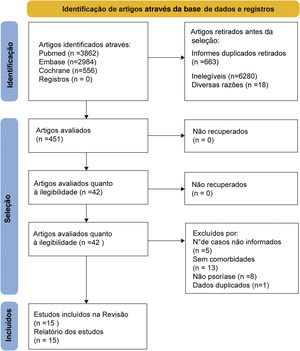
ResultadosSeleção dos estudosA estratégia de busca (fig. 1) produziu 7.412 referências potencialmente relevantes (3.862 no Pubmed, 2.984 no EMBASE e 566 na Cochrane Library). Ao final, restaram 15 estudos retrospectivos de coorte, contendo 216.348 pacientes com psoríase e 9.896.962 população em geral. Todos os estudos foram baseados em um banco de dados gerenciado, com base em códigos de diagnóstico para identificar e verificar o diagnóstico de psoríase e comorbidades em órgãos internos.
Características dos estudosAs principais características clínicas e avaliação da qualidade dos estudos incluídos estão resumidas na tabela 1. Esses estudos foram realizados em sete países: EUA, Reino Unido, Alemanha, Dinamarca, Itália, Taiwan e Coreia do Sul. A média de idade dos pacientes com psoríase variou de 12,0 a 69,5 anos, com o sexo feminino variando de 32,58 a 59,19%. Para a população geral, a média de idade variou de 12,0 a 70,6 anos e o sexo feminino variou de 22,14 a 67,42%. Apenas dois estudos não relataram a média de idade,26,27 e um estudo investigou principalmente crianças com psoríase.28 Assim, a amplitude das características etárias foi grande após a síntese dos dados. Havia poucos dados específicos de comorbidades em órgãos internos por raça/etnia. Portanto, nenhuma análise de subgrupo foi realizada em relação a essa variável.28,29
Características dos estudos incluídos: psoríase e comorbidades
| Estudo | País | Período do estudo | Fontes de dados | Média de idade, (a); sexo feminino (%) | N° de pacientes com psoríase | N° de Controles | Comorbidades específicas | NOS | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Psoríase | Controle | Todos | Comorbidades | Todos | Comorbidades | ||||||
| Ahlehoff O, 201130 | Dinamarca | 2002 ‐ 2006 | The Danish National Patient Register | 69,5 (12,1); 36,58 | 70,6 (13,5); 38,72 | 462 | 199 | 48.935 | 20.356 | DCV, DR, DP | 6 |
| Ahlehoff O, 201231 | Dinamarca | 1997.01 ‐ 2006.12 | The Danish National Patient Register | 46,1 ± 16,9; 49,72 | 43,7 ± 19,7; 49,03 | 39.558 | 530 | 4.478.926 | 55.660 | DCV, DR, DC, DP | 7 |
| Armstrong AW, 201332 | EUA | 2004 ‐ 2009 | University of California Davis | 53 (40‐63); 59,19 | 53 (40‐63); 51,11 | 2.078 | 1776 | 6.234 | 3.616 | DCV, DC, DP | 6 |
| Charlton R, 201833 | RU | 1998.01 ‐ 2014.12 | The UK Clinical Practice Research Datalink | 49 (39‐59); 50,95 | 49 (39‐59); 50,95 | 27.132 | 8444 | 27.132 | 7.051 | DCV, DC | 7 |
| Chiang CH, 201134 | Taiwan | Before 2007 | Longitudinal Health Insurance Database 2007 | 45,3 ± 17,4; 43,69 | 43,5 ± 17,4; 22,14 | 2.783 | 1066 | 13.910 | 5.145 | DCV, DR | 6 |
| Feldman SR, 201535 | EUA | 2007.01 ‐ 2012.03 | The OptumHealth Reporting and Insights claims database | 47,62; 44,50 | 47,62; 44,50 | 5.492 | 881 | 5.492 | 499 | DR, DC, DP, DH | 7 |
| Khalid U, 201536 | Dinamarca | 1997.01 ‐ 2011.12 | The Danish National Patient Register | 43,3 (15,8); 51,48 | 41,9 (19,9); 5 0,71 | 70.665 | 1292 | 5.036.959 | 105.321 | DCV, DR, DP | 7 |
| a Lee S, 201737 | EUA | 2010.11 ‐ 2015.10 | The US Department of Defense population | 48,1; 51,84 | 48,1; 51,84 | 7.249 | 2932 | 72.490 | 22.367 | CVD, DC | 7 |
| Min C, 201926 | Coreia do Sul | 2002‐2013 | The Korean National Health Insurance Service‐National Sample Cohort | NR; 43,32 | NR; 43,32 | 11.071 | 5187 | 44.284 | 20.298 | DCV, DC | 7 |
| Prasada S, 202029 | EUA | 2000.01 ‐ 2019.01 | The Northwestern Medicine Enterprise Data Warehouse | 49,72 (15,95); 51,71 | 48,60 (16,65); 57,34 | 5.365 | 1536 | 19.358 | 5.241 | DCV, DR | 7 |
| Schell C, 201538 | Alemanha | NR | Eberhard Karls University Tübingen | 48,3 ± 15,6; 43,33 | 49,1 ± 18,6; 60,00 | 300 | 158 | 300 | 150 | DCV, DR, DP, DH | 6 |
| Tollefson MM, 201828 | EUA | 2004.01 ‐ 2013.12 | Optum Laboratories Data Warehouse | 12,0 (4,4); 53,52 | 12,0 (4,4); 53,52 | 29.957 | 1200 | 29.957 | 646 | DCV, DH | 8 |
| Vena GA, 201039 | Itália | 2001‐2005 | The Health Search/Thales Database | 52,5 (16,5); 47,41 | 52,4 (16,4); 52,59 | 3.516 | 399 | 17.580 | 1.425 | DCV, DP | 6 |
| Yang YW, 201127 | Taiwan | 2006.01 ‐ 2007.12 | Longitudinal Health Insurance Database 2000 | NR, >18; 32,58 | NR, >18; 67,42 | 1.685 | 1471 | 5.055 | 3.651 | DCV, DR, DC, DP, DH | 8 |
| Yeung H, 201340 | RU | NR | The Health Improvement Network | 46 (37‐55); 49,43 | 46 (36‐55); 52,91 | 9.035 | 1945 | 90.350 | 17.502 | DCV, DR, DC, DP, DH | 6 |
NR, não relatado; NOS, Newcastle‐Ottawa Quality Assessment Scale; DCV, doença cardiovascular; DC, doença cerebrovascular; DR, doença renal; DP, doença pulmonar; DH, doença hepática; EUA, Estados Unidos; RU, Reino Unido.
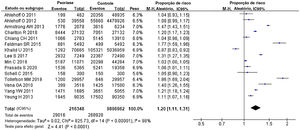
Os riscos de comorbidades em todos os órgãos internos em pacientes com psoríase e na população geral são descritos na figura 2. Foram estudados principalmente o envolvimento cardíaco, renal, pulmonar, cerebral e hepático. Em 15 estudos26–40 havia um total de 216.348 pacientes com psoríase e 9.896.962 controles. Isso demonstrou que os pacientes com psoríase tinham um risco significativamente aumentado dessas comorbidades em órgãos internos, e o RRa foi de 1,20 (IC 95% 1,11‐1,31, I2=98%, p<0,001). Após a remoção do estudo envolvendo principalmente crianças,28 o RRa foi de 1,17 (IC 95% 1,08‐1,27, I2=98%, p <0,001).
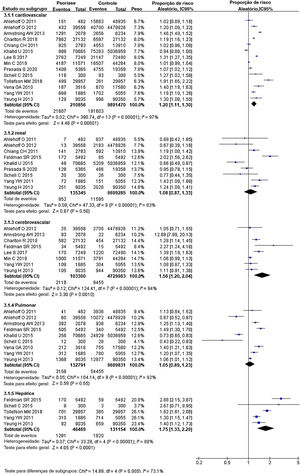
Psoríase e comorbidades específicas de órgãosEm 14 estudos,26–34,36–40 somando 210.856 pacientes com psoríase e 9.891.470 controles, o RRa para eventos cardiovasculares foi de 1,20 (IC 95% 1,11‐1,30, I2=97%, p <0,001), mostrando aumento significante na comparação com a população geral. Em nove estudos27,29–31,34–36,38,40 envolvendo 135.345 pacientes com psoríase e 9.699.285 indivíduos controle, o RRa para doenças renais foi de 1,08 (IC 95% 0,87‐1,33, I2=83%, p <0,001). Em oito estudos26,27,31–33,35,37,40 com 103.300 pacientes com psoríase e 4.729.963 indivíduos controle, o RRa de eventos de doença cerebrovascular foi de 1,56 (IC 95% 1,20‐2,04, I2=94%, p <0,001). Em nove estudos27,30–32,35,36,38,40 com 132.791 pacientes com psoríase e 9.689.831 indivíduos controle, o RRa para a ocorrência de doença pulmonar foi de 1,05 (IC 95% 0,89‐1,23, I2=92%, p <0,001). Em cinco estudos27,28,35,38,40 envolvendo 46.469 pacientes com psoríase e 131.154 controles, o RRa para a ocorrência de doenças hepáticas foi de 1,75 (IC95% 1,33‐2,29, I2=88%, p <0,001), e foi notavelmente maior do que na população geral (fig. 3).
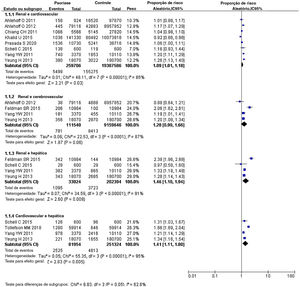
Psoríase e comorbidades em múltiplos órgãos internosPacientes com psoríase relataram sofrer de duas ou mais comorbidades simultaneamente.41–46 Portanto, foram extraídos dados de dois órgãos dos estudos incluídos e os RRa foram calculados (fig. 4). O RRa para doenças renais mais eventos cardiovasculares foi de 1,09 (IC 95% 1,01‐1,18, I2=85%, p <0,001). O RRa para doenças renais mais eventos cerebrovasculares foi de 1,28 (IC 95% 0,99‐1,66, I2=87%, p <0,001). O RRa para doenças renais mais doenças hepáticas foi de 1,46 (IC 95% 1,10‐1,94, I2=91%, p <0,001). O RRa para eventos cardiovasculares mais doenças hepáticas foi de 1,41 (IC 95% 1,11‐1,80, I2=95%, p <0,001).
Riscos de comorbidades em órgãos internos na psoríase leve e moderada/graveHavia três estudos subdividindo os pacientes com psoríase em subgrupo leve e moderado/grave.31,32,36 No total, eles incluíram 97.285 pacientes com psoríase leve e 15.016 pacientes com psoríase moderada/grave. O RRa de comorbidades em órgãos internos foi de 0,61 (IC 95% 0,46‐0,81, I2=94%, p <0,001) para psoríase leve, menor portanto do que o de pacientes com psoríase moderada/grave (fig. S1 suplementar).
Análises de sensibilidadeA sensibilidade é um importante indicador da qualidade e heterogeneidade da literatura. Um estudo foi excluído de cada vez para estimar o efeito no RRa. Não houve mudança óbvia nem diminuição significativa na heterogeneidade. As análises de sensibilidade foram realizadas para avaliar qual estudo forneceu maior heterogeneidade aos dados pelo gráfico de Galbraith. Todos os estudos mostraram resultados estáveis e confiáveis (fig. S2 suplementar). Após avaliação cuidadosa, concluiu‐se que nem todos os estudos eram sensíveis aos RRa e não podiam ser excluídos arbitrariamente. Os resultados dos escores foram avaliados pela Newcastle‐Ottawa Quality Assessment Scale para todos os estudos incluídos na tabela 1. Todos os estudos pontuaram pelo menos 6 pontos, o que está de acordo com os requisitos para a continuação do estudo. Por outro lado, o comando Metaninf do software Stata foi utilizado para avaliar o impacto de um único estudo. Após a exclusão de um estudo de cada vez, o ponto de estimativas não ficou fora do IC de 95% (fig. S3 suplementar).
Viés de publicaçãoO gráfico de funil foi utilizado para analisar o viés de publicação de 15 estudos. O resultado do gráfico mostrou um certo grau de viés de publicação. O método de Egger foi utilizado para verificar e quantificar o gráfico de funil. O valor de p foi verificado para determinar se havia viés de publicação. O valor T (p=0,854) significou que não houve viés de publicação (fig. S4 suplementar).
Qualidade dos estudosEm relação à qualidade de todos os estudos, o escore na escala NOS variou de 6 a 8. Foi determinado que seis estudos tinham baixo risco de viés, sete estudos tinham risco médio de viés e dois tinham alto risco de viés (tabela 1).
Análise de subgrupoAs análises de subgrupos foram conduzidas, incluindo regiões (países ocidentais vs. países asiáticos), período do estudo (até 2000 vs. após 2000) e financiamento (com vs. sem). A região pesquisada em três estudos foi a Ásia;26,27,34 no restante foi o Ocidente. Os resultados mostraram os países asiáticos com RRa de 1,09 (IC 95% 0,95‐1,24, I2=98%, p <0,001) e 1,24 (IC 95% 1,12‐1,37, I2=98%, p <0,001) para os países ocidentais. O I2 foi de 55,5% e o valor de p foi de 0,13 entre os subgrupos (fig. S5 suplementar).
Dois estudos não apontaram claramente a duração do estudo,38,40 e os demais foram divididos em dois grupos para discussão posterior. Os períodos de pesquisa de quatro estudos foram ao longo da década de 2000,31,33,34,36 e o RRa foi de 1,04 (IC 95% 0,89‐1,21, I2=97%, p <0,001). O RRa dos estudos restantes (após 2000) foi de 1,31 (IC 95% 1,17‐1,47, I2=99%, p <0,001). O I2 foi de 82,7% e o valor de p foi de 0,02 entre os subgrupos (fig. S6 suplementar).
Houve algumas pesquisas sem financiamento,27,32 enquanto o restante dos estudos foi financiado. A análise mostrou que o RRa de pesquisas não financiadas foi de 1,33 (IC 95% 1,10‐1,62, I2=99%, p <0,001), e o RRa de pesquisas financiadas foi de 1,18 (IC 95% 1,09‐1,29, I2=98%, p <0,001). O I2 foi de 18,7% e o valor de p foi de 0,27 entre os subgrupos (fig. S7 suplementar).
Esses resultados de análises de subgrupos, incluindo regiões (países ocidentais vs. asiáticos), período de estudo (até 2000 vs. após 2000) e financiamento (com vs. sem), não forneceram nenhuma fonte específica de heterogeneidade.
MetarregressãoDe acordo com as características dos estudos incluídos, novas variáveis concomitantes foram geradas após a atribuição de variáveis dummy de acordo com as regiões (países ocidentais vs. asiáticos), período do estudo (até 2000 vs. após 2000) e financiamento (com vs. sem). O LogRR logarítmico de RR indicador de efeito de cada estudo era variável dependente. As metarregressões foram todas realizadas (p > 0,05), mas não houve fonte de heterogeneidade.
DiscussãoO presente estudo é a primeira metanálise de risco de comorbidades relacionadas a órgãos internos em pacientes com psoríase. Esses riscos de comorbidade em órgãos internos foram consistentes com os dados publicados anteriormente em nível de doença única. Por exemplo, estudos anteriores mostraram que pacientes com psoríase tinham um risco maior de hipertensão (OR=1,58, IC 95% 1,42‐1,76),47 doença renal em estágio terminal (RR=1,29, IC 95% 1,05‐1,60),48 acidente vascular cerebral (OR=1,08, IC 95% 1,00‐1,16),49 doença hepática gordurosa não alcoólica (OR=2,15, IC 95% 1,57‐2,94),24 e DPOC (OR=1,90, 95% IC 1,36‐2,65).21 Foi observado que os pacientes com psoríase tinham um risco significativamente maior de comorbidades em órgãos internos do que a população geral. Por exemplo, o RRa de comorbidade foi de 1,20 para o órgão cardiovascular geral, 1,75 para o fígado, 1,56 para o órgão cerebrovascular, 1,08 e 1,05 para o órgão renal e órgãos pulmonares, respectivamente. Em doenças cardiovasculares, hepáticas e cerebrovasculares, os riscos de comorbidades em órgãos internos na psoríase foram acentuadamente maiores do que na população geral. Embora não houvesse diferença significativa entre pacientes com psoríase e controles em relação às doenças renais e pulmonares, os resultados também podem servir de referência para pesquisas futuras. Além disso, em comparação com pacientes com psoríase leve, foi demonstrado que pacientes com psoríase moderada/grave tinham um risco acentuadamente maior de comorbidades em órgãos internos.
Estudos anteriores mostraram que pacientes com psoríase podem sofrer de duas ou mais comorbidades simultaneamente – por exemplo, insuficiência cardíaca combinada com doença renal crônica,43 gota ou lesão renal aguda combinada com hipertensão, cirrose hepática ou doença cerebrovascular.44–46 Para descobrir esses riscos combinados de comorbidades na psoríase, foram reunidos dados de vários órgãos internos. Observou‐se que o RRa para doenças renais mais eventos cardiovasculares no mesmo paciente com psoríase era de 1,09 (IC 95% 1,01‐1,18), 1,28 (IC 95% 0,99‐1,66) para doenças renais mais eventos cerebrovasculares, 1,46 (IC 95% 1,10‐1,94).) para doenças renais mais doenças hepáticas e 1,41 (IC 95% 1,11‐1,80) para eventos cardiovasculares mais doenças hepáticas. Esses valores mostraram que os pacientes com psoríase tinham riscos significativamente maiores de comorbidades em múltiplos órgãos, não apenas comorbidades em um único órgão.
A fim de analisar melhor a relação entre os riscos de comorbidades em órgãos internos na psoríase e o ano do estudo e a região dos pacientes, foram comparados vários conjuntos de dados. Pelas características diversas dos anos incluídos nos estudos, o ano de 2006 foi considerado o ponto de demarcação, com base no princípio da busca da máxima similaridade. Seis grupos de dados significativos foram selecionados,27,30–32,35,37 e o RRa foi de 0,23 (IC 95% 0,05‐1,00, I2=100%, p <0,001) após a fusão de dados (fig. S8 suplementar). Isso sugeriu que os pacientes com psoríase após o ano de 2006 eram mais propensos a sofrer de comorbidades em órgãos internos. Como foram incluídos poucos estudos realizados no Oriente, três grupos combinados com as características dos estudos do Oriente foram utilizados para estudo comparativo.26,27,32–34,39 Após a fusão dos dados, o RRa foi de 1,73 (IC 95% 1,07‐2,77), I2=100%, p <0,001; fig. S9 suplementar). O resultado sugeriu que os pacientes asiáticos com psoríase eram mais propensos a sofrer de comorbidades em órgãos internos. Essas conclusões precisam de mais estudos para confirmação adicional.
A patogênese da psoríase e comorbidades em órgãos internos pode ser mediada por certas citocinas representativas, como interleucina‐17 (IL‐17),50–53 interleucina‐23 (IL‐23),54 e fator de necrose tumoral‐ɑ (TNF‐ɑ).55,56 Elas podem chegar a qualquer local do corpo através da circulação sanguínea e podem mediar respostas inflamatórias sistêmicas na psoríase.57–61 As citocinas inflamatórias atuam em cada sistema juntas ou isoladamente. Os efeitos são gerados pelo mesmo mecanismo molecular e via inflamatória imune. Essas questões precisam ser esclarecidas e ainda precisam de mais estudos. Na verdade, as citocinas envolvidas da patogênese de cada órgão interno podem ser as mesmas ou absolutamente diferentes. Pesquisas existentes mostram que a principal citocina inflamatória envolvida da psoríase com disfunções articulares ou diabetes é o TNF‐ɑ. 62–66 No entanto, a citocina na psoríase envolvendo o sistema cardiovascular pode ser a IL‐17 ou IL‐23.67–69 Tudo isso ainda precisa de mais investigação.
O presente estudo pode fornecer referências para tratamentos clínicos eficazes. Ultimamente, a terapia com anticorpos biológicos desempenha um papel promissor no controle da morbidade e mortalidade da psoríase. 70–75 Se os mecanismos moleculares e as citocinas‐alvo desreguladas nos órgãos internos afetados forem diferentes, então a escolha do anticorpo biológico deve ser totalmente diferente.76–80 Nenhum anticorpo biológico é uma panaceia,81–84 e deve‐se tentar fornecer aos pacientes um plano de tratamento mais individualizado de acordo com as comorbidades em órgãos internos afetados pela psoríase.
Há várias limitações em nossa metanálise. Primeiro, há heterogeneidade. Considerou‐se que a heterogeneidade era normalmente distribuída e aceitável. A heterogeneidade estatística não afetou o resultado. Observou‐se que o índice de heterogeneidade na metanálise de prevalência geral sempre foi alto e estava relacionado ao grande número de objetos de estudo e à natureza dos estudos observacionais. Nesse estudo, a análise de subgrupo e metarregressão foram realizadas para tentar encontrar a fonte da heterogeneidade. Também foi utilizado o modelo de efeitos aleatórios para abordar a potencial heterogeneidade. No entanto, cada estudo foi qualitativamente semelhante à análise de todas as comorbidades em órgãos internos e comorbidades em órgãos individuais. Em segundo lugar, algumas análises sistemáticas, metarregressão e análises de subgrupos não apresentaram um alto poder estatístico devido ao pequeno número de estudos incluídos. Deve‐se ter cuidado ao analisar esses dados. Em terceiro lugar, o tema do presente estudo é novo e não há estudos sobre comorbidades em órgãos internos na psoríase. A abordagem PECO é diferente da expressão PECO tradicional e pode causar confusão. A população do estudo incluiu o grupo de exposição mais o grupo controle, ou seja, a População contém Exposição e Comparação. Entretanto, os resultados do presente estudo ainda podem servir de referência para os médicos no manejo das comorbidades da psoríase.
ConclusõesFoi demonstrado que os pacientes com psoríase têm risco aumentado de comorbidades em órgãos internos únicos e múltiplos. Isso não foi relatado anteriormente na literatura publicada. Esses resultados sugerem que deve haver controle da inflamação sistêmica no tratamento, principalmente para pacientes moderados/graves.
Suporte financeiroEsse estudo recebeu suporte financeiro parcial da National Natural Science Foundation of China (n° 81771783, 82073444).
Contribuições dos autoresXuemei Tang: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica; manejo dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.