Existe uma necessidade óbvia de biomarcadores mais rápidos e específicos de infecções bacterianas em pacientes com psoríase pustulosa generalizada.
ObjetivoAvaliar as propriedades diagnósticas e definir valores de corte adequados de procalcitonina e proteína C‐reativa na predição de infecção bacteriana em pacientes com psoríase pustulosa generalizada.
MétodosEste estudo retrospectivo incluiu 64 pacientes com psoríase pustulosa generalizada internados entre junho de 2014 e maio de 2017. Os valores de procalcitonina, proteína C‐reativa, detalhes da infecção e outros parâmetros clínicos foram analisados.
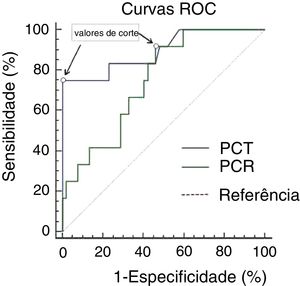
ResultadosA análise da curva característica de operação do receptor gerou áreas similares (p=0,051) sob a curva para procalcitonina (0,896; IC 95%: 0,782‐1000) e proteína C‐reativa (0,748; IC 95%: 0,613±0,883). Um valor de corte de 1,50 ng/mL para procalcitonina e 46,75mg/dL para proteína C‐reativa proporcionou a melhor combinação de sensibilidade (75,0% para procalcitonina; 91,7% para proteína C‐reativa) e especificidade (100% para procalcitonina; 53,8% para proteína C‐reativa). A procalcitonina foi significativamente correlacionada positivamente com os níveis de proteína C‐reativa tanto no grupo com infecção (r=0,843, p=0,040) quanto no grupo sem infecção (r=0,799, p=0,000).
Limitações do estudoO tamanho da amostra e o desenho retrospectivo são limitações do presente estudo.
ConclusõesOs níveis séricos de procalcitonina e proteína C‐reativa foram igualmente bem‐sucedidos na diferenciação entre infecção bacteriana e ausência de infecção em pacientes com psoríase pustulosa generalizada. Os valores de referência da procalcitonina e da proteína C‐reativa utilizados na predição de infecção bacteriana na maioria dos casos clínicos pode não ser adequado para pacientes com psoríase pustulosa generalizada109. A proteína C‐reativa apresentou melhor sensibilidade diagnóstica que a procalcitonina; no entanto, a especificidade da procalcitonina foi superior à da proteína C‐reativa.
A psoríase pustulosa generalizada (PPG) é variante rara, mas grave, da psoríase. É caracterizada por início súbito de eritema disseminado e pústulas superficiais e estéreis que podem coalescer para formar lagos de pus, acompanhadas por febre alta e hiperleucocitose, que podem resultar em morbidade e até mortalidade significativas.1 A PPG tem sido amplamente reconhecida como doença autoimune inflamatória prototípica.2 Fatores hereditários, ambientais, infecciosos e imunológicos têm sido propostos para a etiopatogênese da doença. A infecção é problema comum e uma das principais causas de mortalidade em pacientes com PPG,3 podendo levar a distúrbios imunológicos relacionados à própria doença ou às terapias imunossupressoras.4 As infecções podem ser diagnosticadas por características clínicas e culturas positivas e/ou resposta à antibioticoterapia. No entanto, um grande obstáculo na identificação da presença de infecção em pacientes com PPG é o fato de que as manifestações clínicas da infecção são bastante semelhantes às do surto da doença. Em alguns pacientes, ambas as situações – infecção e exacerbação da doença – podem coexistir, tornando o diagnóstico e a abordagem terapêutica ainda mais desafiadores. A infecção concomitante muitas vezes exige tratamento antibiótico com a redução das doses de imunossupressores; por outro lado, exacerbações da PPG requerem aumento da imunossupressão. Considerando que as terapias para infecção e para exacerbações da PPG são completamente opostas, a detecção de infecções o mais cedo possível em pacientes com PPG é crucial para a tomada de decisão da estratégia de tratamento para prevenir evoluções desfavoráveis. Portanto, um marcador simples que ajudasse a diagnosticar precocemente a infecção bacteriana em pacientes com PPG seria muito útil.
Marcadores biológicos como procalcitonina (PCT) e proteína C‐reativa (PCR) têm sido usados para distinguir as infecções bacterianas de infecções não bacterianas ou surtos da doença em algumas doenças autoimunes, como lúpus eritematoso sistêmico, doença de Behçet e púrpura de Henoch‐Schönlein, embora os resultados tenham sido controversos.5–9 A PCT é uma proteína com 116 aminoácidos e um peso molecular de 13 kDa. É a precursora na síntese de calcitonina (CT), um peptídeo regulador de cálcio que desempenha papel vital na homeostase do cálcio.10 Pesquisas anteriores observaram que os níveis séricos de PCT aumentam após a infecção bacteriana; demonstrou‐se que a PCT é um marcador útil para o diagnóstico precoce de infecção bacteriana e para avaliar a gravidade da infecção.11–14 A PCR é proteína de fase aguda, cujos níveis aumentam durante infecções, como pneumonia e sepse, e é produzida predominantemente pelas células do fígado.15,16 No entanto, do ponto de vista dos autores, não existem informações suficientes sobre a importância da PCT e da PCR no diagnóstico de infecção em pacientes com PPG. O objetivo do presente estudo foi comparar as propriedades diagnósticas de PCT e PCR para infecção bacteriana em pacientes com PPG e definir valores de corte adequados para o reconhecimento de infecção bacteriana.
MétodosPacientesOs autores primeiro revisaram o banco de dados eletrônico de 102 pacientes com diagnóstico primário de PPG de acordo com os critérios diagnósticos, entre junho de 2014 a maio de 2017.17 Os seguintes critérios de exclusão foram adotados: pacientes grávidas ou com doenças sistêmicas (hematológicas, hepáticas ou cardíacas), hiperesplenismo, hemorragia maciça aguda ou intoxicação, lesões físico‐químicas, trauma grave, história de cirurgia<1 mês, doenças autoimunes, história de ingestão de medicamentos <3 meses (hormônio glicocorticoide, agentes imunossupressores ou outros fármacos que podem influenciar a contagem de leucócitos). Pacientes com infecções bacterianas ambíguas (clinicamente suspeitas, mas sem resultados positivos na cultura), infecções não bacterianas (infecção viral e/ou fúngica) ou infecções por Mycobacterium tuberculosis também foram excluídos do estudo. Com base nesses critérios de exclusão, 64 pacientes com PPG com registros médicos completos e detalhados foram incluídos neste estudo retrospectivo. As informações dos pacientes e as amostras de sangue foram coletadas rotineiramente nas primeiras 12 horas após a hospitalização. Os valores de PCT, PCR, contagem de leucócitos, relação de neutrófilos, detalhes da infecção e outros parâmetros clínicos (incluindo sexo, idade, duração, temperatura corporal, dias de hospitalização, entre outros) dos pacientes com PPG foram registrados. O estudo foi aprovado pelo Comitê de Ética do hospital (n° 2017005).
Avaliação dos índices hematológicosA contagem de leucócitos e a relação de neutrófilos foram medidas usando um analisador hematológico automatizado (Sysmex – Kobe, Japão). Os níveis séricos de PCR e PCT foram medidos por imunoensaio nefelométrico (Beckman Coulter – Estados Unidos) e imunoensaio de eletroquimioluminescência (BRAHMS – Alemanha), respectivamente.
Definição de infecçãoO diagnóstico de infecção bacteriana foi baseado nos resultados positivos da cultura de microrganismos patogênicos. A presença de infecção foi confirmada por um teste positivo de patógenos em várias amostras (sangue, expectoração, pus, fezes, urina ou outras culturas). A infecção bacteriana foi definida como uma cultura positiva para microrganismos aeróbios ou anaeróbios, com identificação das espécies bacterianas. Uma resposta positiva à terapia antibacteriana padrão também foi usada para sustentar o diagnóstico de infecção bacteriana.
Análise estatísticaO software SPSS v. 23.0 (SPSS, Inc. – Estados Unidos) foi utilizado para a análise dos dados. As variáveis qualitativas foram avaliadas pelo teste qui‐quadrado. Variáveis quantitativas com distribuição não normal foram expressas como mediana (variação), enquanto as variáveis quantitativas com distribuição normal foram expressas como média±desvio padrão. A análise de variância foi usada para comparar as diferenças entre os grupos de distribuição normal, enquanto o teste de Mann‐Whitney foi usado entre os grupos de distribuição não normal. Curvas de característica de operação do receptor (ROC) foram mapeadas para avaliar o poder diagnóstico dos níveis séricos de PCT e PCR, determinando a área sob a curva (AUC). Sensibilidade, especificidade, valor preditivo positivo (VPP) e valor preditivo negativo (VPN) de PCT e PCR também foram calculados. Os coeficientes de correlação entre os grupos foram obtidos calculando‐se a correlação do coeficiente de Pearson (distribuição normal) ou a correlação do coeficiente de Spearman (distribuição não normal). Valores‐p <0,05 foram considerados significativos, e todos os testes foram bicaudais.
ResultadosCaracterísticas dos pacientesA tabela 1 apresenta as características demográficas e clínicas dos pacientes do estudo. Um total de 64 pacientes com PPG foram inscritos, metade do sexo masculino (n=32, 50%). Infecção bacteriana foi diagnosticada em 12 pacientes (18,75%). O grupo com infecção incluiu cinco casos de infecção do trato urinário (três casos foram Escherichia coli e um caso de Bacillus proteus e Streptococcus uberis, respectivamente), três casos de pneumonia (dois casos foram Streptococcus pneumoniae, um caso foi Haemophilus influenzae) e quatro casos de infecções bacterianas da pele e partes moles (todos os casos foram Staphylococcus aureus). Não se observou uma diferença significativa na distribuição por sexo (masculino/feminino 7/5 vs. 25/27, p=0,522); idade (49,83±14,88 vs. 39,88±16,22, p=0,057); duração (96 [24‐465] vs. 72 [1‐360], p=0,369) ou tempo de hospitalização desde o diagnóstico de PPG (13,5 [6‐20] vs. 12,5 [6‐26], p=0,782) entre os grupos de pacientes com e sem infecção. A temperatura corporal (37,4 [36,7‐38,9] vs. 36,8 [36,0‐39,2]; p=0,002) e os níveis séricos de PCR (68,35 [32,94‐162,83] vs. 45,65 [0,50‐161,95], p=0,008) e PCT (2,25 [0,12‐6,26] vs. 0,15 [0,05‐1,02], p=0,000) foram maiores no grupo com infecção do que no grupo sem infecção; essas diferenças foram estatisticamente significativas.
Características, parâmetros clínicos e índices sanguíneos de pacientes com psoríase pustulosa generalizada (PPG)
| Características dos pacientes | Grupo com infecção | Grupo sem infecção | p |
|---|---|---|---|
| Sexo | |||
| Masculino | 7 | 25 | 0,522 |
| Feminino | 5 | 27 | |
| Idade, média ± DP (anos) | 49,83 ± 14,88 | 39,88 ± 16,22 | 0,057 |
| Duração (meses), mediana (intervalo) | 96 (24‐465) | 72 (1‐360) | 0,369 |
| Infecção bacteriana | |||
| Infecção do trato urinário | 5 | ||
| Pneumonia | 3 | ||
| Infecções bacterianas da pele e das partes moles | 4 | ||
| Temperatura corporal (°C), mediana (intervalo) | 37,4 (36,7‐38,9) | 36,8 (36,0‐39,2) | 0,002 |
| Dia de hospitalização, mediana (intervalo) | 13,5 (6‐20) | 12,5 (6‐26) | 0,782 |
| Contagem de leucócitos, média ± DP (10^9/109L) | 13,27 (9,38‐23,32) | 10.01(3,27‐17,50) | 0,001 |
| Relação de neutrófilos, mediana (intervalo) | 0,79 (0,71‐0,89) | 0,78 (0,49‐0,90) | 0,092 |
| PCT (ng/mL), mediana (intervalo) | 2,25 (0,12‐6,26) | 0,15 (0,05‐1,02) | 0,000 |
| PCR (mg/L), mediana (intervalo) | 68,35 (32,94‐162,83) | 45,65 (0,50‐161,95) | 0,008 |
PCR, proteína C‐reativa; PCT, procalcitonina.
Tanto a PCT (2,25 vs. 0,15 ng/mL, p=0,000) quanto a PCR (68,35 vs. 45,65mg/dL, p=0,008) foram significativamente maiores em pacientes com infecção bacteriana em comparação com aqueles sem infecção. A análise da curva ROC gerou AUC semelhantes (p=0,051) para PCT (0,896; 95% CI: 0,782–1,000) e PCR (0,748; IC 95%: 0,613–0,883), como mostrado na figura 1 e na tabela 2. Um valor de corte de 1,50 ng/mL para PCT apresentou a melhor combinação de sensibilidade (75,0%) e especificidade (100%), com VPP e VPN de 100% e 94,5%, respectivamente. A diminuição do limiar de PCT para 0,115 ng/mL resultou em 100% de sensibilidade, mas a especificidade reduziu para 42,3%. Um nível de corte de 46,75mg/dL para PCR levou a uma combinação de 91,7% de sensibilidade e 53,8% de especificidade, com VPP e VPN de 31,4% e 96,6%, respectivamente. A diminuição do limiar de PCR para 31,67 ng/mL resultou em 100% de sensibilidade, mas a especificidade foi reduzida para 40,4%. Para atingir 100% de especificidade, o limite de PCR precisaria ser aumentado para 162,23mg/dL.
Curvas ROC de procalcitonina (PCT) e proteína C‐reativa (PCR) em pacientes com psoríase pustulosa generalizada (PPG). Curvas ROC comparando sensibilidade e especificidade dos níveis de PCT e PCR para diagnosticar infecção bacteriana (12 pacientes com infecção bacteriana e 52 sem infecção). Os valores de corte com a melhor combinação de sensibilidade e especificidade para PCT e PCR foram de 1,50 ng/mL e 46,75mg/L, respectivamente.
Propriedades diagnósticas e valores de corte adequados da procalcitonina (PCT) e da proteína C‐reativa (PCR) para o diagnóstico de infecção bacteriana em pacientes com psoríase pustulosa generalizada (PPG)
| PCT | PCR | |
|---|---|---|
| Valor de corte | 1,50 ng/mL | 46,75 mg/dL |
| Sensibilidade, % | 75 | 91,7 |
| Especificidade, % | 100 | 53,8 |
| Valor preditivo positivo, % | 100 | 31,4 |
| Valor preditivo negativo, % | 94,5 | 96,6 |
| Intervalo de confiança assintótico de 95% | 0,782–1,000 | 0,613–0,883 |
| Área sob a curva de operação do receptor | 0,896 | 0,748 |
No grupo sem infecção, PCT e PCR estavam ambas positivamente correlacionadas com a idade (r=0,930, p=0,000 para PCT; r=0,691, p=0,000 para PCR), contagem de leucócitos (r=0,835, p=0,000 para PCT; r=0,989, p=0,000 para PCR) e razão de neutrófilos (r=0,962, p=0,000 para PCT; r=0,843, p=0,001 para PCR); no entanto, a PCR (r=0,500, p=0,000), mas não a PCT (r=−0,044, p=0,730) estava positivamente correlacionada com a temperatura corporal no grupo sem infecção. No grupo com infecção, PCT (r=0,962, p=0,000) e PCR (r=0,799, p=0,000) estavam positivamente correlacionadas com a temperatura corporal; no entanto, nem a PCT nem a PCR estavam correlacionadas ou moderadamente correlacionadas (r <0,5) com a idade (r=0,281, p=0,025 para PCT; r=0,367, p=0,003 para PCR), contagem de leucócitos (r=−0,266, p=0,034 para PCT; r=0,070, p=0,584 para PCR) ou relação de neutrófilos (r=0,209, p=0,098 para PCT; r=−0,059, p=0,646 para PCR) nesse grupo. A PCT correlacionou‐se positivamente com os níveis de PCR nos grupos com (r=0,843, p=0,040) e sem infecção (r=0,799, p=0,000). A tabela 3 apresenta mais detalhes.
Correlação entre os níveis séricos de procalcitonina (PCT)/proteína C‐reativa (PCR) e parâmetros clínicos em pacientes com psoríase pustulosa generalizada (PPG)
| Grupo com infecção | Grupo sem infecção | |||||||
|---|---|---|---|---|---|---|---|---|
| PCT | PCR | PCT | PCR | |||||
| r | p | r | p | r | p | r | p | |
| Idade | 0,281 | 0,025 | 0,367 | 0,003 | 0,930 | 0,000 | 0,691 | 0,000 |
| Temperatura corporal | 0,962 | 0,000 | 0,799 | 0,000 | −0,044 | 0,730 | 0,500 | 0,000 |
| Contagem de leucócitos | −0,266 | 0,034 | 0,070 | 0,584 | 0,835 | 0,000 | 0,989 | 0,000 |
| Relação de neutrófilos | 0,209 | 0,098 | −0,059 | 0,646 | 0,962 | 0,000 | 0,843 | 0,001 |
| PCT | — | — | 0,843 | 0,040 | — | — | 0,799 | 0,000 |
Sabe‐se que pacientes com PPG são imunocomprometidos pela própria doença ou pela terapia imunossupressora concomitante; além disso, as crises podem às vezes imitar infecções, com leucocitose, febre e calafrios.4 A identificação imediata de infecção bacteriana em estágio inicial é muito importante, já que o tratamento etiológico adequado e a prevenção de terapia antimicrobiana desnecessária podem não apenas reduzir a morbidade, a mortalidade e os custos aos pacientes, como também reduzir o surgimento de bactérias resistentes a antibióticos. A cultura microbiológica leva no mínimo 24‐48 horas; além disso, culturas negativas não excluem a presença de infecção.18 Portanto, há uma necessidade óbvia de biomarcadores mais específicos de infecções bacterianas em pacientes com PPG.
A PCT, precursora do hormônio calcitonina, é produzida pelas células C da glândula tireoide ou pelas células neuroendócrinas do pulmão ou intestino em resposta a citocinas como a interleucina‐6 (IL‐6) e o fator de necrose tumoral‐alfa (TNF‐α); no sangue de pessoas saudáveis, os níveis de PCT são baixos.19,20 O nível de PCT aumenta sensivelmente durante infecções bacterianas, atingindo um platô entre 12 e 48 horas; após esse período, o nível de PCT diminui se o estímulo parar. Níveis baixos são detectados durante infecções virais ou condições febris não infecciosas.21,22 A PCR, sintetizada pelo fígado, é uma das proteínas de inflamação da fase aguda, cuja concentração inicial em indivíduos saudáveis é inferior a 1mg/L. O nível de PCR sérica aumenta seis a oito horas após a estimulação por IL‐6, com uma meia‐vida de 20 a 24 horas.23
O presente estudo demonstrou que os níveis de PCT e PCR dos pacientes com PPG no grupo com infecção foram significativamente maiores do que os do grupo sem infecção, sugerindo que tanto a PCT quanto a PCR podem ser usadas para diferenciar uma possível infecção bacteriana de uma exacerbação da PPG, o que foi confirmado pelo cálculo das AUC ROC. Com base nas AUC ROC, PCT (AUC=0,896) e PCR (AUC=0,748) tiveram um desempenho igualmente bom (p=0,051) na diferenciação entre infecção bacteriana e não bacteriana em pacientes com PPG. Os valores de corte que apresentaram a melhor combinação de sensibilidade e especificidade, usando os métodos laboratoriais indicados, foram de 1,50 ng/mL para PCT e 46,75mg/dL para PCR. Quanto a esses limiares, a PCR apresentou melhor sensibilidade (91,7%) do que a PCT (75%), mas a especificidade diagnóstica da PCT (100%) foi superior à da PCR (42,9%). Ambos os testes geraram altos VPP (94,5% para PCT e 96,6% para PCR). Portanto, esses valores de corte devem ser usados para descartar infecção bacteriana. Em consonância com os achados de registros anteriores,24,25 o estudo atual indicou que a especificidade diagnóstica da PCT na detecção de infecção bacteriana é superior à PCR em pacientes com PPG. Isso pode ser atribuído ao fato, comprovado em estudos anteriores, de que a PCT parece não ser influenciada por infecções virais, distúrbios autoimunes ou alérgicos, imunossupressores ou esteroides.26–28 No entanto, a PCR é um biomarcador de inflamação e não de infecção. Seu nível aumenta na maioria dos casos patológicos associados à inflamação, como infecções bacterianas/virais, traumas, crises de doenças sistêmicas e período pós‐cirúrgico, entre outros.29
Para “incluir” completamente pacientes com infecção bacteriana, os pontos de corte que apresentaram 100% de sensibilidade foram> 0,115 ng/mL para PCT e> 31,67mg/dL para PCR; esses valores foram maiores que os valores de referência da PCT (0,05 ng/mL) e PCR (3mg/dL) para previsão de infecção suspeita na prática clínica. Portanto, é possível que os valores de referência de PCT e PCR, aplicados à previsão de provável infecção na maioria dos casos clínicos, possam não ser adequados para pacientes com PPG. No entanto, deve‐se considerar a possibilidade de baixas especificidades (42,3% para PCT; 40,4% para PCR) e altas taxas de falsos positivos se os valores de corte de PCT e PCR com 100% de sensibilidade forem usados como marcadores para o diagnóstico de infecção bacteriana.
A literatura apresenta controvérsias em relação à correlação entre PCT ou PCR e idade na população infectada ou não infectada; o presente estudo indicou que PCT/PCR estavam moderadamente (r> 0,5) positivamente correlacionadas com a idade no grupo com infecção, mas não no grupo sem infecção (r <0,5).27,30–32 Nos presentes resultados, é importante destacar que tanto no grupo com infecção quanto no sem infecção observou‐se uma correlação positiva entre os níveis de PCR e PCT; os valores de corte de PCR e PCT para diferenciar a infecção bacteriana da exacerbação da PPG são maiores do que os de outras doenças autoimunes. Isso pode ser parcialmente explicado pelo fato de que algumas citocinas, incluindo a IL‐6, podem ser induzidas pela resposta imune de Th2da PPG, que pode estimular simultaneamente os níveis de síntese de PCT e PCR.33 A presente pesquisa também mostrou que, apenas no grupo sem infecção, PCT e PCR estavam positivamente correlacionadas com a contagem de leucócitos e a relação de neutrófilos, respectivamente. Estudos anteriores indicaram que a superregulação de leucócitos e neutrófilos são as respostas do corpo à inflamação sistêmica causada pela PPG.34 As correlações positivas entre PCR/PCT e contagem de leucócitos ou razão de neutrófilos no grupo sem infecção podem refletir tal possibilidade; assim, PCR e PCT (sem infecção), indiretamente influenciados por mediadores inflamatórios (incluindo TNF‐α e IL‐6, entre outros) poderiam ser considerados biomarcadores de inflamação na PPG. Se o paciente sofria de uma infecção concomitante, o aumento da PCR poderia ativar a via metabólica complementar clássica e se ligar às bactérias, com subsequente ativação da citotoxicidade mediada por leucócitos; assim, presume‐se que as correlações entre PCR e contagem de leucócitos/neutrófilos na condição anterior não infectada possam ser alteradas.35 Por sua vez, a PCT, que poderia ser diretamente influenciada pelas endotoxinas e lipopolissacarídeos bacterianos, não estava mais correlacionada com a contagem de leucócitos ou a relação de neutrófilos.36 Por outro lado, estudos anteriores apontaram que a PCT é produzida por diferentes tipos de células (incluindo células C da tireoide, células neuroendócrinas e células mononucleares do sangue periférico e tecidos do parênquima, entre outras) em condições fisiológicas e patológicas.37–39 No entanto, não se conhece o local da produção de PCT na PPG, nem a existência de alguma relação com os leucócitos. Além disso, não está claro se o aumento da PCT é meramente um epifenômeno ou se está relacionado à patogênese da PPG. PCR (tanto no grupo com infecção quanto no grupo sem infecção) e PCT (apenas no grupo com infecção) estavam positivamente correlacionadas com a temperatura corporal; no entanto, os resultados sobre as correlações entre PCR/PCT e temperatura corporal ainda não podem ser explicados. Portanto, mais estudos precisam ser realizados.
O presente estudo tem algumas limitações. Em primeiro lugar, seu desenho retrospectivo pode ter gerado viés de seleção. Em segundo lugar, os pacientes foram alocados para o grupo com infecção com base na cultura positiva de patógenos; portanto, existe a possibilidade de um resultado de cultura falso negativo. Quatro pacientes apresentavam suspeita clínica de infecção local, mas suas culturas foram negativas; todos esses quatro casos ambíguos foram excluídos do estudo, visando eliminar essa limitação. As técnicas de medição e os critérios diagnósticos para infecção utilizados neste estudo foram consistentes em todos os participantes. Por fim, a população amostral deste estudo foi reduzida, devido à raridade da PPG e dos critérios rígidos de exclusão adotados; o número insuficiente de pacientes em alguns subgrupos de análise dificultou a obtenção de conclusões robustas. Porém, tanto quanto é do conhecimento dos autores, não há relatos sobre as propriedades diagnósticas de PCT e PCR para infecção bacteriana em pacientes com PPG. Mais estudos, envolvendo um maior número de casos, se fazem necessários.
ConclusãoNo presente estudo, tanto a PCT quanto a PCR demonstraram ter a capacidade de diferenciar a infecção bacteriana das exacerbações da PPG. Os valores de referência de PCT e PCR aplicados à predição de infecção bacteriana na maioria dos casos clínicos podem não ser adequados para pacientes com PPG. Observou‐se uma correlação positiva entre os níveis de PCR e PCT, e os valores de corte de PCR e PCT para diferenciar a infecção bacteriana da exacerbação da PPG são maiores do que os de outras doenças autoimunes. Com base nas AUC ROC, PCT e PCR tiveram um desempenho igualmente bom na diferenciação entre infecção bacteriana e não bacteriana em pacientes com PPG. A PCR apresentou melhor sensibilidade diagnóstica que a PCT; no entanto, a especificidade da PCT foi superior à da PCR.
Suporte financeiroO estudo foi apoiado pelo Projeto de Pesquisa Clínica e Transformação Chave da Sichuan Academy (2016LZ02) e a Fundação Especial para Jovens Cientistas (2016QN15) da Sichuan Academy of Medical Sciences & Sichuan Provincial People's Hospital.
Contribuição dos autoresSiyu Wang: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Zhen Xie: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Zhu Shen: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem a todos os pacientes que participaram deste estudo.
Como citar este artigo: Wang S, Xie Z, Shen Z. Serum procalcitonin and C‐reactive protein in the evaluation of bacterial infection in generalized pustular psoriasis. An Bras Dermatol. 2019;94:542–8.
Trabalho realizado na Sichuan Academy of Medical Sciences & the Sichuan Provincial People's Hospital, Chengdu, Sichuan, China.