Kathon CG, combinação de metilcloroisotiazolinona e metilisotiazolinona amplamente empregada como conservante em cosméticos, produtos de limpeza doméstica e produtos industriais, como tintas e colas, tem emergido como importante agente sensibilizante na dermatite alérgica de contato.
ObjetivosEste estudo avaliou a reatividade a essa substância em pacientes submetidos ao teste epicutâneo no Instituto de Dermatologia em Bauru, São Paulo, de 2015 a 2017, e sua correlação com outros conservantes, atividade profissional desempenhada e localização das lesões relatadas pelos pacientes.
MétodosOs pacientes foram submetidos a testes epicutâneos com a bateria padronizada pelo grupo brasileiro de estudo em dermatite de contato.
ResultadosEntre os 267 pacientes testados, 192 (71,91%) apresentaram positividade a pelo menos uma substância e 29 (15,10%) apresentaram reação positiva ao Kathon CG, entre esses o sexo feminino foi predominante (n = 27); a principal atividade profissional foi a de limpeza (17,24%), seguida pelas áreas de estética (13,79%) e saúde (10,34%). Os alérgenos mais prevalentes foram o sulfato de níquel (56,3%), seguido por cloreto de cobalto (23,4%), neomicina (18,2%), bicromato de potássio (17,7%), thimerosal (14,5%), formaldeído (13,2%), parafenilenodiamina (9,3%) e perfume mix (8,3%).
Limitações do estudoNão temos dados de pacientes submetido ao teste epicutâneo uma década antes deste estudo, para certificarmos se a sensibilização ao Kathom CG tem ascendido.
ConclusãoAlta positividade ao Kathon CG corrobora os recentes achados da literatura, sugere maior atenção à concentração desta substância usada em cosméticos e produtos de uso doméstico.
A dermatite alérgica de contato (DAC) é um processo inflamatório mediado por mecanismos imunológicos que apresenta impacto socioeconômico significativo,1 uma vez que constitui importante causa de consultas dermatológicas e mesmo de afastamento dos pacientes de suas atividades, com grande repercussão na qualidade de vida e impacto ocupacional.
A gama de alérgenos clinicamente relevantes, os quais podem ser substâncias orgânicas e inorgânicas, naturais ou sintéticas, tem crescido especialmente nos países mais industrializados. Além disso, fatores relacionados ao estilo de vida também influenciam na ocorrência da DAC. Até 1995 estimava‐se que tínhamos no meio ambiente ao redor de seis milhões de substâncias químicas. Dessas, cerca de três mil já foram citadas na literatura médica como sensibilizantes de contato, 30 delas seriam responsáveis por 80% das ocorrências de DAC.1,2
A prevalência da DAC por um determinado antígeno depende do seu potencial sensibilizante, além da frequência e do tempo de exposição a ele. Assim, o perfil de sensibilização de uma determinada população muda constantemente à medida que a presença e exposição aos sensibilizantes alteram‐se com o tempo.3
Vários estudos salientam a importância da identificação da substância que em contato com a pele pode desencadear um quadro de DAC.4–6 Nesse contexto, trabalhos recentes têm mostrado aumento na sensibilização à substância comercialmente denominada Kathon CG ou Euxil K100,7,8 combinação de metilcloroisotiazolinona (MCI) e metilisotiazolinona (MI). Segundo Geier et al.,9 esse incremento seria devido ao aumento da sensibilização ao componente MI.
A combinação MCI/MI, composta de três partes de metilcloroisotiazolinona e uma parte de metilisotiazolinona, é amplamente usada como conservante na concentração 0,0015% (15 ppm) em cosméticos, produtos de limpeza doméstica e produtos industriais, como tintas e colas, no Brasil. Na bateria de teste padrão a substância é empregada na concentração de 0,5% em vaselina.4
Os dados do grupo americano de DAC de 2009−2010 revelaram uma frequência de 2,5% de sensibilização ao MCI/MI entre 4.032 pacientes testados. A frequência global de pacientes sensibilizados permaneceu constante em torno de 2,1% de 1998−2009, mas aumentou para 3,9% em 2011.9–11 No Brasil, Scherrer e Rocha,7 em 2014, demonstraram aumento da positividade ao MCI/MI de 2009−2012, no qual 11,14% dos pacientes mostraram positividade a essa substância, contrastando com 3,35% de positividade de 2006−2009.
Uma vez que a DAC devido ao Kathon CG (MCI/MI) é uma dermatose relativamente comum em adultos em fase produtiva e estudos têm demonstrado que a frequência de positividade a esse composto tem aumentado, consideramos relevante fazer um estudo retrospectivo dos resultados do teste de contato (patch test) feito em pacientes atendidos no Instituto Lauro de Souza Lima, Bauru (SP) para avaliar a magnitude do problema nesse serviço.
Casuística e métodoFoi efetuado um estudo retrospectivo baseado nos resultados dos testes epicutâneos feitos no serviço de imunologia do Instituto Lauro de Souza Lima, Bauru (SP) em pacientes com hipótese diagnóstica de DAC ou outra reação de hipersensibilidade tardia com impacto cutâneo considerando‐se o período de janeiro de 2015 e junho de 2017. Os seguintes parâmetros foram avaliados: sexo, idade, atividade profissional, localização das lesões e frequência de sensibilização aos elementos testados.
As substâncias testadas pertencem à bateria padrão preconizada pelo Grupo Brasileiro de Estudos em Dermatite de Contato (GBEDC‐1996),4 fabricada pela FDA‐Allergenic/Immunothec (RJ, Brasil), composta por 30 substâncias (tabela 1). Em todos os casos, foram usados contensores do tipo Finn Chambers (Oy, Finland) e as leituras foram feitas em 48 e 96 horas de acordo com os critérios do International Contact Dermatitis Research Group (ICDRG) de 1981, segundo o qual: (‐) reação negativa; reação duvidosa; (+) reação fraca, com leve eritema e algumas pápulas; (++) reação de média intensidade, com eritema, pápulas e algumas vesículas; (+++) reação intensa, com eritema, pápulas e vesículas confluentes. Não foram consideradas reações de irritação.
Bateria padrão brasileira de testes de contato preconizada pelo Grupo Brasileiro de Estudos em Dermatite de Contato, 1996
| Substance | Concentration | Substance | Concentration |
|---|---|---|---|
| Anthraquinona | 2,0% | Neomicina | 20,0% |
| Balsamo‐do‐Peru | 25,0% | Nitrofurazona | 1,0% |
| Benzocaina | 5,0% | Parabenos (2) | 12,0% |
| Bicromato de potássio | 0,5% | Parafenilenodiamina | 1,0% |
| Butil fenol‐ p‐terciario | 3,0% | Perfume‐mix (3) | 8,0% |
| Carba‐mix (1) | 3,0% | PPD‐mix (4) | 0,6% |
| Cloreto de cobalto | 1,0% | Prometazina | 1,0% |
| Colofônio | 20% | Propileneglicol | 1,0% |
| Ethilenodiamina | 1,0% | Quaternium | 2,0% |
| Formaldeido | 2,0% | Quinolina‐mix (5) | 5,0% |
| Hidroquinona | 1,0% | Resina epóxi | 1,0% |
| Irgasan | 1,0% | Sulfato de níquel | 5,0% |
| Kathon CG | 0,5% | Terebentina | 10,0% |
| Lanolina | 20,0% | Thimerosol | 0,1% |
| Mercaptobenzotiazol | 1,0% | Thiuram‐mix (6) | 1,0% |
* Todas as substâncias diluídas em vaselina sólida, com exceção do formaldeído diluído em água.
(1) Difenilguanidina, Dietilcarbamato de zinco, Dimetilcarbamato de zinco, 1% cada; (2) Mercaptobenzotiazol, Dibenzotiazol dissulfito, Morfolinilmercaptobenzotiazol, N‐ciclohexil‐2‐benzoltiazol sulfonamida, 0,5% cada; (3) Metilparaben, Etilparaben, Propilparaben, Butilparaben, Benzilparaben, 0,2% cada; (4) Eugenol, Isoeugenol, Álcool cinâmico, Geraniol, Hidroxicitronela, Aldeído alfa‐amilcinâmico, Oak moss absolute, 1% cada; (5) N‐fenil‐N‐isopropil‐p‐fenilenodiamina, N‐N‐difenil‐p‐fenilenodiamina, 0,2% cada; (6) Clioquinol, Clorquinadol, 3% cada; (7) Dissulfito de tetrametiltiuram, Monossulfito de tetrametiltiuram, 0,5% cada.
Fonte: GBEDC, 2000.
Esses dados foram inseridos em uma planilha Excel® (Microsoft®), a partir da qual foi feita a quantificação e análise descritiva dos resultados. Teste não paramétrico de qui‐quadrado foi usado para análise comparativa das proporções em relação aos estudos do grupo brasileiro de dermatite de contato4 e ao feito na Santa Casa de São Paulo durante 2006−2011.12 Foi usado um modelo de regressão logística binária para avaliar a associação da sensibilidade ao Kathon CG e o sexo e ocupação dos pacientes. A concomitância de reações positivas a diferentes substâncias conservantes foi calculada com o teste exato de Fisher. O nível de significância adotado foi de p ≤ 0,05.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Instituto Lauro de Souza Lima, Bauru (SP) (número: 2 903 882).
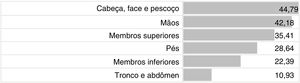
ResultadosNo período avaliado, 267 pacientes, com média de 43±16 anos, 191 (72,9%) do sexo feminino, foram submetidos ao teste alérgico de contato e, desses, 192 (71,91%) apresentaram positividade a pelo menos uma substância testada. Segmento cefálico, inclusive cabeça, face e pescoço (44,79%), mãos (42,18%) e membros superiores (35,41%) foram os locais mais acometidos (fig. 1).
Entre as substâncias testadas, a mais prevalente foi o sulfato de níquel (56,25%), seguido por cloreto de cobalto (23,43%), neomicina (18,22%), bicromato de potássio (17,70%), Kathon CG (15,10%), thimerosal (14,58%), formaldeído (13,02%), parafenilenodiamina (9,37%) e perfume mix (8,33%), conforme demonstrado na tabela 2.
Prevalência de reatividade para cada substância sensibilizante (n = 192 pacientes com testes positivos a pelo menos uma substância)
| Substâncias sensibilizantes | Número de testes | Prevalência |
|---|---|---|
| Sulfato de níquel | 108 | 56,25% |
| Cloreto de cobalto | 45 | 23,43% |
| Neomicina | 35 | 18,22% |
| Bicromato de potássio | 34 | 17,70% |
| Kathon CG | 29 | 15,10% |
| Timerosal | 28 | 14,58% |
| Formaldeído | 25 | 13,02% |
| Parafenilenodiamina | 18 | 9,37% |
| Perfume‐mix | 16 | 8,33% |
| Colofônio | 11 | 5,72% |
| Bálsamo‐do‐peru | 9 | 4,68% |
| Irgasan | 8 | 4,21% |
| Tiuran‐mix | 6 | 3,12% |
| Carba‐mix | 6 | 3,12% |
| Etilenodiamina | 5 | 2,60% |
| Parabeno‐mix | 5 | 2,60% |
| Quaternium 15 | 4 | 2,08% |
| Quinolina‐mix | 4 | 2,08% |
| Nitrofurazona | 4 | 2,08% |
| Epóxi‐resina | 4 | 2,08% |
| Lanolina | 3 | 1,56% |
| Mercapto‐mix | 3 | 1,56% |
| Hidroquinona | 2 | 1,04% |
| PPD‐“mix” | 2 | 1,04% |
| Prometazina | 2 | 1,04% |
| Benzocaína | 2 | 1,04% |
| Butil fenol para terciário | 1 | 0,52% |
| Terebintina | 1 | 0,52% |
| Antraquinona | 0 | 0 |
| Propilenoglicol | 0 | 0 |
Quando comparadas as taxas de positividade às substâncias alérgicas entre os grupos de pacientes avaliados por nós e aqueles estudados pelo grupo brasileiro de dermatite de contato (2000) e pelo grupo da Santa Casa de São Paulo (2006–2011), encontramos concomitante diferença significante de positividade aumentada para oito substâncias, as que apresentaram maior positividade foram sulfato de níquel e cloreto de cobalto (tabela 3).
Frequência de sensibilização de substâncias positivas com diferença significativa em relação a dois estudos da literatura no Brasil (Grupo Brasileiro de Dermatite de Contato[4] e da Santa Casa de São Paulo durante 2006−2011[12])
| Substância diferença significante | Estudo ILSL | GBDC 2000 | Santa Casa | Qui‐quadrado | Qui‐uadrado |
|---|---|---|---|---|---|
| % | % | % | p < 0,05 GBDC×ILSL | p < 0,05 SC×ILSL | |
| Sulfato de níquel | 56,25 | 25,1 | 28,16 | 73.4839 (p < 0,00001) | 50.9494 (p < 0,00001) |
| Cloreto de cobalto | 23,43 | 11,0 | 10,52 | 21.8247 (p < 0,000003) | 20.8348 (p < 0,000005) |
| Neomicina | 18,22 | 4,3 | 7,28 | 49.8009 (p < 0,00001) | 19.7243 (p < 0,000009) |
| Bicromato de potassio | 17,7 | 8,1 | 11,7 | 17.0606 (p < 0,000004) | 5.6508 (p < 0,017) |
| Kathon CG | 15,1 | 2,2 | 2,43 | 64.9045 (p < 0,00001) | 45.8274 (p < 0,00001) |
| Formaldeido | 13,02 | 3,8 | 3,24 | 26.747 (p < 0,00001) | 26.7292 (p < 0,00001) |
| Colofônio | 5,72 | 2,6 | 2,75 | 5.2608 (p < 0,02) | 3.8937 (p < 0,04) |
| Irgasan | 4,21 | 0,7 | 0,81 | 14.8632 (p < 0,00012) | 10.4576 (p < 0,001) |
| Total de pessoas com testes positivos | 192 | 967 | 618 |
ILSL, Instituto Lauro de Souza Lima.
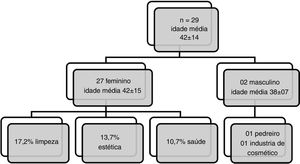
Entre os 29 pacientes que apresentaram reação positiva ao Kathon CG 93,10% eram do sexo feminino (fig. 2). As partes do corpo mais acometidas pela DAC nos pacientes sensíveis ao Kathon CG foram: mãos (58,6%), cabeça, face e pescoço (48,3%), seguidos pelos membros superiores (44,8%). A atividade profissional mais prevalente foi a de limpeza (17,24%), seguida da área estética (13,79%) e saúde (10,73%). Entre os dois indivíduos do sexo masculino com teste positivo a essa substância um era pedreiro e o outro trabalhava em indústria de cosméticos. Por meio de regressão logística binária verificamos que a positividade ao Kathon CG está relacionada ao sexo feminino (OR = 9,7; 95% IC: 1,3 a 76,9); entretanto nenhuma associação com ocupação foi observada neste estudo.
Com relação à resposta obtida na leitura deste teste, identificamos 65,5% de pacientes com possível relevância ao Kathon CG, devido à positividade estar associada ao uso do material pelo paciente.
Ao avaliar outras substâncias conservantes testadas na bateria padrão, encontramos, entre os 192 pacientes que reagiram ao teste epicutâneo, positividade de 13,02% ao formaldeído, 4,21% ao Irgasan, 2,60% ao parabeno e 2,08% ao quartenium 15. No entanto, com relação à concomitância, verificamos 27,58% de positividade ao formaldeído entre os pacientes reativos ao Kathon CG, a qual foi estatisticamente significante (p = 0,0304) e 6,89% de positividade a cada um dos outros conservantes.
DiscussãoO Kathon CG é atualmente uma das causas mais frequentes de alergia de contato a conservantes devido ao seu amplo e generalizado uso, tanto na esfera privada como na vida profissional.8,9 Nesse contexto, nosso trabalho verificou alta positividade a essa substância (15,10%) nos pacientes testados, o que está de acordo com um estudo retrospectivo feito no Brasil que mostrou 11,14% de sensibilização para MCI/MI de 2009–2012, contrastou com o período anterior (3,35%).7 Isso talvez decorra do uso largamente difundido dessa substância em cosméticos e produtos domésticos no Brasil.
Os cosméticos são produtos de uso contínuo, que eventualmente podem desencadear reações de hipersensibilidade em indivíduos geneticamente pré‐dispostos, porém a alergia não pode ser justificada apenas por fatores genéticos, é multifatorial.13,14 Assim, a maior ocorrência de positividade ao Kathon CG no sexo feminino pode ser explicada pela sensibilização decorrente do uso frequente de cosméticos, como observado no estudo de Pónyai et al. (2016).15
Desde a introdução do MCI/MI na década de 1980,1,16 esse produto manifestou‐se como um potente sensibilizador, impôs a diminuição da concentração máxima em cosméticos para 15 ppm.4 A frequência de sensibilização manteve‐se estável na Europa entre 1% a 4%17 e na Espanha entre 3% e 4%18,19 até 2008. Desde então a frequência de sensibilização duplicou e alcançou 8% em 2012 na Espanha.20 Nossos dados mostram um cifra ainda mais elevada de sensibilização (15,10%).
O local do eczema é de grande importância. Assim, a dermatite na face está geralmente relacionada com cosméticos e das mãos com fatores ocupacionais.21 Nosso estudo confirma tais dados em relação ao MCI/MI, apresenta como localizações mais frequentes as mãos, seguidas pela região da cabeça e pescoço, o que sugere a exposição a agentes causadores de alergia como xampus, cremes, produtos de limpeza (detergentes, removedores de manchas e amaciantes de roupa). Cabe aqui mencionar que o MCI/MI também está presente em fluidos metalúrgicos, tintas de parede, lacquers, tintas de impressora e colas,22 o que poderia justificar as fontes de sensibilização do paciente cujos locais acometidos eram braço e mãos e a profissão de pedreiro.
Quanto à faixa etária dos pacientes (média de 43±16 anos) é concordante com período de maior atividade profissional da população. Isso demonstra a necessidade de maior conscientização por parte da população empregada e empregadora quanto ao acompanhamento das alergias ocupacionais, seus riscos e prejuízos em longo prazo.
No presente estudo também foi comparada a alergia de contato do MCI/MI às reações apresentadas às outras substâncias conservantes presentes no teste epicutâneo. Assim, o que reforçou nossos achados, que mostram a concomitância entre as substâncias MCI/MI e formaldeído (p = 0,0304), o estudo feito por Statham et al.,23 bem como no estudo de Pontén et al.,24 tem mostrado associação entre alergias de contato a essas substâncias. A concomitância de testes positivos a esses elementos ocorre, na maioria das vezes, por cossensibilização, devido à exposição simultânea a diferentes materiais que contêm esses elementos. Nesse sentido, nossos achados refletem o comportamento do consumidor em relação aos cosméticos, bem como aos produtos de limpeza doméstica.25,26 Vale aqui ressaltar que MCI/MI e formaldeído também estão presentes em ambientes de trabalho e a sensibilização a esses agentes pode causar dermatite de contato ocupacional, às vezes por exposições inesperadas, como o caso de um dos pacientes do gênero masculino, cuja atividade profissional é a construção civil, na qual poderia entrar em contato com tinta à base de água, laca e produtos para polimento de madeira.
A partir da correta identificação dos componentes dos cosméticos e dos produtos industrializados desencadeantes das alergias, o paciente deve ser adequadamente orientado em relação ao nome químico da substância, sinônimos e produtos nos quais ocorre sua presença e principais formas de evitar a exposição.
ConclusãoNossos resultados mostram alta positividade ao Kathon CG e apoiam os recentes achados da literatura. Além do mais, sugerem maior atenção à concentração usada do composto MCI/MI em cosméticos, bem como em produtos destinados ao uso doméstico.
Suporte financeiroNenhum.
Contribuição dos autoresEliane Aparecida Silva: Análise estatística; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa.
Marcia Regina Miras Bosco: Obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Rejane Rojas Lozano: Obtenção, análise e interpretação dos dados.
Ana Carla Pereira Latini: Análise estatística; aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Vânia Nieto Brito de Souza: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Silva EA, Bosco MRM, Lozano RR, Latini ACP, Souza VNB. High rate of sensitization to Kathon CG, detected by patch tests in patients with suspected allergic contact dermatitis. An Bras Dermatol. 2020;95:194–9.
Trabalho realizado no Instituto Lauro de Souza Lima, Bauru, SP, Brasil.