Estudos clínicos demonstraram que a inibição de IL‐17A com secuquinumabe é eficaz para melhorar a pele de pacientes com psoríase e tem um perfil de segurança favorável.
ObjetivoDeterminar se o uso de secuquinumabe é eficaz e seguro para o tratamento da psoríase crônica moderada a grave com base na experiência da prática clínica.
MétodoFoi realizado um estudo retrospectivo multicêntrico em nove centros de referência avaliando pacientes com psoríase que receberam tratamento com secuquinumabe entre março de 2018 e novembro de 2020. Dados sobre características demográficas, escores do Psoriasis Area and Severity Index (PASI) e tratamentos anteriores foram coletados dos prontuários médicos. Os pacientes foram avaliados em 12, 24 e 52 semanas em relação à resposta ao tratamento e efeitos colaterais.
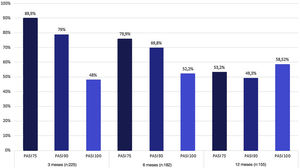
ResultadosNo total, 229 pacientes foram recrutados para o estudo. Uma melhora no escore do PASI de ≥ 90 pontos em relação à linha basal foi obtida por 79%, 69,8% e 49,3% dos pacientes nas semanas 12, 24 e 52, respectivamente. Os eventos adversos mais comuns foram infecções por Candida e fadiga. No total, 74 (32%) pacientes interromperam o tratamento na semana 52, inclusive em virtude de eventos adversos ou por ineficácia secundária.
Limitações do estudoDesenho retrospectivo.
ConclusõesEsses achados sugerem que a terapia com secuquinumabe é razoavelmente eficaz em pacientes com psoríase moderada a grave. Comorbidades e tempo de evolução da doença podem afetar a resposta ao tratamento. As taxas de eventos adversos foram altas nessa população de pacientes.
A psoríase é doença inflamatória, imunomediada, sistêmica e crônica.1,2 Estudos epidemiológicos em todo o mundo estimaram a prevalência da psoríase em 0,6 a 4,8%.3 Na Turquia, uma prevalência de 0,7 a 1,8% foi relatada em estudos clínicos.4,5
Recentemente, aumentou o uso de terapias direcionadas a citocinas para o tratamento da psoríase moderada a grave. O secuquinumabe é um anticorpo monoclonal IgG1‐kappa humano, desenvolvido para bloquear as ações de IL‐17A.6–9 Em 2015, um anticorpo anti‐IL‐17 foi aprovado pela primeira vez para o tratamento de psoríase moderada a grave e artrite psoriásica em pacientes adultos.10 O secuquinumabe demonstrou alta eficácia no tratamento de psoríase moderada a grave e artrite psoriásica, com início de ação rápido, resposta sustentada e perfil de segurança favorável.11,12 Dados dos estudos ERASURE e FIXTURE revelaram que uma dose subcutânea (s.c.) de 300mg atinge um efeito de pico na semana 16, com eficácia sustentada durante as 52 semanas de tratamento.13 Em relação à segurança, os inibidores de IL‐17A estão associados a vários efeitos colaterais e a aumento da incidência de infecções por Candida.11,13 Até o momento, há escassez de dados da prática clínica na literatura em termos de eficácia e segurança do secuquinumabe. O presente estudo analisa a eficácia, a segurança e os efeitos colaterais do secuquinumabe em pacientes com psoríase moderada a grave.
MétodosPacientes e localPacientes com idade ≥ 18 anos, tratados com secuquinumabe para psoríase em nove centros de dermatologia entre março de 2018 e novembro de 2020, foram incluídos no presente estudo. Os pacientes que não receberam terapia com secuquinumabe e aqueles com idade <18 anos foram excluídos. Os dados foram analisados retrospectivamente. As características sociodemográficas dos pacientes (idade, sexo, índice de massa corporal [IMC], comorbidades, tabagismo, e etilismo) e características relacionadas à doença (tratamentos convencionais anteriores [se houvesse], agentes biológicos anteriores, duração da doença e escore no Psoriasis Area and Severity Index [PASI] antes de iniciar o uso de secuquinumabe) foram coletadas dos prontuários médicos. O secuquinumabe foi administrado de acordo com um regime de dosagem padrão (300mg s.c., uma vez por semana durante cinco semanas e, subsequentemente, uma vez por mês). A resposta ao tratamento com secuquinumabe foi determinada com base no escore PASI em 12, 24 e 52 semanas. A eficácia do tratamento foi indicada pelas taxas de resposta PASI 50, PASI 75, PASI 90 e PASI 100.
Quando o secuquinumabe foi descontinuado, o motivo da descontinuação (falta de eficácia do tratamento, eventos adversos, problemas financeiros ou outras causas) foi registrado. Eventos adversos como infecções, neoplasias malignas e neutropenia também foram registrados. Na ocorrência de infecção por Candida, características clínicas como o local de ocorrência, extensão do envolvimento e se a terapia sistêmica era necessária foram avaliadas.
O protocolo do estudo foi aprovado pelo Comitê de Ética local (Número: 439, Data: 17/11/2020) e todos os pacientes deram seu consentimento informado antes da participação.
Análise estatísticaO software NCSS (LLC, Kaysville, UT, EUA) foi utilizado para as análises estatísticas.
Além da estatística descritiva (média, desvio‐padrão, mediana, frequência e proporção), o teste de Shapiro‐Wilk e box‐plots foram utilizados para avaliar a normalidade da distribuição dos dados. Os grupos foram comparados por meio do teste Qui‐Quadrado, teste U de Mann‐Whitney, teste exato de Fisher e análise de correlação de Spearman; p <0,05 foi aceito como estatisticamente significativo. As avaliações de eficácia foram analisadas “conforme observado”, e os pacientes que não eram elegíveis para avaliação não foram incluídos na análise. A sobrevida do medicamento foi analisada pelo método de Kaplan‐Meier, enquanto as diferenças entre os grupos foram detectadas com o teste de log‐rank.
ResultadosCaracterísticas demográficas dos pacientesNo total, 229 pacientes (139 [60,7%] do sexo masculino e 90 [39,3%] do feminino) foram incluídos no estudo. A média de idade dos pacientes era de 19± 78 anos; a duração média da doença foi de 215,4±129,4 meses; 71 (31%) apresentavam IMC ≥ 30kg/m2. Artrite psoriásica estava presente em 78 (34,1%) pacientes; tabagismo foi relatado por 93 (40,6%) pacientes. Comorbidades estavam presentes em 104 pacientes (45,41%), e as mais comuns foram hipertensão (17,9%), hiperlipidemia (12,23%) e diabetes mellitus (11,35%). As características demográficas dos pacientes são mostradas na tabela 1.
Características demográficas dos pacientes
| Característica | Total de pacientes (n=229) |
|---|---|
| Idade (anos) | 19±78 |
| Sexo masculino, n (%) | 139 (60,7) |
| Média do IMC (kg/my) | 28,3±5,4 |
| IMC ≥ 30 kg/my, n (%) | 71 (31) |
| Tabagismo, n (%) | 93 (40,6) |
| Etilismo, n (%) | 29 (12,7) |
| Artrite psoriásica, n (%) | 78 (34,1) |
| Tempo de evolução da psoríase, meses | 215,4±129,4 |
| Escore PASI na linha basal | 12±42,5 |
| Comorbidades n (%) | |
| Hipertensão | 41 (17,9) |
| Hiperlipidemia | 28 (12,23) |
| Diabetes mellitus | 26 (11,35) |
| Asma | 15 (6,55) |
| Doença cardíaca | 7 (3,06) |
| Tratamentos sistêmicos anteriores, n (%) | |
| Metotrexato | 207 (90,39) |
| Acitretina | 121 (52,84) |
| Ciclosporina | 69 (30,13) |
| Fototerapia | 83 (36,24) |
| Pacientes bio‐naive | 111 (48,4) |
| Pacientes bio‐switched | 118 (51,5) |
| Terapia biológica anterior, n (%) | |
| Adalimumabe | 78 (34,06) |
| Etanercepte | 38 (16,59) |
| Ustekinumabe | 38 (16,59) |
| Infliximabe | 18 (7,86) |
| Certolizumabe | 1 (0,44) |
| Golimumabe | 1 (0,44) |
Enquanto 118 de 229 (51,5%) pacientes não eram naive (virgens de tratamento) em relação ao uso de agentes biológicos, 111 (48,4%) não haviam recebido tratamento biológico anteriormente (bio‐naive; tabela 1). Os tratamentos anteriores estão listados na tabela 1.
EficáciaA média do escore PASI dos pacientes antes do tratamento era de 12±42,5. Na semana 12 de tratamento, 89,9% dos pacientes atingiram PASI 75, 79% atingiram PASI 90 e 48% atingiram PASI 100. As taxas de resposta PASI 75, 90 e 100 em 24 e 52 semanas estão resumidas na figura 1. Em 12, 24 e 52 semanas, não houve diferença significativa na melhora dos escores PASI entre pacientes bio‐naive e bio switched (que haviam usado outro biológico anteriormente) (p >0,5). Enquanto 182 (79,4%) pacientes atingiram a semana 24 de tratamento com secuquinumabe, 155 (68%) atingiram a semana 52 (fig. 1). Não foi encontrada diferença significativa na taxa de resposta PASI 75, 90 e 100 após o tratamento entre os grupos com IMC ≥ 30kg/my e IMC <30kg/m2 (p >0,5). Além disso, nenhuma diferença significativa foi encontrada em relação à taxa de resposta PASI 75, PASI 90 ou PASI 100 entre pacientes com e sem artrite (p >0,5).
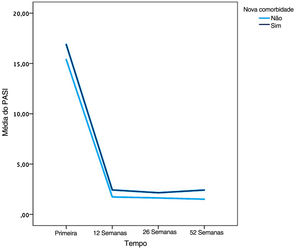
O escore PASI médio foi menor nos pacientes sem comorbidades em 12 semanas do que em pacientes com comorbidades, de acordo com o teste U de Mann‐Whitney (p=0,034; fig. 2).
Houve associação significativa entre o escore PASI e o tempo de evolução da doença em 24 semanas. A menor duração da doença foi associada à maior redução do PASI de acordo com a análise de correlação de Spearman (p=0,016).
Idade, sexo e quantidade de medicamentos biológicos utilizados antes do secuquinumabe não tiveram impacto significativo na resposta terapêutica ao secuquinumabe (p >0,5).
Segurança e efeitos colateraisEfeitos colaterais foram observados em 135 (58,9%) pacientes em uso de secuquinumabe. O evento adverso mais comum foi infecção por Candida (10,4%), seguido de fadiga (7,42%) e nasofaringite (6,99%; tabela 2). Dos 229 pacientes, 23 (10,04%) apresentaram infecções mucocutâneas por Candida, comumente apresentando‐se como candidíase vulvovaginal e intertriginosa (tabela 2). Dos 23 pacientes, 14 foram tratados com cremes antifúngicos tópicos. Apenas cinco pacientes foram tratados com terapia antifúngica sistêmica, dos quais quatro (1,75%) interromperam o tratamento com secuquinumabe. Nos 74 (32%) pacientes que descontinuaram o secuquinumabe, os motivos da descontinuação incluíram vários eventos adversos em 24 (10,48%), ineficácia secundária em 20 (8,73%), não adesão ao tratamento em 12 (5,24%), solicitação do paciente em 12 (5,24%) e ineficácia primária em dois casos (0,87%; tabela 3).
Eventos adversos mais comuns em pacientes tratados com secuquinumabe
| Evento adverso | n (%) |
|---|---|
| Infecções por Candida | 23 (10,4) |
| Candidíase vaginal | 9 (3,93) |
| Candidíase intertriginosa | 9 (3,93) |
| Candidíase orofaríngea | 4 (1,75) |
| Onicomicose | 3 (1,31) |
| Erosio interdigitalis blastomycetica | 3 (1,31) |
| Fadiga | 17 (7,42) |
| Nasofaringite | 16 (6,99) |
| Artrite paradoxal | 13 (5,68) |
| Bronquite | 4 (1,75) |
| Artralgia | 4 (1,75) |
| Prurido | 3 (1,31) |
| Aumento de peso corporal | 3 (1,31) |
Razões para descontinuação em pacientes tratados com secuquinumabe
| Razões para descontinuação | N=74 (32%) |
|---|---|
| Eventos adversos | 24 (10,48) |
| Ineficácia secundária | 20 (8,73) |
| Não adesão ao tratamento | 12 (5,24) |
| Solicitação do paciente | 12 (5,24) |
| Ineficácia primária | 2 (0,87) |
| Outros | 2 (0,87) |
| Gravidez | 1 (0,44) |
| Problemas financeiros | 1 (0,44) |
A duração média do seguimento dos pacientes foi de 47 semanas (4‐120 semanas). A figura 3 demonstra a curva de Kaplan‐Meier de sobrevida do medicamento nessa coorte de pacientes. A sobrevida do medicamento foi de 68% na semana 52 (155 pacientes) e 30% (68 pacientes) na semana 120 (fig. 3).
Também foi realizada uma subanálise considerando eventos adversos ou ineficácia secundária como causa de descontinuação. Em relação a eventos adversos, não houve diferença significativa em relação à persistência na terapia entre o grupo que continuou com o tratamento e o que não continuou. A persistência na terapia foi de 62% (mediana do tempo de sobrevida=52 semanas), 10% (mediana do tempo de sobrevida=45 semanas) para esses pacientes, respectivamente.
Em relação à ineficácia secundária, a comparação da taxa de sobrevida do medicamento entre o grupo que continuou o tratamento e o que não continuou não mostrou diferenças significativas.
De acordo com a análise de Kaplan‐Meier, sexo, idade (< 50 anos ou> 50 anos), IMC (< 30 ou ≥ 30), presença de artrite psoriásica ou comorbidades, e tratamento biológico recebido anteriormente não parecem ter afetado de maneira significativa a sobrevida global do secuquinumabe.
DiscussãoO secuquinumabe é medicamento biológico utilizado para o tratamento da psoríase que atua inibindo a IL‐17A.14 Vários estudos de prática clínica já relataram a eficácia e a segurança do uso de secuquinumabe na psoríase (tabela 4). Em um estudo multicêntrico prospectivo recente que incluiu 158 pacientes, as proporções de pacientes que atingiram PASI 75 nas semanas 12, 24 e 52 foram de 83,5%, 89% e 78,5%, respectivamente; as proporções que atingiram PASI 90 nos mesmos momentos foram 62%, 64,6% e 63,2%.15 Foram encontradas respostas PASI 75 e PASI 90 de 79,9% e 69,8% na semana 24 e 53,2% e 49,3% na semana 52, respectivamente. As proporções que atingiram o PASI 100 nos mesmos pontos foram de 52,2% e 58,52%, respectivamente.
Estudos de prática clínica sobre a eficácia do secuquinumabe
| Estudo | Desenho | Número de pacientes | Baseline characteristics | Eficácia | Efeitos colaterais (%) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Idade (anos, média) | Sexo masculino (%) | Artrite psoriásica (%) | Comorbidades (%) | Escore PASI 75/ 90/ 100 em 12 semanas (%) | Escore PASI 75/ 90/ 100 em 24 semanas (%) | Escore PASI 75/ 90/ 100 em 52 semanas (%) | ||||
| Schwensen et al. (2017) | Retrospectivo | 69 | 48 (40,5‐57,5) | – | 43,5 | – | 52,9/ 35,3 | – | – | 26,1 |
| Momose et al. (2017) | Retrospectivo | 83 | 57,3±15,2 | 68,7 | 14,4 | – | 80/ 64/ 53 | 77/ 65/ 51 | 76/ 58/ 43 | – |
| Galluzzo et al. (2018) | Retrospectivo | 107 | 47,5±12,8 | 75 | 14,9 | 51,3 | 80/ 67,5/ 55 | 76,8/ 71/ 58 | 92/ 81,6/ 78,9 | 9,3 |
| Notario et al. (2019) | Retrospectivo | 136 | 49±12,7 | 71,3 | 33,1 | – | 67,2/ 53,7 (16 semanas) | – | 69/ 46 | – |
| Ortiz‐Salvador et al. (2019) | Prospectivo | 158 | 28±17,7 | 57 | 34,8 | – | 83,5/ 62 | 89/ 64,6 | 78,5/ 63,2 | 17,7 |
| Romboti et al. (2019) | Retrospectivo | 83 | 48,0 (21‐76) | 51 | 43,9 | – | 83,8/ 70/ 46,3 (16 semanas) | – | 92/ 86/ 40 | 7,2 |
| Ger et al. (2019) | Retrospectivo | 118 | 48,0±13,8 | 74,5 | 39,8 | – | 64/ 28 | 63/ 32 | 53,7/ 27,8 (48 semanas) | 61 |
| Carpentiari et al. (2020) | Retrospectivo | 120 | 49,8±13,5 | 64,2 | 38,3 | 47,5 | – | – | – | 23,3 |
| Huang et al. (2020) | Retrospectivo | 81 | 40,1±11,1 | 67,9 | 19,8 | – | 91,1/ 73/ 38,3 (16 semanas) | – | – | 42 |
| Zhao et al. (2021) | Retrospectivo | 106 | 39,6±12,2 | 64,1 | 14,1 | 79,2 | 93,2/ 81,4/ 76,2 | 91,5/ 86,4/ 79,9 | – | 47,2 |
| Presente estudo | Retrospectivo | 229 | 19±78 | 60,7 | 34,1 | 45,41 | 89,9/ 79/ 48 | 79,9/ 69,8/ 52,2 | 53,2/ 49,3/ 58,52 | 58,9 |
Georgakopoulos et al. sugeriram que menos pacientes com psoríase na prática clínica do mundo real mantêm resultados eficazes na semana 52 do que aqueles incluídos em estudos randomizados controlados.16 Embora a resposta PASI 75/90 tenha diminuído gradualmente ao longo de 52 semanas de uso de secuquinumabe, a taxa de resposta PASI 100 foi maior na presente coorte.
Em outro estudo, foram avaliados 69 pacientes com psoríase que iniciaram o tratamento com secuquinumabe principalmente por falha no tratamento com anti‐TNF e/ou anti‐IL12‐23. Na semana 12, 66,7% dos pacientes ainda em uso de secuquinumabe apresentaram uma redução de pelo menos 50% no PASI (PASI 50) em relação à linha basal.17 No presente estudo, 225 (98%) pacientes ainda estavam recebendo tratamento na semana 12, e aproximadamente 50% deles alcançaram PASI 100.
No estudo de Notario et al., as porcentagens de pacientes com IMC ≥ 30kg/my que alcançaram respostas PASI 75 e PASI 90 foram significativamente menores do que aqueles com IMC <30kg/m2.18 Em outro estudo, uma análise de todos os pacientes que receberam 300mg de secuquinumabe por 12 semanas mostrou que a proporção de respondedores PASI 75 foi menor entre aqueles com IMC> 25kg/m2 do que naqueles com IMC <25kg/m2.19 Em contraste, Schwensen et al. relataram que os escores PASI basais não eram diferentes em relação ao status de obesidade (o indivíduo com IMC> 25kg/m2 foi considerado obeso).17 De maneira similar a Schwensen et al., não foi detectada nenhuma associação entre IMC e resposta PASI no presente estudo.
Galluzzo et al. mostraram que pacientes mais jovens responderam ao tratamento mais rapidamente: as taxas de PASI 75, PASI 90 e PASI 100 foram maiores em pacientes na semana 4. Outros parâmetros, como sexo e o escore PASI na linha basal, não foram associados às taxas de resposta PASI 75, PASI 90 e PASI 100.20 Da mesma maneira, Huang et al. observaram que a idade mais jovem estava associada a uma melhor resposta clínica ao secuquinumabe.21 Houve associação significativa entre a resposta PASI e o tempo de evolução da doença no presente estudo. Uma duração mais curta da doença foi associada a escores PASI mais baixos na semana 24 (p=0,016), mas tais associações não ocorreram com idade ou sexo. Em outro estudo, a resposta PASI 75 encontrada foi mais baixa em pacientes com artrite psoriásica quando comparada a pacientes sem artrite psoriásica.22 Ortiz‐Salvador et al. mostraram que as taxas de resposta PASI 75 e PASI 90 não estavam associadas ao escore PASI basal, idade, sexo, tabagismo ou presença de artrite psoriásica ou dislipidemia.15 O grau de melhora no escore PASI não teve associação com artrite psoriásica na presente coorte, mas o escore PASI médio foi menor em pacientes sem comorbidades na semana 12 (p=0,034).
Galluzzo et al. recrutaram 107 pacientes (75% do sexo masculino) com psoríase, com média de idade de 47,5 anos, em seu estudo retrospectivo. Aproximadamente 51,3% dos pacientes apresentavam comorbidades; as mais frequentes foram obesidade (23,4%), hipertensão (15%), hiperlipidemia (13,1%) e diabetes mellitus tipo 2 (10,3%).20 Do mesmo modo, no presente estudo, as comorbidades mais observadas foram obesidade (31%), hipertensão (17,9%), hiperlipidemia (12,23%) e diabetes mellitus (11,35%). Galluzzo et al. também mostraram que PASI 75, PASI 90 e PASI 100 foram alcançados com mais frequência por pacientes bio‐naive nas semanas 12 e 24. No total, 55 (51,4%) pacientes haviam sido tratados anteriormente com outras terapias biológicas e 52 (48,6%) eram bio‐naive em relação ao tratamento com produtos biológicos.20 Da mesma maneira, em outro estudo, a exposição anterior a ≥ 1 terapia biológica foi associada a uma resposta terapêutica diminuída ao secuquinumabe na semana 16.18 No estudo de Ger, as taxas de resposta PASI 50 e PASI 75 nas semanas 12 e 24 em pacientes sem falha biológica anterior também foram significativamente maiores do que aqueles com falha biológica anterior.23 No presente estudo, enquanto 111 (48,4%) pacientes eram bio‐naive, 118 (51,5%) eram bio‐switched, ou seja, haviam usado outro medicamento biológico anteriormente. Em relação à resposta PASI, não houve diferença significativa entre os pacientes bio‐naive e bio‐switched (p> 0,5). Em outro estudo, não foi observada diferença significativa na eficácia entre pacientes bio‐naive e bio‐switched.24
Carpentieri et al. dividiram seus pacientes recebendo secuquinumabe em bio‐naive, história de ineficácia de um agente biológico e não respondentes a ≥ 2 grupos de agentes biológicos. Ao final do estudo, eles relataram que os escores PASI haviam diminuído em três e 12 meses em todos os grupos.25 Também analisamos pacientes que receberam um ou mais agentes biológicos. Após o tratamento, o escore PASI diminuiu em ambos os grupos em 12, 24 e 52 semanas.
Carpentieri et al. relataram que 18 dos 120 pacientes (15%) descontinuaram o uso de secuquinumabe (oito pacientes em virtude de eventos adversos e dez por falta de eficácia).25 Notario et al. relataram uma taxa de descontinuação de 21,3% (29/136). Os motivos citados para a descontinuação incluíram eventos adversos graves, falta de eficácia, perda de seguimento, gravidez e cirurgia de grande porte.18 Em outro estudo, os pacientes que descontinuaram e aqueles que mantiveram o tratamento receberam secuquinumabe por uma mediana de tempo de 25,5 e 99,9 semanas, respectivamente. Dos 91 pacientes, 22 (24,2%) descontinuaram o secuquinumabe por perda de eficácia (14 pacientes, 15%), eventos adversos (cinco pacientes, 5,4%), desejo de engravidar (dois pacientes) e perda de seguimento (um paciente).26 No estudo de Ortiz‐Salvador et al., 27 (17,1%) pacientes interromperam o tratamento por falta de eficácia (oito pacientes), perda de eficácia (15 pacientes) ou interrupção do seguimento (quatro pacientes).15
Em nosso estudo, 155 (68%) pacientes atingiram a 52ª semana de tratamento e 74 (32%) descontinuaram o tratamento. Os motivos da descontinuação incluíram vários eventos adversos (10,48%), ineficácia secundária (8,73%), não adesão ao tratamento (5,24%) e solicitação do paciente (5,24%), entre outros motivos. Os eventos adversos mais comuns relacionados à descontinuação foram fadiga, nasofaringite e infecções por Candida.
Em estudos de prática clínica, a taxa de eventos adversos para o uso de secuquinumabe variou de 7,2 a 61%.22,23 Os eventos adversos relatados por Zhao et al. incluíram nasofaringite, infecções bacterianas superficiais da pele, prurido, urticária e eczema.27 Ortiz‐Salvador et al. relataram eventos adversos em 28 pacientes (17,7%) – os mais frequentes foram cefaleia (5,7%), nasofaringite (5,7%) e hipertensão (3,8%).15 No estudo SIGNATURE, que investigou a eficácia do secuquinumabe em pacientes nos quais a terapia com inibidor de TNF‐α havia falhado, eventos adversos decorrentes do tratamento ocorreram em 83,7% dos casos; entretanto, a maioria dos eventos foi de gravidade leve ou moderada.28
Recentemente, analisamos os efeitos adversos dos agentes biológicos utilizados no tratamento da psoríase. A taxa de efeitos adversos foi de 67,4% nos pacientes em uso de anti‐TNF‐α e de 55,3% naqueles em uso de inibidores de IL (ustequinumabe e secuquinumabe). Entretanto, as taxas de efeitos adversos graves foram semelhantes (4,8% no grupo anti‐TNF‐α e 3% nos inibidores de IL, mas menos frequentes no grupo secuquinumabe [1,6%]).29
No estudo atual, não houve eventos adversos graves no tratamento com secuquinumabe por até 52 semanas. A taxa de eventos adversos foi de 58,9% (135 pacientes), e o efeito adverso mais comumente observado foi infecção por Candida (10,04%), seguido de fadiga (7,42%).
A via da IL‐17 regula a imunidade na infecção por Candida, provavelmente via up‐regulação de citocinas pró‐inflamatórias (IL‐6 e quimiocinas recrutadoras de neutrófilos), entre outras ações. O uso de inibidores de IL‐17 tem sido associado a um risco aumentado de candidíase mucocutânea.30 A taxa de infecção por Candida com o uso de secuquinumabe varia entre 0,0% e 5,0%.31 Em um estudo japonês, a infecção por Candida foi detectada em apenas um de 52 pacientes com psoríase e foi completamente resolvida em 14 dias, sem interrupção do tratamento.32 Entretanto, em outro estudo com 91 pacientes recebendo secuquinumabe, o tratamento foi interrompido em um paciente com candidíase oral.22 Em dois outros estudos, as taxas de infecção por Candida foram idênticas (3,7%).15,18
Um estudo recente relatou infecções por Candida em 16 pacientes com psoríase tratados com secuquinumabe 300mg por 12 meses. Todos os pacientes foram avaliados clinicamente, e amostras de swab e coprocultura para infecção por Candida foram obtidas durante a terapia. Swabs orais foram positivos para Candida albicans em dois pacientes, e a coprocultura foi positiva em um paciente. Após 12 meses de terapia com secuquinumabe, todos os pacientes foram negativos para infecção por Candida, embora nenhuma terapia antifúngica tenha sido prescrita, e nenhum paciente apresentou sinais clínicos de infecção por Candida.33
Em outro estudo, a infecção por Candida foi relatada em 5,7% dos pacientes. As formas mais comuns de candidíase foram oral (3,6%), vulvovaginal (0,9%), genital (0,3%) e esofágica (0,6%).34
No presente estudo, infecção por Candida foi observada em 23 pacientes (10,04%). Essa alta taxa pode estar relacionada aos exames realizados de maneira meticulosa, principalmente para Candida. Na maioria dos casos, a candidíase foi vulvovaginal, intertriginosa ou orofaríngea. O tratamento tópico foi suficiente para a maioria dos pacientes; terapia sistêmica foi utilizada em apenas cinco casos. Quatro desses pacientes (1,75%) descontinuaram o tratamento com secuquinumabe em virtude da infecção por Candida; a maioria apresentava envolvimento da mucosa.
Reações paradoxais, como psoríase palmoplantar e psoríase inversa, têm sido descritas na literatura em associação com inibidores anti‐TNF‐α, secuquinumabe e ustequinumabe. A artrite paradoxal pode ser desencadeada pelo ustequinumabe, mas raramente foi relatada em associação com o uso de secuquinumabe.24,35 Curiosamente, artrite paradoxal se desenvolveu em 13 dos pacientes do presente estudo (5,68%) com psoríase. Suspeita‐se que a artrite tenha ocorrido como resultado de alterações no equilíbrio de citocinas e devido ao uso anterior de outros agentes biológicos.
As limitações do presente estudo incluem seu desenho retrospectivo, o que causou algumas dificuldades em relação ao acesso aos dados. Além disso, em razão do pequeno número de pacientes em alguns grupos, a análise de pequenas diferenças não foi possível.
ConclusãoNeste estudo, as taxas de resposta PASI 90 e PASI 100 foram altas em pacientes com psoríase moderada a grave. Ao contrário de outros estudos, foi demonstrado que os escores PASI diminuíram mais rapidamente em pacientes com curta duração da doença em 24 semanas, e escores PASI médios mais baixos foram alcançados em pacientes sem comorbidades em 12 semanas. Esses resultados mostram que fatores como a presença de comorbidades e o tempo de evolução da doença podem afetar negativamente as respostas PASI. Assim como em outros estudos, eventos adversos como fadiga e nasofaringite ocorreram nessa coorte. Entretanto, as taxas de infecção por Candida e artrite paradoxal foram maiores na população de pacientes do presente estudo em comparação com outros estudos de prática clínica.
Suporte financeiroNenhum.
Contribuição dos autoresIlteris Oguz Topal: Concepção e planejamento do estudo, elaboração e redação do manuscrito, aprovação da versão final do manuscrito.
Sevim Baysak: Obtenção e/ou processamento de dados, investigação.
Ilknur Kıvanc Altunay: Revisão crítica do manuscrito, redação do manuscrito, análise e interpretação dos dados.
Asude Kara Polat: Obtenção e/ou processamento de dados, metodologia.
Eylem Emel Arıkan: Obtenção e/ou processamento de dados.
Ezgi Özkur: Obtenção e/ou processamento de dados, revisão da literatura.
Sema Aytekin: Obtenção e/ou processamento de dados, revisão da literatura.
Bilal Dogan: Obtenção e/ou processamento de dados.
Tuğba Özkök Akbulut: Obtenção de dados e curadoria.
Filiz Topaloğlu Demir: Obtenção de dados e curadoria.
Ayse Serap Karadağ: Revisão crítica do manuscrito, obtenção de dados.
Conflito de interessesNenhum.
Como citar este artigo: Oguz Topal I, Baysak S, Altunay IK, Polat AK, Arıkan EE, Özkur E, et al. Evaluation of the efficacy, safety, and side effects of secukinumab in patients with moderate‐to‐severe psoriasis: real‐world data from a retrospective multicenter study. An Bras Dermatol. 2022;97:566–74.
Trabalho realizado no Departamento de Dermatologia e Venereologia, University of Health Sciences, Prof. Dr. Cemil Tascioglu City Hospital, Istambul, Turquia.












![Sobrevida do medicamento secuquinumabe em 120 semanas (30% [IC 95% 68,2.81], TMS: 74,6 semanas), 52 semanas (68% [IC 95% 43,7.47], TMS: 45,4 semanas).](https://static.elsevier.es/multimedia/26662752/0000009700000005/v1_202209080628/S2666275222001497/v1_202209080628/pt/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)

