As neoplasias malignas são causa importante de morbidade e mortalidade após transplantes de órgãos sólidos. O câncer de pele é a neoplasia maligna não linfoide mais prevalente durante o seguimento após transplante cardíaco. Em vitude da complexidade da terapia imunossupressora e da alta prevalência e incidência de câncer de pele nessa população, os dermatologistas desempenham papel importante no seguimento de curto e longo prazo do receptor de transplante cardíaco.
ObjetivosO objetivo do presente estudo é apresentar dados de revisão sistemática da literatura com foco na ocorrência de câncer de pele em pacientes submetidos a transplante cardíaco.
MétodosFoi realizada uma revisão sistemática da literatura nas bases de dados EMBASE, Scopus e PubMed de agosto a setembro de 2021 para investigar a incidência de câncer de pele em pacientes submetidos a transplante cardíaco. Foram selecionados estudos de coorte retrospectivos e prospectivos apresentando dados sobre a frequência de câncer de pele em pacientes após transplante cardíaco. Os critérios de exclusão incluíram artigos que não classificaram o tipo de transplante de órgão e estudos que não avaliaram a frequência de câncer de pele na população específica.
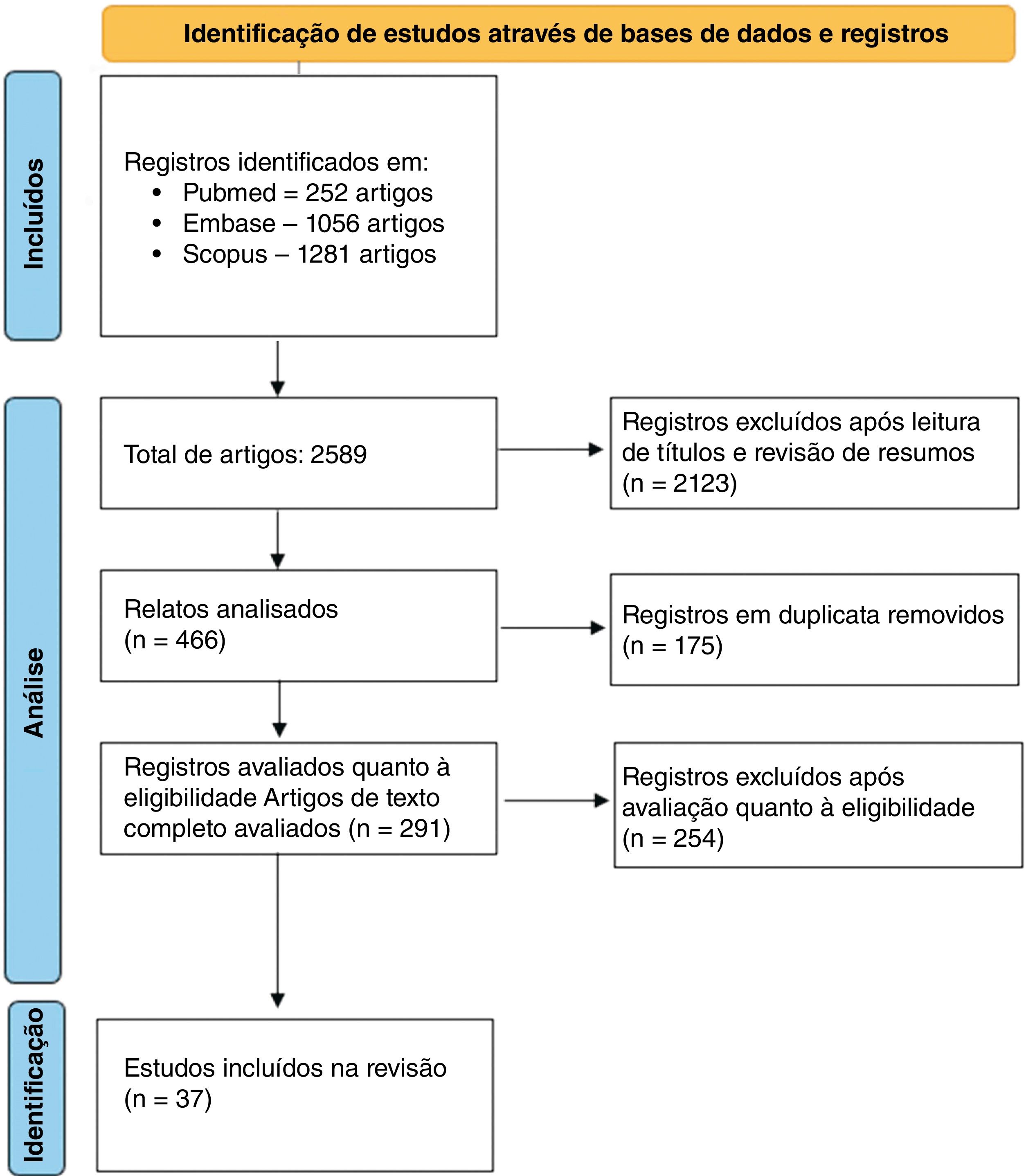
ResultadosCom base na estratégia de busca, foram encontrados 2.589 estudos, dos quais 37 foram elegíveis para inclusão neste estudo. Os dados fornecidos são de 20 países diferentes, no período de 1974 a 2015. A incidência de câncer de pele não melanoma (CPNM) varia de 0,97% a 52,8%. A incidência de carcinoma espinocelular (CEC) varia de 1,19% a 89% e a incidência de carcinoma basocelular (CBC) varia de 2% a 63%. A incidência de melanoma (MM) varia de 0,94% a 4,6%
Limitações do estudoA análise envolveu foco exclusivo em pacientes com transplante cardíaco, e a análise estatística da amostra pode ter sido prejudicada. A heterogeneidade significante entre os estudos representou um desafio durante a análise dos resultados. Além disso, o estudo é limitado por variações nos períodos de seguimento entre os estudos incluídos.
ConclusãoApesar de reunir dados metodologicamente heterogêneos, essa revisão sistemática foi capaz de mostrar a importância epidemiológica do câncer de pele em pacientes transplantados cardíacos. Esse estudo reforça o importante papel dos dermatologistas no seguimento de curto e longo prazo de pacientes transplantados cardíacos.
Câncer é causa importante de morbidade e mortalidade após transplante de órgãos sólidos,1 e a correlação entre imunossupressão e o desenvolvimento de neoplasias malignas está bem documentada.2,3 Em geral, os receptores de transplantes têm um risco aumentado de desenvolver neoplasias malignas quando comparados com a população em geral, e os transplantes cardíacos são descritos entre aqueles com maior risco.2,3 A incidência de câncer após o transplante cardíaco é duas a três vezes maior em comparação com o transplante renal,3 e esse fato pode ser atribuído à imunossupressão agressiva que esses pacientes requerem.3,4
O câncer de pele é a neoplasia maligna não linfoide mais prevalente que ocorre no seguimento do transplante cardíaco.5 Os CPNM, como o carcinoma espinocelular (CEC) e o carcinoma basocelular (CBC), estão entre os mais prevalentes.2,6
Sabe‐se que o risco de desenvolvimento de CEC aumenta de 10 a 16 vezes em pacientes transplantados em comparação com a população em geral.6 Estudos estimam que a incidência de CEC seja de 65 a 250 vezes maior em receptores de transplante de órgãos sólidos (RTOS) quando comparados com a população em geral.7 A taxa de incidência de CEC para CBC na população em geral é de cerca de 1:4. Por outro lado, entre os RTOS, essa taxa é de 5:1, portanto, o CEC é mais frequente do que o CBC em pacientes transplantados.6,8
O melanoma é o tipo mais agressivo de câncer de pele e também tem incidência aumentada em RTOS. O risco de desenvolver melanoma após um transplante de órgão sólido é de duas a oito vezes maior em comparação com a população em geral.6 Além disso, o melanoma nessa população pode ter pior prognóstico.9
Apesar do arsenal terapêutico medicamentoso, o transplante cardíaco é tratamento que salva vidas em pacientes com insuficiência cardíaca avançada. Ele fornece melhores taxas de sobrevida do que a terapia clínica isolada, uma vez que a insuficiência cardíaca avançada é uma condição grave e potencialmente fatal.10
A associação de transplante de órgão sólido e câncer de pele está bem estabelecida, principalmente em transplantes renais.6 Atualmente, existem poucos estudos focados especificamente em pacientes com transplante cardíaco e desenvolvimento de tumores de pele.
De acordo com dados do Global Observatory on Donation and Transplantation (GODT), um total de 8.408 transplantes cardíacos foram realizados em todo o mundo em 2021 em 54 países. Nos Estados Unidos, com base em informações fornecidas pela United Network for Organ Sharing (UNOS), houve aumento de 4,3% na porcentagem de transplantes cardíacos entre 2020 e 2021.11 Esse aumento foi mantido mesmo durante a pandemia de COVID‐19.11
Considerando o aumento do número de transplantes cardíacos realizados nos últimos anos, as melhores taxas de sobrevida em longo prazo após esse procedimento e a associação entre imunoterapia e neoplasias malignas, os autores acreditam que entender detalhadamente a epidemiologia do câncer de pele após o transplante cardíaco é fundamental para fornecer cuidados adequados a esses pacientes e promover a equidade na saúde cutânea.
O objetivo deste estudo é apresentar dados de uma revisão sistemática da literatura sobre a ocorrência de câncer de pele em pacientes receptores de transplante cardíaco.
Materiais e métodosEstratégia de buscaO presente estudo consistiu em revisão sistemática da literatura sobre a frequência, prevalência e incidência de câncer de pele especificamente em pacientes receptores de transplante cardíaco.
A estratégia de busca abrangente foi realizada na base de dados PubMed em 1° de julho de 2021. A busca nas plataformas EMBASE e Scopus foi realizada em 27 de agosto de 2021. Foram utilizadas as seguintes sequências de busca para identificar artigos relevantes: “neoplasms”, “basal cell carcinoma”, “squamous cell”, “squamous cell carcinoma”, “nonmelanoma”, “melanoma”, “skin neoplasms”, “skin cancer” e “transplant recipient”, “organ transplantation”, “solid organ transplant”, “immunosuppression”, “immunocompromised host” e “heart” ou “cardiac”. A estratégia também incluiu a busca por esses termos nas referências bibliográficas dos artigos selecionados.
Seleção dos estudosOs artigos selecionados foram analisados por dois avaliadores independentes que revisaram criticamente as principais características de cada estudo, como população e tamanho da amostra, casuística dos pacientes, país, avaliações dermatológicas e análise epidemiológica geral. Um terceiro examinador avaliou e revisou o trabalho quando houve discordância entre os dois avaliadores prévios.
Os títulos foram lidos primeiro e, em seguida, os títulos e os resumos. Os artigos que estavam dentro do escopo dessa pesquisa foram lidos integralmente. Após a leitura do texto completo, os artigos que atendiam aos critérios de inclusão foram selecionados. Os estudos qualificados para revisão de texto completo foram analisados posteriormente pelos seguintes critérios: autor, ano de publicação, desenho do estudo, país, dados/período avaliados, tamanho da população do estudo, medicamentos imunossupressores, resultados e outras informações relevantes.
Critérios de inclusão e exclusãoForam incluídos artigos originais escritos em inglês sobre a prevalência e incidência de câncer de pele em pacientes que receberam transplante cardíaco. O câncer de pele foi dividido em CEC, CBC e MM. Nos artigos selecionados, a frequência de câncer de pele na população estudada precisava ser diretamente mencionada e facilmente calculada. Foram incluídos desenhos de estudos de coorte retrospectivos e prospectivos na presente análise.
Os critérios de exclusão foram artigos de revisão, estudos de ensaios clínicos, artigos sem avaliação individual por tipo de transplante de órgão (avaliação apenas das coortes gerais), relatos de caso e estudos que não avaliaram a frequência de câncer de pele na população específica. Quando as instituições publicaram estudos de coorte duplicados com números acumulados de pacientes, apenas os relatos mais completos foram incluídos.
Avaliação da qualidadeOs artigos selecionados foram avaliados em relação à qualidade metodológica utilizando a ferramenta Newcastle Ottawa Scale (NOS) Quality Assessment Form para estudos de coorte. Estudos com escores da NOS de 0–3, 4–6 e 7–9 foram considerados de baixa, moderada e alta qualidade, respectivamente.12
A estimativa da exposição solar foi adicionada como critério de variável de comparabilidade, porque é fator de risco importante para o desenvolvimento de câncer de pele em qualquer população. Foi considerada a avaliação da exposição à radiação ultravioleta (UV) no questionário aplicável aos pacientes ou o cálculo do tempo que essa exposição representa.
A qualidade e a relevância dos artigos foram investigadas por dois revisores independentes.
ResultadosInicialmente, foram identificados 2.589 registros por meio da busca bibliográfica. A primeira triagem foi realizada pela leitura dos títulos. Dos títulos selecionados, foram examinados os resumos, e 2.123 artigos foram excluídos nesse processo. Foram identificados 175 artigos duplicados. No final, 291 artigos foram lidos na íntegra e, após a triagem considerando os critérios de elegibilidade e inclusão, 37 estudos foram incluídos nesta revisão sistemática. A figura 1 resume a estratégia de busca e a seleção dos artigos. Os artigos selecionados e suas características clínicas estão resumidos na tabela 1.
Resumo de todos os artigos do estudo
| Primeiro autor/ano | Desenho do estudo | País | Período avaliado | Tamanho da amostra (transplante cardíaco) | Medicamentos imunossupressores | Resultados: câncer de pele em transplante cardíaco | Desenho do estudo: prevalência ou incidência e outras informações relevantes |
|---|---|---|---|---|---|---|---|
| Jensen et al., 199513 | Coorte | Noruega | 1983 a 1992 (9a) | 140 (M: 113 F: 27)Média de idadea: 47,7 (2‐67) | CsA, AZA e prednisolona.Nenhuma terapia de indução citolítica foi utilizada. | Total de pacientes com câncer de pele: 18 (12,8%)Total de lesões cutâneas: 27 lesões (0,19 lesões/paciente)CEC: 10 (7,1%)CBC: 9 (6,4%)MM: 1 (0,7%)Doença de Bowen: 13 (9,3%)ceratose actínica: 18ceratoacantoma: 8 (5,7%)Nenhum dos pacientes morreu devido a câncer de pele.Nenhuma lesão metastática foi diagnosticada. | Incidência |
| Espanã et al., 199514 | Coorte | Espanha | 1984 a 1993 (9a) | 111 (M&F)Média de idade: 49,5 (2‐69) | 1984 a 1986 e 1989 a 1993: CsA, 6‐metilprednisolona e globulina e antitimócito equina.1986 a 1989: CsA, AZA e corticosteroide.1986 a 1989. Em pacientes Cr >1,5, CsA foi substituído por OKT3. | Total de pacientes com câncer de pele: 14 (12,6%)Total de lesões de pele: 26 (0,53 lesões/paciente)CEC: 9 pacientes (64,2%)CBC: 8 pacientes (57,1%)MM: ND | IncidênciaA proporção de CEC foi de 1:1,5 para primeira neoplasia maligna. A proporção de CBC para CEC foi de 1:1,3. O câncer de pele apareceu em média 31,5 meses após o transplante. O CBC apareceu em média aos 25,3 meses e o CEC aos 36 meses. A maioria dos casos de câncer apareceu nos primeiros quatro anos após o transplante. |
| Sigfusson et al., 199615 | Coorte (crianças) | Estados Unidos | 1975 a 1989 (14a) | 68 (M&F)Média de idade: ND (<18a)Transplante cardíaco pediátrico | 1975 a 1980: AZA e corticosteroides1980 a 1989: CsA, AZA and corticosteroides | Total de pacientes com câncer de pele: 1Total de lesões cutâneas: 1CEC: 1CBC: NDMM: ND | Prevalência |
| Ong et al., 199916 | Coorte | Austrália | 1984 a 1998 (14a) | 400 (M&F)Sexo: NDMediana de idade: 47,9 (6,6‐67) | AZA e CsA com ou sem prednisolona.Episódios de rejeição: metilprednisolona pulsada IV, OKT3, globulina antitimócito, irradiação linfoide total, tacrolimus, MMF | Total de pacientes com câncer de pele: 152 (38%)Total de lesões cutâneas: 1.436CEC: 113 pacientes (28,2%) – 849 lesões (2,1 lesões/paciente)CBC: 92 pacientes (23%) – 285 lesões (32,2%)MM: 7 pacientes (4,6%) – 7 lesõesCeratose actínica: 19 pacientes – 28 lesõesDoença de Bowen: 79 pacientes – 263 lesões | IncidênciaTaxas brutas de incidência cumulativa de câncer de pele:1 ano: 8,5%; 3 anos: 21%; 5 anos: 31%; 10 anos: 43%. Razão NCEC/CBC de 3:1; houve uma proporção maior de CEC em pacientes masculinos (3,2:1 vs. 1,3:1). A maioria das lesões ocorreu na cabeça e no pescoço.Metástases se desenvolveram em nove pacientes masculinos com CEC e quatro com melanoma. Onze mortes por câncer de pele (seis por CEC, quatro por melanoma, um por carcinoma de células de Merkel) foram responsáveis por 27% das mortes ocorridas no quarto ano após o transplante. |
| Fortina et al., 200017 | Coorte | Itália | Período de seguimento médio: 4,7 anos (1 mês ‐ 12 anos) | 252 (M: 219 F: 33)Média de idade: 49 ± 14 | CsA e AZA (terapia dupla, n = 67), ou com CsA, AZA e prednisona oral (terapia tripla, n = 185).Imunossupressão de indução: CsA ou AZA administrada seis horas antes da operação, e um bolus de metilprednisolona durante o bypass cardiopulmonar.Episódios de rejeição: metilprednisolona IV, OKT3 ou GAT. | Total de pacientes com câncer de pele: 40 (15,8%)Total de lesões cutâneas: 72 (1,8 lesões/paciente)CEC: 17 pacientes (42%) – 36 lesões.CBC: 20 pacientes (50%) – 24 lesõesMM: Um paciente (2,5%) – 1 lesãoDoença de Bowen: 8 pacientes – 9 lesõesSarcoma de Kaposi: 1Carcinoma de células de Merkel: 1 | IncidênciaA proporção de CEC/ CBC na população transplantada foi de 1,17:1. Um número maior de pacientes com TC (40, 16%) desenvolveu pelo menos um câncer de pele em comparação aos pacientes com transplante renal (16, 7%, p = 0,004). O intervalo médio entre o transplante e a detecção do primeiro câncer de pele foi menor em TC (4,5 anos) do que em TR (6,7 anos, p = 0,05). |
| Caforio et al., 200018 | Coorte | Itália | ND | 300 (M: 258 F: 42)Média de idade: 49 ± 15 | Recebendo terapia padrão dupla (CsA + AZA) ou tripla (CsA + AZA + prednisona).Os receptores de TC foram tratados com CsA e AZA (terapia dupla, n = 62) ou com CsA, AZA e prednisona oral (terapia tripla, n = 238).No pós‐operatório, a maioria (83%) dos pacientes recebeu globulina antilinfócito (GAL) ou globulina antitimócito (GAT), ou ambas, por 3 a 5 dias. | Total de pacientes com câncer de pele: 48 (16%)Total de lesões cutâneas: 104 (2,1 lesão/paciente)CEC: 22 pacientes – 53 lesões (45,8%)CBC: 24 pacientes (50%) – 37 lesõesMM: Dois pacientes (4,1%) – 2 lesõesDoença de Bowen: 9 pacientes – 9 lesõesSarcoma de Kaposi: 1 paciente – 1 lesãoCarcinoma de células de Merkel: 1 paciente – 1 lesão | IncidênciaA relação CEC/CBC foi de 1,43:1. A grande maioria das lesões ocorreu na cabeça e pescoço (73, ou 70%). O intervalo médio entre o TC e a detecção do primeiro câncer de pele correlacionou‐se com a idade no transplante (p = 0,01). Pacientes com TC com idade > 50 anos apresentaram início mais precoce de lesões de câncer de pele do que aqueles com idade < 50 anos (4 ± 3 vs. 6 ± 3 anos, p < 0,001). Três pacientes morreram de metástase precoce de melanoma (n = 1), Carcinoma de células de Merkel (n = 1) e sarcoma de Kaposi (n = 1). |
| Catena et al., 200119 | Coorte | Itália | Submetidos a transplante até 1997 | 124 (M:124)Média de idade: 55 (44‐62) | Todos os pacientes receberam imunossupressão tripla e todos apresentaram episódios de rejeição. | Total de pacientes com câncer de pele: NDTotal de lesões cutâneas: NDCEC: NDCBC: NDMM: 2 (1,6%) | IncidênciaQuando o diagnóstico de câncer foi feito, todos os pacientes já tinham doença metastática. Disparidade marcante no intervalo para neoplasia maligna de novo entre receptores de TR e TC (69 versus 24 meses); isso provavelmente está relacionado ao nível mais alto de terapia de imunossupressão. |
| Caforio et al., 200120 | Coorte | Itália | 304 (M: 261 F: 43)Média de idade: 49 ± 15 | Terapia padrão dupla (CsA, AZA) ou tripla (CsA, AZA, prednisona). | Total de pacientes com câncer de pele: 57 (18,75%)Total de lesões cutâneas: 104 lesões (1,82 lesões por paciente)CEC: 26 pacientes (45,6%)CBC: 27 pacientes (47,3%)MM: ND | IncidênciaA proporção CEC/CBC foi de 1,43:1, e a maioria das lesões era localizada em cabeça e pescoço. TC > 49 anos (p = 0,008; RR = 3,0), tipo de pele II (p = 0,0001; RR = 3,5), ceratose actínica (p = 0,0007, RR = 2,8) e exposição à luz solar > 30.000 horas (p = 0,01; RR = 2,1) foram fatores de risco para tumores de pele de qualquer tipo. | |
| Fortina et al., 200421 | Coorte | Itália | Pelo menos três anos de seguimento | 230 (M: 198 F: 32)Média de idade: 50,2 ± 11,0 | CsA e AZA (terapia dupla; n = 37) ou CsA, AZA e prednisona oral (terapia tripla; n = 193).A prednisona oral foi adicionada ao regime de terapia dupla de CsA e AZA em casos de rejeição repetida ou persistente ou de efeitos nefrotóxicos de CsA. | Total de pacientes com câncer de pele: 48 pacientes (20,8%)Total of lesões cutâneas: 120 lesões (apenas CPNM)CEC: 26 pacientes (54,1%) – 83 lesões (3,19 lesões/paciente)CBC: 13 pacientes (27%) – 37 lesões (2,84 lesões/paciente)MM: Não avaliado (ND) | IncidênciaIncidência cumulativa de CPNM em receptores de TC: CEC: 5a: 6,5% (IC95% 3,2%–9,7%); 10a: 19,7% (IC95% 13,3%–26,1%)CBC: 5a: 6% (IC95%, 2,9%–9,1%); 10a: 12% (7%–17%)O risco cumulativo de CECs e CBCs aumentou acentuadamente com o aumento da idade no momento do transplante. A proporção CEC/CBC foi de 2,2:1. A maioria das lesões ocorreu em cabeça e pescoço (n = 91; 69,5%). Nenhum tumor metastático ou fatal ocorreu. A mediana do tempo entre o transplante e o aparecimento do primeiro CPNM foi de 5,2 anos (3,5–7,8 anos, 25°–75° percentil). |
| Shiba et al., 20046 | Coorte | Estados Unidos | 1980 a 1991 (11a) | 142 (M: 109 F: 33)Média de idade: 51,4 ± 9,9 | Regimes imunossupressores iniciais de sobreviventes de 10 anos:CsA/P/RATAG: 6 (4,2%); CsA/P: 23 (16,2%); CsA/AZA: 8 (5,6%); CsA/AZA/P/ATGAM: 12 (8.5%); CsA/AZA/P: 30 (21,1%); CsA/AZA/P/PKT3: 63 (44,4%); CsA foi administrada em todos os casos como parte do regime imunossupressor inicial.Os regimes de manutenção em 10 anos incluíram o seguinte: CsA AZA e prednisona: 70 (49,3%); CsA, AZA: 19 (13,4%) receberam; CsA, prednisona: 18 (12,7%); CsA, MMF e prednisona: 10 (7,0%); CsA e MMFl: 5 (3,5%); TAC e AZA: 2 (1.4%); TAC, MMF, e prednisona: 2 (1,4%); CsA somente: 1 (0,7%); Regimes desconhecidos: 14 (9,9%); Regime medicamentoso único (apenas CsA): 2 (em virtude de neoplasias malignas refratárias. | Total de pacientes com câncer de pele: 34 (38%)Total de lesões cutâneas: NDCEC: NDCBC: NDMM: 4 pacientes (2,8%)Cinquenta e quatro pacientes (38,0%) apresentaram câncer de pele em 8,1 ± 3,7 anos (1,6–16,6 anos) após TC. A maioria das lesões foram carcinoma espinocelular recorrente ou carcinoma basocelular | Incidência |
| El‐hamamsy et al., 200522 | Coorte | Canadá | 1982 a 2002 (20a) | 207 (M: 172 F: 35)Idade: 46 ± 11 | 1988 e 2002: 154 pacientes receberam timoglobulina IV.Prednisona oral, AZA ou MMF, que substituiu a AZA desde 1997 foram iniciadas após a extubação do paciente.A CsA foi iniciada no dia 2 ao dia 5 do pós‐operatório após o transplante. | Total de pacientes com câncer de pele: 84 pacientes (42%)Total de lesões cutâneas: NDCEC: 1 paciente (1,19%)CBC: 16 pacientes (19,0%)MM: NDSarcoma de Kaposi (SK): 2%Doença de Bowen: 5% | IncidênciaOs pacientes foram divididos em dois grupos: com neoplasia pós‐transplante (n = 43) e sem câncer (n = 165).Não houve diferenças entre os dois grupos quanto à idade do receptor, gênero, doença subjacente, histórico de tabagismo e número de episódios de rejeição tratados no primeiro ano. Quando examinados separadamente, nenhuma associação significante foi encontrada entre a administração de qualquer medicamento e o desenvolvimento de uma lesão neoplásica. |
| Mello Júnior et al., 200623 | Coorte | Brasil | 1986 a 2002 (16a) | 106 (M: 87 F: 19)Média de idade: 43,7 (12–64) | Todos os pacientes foram submetidos a CsA, AZA e um agente corticoide.Dois pacientes também receberam ortoclona (OKT3) para tratar rejeição.O protocolo do regime imunossupressor consistiu em CsA, AZA e corticosteroide. | Total de pacientes com câncer de pele: 13 pacientes (12,26%)Total de lesões cutâneas: NDCEC: 8 (34,80%)CBC: 5 (21,70%)MM: não avaliado (ND) | Incidência |
| Geusau et al., 200824 | Coorte | Áustria | 1984 a 2003 (19a) | 322 (M: 260 F: 62)Mediana da idade: 54,02 | Pós‐operatório: RATG, anticorpos monoclonais murinos muromonab OKT3 e anticorpos monoclonais antireceptor de IL‐2. Terapia de manutenção: regime triplo de medicamentos consistindo de CsA ou Tac; AZA ou MMF e prednisolona.Desde o início de 1998: todos os pacientes foram rotineiramente trocados de AZA para MMF. | Total de pacientes com câncer de pele: 73 (23%)Total de lesões cutâneas: 263 (3,6 lesões/paciente)CEC: 27 pacientes (36,9%) – 64 lesões (2,3 lesões/paciente)CBC: 46 pacientes (63%) – 104 lesões (2,2 lesões/paciente)MM: NDDoença de Bowen: 25 pacientes (7,7%) – 61 lesões (2,44 lesões/paciente)Carcinoma de Bowen: 16 pacientes (4,9%) – 34 lesões (2,1 lesões/paciente) | IncidênciaA proporção de CEC (incluindo doença de Bowen e carcinoma de Bowen) para CBC foi de 1,6:1,33 pacientes tinham apenas um tumor de pele, 40 pacientes desenvolveram mais de um tumor (28 tinham 2–5 neoplasias malignas de pele, 12 mais de 5).Taxas de incidência cumulativa para CPNM: 5 anos: 7,3%; 10 anos: 26,9%; 15 anos: 56,5%Taxa de incidência geral de CPNM: 33,1 casos por 1.000 pessoas‐ano pós‐transplante. 32 dos pacientes (44%) com pelo menos um tumor tinham CA (vs. 10% sem tumor; p < 0,0001). Tempo médio do transplante até o diagnóstico do primeiro CPNM: 79,56 meses. |
| Brewer et al., 200925 | Coorte | Estados Unidos | 1988 a 2006 (18a) | Todos os receptores de transplante cardíaco na Clínica Mayode 1988 a 2006. (n = ND)312 (M: 227 F: 85) tiveram câncer de pele.Média de idade: 47,4 ± 16,37 | NA número de pacientes com terapia imunossupressora individualmente. Os medicamentos que não foram significantemente associados ao desenvolvimento de CEC incluíram AZA, CsA, MMF, sirolimus, corticosteroides, e TAC.O MMF foi significantemente associado a um risco aumentado de CBC (HR = 2,32; p = 0,005)Os medicamentos que não foram significantemente associados ao desenvolvimento de CBC incluíram CsA, sirolimus, corticosteroides e TAC.AZA foi significantemente associada a um risco reduzido de desenvolvimento de CBC (HR = 0,56; p < 0,05) | Total de pacientes com câncer de pele: 312Total de lesões cutâneas: 1395 (9,6 lesões/paciente)CEC: Pacientes ND – 1236 lesões (89%)CBC: Pacientes ND – 151 lesões (11%)MM: 5 lesões (< 1%)Angiossarcoma: um pacienteFibroxantoma atípico: 1 pacienteCarcinoma pilomatricial: 1 paciente | IncidênciaPacientes tiveram CEC:5a: 15,4% / 10a: 32,3% / 15a: 38,2%Pacientes tiveram CBC:5a: 10,3% / 10a: 19,2% / 15a: 31,6%Câncer de pele de qualquer tipo:5a: 0,4% / 10a: 7,5% / 15a: 46,4%Taxas de incidência cumulativa de um segundo CEC: 1a: 44% / 3a: 67,4% / 5a: 75,9%Taxas de incidência cumulativa de ter um CEC: 1a: 36,7% / 3a: 54,7% / 5a: 65,9%Taxas de incidência cumulativa de um segundo CBC: 1a: 32,1% / 3a: 48,6% / 5a: 51,4%Taxas de incidência cumulativa de desenvolvimento de CBC:1a: 16,3% / 3a: 31,8% / 5a: 45,7%Incidência cumulativa de morte:5a: 18,4% (IC95% 13,6%–23,0%); 10a: 37.9% (IC95% 30,5%–44,5%); 15a: 63,5% (IC95% 51,5%–72,5%); 18a: 78,7% (IC95% 57,7%–89,3%)Carga tumoral de CEC pós‐transplante dos 312 pacientes: 76 pacientes (24,4%) tinham pelo menos um CEC, 24 pacientes (7,7%) tinham apenas um CEC, e 19 (6,1%) tinham 10 ou mais CECs. A avaliação da carga tumoral de CBC de receptores de transplante cardíaco mostrou que 54 pacientes (17,3%) tinham pelo menos um CBC, 23 pacientes (7,4%) tinham apenas um CBC, e dois pacientes (0,6%) tinham dez ou mais CBCs. |
| Chen et al., 200926 | Coorte | Taiwan | 1987 a 2008 (21a) | 66 (M&F) | Todos os pacientes foram tratados com terapia padrão de agente imunossupressor triplo com base em inibidor de calcineurina (CsA ou Tac; Aza ou MMF e prednisolona)Após 1999, o MMF substituiu gradualmente a AZA e o TAC substituiu a CsA como agentes imunossupressores de primeira linha | Total de pacientes com câncer de pele: 1 (1,5%)Total de lesões cutâneas: 1CEC: 1 (1,5%)CBC: NDMM: ND | Incidência |
| Molina et al., 201027 | Coorte | Espanha | 1984 a 2003 (19) | 3393 (M: 2874 F: 519)Média de idade: 51,4 ± 11 | Pacientes recebendo cada tipo de imunossupressor (porcentagens) por período pós‐TC (em qualquer momento): CsA: 2.863 (84,4%); AZA: 2.334 (68,8%); Prednisona: 3365 (99,2%)TAC: 743 (21,9%); MMF: 1.628 (48,0%); sirolimus: 223 (6,6%); everolimus: 27 (0,8%); OKT3: 1503 (44,3%); RATG: 580 (17,1%); basiliximabe: 227 (6,7%); daclizumabe: 139 (4,1%) | Total de pacientes com câncer de pele: 204 (6%)Total de lesões cutâneas: 324 (1,58 lesão por paciente)CEC: pacientes ND – 169 lesões (52%)CBC: pacientes ND – 104 lesões (32%)MM: pacientes ND – 9 lesões (2,7%)SK: pacientes ND – 4 lesõesTumores malignos indiferenciados: pacientes ND – 23 lesões | IncidênciaO RR de desenvolvimento de CEC em pacientes transplantados em uma zona de alta insolação (> 2500 horas/ano) foi de 8,7 (IC 95% 4,3–17,8; p = 0,0001) em relação aos pacientes que foram transplantados em uma zona de baixa insolação, e no CBC o RR foi 3 (IC95% 1,7–5,4; p = 0,0001). AZA foi associada a um risco aumentado de CEC (RR = 1,8; IC95% 1,2–2,7; p = 0,003). A terapia de indução foi um fator de risco para CPNM (RR = 2,1; IC95% 1,6–2,7; p = 0,0001), CEC (RR = 2,3; IC95% 1,6–3,4; p = 0,0001) e CBC (RR = 2,6; IC95% 1,6–4,2; p = 0,0001), mas apenas OKT3 foi associado tanto ao CEC quanto ao CBC. |
| Hsu et al., 2010 28 | Coorte | China | 1987 a 2008 (21a) | 291 (M: 244 F: 47)Média de idade: 45,1 ± 16,1 | Todos os pacientes receberam terapia imunossupressora tripla. Desde 1995, o RATG tem sido utilizado para terapia de indução. | Total de pacientes com câncer de pele: 3 (1%)Total de lesões cutâneas: NDCEC: NDCBC: NDMM: pacientes ND – nove lesões (2,7%)Nenhum caso de sarcoma de Kaposi. | IncidênciaA incidência de câncer de pele aumentou ligeiramente.Provavelmente resultou de uma relativa raridade de câncer de pele na população chinesa. |
| Doesch et al., 201029 | Coorte | Alemanha | 1989 e 2005 | 211 (M: 175 F: 36)Média de idade: 51,4 ± 10,5 | Todos os 211 receptores de transplante receberam RATG por via intravenosa.1989–2001: CsA combinado com azatioprina2001–2003: CsA e MMF2003 – em diante: inibidores de mTOR (everolimus/sirolimus) | Total de pacientes com câncer de pele: 36 (17,1%)CEC: 9 pacientes (4,2%) ‐ lesões NDCBC: 24 pacientes (11,3%) – lesões NDMM: NDLesões pré‐cancerosas: três pacientes (1,4%) | IncidênciaO intervalo médio entre o transplante e o diagnóstico inicial de uma neoplasia maligna cutânea foi de 7,6 ± 3,5 anos. |
| Jensen et al., 201030 | Coorte | Dinamarca | 1977 a 2006 (29a) | 459 (M: 368 F: 91)Mediana da idade: 50 (2–89) | Terapia de indução de alta dose até um ano após o transplanteTerapia de manutenção: AZA, CsA, prednisolona | Total de pacientes com câncer de pele: 40 pacientes (8,7%)Total de lesões cutâneas: NDCEC: 26 pacientes (65%)CBC: 14 pacientes (35%)MM: ND | IncidênciaTransplante de coração: CBC: SIR de 5,6 (IC95% 3,1–9,5); CEC: SIR de 113 (IC95% 74–166)Maior risco de CEC entre receptores de coração, que são mantidos no regime de dosagem mais alta de medicação imunossupressora. |
| Hamour et al., 201110 | Coorte | Inglaterra | 1995 a 2007 (12a) | 399 (M: 318 F: 81)Média de idade: 48±12 | Todos os pacientes receberam CsA e corticoides com MMF ou AZA.Terapia de manutenção: MMF e AZARejeições: corticoides em altas doses | Total de pacientes com câncer de pele: NDTotal de lesões cutâneas: NDCEC: NDCBC: NDMM: ND | IncidênciaIncidência cumulativa de neoplasias malignas cutâneas: 1a= 2%; 3a= 4%; 5a= 6%; 7a= 8%; 10a= 13% |
| Alam et al., 201131 | Coorte | Estados Unidos | 1993 a 2003 (10a) | 6271 (M: 4202 F: 2069) | Protocolo de terapia imunossupressora ND.O risco relativo de câncer de pele foi de 1,5 para dosagens mais altas de CsA medidas no seguimento de 1 ano (6 vs. 2 mg/kg/d, p = 0,01), 1,4 para dosagens mais altas de AZA (2,5 vs. 1 mg/kg/d, medidas no seguimento de um ano, p = 0,007) e 1,4 para dosagens mais altas de MMF (40 vs. 10 mg/kg/d, no seguimento de um ano, p = 0,04). | Total de pacientes com câncer de pele: 545 (8,6%)Total de lesões cutâneas: NDCEC: 289 pacientes (53%) – lesões NDCBC: 228 pacientes (41%) – lesões NDMM: 22 pacientes (4%) – lesões NDOutro tipo de câncer de pele: 6 pacientes | IncidênciaA latitude mais baixa teve um RR de câncer de pele de 1,2 (p = 0,03). O histórico de câncer de pele pré‐transplante foi associado a um RR de 2,0 de câncer de pele (p = 0,001). Mortalidade por todas as causas após câncer de pele pós‐transplante variou de acordo com o tipo de câncer de pele. Para CBC, a sobrevida em cinco anos foi de 83% (IC95% 73–90%). Para CEC, a sobrevida em cinco anos foi de 80% (IC 95% 74–86%). Para melanoma, a sobrevida em três anos foi de 50% (IC95% 27–73%). Pacientes brancos foram mais suscetíveis ao câncer de pele do que pacientes não brancos (p < 0,0001), com 83% livres de câncer de pele em 10 anos (IC95% 81–85%). |
| Chivukula et al., 201432 | Coorte | Estados Unidos | 2000 a 2011 (11a) | 402 pacientes (M: 310 F: 92)Média de idade: 54,0±12,4 | Subgrupos:‐ 185 (46.0%) receberam alentuzumabe (M: 140)‐ 56 (13,9%) timoglobulina (M: 46)‐ 161 (40,0%) sem indução (M: 124)2000–2006: inibidor de calcineurina e esteróides tipicamente2006 – em diante: todos os pacientes receberam terapia de indução de rotina com alentuzumabe e foram posteriormente tratados com a ICN e um agente secundário sem uso de esteroides pós‐operatórios. | Alentuzumabe:Total de pacientes com câncer de pele: 15 (8,1%) – lesão NDCEC: 10 pacientes (5,4%) – lesão NDCBC: 4 pacientes (2,2%) – lesão NDMM: 1 paciente (0,5%) ‐ lesão NDTimoglobulina:Total de pacientes com câncer de pele: quatro (71%) – lesão NDCEC: 1 paciente (1,8%) – lesão NDCBC: 2 pacientes (3,6%) – lesão NDMM: 1 (1,8%) – lesão NDSem indução:Total de pacientes com câncer de pele: 11 (6,8%) – lesão NDCEC: 5 pacientes (3,1%) – lesão NDCBC: 5 pacientes (3,1%) – lesão NDMM: 1 paciente (0,6%) – lesão ND | IncidênciaCânceres de pele foram as neoplasias malignas mais comuns após transplante cardíaco: CEC seguido por CBC. Nem alentuzumabe nem timoglobulina foram associados a maiores taxas de neoplasia maligna cutânea precoce. Quatro anos após o transplante cardíaco, a indução com alentuzumabe mostrou taxas semelhantes de sobrevida livre de câncer, tanto no geral quanto para cânceres não cutâneos, em comparação com timoglobulina e indivíduos de controle histórico não induzidos. |
| Fuchs et al., 201433 | Coorte | Alemanha | 2003 a 2007 (4a) | 145 (M&F)grupo CsA = média de idade: 58,8 ± 11,4grupo TAC – média de idade: 49,1 ± 13,0 | Os pacientes foram divididos em um grupo CsA (n = 25) e um grupo TAC (n = 120).A terapia imunossupressora inicial foi realizada em todos os pacientes com CsA, usando AZA e metilprednisolona. Terapia de manutenção: CsA ou TAC ou em combinação com um inibidor da síntese de DNA como AZA ou MMF. | Total de pacientes com câncer de pele: sete (4,8%)Total de lesões cutâneas: NDCEC: 2 pacientes (1,3%) – lesões NDCBC: 3 pacientes (2%) – lesões NDMM: 2 pacientes (1,3%) – lesões ND | IncidênciaMetástase: um melanoma com metástases em linfonodos.Não houve diferença significante entre os dois ICN CsA e TAC em relação à incidência de tumores, sobrevida global e complicações pós‐operatórias importantes em pacientes de TC. |
| Park et al., 201434 | Coorte | Coreia | 1990 a 2008 (18a) | 207 (M&F) | Protocolo de terapia imunossupressora ND. | Total de pacientes com câncer de pele: 7 (3,3%)Total de lesões cutâneas: NDCEC: NDCBC: NDMM: ND | IncidênciaAssociação entre os fatores indicados e o risco de câncer de pele, incluindo carcinoma in situ em receptores de transplante de órgãos (somente coração): HR: 3,5 (1,3–10,0); p = 0,01 |
| Rivinius et al., 20153 | Coorte | Alemanha | 1989 a 2014 (25a) | 381 (M: 300 F: 81)Média de idade: 51,2 ± 10,5 | Terapia imunossupressora inicial: CsA e AZA foi substituída por CsA e MMF em 2001, e por TAC e MMF em 2006.Inibidores de mTOR (everolimus/sirolimus) foram usados a partir de 2003. | Total de pacientes com câncer de pele: 74 (19,4%)CEC: 28 pacientes (37,8%) – lesões NDCBC: 30 pacientes (40,6%) – lesões NDMM: dois pacientes (2,7%) – lesões ND | Incidência |
| Secnikova et al., 201535 | Coorte | República Checa | 1993 a 2010 (17a) | 603 (M: 493 F: 110) | Regime inicial padrão: esteroides, inibidores de calcineurina (CsA ou tacrolimus) e antimetabólitos (MMF ou AZA).2004/2005 em diante: inibidores de mTOR (sirolimus, everolimus) | Total de pacientes com câncer de pele: 119 pacientes (19,7%)Total de lesões cutâneas: NDCEC: 62 pacientes (52,1%) – lesões NDCBC: 37 pacientes (31,1%) – lesões NDMM: 3 pacientes (2,5%) – lesões NDCeratose actínica: 11 pacientes (9,2%) – lesões NDDoença de Bowen: 4 pacientes (3,3%) – lesões NDCarcinoma de células de Merkel: 1 paciente (0,84%) – lesões ND | IncidênciaA mediana de tempo para desenvolver neoplasia maligna cutânea não melanoma foi de dez anos. |
| Keer et al., 20164 | Coorte | Bélgica | 1987 a 2013 (26a) | 541 (M: 431 F: 110)Média de idade: 50 ± 14 | Antes de 2000: CsA, AZA e metilprednisolonaApós 2000: MMF substituiu AZA e AZA e TAC substituíram CsA.Todos os pacientes receberam terapia de indução com globulina antitimócito policlonal de coelho.CsA: 272 (50%); TAC: 269 (50%); AZA: 237 (44%); MMF: 304 (56%) | Total de pacientes com câncer de pele: 112 (20,7%)Total de lesões cutâneas: 294 (2,6 lesões por paciente)CEC: 58 pacientes (51,7%) – lesões NDCBC: 51 pacientes (45,5%) – lesões NDMM: 2 pacientes (1,7%) – lesões NDSK: 1 paciente (0,89%) lesões ND | Incidência |
| Delgado et al., 201636 | Coorte | Espanha | 1984 a 2010 | 4.561(M: 3.808 F: 753)Média de idade: ND | A coorte foi classificada em TA (TA/ neoplasiamaligna não cardíaca): 77 (1,7%) e nenhum tumor anterior (NTA); 4.484 (98,3%) com tumor anterior. (Grupo sem nenhum tumor anterior: 84% e grupo com tumor anterior: 62%) | Total de pacientes com câncer de pele: 637 pacientesTotal de lesões cutâneas: NDCEC: 382 (TA = 8, NTA = 374) – lesão NDCBC: 228 (TA = 2, NTA = 226) – lesão NDMM: 15 pacientes (TA = 2, NTA = 13) – lesão NDSK: 12 (TA = 0, NTA = 12) – lesão ND | IncidênciaEste foi o único estudo a relatar receptores de transplante cardíaco com histórico prévio de neoplasia |
| Mcpherson et al., 201737 | Coorte | Escócia | 1992 a 2016 (24a) | 363 (M: 285; F: 78) | Regime mais comum: CyA e MMF. 116 pacientes receberam indução adicional de OKT3 entre 1995 e 1998 e 72 pacientes receberam r‐ATG entre 2010 e 2016CyA+MMF: 216 pacientes; CyA+AZA: 111 pacientes | Total de pacientes com câncer de pele: 60 (16,5%)Total de lesões cutâneas: NDCEC: 26 (7,1%) – lesão NDCBC: 34 (9,3%) – lesão NDMM: ND | Incidência |
| Bhat et al., 20181 | Coorte | Estados Unidos | 1987 a 2015 (28a) | 44.162 (M: 33.767; F: 10.395)Média de idade: 52,0 ± 12,0 | 91,4% dos receptores de TC estavam usando três ou mais medicamentos imunossupressores. | Total de pacientes com câncer de pele: 5.060 (11,4%)Total de lesões cutâneas: NDCEC: 3.218 pacientes (63,5%) – lesão NDCBC: 1.175 pacientes (23,2%) – lesão NDMM: 48 (0,94%) – lesão NDSK: 19 (0,37%) – lesão ND | IncidênciaIncidência cumulativa de câncer em vários momentos: Coração (% [IC95%])1a = 1,4 (1,3–1,5); 5a = 10 (9,6–10,3); 10a = 21 (20,5–21,4); 15a = 28,2 (27,5–28,7); 20a = 32 (31,3–32,6)Duração do seguimento (y), média±DP (intervalo): 5,8 (0–24,3) |
| Jäämaa‐Holmberg et al., 201938 | Coorte | Finlândia | 1985 a 2014 (29a) | 479 (M: 381; F:98)Mediana da idade: 52 | Todos os pacientes: receberam imunossupressão com base em inibidores de calcineurina (CsA ou TAC) combinados com AZA ou MMFAté o final de 2010: anticorpos policlonais antitimócitos foram administrados durante os três primeiros dias para todos os pacientes. | Total de pacientes com câncer de pele: 145 (30,2%)Total de lesões cutâneas: NDCEC: 56 pacientes (38,6%) – lesão NDCBC: 83 pacientes (57,2%) – lesão NDMM: 5 pacientes (3,4%) – lesão NDSK: 1 paciente (0,68%) – lesão ND | IncidênciaRazão de incidência esperada/padronizada / IC95% / p‐valorCEC: 1,1 / 51,9 / 39,2–67,4 / p ≤ 0,001CBC: 7,9/10,5 / 8,4–13,0 / p ≤ 0,001Melanoma: 1,3 / 3,8 / 1,2–8,8 / p ≤ 0,01Sarcoma de Kaposi: 0 / 365,0 / 9,2–2033 / p ≤ 0,01 |
| Kimura et al., 201939 | Coorte | Japão | 1999 a 2017 (18a) | 103 (M: 79; F: 24)Grupo com malignidade (n = 7) e grupo sem malignidade (n = 96).Média de idade: 39,6 ±12,6 | Terapia de manutenção inicialPrednisolona: 103 (100%)CsA: 20 (19%) / TAC: 83 (81%) / MMF: 100 (97%) / AZA: dois (1,9%) / Sirolimus: 1 (1%)Terapia de manutenção no desfecho: Prednisolona: 27 (26%) / CsA: 8 (7.8%) / TAC: 88 (85%) / MMF: 38 (37%) / Everolimus: 67 (65%)Terapia de indução: 41 (40%)Basiliximabe: 33 (32%) / OKT3: 7 (6.8%) / Daclizumabe: 1 (1%) | Total de pacientes com câncer de pele: um paciente (0,97%)Doença de Bowen: um pacienteCEC: NDCBC: NDMM: ND | IncidênciaDoença linfoproliferativa pós‐transplante e câncer de cólon foram mais comuns do que câncer de pele em receptores japoneses.Essas diferenças podem ser causadas por diferenças em etnia, dieta, ambiente e estado viral. Por exemplo, tipo de pele II e exposição solar > 30.000h não são comuns no Japão e podem explicar a baixa prevalência de câncer de pele. |
| Park et al., 201940 | Coorte | Canadá | 1994 a 2013 (19a) | 684 (M: 530; F: 144)Mediana de idade: 53 (44–59) | ND | Total de pacientes com câncer de pele: NDDoença de Bowen: NDCEC: NDCBC: NDMM: ND | IncidênciaIncidência cumulativa de carcinoma de queratinócitos (IC95%) – transplante de coração2a: 5,68 (4,10–7,61)5a: 15,04 (12,32–18,02)10a: 26,67 (22,73–30,76)15a: 34,27 (29,37–39,23)19a: 37,18 (31,48–42,87) |
| Asleh et al., 201941 | Coorte | Estados Unidos | 1994 a 2016 (22a) | 523 (M: 354; F: 169)Média de idade: 50,0 ± 13,6 | Todos os pacientes receberam terapia de indução com RATG, e uma minoria de pacientes recebeu muromonab‐CD3 (OKT3)Manutenção: ICN (tacrolimus ou ciclosporina), um antimetabólito (MMF ou AZA) e doses decrescentes de prednisona. | Distribuição de eventos de câncer durante a terapia com ICN ou SRLCEC:Geral: 123 (23,5%) / recebendo ICN: 70 (13,3%) / recebendo SRL: 53 (10,1%)CBC:Geral: 46 (8,7%) / recebendo ICN: 22 (4,2%) / recebendo SRL: 24 (4,5%)Número total de ocorrências primárias subsequentes de CPNMCEC:Geral: 276 (52,7%)/ recebendo ICN: 179 (34,2%) / recebendo SRL: 97 (18,5%)CBC:Geral: 41 (7,8%) / recebendo ICN: 19 (3,6%) / recebendo SRL: 2 (0,3%)MM: ND | IncidênciaA maioria das neoplasias malignas eram CPNM (n = 169; 92 no grupo ICN e 77 no grupo SRL).A conversão para SRL foi associada a um risco significantemente menor de ocorrências primárias subsequentes de CPNM em comparação com a terapia com ICN (HR não ajustado = 0,44; IC95%: 0,27 a 0,71; p < 0,001; HR ajustado = 0,44; IC95% 0,28 a 0,69; p < 0,001) |
| O’neill et al., 2019 42 | Coorte | Irlanda | 1994 a 2014 (20a) | 214 (M: 166; F: 48)Mediana da idade: 47,1 | – | Total de pacientes com câncer de pele: 59 pacientes (27%)Total de lesões cutâneas: NDCEC: 36 pacientes (16,8%)CBC: 40 pacientes (18,6%)MM: 0 | IncidênciaRazões de incidência padronizadas (SIR) para todos os cânceres de pele em transplantes cardíacos: 9,26 (7,05–11,94)Total de casos incidentes: 59SIR para CPNM (carcinoma de queratinócitos) em transplantes cardíacos: 9,87 (7,51–12,73)Total de casos incidentes: 59SRI para CPNM CBC em transplantes cardíacos: 8,7 (6,22–11,85)Total de casos incidentes: 40SRI para CPNM CEC em transplantes cardíacos: 19,05 (13,34–26,37)Total de casos incidentes: 36 |
| Infusino et al., 202043 | Coorte | Itália | 1974 a 2014 (40a) | 133 (M&F) | Os pacientes foram tratados com medicamentos imunossupressores de acordo com as diretrizes específicasisoladamente ou em associação, ciclosporina, tacrolimus ou sirolimus, enquanto micofenolato de sódio, micofenolato mofetil e everolimus foram sempre administrados em associação com outros medicamentos. | Total de pacientes com câncer de pele: 70 (52,6%)Total de lesões cutâneas: NDCEC+ceratose actínica: 91 (68,4%)CBC: 21 (15,7%)MM: 0 | IncidênciaOs pacientes submetidos a transplante cardíaco apresentaram taxas estatisticamente significantemente maiores de CPNM e CA em comparação com casos de transplantes de outros órgãos (52,6%, p = 0,0352). |
| Yeh et al., 202044 | Coorte | Taiwan | 1997 a 2011 (14a) | 687 (M: 548; F: 139) | TAC: 188 (27,4%); CsA: 445 (64,3%); MMF: 433 (63,0%); AZA: 111 (16,2)Everolimus: 47 (6,8%)Sirolimus: 0 (0%)Esteroide:638 (92,9%)Aproximadamente 79% dos receptores de transplante cardíaco usaram timoglobulina | Total de pacientes com câncer de pele: dois (0,29%)Total de lesões cutâneas: NDCEC: NDCBC: NDMM: 0 | IncidênciaIncidências significantemente maiores de câncer de pele não melanomaSIR (IC95%): 5,8 (1,5–23,3)Razão de incidência padronizadaIncidências significantemente maiores de câncer de pele não melanoma (SIR = 5,8; IC95%, 1,5–23,3; p < 0,05) |
CA, ceratose actínica; AZA, azatioprina; CBC, carcinoma basocelular; ICN, inibidor de calcineurina; CsA, ciclosporina; TC, transplante cardíaco; TR, transplante renal; MM, melanoma; MMF, micofenolato mofetil; mTOR, proteína alvo da rapamicina em mamíferos; CPNM, câncer de pele não‐melanoma; ND, não disponível; NTA, nenhum tumor anterior; RATG, imunoglobulina antitimócito de coelho; CEC, carcinoma espinocelular; SRL, sirolimus; TAC, tacrolimus; M&F, masculino e feminino; a, unidade de idade em anos; IC, intervalo de confiança; RR, risco relativo.
Os 37 estudos incluídos nesta revisão foram conduzidos em 19 países diferentes: Estados Unidos (sete estudos), Itália (seis estudos), Alemanha (três estudos), Espanha (três estudos), Taiwan (dois estudos), Austrália (dois estudos), Canadá (dois estudos), Bélgica (um estudo), Japão (um estudo), Finlândia (um estudo), Brasil (um estudo), Inglaterra (um estudo), Noruega (um estudo), Coreia (um estudo), China (um estudo), Irlanda (um estudo), República Tcheca (um estudo), Dinamarca (um estudo) e Escócia (um estudo). Os dados fornecidos são de 19 países diferentes, no período de 1974 a 2015.
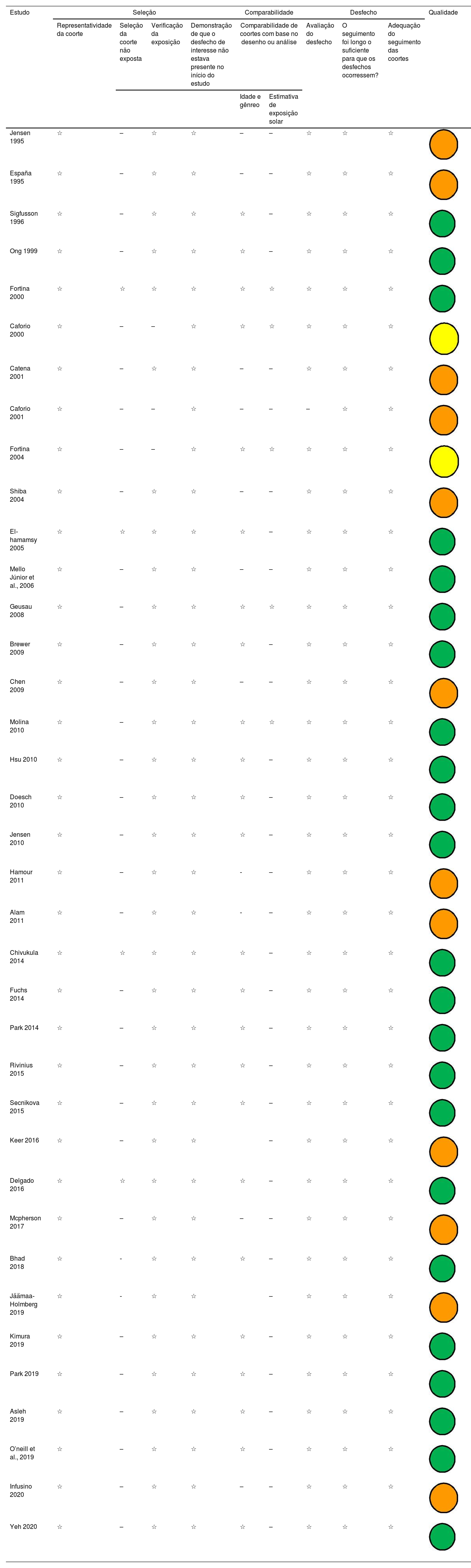
A qualidade metodológica dos estudos variou em uma faixa de escores de 1 a 9, usando a ferramenta Newcastle Ottawa Scale (NOS) Quality Assessment Form para estudos de coorte. A tabela 2 mostra o controle de qualidade para cada um dos artigos selecionados. Na avaliação, 23 (62%) estudos foram classificados como de boa qualidade, dois (5,4%) estudos foram classificados como de qualidade razoável e 12 (32,4%) estudos foram classificados como sendo de baixa qualidade.
Resumo da análise de qualidade usando o Newcastle‐Ottawa Quality Assessment Form for Cohort Studies modificado
| Estudo | Seleção | Comparabilidade | Desfecho | Qualidade | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Representatividade da coorte | Seleção da coorte não exposta | Verificação da exposição | Demonstração de que o desfecho de interesse não estava presente no início do estudo | Comparabilidade de coortes com base no desenho ou análise | Avaliação do desfecho | O seguimento foi longo o suficiente para que os desfechos ocorressem? | Adequação do seguimento das coortes | |||
| Idade e gênreo | Estimativa de exposição solar | |||||||||
| Jensen 1995 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| España 1995 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Sigfusson 1996 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Ong 1999 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Fortina 2000 | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | |
| Caforio 2000 | ☆ | – | – | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | |
| Catena 2001 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Caforio 2001 | ☆ | – | – | ☆ | – | – | – | ☆ | ☆ | |
| Fortina 2004 | ☆ | – | – | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | |
| Shiba 2004 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| El‐hamamsy 2005 | ☆ | ☆ | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Mello Júnior et al., 2006 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Geusau 2008 | ☆ | – | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | |
| Brewer 2009 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Chen 2009 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Molina 2010 | ☆ | – | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | ☆ | |
| Hsu 2010 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Doesch 2010 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Jensen 2010 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Hamour 2011 | ☆ | – | ☆ | ☆ | ‐ | – | ☆ | ☆ | ☆ | |
| Alam 2011 | ☆ | – | ☆ | ☆ | ‐ | – | ☆ | ☆ | ☆ | |
| Chivukula 2014 | ☆ | ☆ | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Fuchs 2014 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Park 2014 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Rivinius 2015 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Secnikova 2015 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Keer 2016 | ☆ | – | ☆ | ☆ | – | ☆ | ☆ | ☆ | ||
| Delgado 2016 | ☆ | ☆ | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Mcpherson 2017 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Bhad 2018 | ☆ | ‐ | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Jäämaa‐Holmberg 2019 | ☆ | ‐ | ☆ | ☆ | – | ☆ | ☆ | ☆ | ||
| Kimura 2019 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Park 2019 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Asleh 2019 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| O’neill et al., 2019 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
| Infusino 2020 | ☆ | – | ☆ | ☆ | – | – | ☆ | ☆ | ☆ | |
| Yeh 2020 | ☆ | – | ☆ | ☆ | ☆ | – | ☆ | ☆ | ☆ | |
Qualidade: Boa (
); Razoável (); Ruim ().Boa qualidade, 3 ou 4 estrelas no domínio de seleção e 1 ou 2 estrelas no domínio de comparabilidade e 2 ou 3 estrelas no domínio de desfecho/exposição. Qualidade razoável, 2 estrelas no domínio de seleção e 1 ou 2 estrelas no domínio de comparabilidade e 2 ou 3 estrelas no domínio de desfecho/exposição. Qualidade ruim, 0 ou 1 estrela no domínio de seleção ou 0 estrelas no domínio de comparabilidade ou 0 ou 1 estrela no domínio de desfecho/exposição.
Aqui, os autores fornecem uma visão geral abrangente sobre a frequência de câncer de pele em pacientes após transplante cardíaco.
DiscussãoRevisão sistemática abrangente sobre câncer de pele foi conduzida entre pacientes submetidos a transplante cardíaco, resumindo dados de 37 estudos. Que seja de conhecimento dos autores, esta é a primeira revisão sistemática com foco específico na frequência de câncer de pele nessa população específica de pacientes.
A incidência de CPNM nesta revisão sistemática varia de 0,97% em uma coorte de Taiwan a 52,8% em uma coorte italiana.
A maior incidência de CPNM no estudo da Itália (Infusino et al.) pode ser atribuída ao bom tamanho da amostra, seguimento de longo prazo, análise realizada por tipo de transplante de órgão, predisposição de pele branca em pacientes italianos, exposição à luz UV e alta prescrição de imunossupressão em pacientes submetidos a transplante cardíaco.43
A menor incidência de CPNM em Taiwan (Yeh et al.) pode ter sido influenciada por fatores genéticos que reduzem a prevalência desse tipo de câncer na população asiática.44
A incidência de CEC varia de 1,19% em um estudo conduzido no Canadá a 89% em um estudo conduzido nos Estados Unidos.22,25 A incidência de CBC varia entre 2% e 63%, na Alemanha e Áustria, respectivamente.24,33 Isso está de acordo com a literatura existente; observa‐se que o CEC ocorre com mais frequência do que o CBC em receptores de órgãos sólidos.
Considerando o MM, a maior incidência foi de 4,6% em estudo conduzido na Austrália (Ong et al.).16 Esse estudo confirma associações significantes entre câncer de pele e antígenos HLA em pacientes submetidos a transplante cardíaco. Também reforça a importância de exames regulares de pele no seguimento.
A menor incidência de MM foi de 0,94% em uma coorte dos Estados Unidos (Bhat et al.).1 As limitações desse estudo incluem a subnotificação de cânceres de pele no registro e fatores de risco individuais para câncer de pele.
Todos os artigos que fornecem o gênero nas características demográficas da amostra tiveram predominância masculina na população em análise.
O câncer de pele é a neoplasia maligna mais comum entre os receptores de transplante de órgãos sólidos. Entre os subtipos de câncer de pele, o não melanoma é o mais prevalente nessa população. Também está bem estabelecido que os pacientes de transplante cardíaco requerem doses mais altas de terapia imunossupressora antes e depois do procedimento cirúrgico em comparação a transplantes de outros órgãos sólidos.
Muitos estudos na literatura abordaram a prevalência de câncer de pele no seguimento do transplante renal. Embora seja um procedimento mais comum do que o transplante cardíaco, os pacientes geralmente precisam de doses mais baixas de terapia imunossupressora após o procedimento. Portanto, é fundamental entender o efeito da terapia imunossupressora na incidência do câncer de pele em diferentes transplantes de órgãos sólidos.
Diversos fatores contribuem para o desenvolvimento de neoplasias malignas após o transplante, incluindo idade avançada no transplante, retransplante, tipo e grau da terapia imunossupressora, exposição à luz solar, tipo de pele e gênero masculino.1,17,25,27,45
Assim, destaca‐se que os pacientes transplantados cardíacos são particularmente suscetíveis ao desenvolvimento de câncer de pele devido a dois fatores principais: o acentuado grau de imunossupressão necessária, bem como a idade avançada no momento do transplante.1,25
Além disso, enfatiza‐se que, além de sua alta prevalência, o CEC parece ser mais agressivo em receptores de transplantes de órgãos sólidos (RTOS), com maior risco de metástase. Esses pacientes têm, em média, dez vezes mais risco de metástase quando comparados à população em geral, o que está associado ao aumento da morbidade e mortalidade desses pacientes.5,18,46 Explorar uma compreensão abrangente do comportamento do CEC em pacientes com imunossupressão elevada, como pacientes transplantados cardíacos, é um ponto crucial.
Os receptores de transplante de órgãos sólidos têm um risco aumentado de desenvolver melanoma.6,46 Estima‐se que eles tenham um risco até dois a oito vezes maior em comparação com a população em geral, com um tempo médio de desenvolvimento de cinco anos após o transplante.6,46 Estudos mostram que a probabilidade de desenvolver melanoma após o transplante cardíaco é maior quando comparado com outros subgrupos de receptores de transplante de órgãos, o que pode ser atribuído à terapia imunossupressora mais acentuada nesses pacientes.47
Contudo, esses dados são controversos na literatura, uma vez que alguns estudos não mostram risco substancial de melanoma nesses pacientes.48 Como há muitos artigos mostrando risco aumentado de melanoma em RTOS, e considerando que o melanoma é neoplasia maligna potencialmente fatal, recomenda‐se que os profissionais de saúde procedam com cautela ao considerar MM em populações vulneráveis submetidas à imunossupressão.6,9,46,47,49 Outro fato importante a destacar nesse contexto é que a incidência de MM tem aumentado na população em geral, o que deve ser um alarme para grupos suscetíveis, como a população no presente estudo.9,47,50
Na presente revisão sistemática, apenas um estudo analisou a população pediátrica submetida a transplante cardíaco. Sigfússon et al. avaliaram todos os transplantes cardíacos em um pequeno centro em pacientes com menos de 18 anos, e de um total de 68 pacientes que sobreviveram cinco anos após o procedimento, apenas um CEC foi registrado.15
A maioria dos artigos fornece a idade média no momento do transplante e o desvio padrão. Muitos artigos não fornecem a faixa etária, então não é possível determinar qual idade é a mais jovem na coorte.
A presente revisão está de acordo com a literatura sobre o câncer de pele como a neoplasia maligna mais comum entre os receptores de transplante de órgãos sólidos. Associado a esse fato, entre os receptores de transplante de órgãos sólidos, os pacientes com transplantes cardíacos são considerados população vulnerável porque precisam de terapia imunossupressora acentuada e forte. Como o risco de rejeição do órgão transplantado pode ser fatal, esses pacientes geralmente recebem três tipos diferentes de medicamentos imunossupressores. Esse fato pode ser uma das principais razões pelas quais esses pacientes têm taxas muito altas de câncer de pele, como o presente estudo sugere. A presente revisão mostra que a maioria dos estudos encontrou uma frequência aumentada de câncer de pele nessa população e mostra a importância de estudos‐alvo focados nessa população específica.
Curiosamente, a presente análise confirma que a incidência de câncer de pele é relatada como sendo menor em países asiáticos, incluindo estudos realizados em Taiwan, Japão, Coreia e China.26,28,34,39,44 Esses autores sugerem que influência genética, etnia, dieta, ambiente, estado viral, fototipo, e exposição à luz solar podem justificar essa observação.26,28,39,40,44
Em geral, era difícil determinar se as neoplasias de pele existiam antes do transplante ou se essas lesões se desenvolveram após a terapia de imunossupressão, porque essa informação não é fornecida pelos artigos. Os pacientes não foram examinados por dermatologista antes do transplante cardíaco, então não há dados para confirmar que lesões preexistentes estavam ausentes e que todos os casos de câncer de pele foram consequência da terapia imunossupressora, embora seja presumido que isso provavelmente seja verdade para a maioria dos casos. Uma avaliação dermatológica completa antes do transplante de órgão sólido também é importante porque uma das dificuldades encontrada foi estabelecer a classificação correta de: incidência, prevalência e taxa de frequência.
Terapia de imunossupressãoCom foco nos medicamentos imunossupressores em transplante cardíaco e câncer de pele, Bhat et al., 2018 mostraram que um número menor de medicamentos imunossupressores está associado a uma incidência reduzida de câncer de pele e nenhuma alteração significante foi encontrada para o sarcoma de Kaposi.1
Fortina et al., 2000 descobriram que o tipo de regime imunossupressor não afetou o risco de câncer de pele em pacientes submetidos a transplante cardíaco.17 Em outro estudo em 2004, eles descobriram que não havia associação entre doses cumulativas de cada medicamento imunossupressor usado na imunossupressão de manutenção ou na imunossupressão da rejeição aguda e o risco de desenvolvimento de CBC e CEC em pacientes submetidos a transplante cardíaco.21 Eles também sugerem que os CECs, mas não os CBCs, estão relacionados aos níveis globais de imunossupressão após três anos, em vez de medicamentos imunossupressores específicos. Outro ponto neste estudo é que a incidência de CEC aumentou substancialmente pela alta exposição ocupacional à luz solar, mas não a do CBC.21
Os resultados de Molina et al., 2010 sugerem que o CEC no transplante cardíaco depende do tipo de terapia imunossupressora prescrita, e não apenas da duração e da dose da imunossupressão.27 Eles descobriram que micofenolato mofetil (MFM) foi fator protetor contra o CEC, a azatioprina foi fator de risco e o tacrolimus e a ciclosporina não tiveram efeito.27 Neste estudo, nenhum medicamento imunossupressor foi associado ao carcinoma basocelular e a alta exposição à luz solar foi fator de risco para ambos os tumores, CBC e CEC.27
Brewer et al. mostram um risco aumentado de CBC em pacientes utilizando MFM em comparação com aqueles usando azatioprina, enquanto o tacrolimus e o sirolimus não tiveram efeitos significantes na diminuição do risco de CBC e CEC, respectivamente.25 Asleh et al. mostram que a substituição do inibidor da calcineurina pelo sirolimus teve impacto positivo em pacientes suscetíveis com histórico de câncer de pele não melanoma no período pós‐transplante cardíaco.41 Fuchs et al., em estudo comparando ciclosporina e tacrolimus após transplante cardíaco, não observaram diferença significante entre os grupos, incluindo análise de câncer de pele.33
Geusau et al. descobriram que um número aumentado de CPNM se correlaciona com a duração da terapia imunossupressora, e regimes contendo azatioprina pareciam influenciar o desenvolvimento de CPNM; entretanto, esse efeito não foi estatisticamente significante.24 Esse grupo concluiu que a terapia de indução não parece estar associada a maiores incidências de CPNM.24
Muitos estudos sugerem que a proteína alvo da rapamicina em mamíferos (mTOR, do inglês mammalian target of rapamycin) pode ter efeito ligeiramente protetor na prevenção do câncer de pele em transplante de órgãos sólidos.1,3,51
Durante a presente revisão, tirar conclusões sobre a associação entre a terapia imunossupressora e o câncer de pele foi um desafio, porque a maioria dos estudos incluiu pacientes com transplante de órgãos sólidos em geral, e eles não avaliaram órgãos, terapia de imunossupressão e as neoplasias malignas em separado.
Claramente, observa‐se a importância e a necessidade de uma avaliação dos pacientes de transplante cardíaco, focando apenas no resultado do câncer de pele e na associação desse resultado com a terapia de indução e manutenção de imunossupressão.
Além disso, é preciso caracterizar melhor a correlação da terapia imunossupressora e os outros fatores de risco para câncer de pele, o que é complexo, mas necessário para avaliar individualmente cada paciente. Acredita‐se que essa lacuna no conhecimento precisa ser abordada para obter avanços na medicina de precisão nessa população específica. Embora o câncer de pele seja a neoplasia maligna mais comum em pacientes transplantados e influencie diretamente as taxas de mortalidade e morbidade, enfatiza‐se a necessidade de uma avaliação precisa desse resultado.
Limitações do estudoO presente estudo tem algumas limitações. Primeiro, a maioria dos estudos são coortes de pacientes submetidos a transplante de órgão sólido. Eles analisaram todas as coortes e não se concentraram especificamente no transplante cardíaco e suas peculiaridades. Isso pode ser um risco de viés porque a população de transplante cardíaco tem características específicas. Foi selecionada a análise que envolvia apenas pacientes de transplante cardíaco. Dessa maneira, a análise estatística da amostra pode ter sido prejudicada.
Dificuldades na análise ocorreram, principalmente pela heterogeneidade dos estudos; esse ponto é reforçado porque foi o desafio mais notável durante a análise do resultado. Os estudos são heterogêneos na organização da análise estatística. Além disso, os protocolos de imunossupressão variam de acordo com os diferentes centros e protocolos.
Também enfatiza‐se que o desenho de um estudo de coorte fica comprometido quando não há uma coorte de comparação que derive do mesmo centro e que corresponda às mesmas características demográficas. A maioria dos estudos não faz essa coorte de comparabilidade. Esse fato não invalida ou diminui a importância dos dados coletados, mas é importante no momento que o rigor científico dos artigos é avaliado.
Além disso, a maioria dos artigos não mencionou se o diagnóstico de câncer de pele foi confirmado por biopsia com histopatologia e se esses pacientes procuraram serviços dermatológicos fora de seus centros de transplante cardíaco. Ambas as situações hipotéticas podem ser um risco de viés no resultado.
Na análise da qualidade dos estudos utilizando o Newcastle‐Ottawa Quality Assessment Form for Cohort Studies modificado, a qualidade ruim e regular de 14 estudos também é considerada uma limitação do presente estudo.
Comentários adicionaisCinquenta e cinco anos se passaram desde que o primeiro transplante de coração humano foi realizado. Durante esse período, podemos traçar uma visão geral desses pacientes em relação ao desenvolvimento de neoplasias de pele.52 Essa revisão sistemática mostra que pesquisas futuras precisam analisar exclusivamente pacientes de transplante cardíaco e especificamente a incidência de câncer de pele. Também reforça a importância de cuidar dessa população em uma abordagem multidisciplinar, onde o dermatologista desempenha um papel fundamental.
Em virtude da complexidade da terapia imunossupressora personalizada e dos fatores de risco ambientais e individuais, mais estudos são necessários para entender essa interação.
Enfatiza‐se a importância de entender a etnia, avaliar com precisão a exposição à luz solar, o estado viral, o histórico familiar, as comorbidades e o uso de protetor solar nos estudos, e criteriosamente analisar os diferentes tipos de câncer de pele, principalmente CEC, CBC, e MM. É importante avaliar e identificar quais pacientes estão em risco de desenvolver câncer de pele e agir adequadamente.
Reforça‐se a importância de focar em cada população de transplante de órgãos, cada terapia de imunossupressão e cada neoplasia maligna em separado, efetuando a análise estatística de maneira mais precisa e menos generalizada. Uma metodologia mais homogênea será útil para entender a complexidade dessa coorte de pacientes.
ConclusãoO risco de CPNM e melanoma pós‐transplante parece estar aumentando universalmente, e os pacientes submetidos a transplante cardíaco apresentam alta frequência de câncer de pele e outras doenças de pele. Medidas de prevenção e melhor compreensão da doença podem evitar muitos cânceres de pele nessa população.
Os profissionais de saúde devem estar bem familiarizados com cada programa regional de transplante de órgãos e suas características demográficas para diminuir a incidência de câncer de pele entre os pacientes transplantados.
O presente estudo reforça que o dermatologista desempenha papel importante no seguimento de curto e longo prazo dos pacientes submetidos a transplante cardíaco. Essa população requer avaliação cuidadosa e contínua do dermatologista. Essa abordagem pode mudar a morbidade, a mortalidade e a qualidade de vida de muitos pacientes após o transplante cardíaco. O presente estudo mostra que melhorar a comunicação entre cirurgiões que realizam o transplante, cardiologistas de transplante e dermatologistas é ação crucial e essencial no cuidado de pacientes submetidos a transplante cardíaco.
Suporte financeiroNenhum.
Contribuição dos autoresNathalia Hoffmann Guarda Aguzzoli: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Ana Laura Bueno: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Yağmur Halezeroğlu: Obtenção dos dados, ou análise e interpretação dos dados; análise estatística; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Renan Rangel Bonamigo: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores são muito gratos a todos os pacientes anônimos que permitem o seguimento em cada artigo dessa análise multinacional. Os autores agradecem profundamente a ajuda e a revisão incansável de Cristiano Schaffer Aguzzoli. Além disso, também apreciam o rigor científico e a paciência de Guilherme Brodt.
Como citar este artigo: Aguzzoli NHG, Bueno AL, Halezeroğlu Y, Bonamigo RR. Skin cancer after heart transplantation: a systematic review. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.05.004
Trabalho realizado na Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, RS, Brasil.