As células dendríticas plasmocitoides fazem parte da família das células dendríticas e são uma conexão importante entre as imunidades inata e adaptativa. São as mais potentes produtoras de interferon tipo 1, atuando na resposta antiviral, no estímulo de macrófagos e células dendríticas e na ativação e migração de células natural killer. As células dendríticas plasmocitoides atuam também na apresentação de antígenos, na resposta linfocitária‐T, na imunorregulação e na diferenciação de plasmócitos e secreção de anticorpos. As células dendríticas plasmocitoides não estão presentes habitualmente na pele normal; elas infiltram a pele nos processos de cicatrização e em diversas doenças, como infecções virais, doenças inflamatórias, doenças autoimunes e neoplásicas. Nos últimos anos, a presença das células dendríticas plasmocitoides em diversas doenças dermatológicas foi descrita, podendo indicar sua participação na patogênese. Estudos futuros sobre a atuação das células dendríticas plasmocitoides na dermatologia poderão levar a novos alvos terapêuticos.
As células dendríticas plasmocitoides (pDCs) fazem parte da família das células dendríticas e se desenvolvem das células tronco hematopoiéticas da medula. Lennert e Remmele fizeram a primeira menção a esse então novo tipo celular em 1958, denominados linfoblastos e detectados na região paracortical de linfonodos reativos.1 A partir do final dos anos 1980, as pDCs receberam diversas denominações ao longo do tempo (células‐T plasmocitoides, monócitos plasmocitoides).2–5
Caracteristicamente, as pDCs exibem CD123 (interleucina‐3 receptora de cadeia alfa) e BDCA‐2 (Blood Derived Dendritic Cell Antigen‐2 ou CD303) e são mediadores‐chave da imunidade inata, as mais potentes produtoras de interferon tipo I (IFN‐a, IFN‐b, IFN‐l, IFN‐w e IFN‐t), secretando mil vezes mais IFN‐α e IFN‐β que outros tipos celulares.6
Sua ativação ocorre por meio dos TLR (toll like receptors) 7 e 9, gerando uma sinalização que induz a expressão de múltiplos genes codificadores de moléculas imunomoduladoras e pró‐inflamatórias, tais como IFN‐α. O TLR7 responde ao RNA de fita simples (rico em guanosina ou uridina) encontrado nos vírus (influenza, vírus sincicial respiratório), enquanto o TLR 9 detecta moléculas de DNA de fita simples contendo unmethylated CpG (containing motifs) comumente encontrados no genoma de vírus como herpes simples (HSV). Assim, as pDCs detectam as infecções virais por reconhecimento dos ácidos nucleicos virais e constituem importantes mediadoras da imunidade antiviral.6
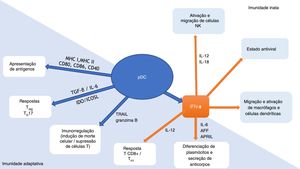
As pDCs são uma conexão importante entre as imunidades inata e adaptativa (fig. 1). Essas células produzem IFNs tipo 1 em resposta às infecções virais, promovendo um estado antiviral por meio da expressão de genes estimulados por IFN e do apoptose de células infectadas. Em conjunto com IFN, as interleucinas (IL)‐12 e IL‐18 ativam as células natural killer (NK), gerando a secreção de IFN‐γ e a lise de células‐alvo. A produção de IFN pelas pDCs também leva ao estímulo de macrófagos e células dendríticas. Por meio da expressão de complexos de histocompatibilidade (MHC) e moléculas coestimuladoras (CD80, CD86, CD40), as pDCs promovem a imunidade adaptativa, atuando como células apresentadoras de antígeno tanto para linfócitos‐T CD4+quanto CD8+. A expressão de indoleamina‐2,3‐dioxigenase (IDO) e ligante coestimulador induzível (ICOSL) geram resposta T‐regulatória (Treg), enquanto a produção de TGF‐β e IL‐6 pelas pDCs leva à resposta T‐helper (Th) 17. Por meio da produção de IFN‐I e IL‐12 pelas pDCs há o estímulo da atividade TCD8+e polarização das células TCD4+para Th1. A produção de IFN‐I, IL‐6, fator de ativação da célula B da família TNF (BAFF) e ligante indutor de proliferação (APRIL) pelas pDCs causa a expansão e estimulação plasmócitos produtores de anticorpos. Ligante indutor de apoptose relacionado a TNF (TRAIL) e granzima B conferem às pDCs a capacidade de eliminar células tumorais, induzir apoptose de células TCD4+infectadas e suprimir a proliferação de células‐T. Além disso, as próprias pDCs estimulam a diferenciação de células plasmocitoides por meio de IFNs tipo I e IL‐6.6–10
Células dendríticas plasmocitoides (pDCs): conexão de relevância entre as imunidades inata e adaptativa. Adaptado de Mitchell et al., 2018 e Swiecki et al., 2015.9,10
APRIL, ligante indutor de proliferação; AFF, fator de ativação da célula B da família fator de necrose tumoral alfa; CD, grupo de diferenciação; ICOSL, ligante coestimulador induzível; IDO, indoleamina‐2,3‐dioxigenase; IFN‐α, interferon alfa; IL, interleucina; MHC, complexo de histocompatibilidade; NK, natural killer; pDC, célula dendrítica plasmocitoide; TGF‐β, fator de transformação do crescimento beta; TH, linfócito T‐helper; TRAIL, ligante indutor de apoptose relacionado ao fator de necrose tumoral alfa; Treg, linfócito T‐regulatório.
As pDCs não estão habitualmente presentes na pele normal; elas infiltram a pele nos processos de cicatrização e em diversas doenças, como infecções virais, doenças inflamatórias, doenças autoimunes e neoplásicas.2,3 Revisão da literatura sobre a presença de pDCs e doenças dermatológicas será descrita a seguir.
Lúpus eritematoso cutâneoNo lúpus eritematoso (LE), as pDCs são as principais produtoras de IFN‐α. Sabe‐se que as pDCs circulantes estão reduzidas nos pacientes com lúpus eritematoso sistêmico (LES), uma vez que elas migram e infiltram os tecidos‐alvo, como a pele. Diversos estudos demonstraram grandes quantidades de pDCs produtoras de IFN‐α nas lesões de lúpus crônico discoide.11–13
Tomasini et al. encontraram diferenças na distribuição das pDCs nos diferentes tipos de lúpus: distribuição superficial nos casos de lúpus subagudo e lúpus discoide, e distribuição ao redor de vasos profundos nos casos de lúpus túmido e retículo‐histiocitose multicêntrica.3 Também verificaram relação positiva entre a intensidade do infiltrado inflamatório e a quantidade de pDCs.
Além disso, o número de pDCs nas lesões de lúpus (LE) e dermatomiosite (DM) correlacionou‐se com a expressão de proteína de resistência ao mixovírus (MxA), proteína induzida por IFN‐α/β, sugerindo que as pDCs são fonte importante de IFN‐α nessas doenças.11,14,15 McNiff et al. verificaram que as pDCs foram preferencialmente detectadas na epiderme nos pacientes com dermatomiosite, quando comparados com os pacientes com lúpus, nos quais a localização foi principalmente na derme, sugerindo que no LE os complexos de autoanticorpos circulantes migram através dos vasos antes de se depositarem na pele.11
Líquen planoVries et al. observaram pDCs CD123+abundantes nos fragmentos de pele de líquen plano, dispostas no infiltrado linfocitário em faixa na junção dermoepidérmica. Além disso, posteriormente demonstraram a replicação de herpes vírus 7 nas células dendríticas plasmocitoides nas lesões de líquen plano (LP) ativo, com diminuição após a remissão da doença.16,17
Wang et al. descreveram aumento da infiltração de células dendríticas plasmocitoides no líquen plano oral, propondo que elas seriam as mediadoras da resposta imune inata nessa doença.18
Líquen estriadoBadr et al. encontraram pDCs no infiltrado inflamatório do líquen estriado, sugerindo que elas possam apresentar um papel na patogênese da doença. Além disso, descreveram a distribuição periécrina das pDCs no líquen estriado (LS), que poderia ser um critério histológico útil para diferenciação entre LS e LP.19
Dermatite atópicaNos pacientes com dermatite atópica (DA) houve um aumento das pDCs circulantes em comparação a controles; além disso, o recrutamento de pDCs nas lesões de DA foi muito menor do que o encontrado em outras dermatoses, como LE e psoríase. Esse fraco recrutamento de pDCs, resultando na baixa produção de IFN tipo 1 nas lesões de DA poderia explicar a maior suscetibilidade dos pacientes com DA a infecções virais, como infecções por herpes simples ou poxvírus.20,21
Erupção polimorfa à luzRossi et al., em contraposição a estudos anteriores, demonstraram aumento estatisticamente significativo de pDCs nos pacientes com erupção polimorfa à luz (EPL), em comparação aos controles saudáveis, provavelmente pelo teste fotoprovocativo realizado.22,23
PsoríaseNestle et al. encontraram grandes quantidades de pDCs no infiltrado de linfócitos‐T presente na derme das placas psoriásicas, ausentes na pele de doadores sadios e de pacientes com DA.24 Além disso, as pDCs também foram encontradas na pele adjacente, mesmo sem lesões aparentes. Os autores também verificaram redução das pDCs no sangue periférico dos pacientes com psoríase quando comparados com indivíduos saudáveis, sugerindo que o acúmulo de pDCs na pele dos pacientes com psoríase ocorre devido à redistribuição das pDCs do sangue para a pele.24 Em modelo animal, os autores demonstraram a produção de IFN‐α pelas pDCs na pele lesada e sua influência para a ativação dos linfócitos‐T, levando ao desenvolvimento das lesões de psoríase.24
Outro estudo sobre psoríase demonstrou que a helioterapia promoveu não apenas melhora clínica, mas também redução do número de pDCs e da expressão de MxA, marcador para IFN‐α, na pele lesional, fortalecendo o papel das pDCs na psoríase.25
A quemerina é um fator quimiotático para pDCs séricas. Albanesi et al. demonstraram forte expressão de quemerina na derme de pele adjacente às lesões psoriásicas.26 Houve baixa expressão de quemerina e poucas pDCs nas placas de psoríase crônica, sugerindo que a expressão de quemerina ocorre nas fases iniciais do desenvolvimento das lesões de psoríase e se correlaciona temporalmente com a presença das pDCs.
Pitiríase liquenoideA fisiopatologia da pitiríase liquenoide (PL) não é totalmente compreendida. A demonstração da expressão de MxA nas lesões de PL estabelece a produção local de IFN tipo 1.27,28
Karouni et al. demonstraram a presença de pDCs na pele de pacientes com PL nas duas formas, pitiríase liquenoide e varioliforme aguda (PLEVA) e pitiríase liquenoide crônica (PLC).29 Além disso, encontraram expressão intensa e difusa de MxA, demonstrando sua ativação e produção de IFN tipo 1. Os autores sugerem que infecções virais, autoantígenos, trauma, antígenos contra drogas e tumores – previamente associados aos casos de PL−poderiam contribuir para o recrutamento e ativação das pDCs, cuja presença também foi demonstrada em outras dermatites de interface, como líquen plano, líquen estriado, lúpus e dermatomiosite.29
Doença do enxerto versus hospedeiroMalard et al. identificaram a presença de pDCs em fragmentos de pele de pacientes com DEVH aguda, assim como uma forte expressão de MxA, sinalizando a produção local de IFN tipo 1.30 Previamente, o mesmo grupo relatou a redução sérica dos níveis de pDCs nos pacientes com DEVH aguda, e os autores sugerem que essa redução retrata a infiltração das pDCs nos tecidos‐alvo da DEVH.30,31 Contudo, a presença de células CD123+na mucosa oral de pacientes com DEVH crônica não foi superior aos controles no estudo realizado por Botari et al., o que poderia sugerir uma participação das pDCs apenas nos estágios iniciais da doença do enxerto versus hospedeiro (DEVH).32
VerrugasA demonstração da presença de pDCs ativadas nas verrugas virais inflamadas foi baseada na expressão intensa de MxA, ao contrário dos dados de Tomasini et al.3,33 Os resultados opostos podem estar relacionados aos diferentes critérios histológicos de verruga inflamada utilizados pelos dois grupos.33
Tassone et al. avaliaram pacientes com síndrome WHIM (verrugas, hipogamaglobulinemia, infecções e mielocatexia), que apresentam verrugas refratárias; os autores apontaram redução das pDCs no sangue periférico e nas lesões cutâneas, bem como ausência da produção de IFN tipo 1, avaliada por meio da expressão de MxA, sugerindo a incapacidade de atividade antiviral das pDCs via TLR9.34
Doenças fúngicasPagliari et al. avaliaram o papel das pDCs em três micoses profundas (cromoblastomicose, lacaziose e paracoccidioidomicose).35 As pDCs foram encontradas em 37% dos fragmentos de pele dos pacientes com cromoblastomicose (CBM) e em 50% dos espécimes de pacientes com paracoccidoidomicose (PCM), porém ausentes nos pacientes com lacaziose. Os autores sugeriram a hipótese de que as pDCs seriam fonte secundária de citocinas relevantes na atividade antifúngica nos casos de CBM e PCM. No caso da lacaziose, a ausência de pDCs poderia significar que essas células não atuam na resposta imune antifúngica.
HanseníaseMassone et al. descreveram a ausência de expressão de CD123 nos fragmentos de biópsia de pele de pacientes com hanseníase, exceto pela expressão focal em dois casos de eritema nodoso hansênico, inferindo que as pDCs não estariam envolvidas na resposta imunológica contra o Mycobacterium leprae.36 Hirai et al., contudo, encontraram pDCs no infiltrado inflamatório e também ao redor dos vasos na pele de pacientes com hanseníase. O número de pDCs nos casos tuberculoides foi significativamente maior em comparação com os casos virchowianos.37
Tumores cutâneosA presença das pDCs nos tumores cutâneos foi analisada por diversos autores. Abbas et al. identificaram em seu estudo a presença de pDCs em 100% dos casos de queratoacantoma (KC) e em 90% dos casos de carcinoma espinocelular.38 No KC, as pDCs foram mais abundantes, representando uma proporção maior do infiltrado inflamatório, e apresentaram maior atividade, sugerindo um possível papel das pDCS na patogênese da regressão dos KC. Recentemente, Fraga et al. corroboraram a presença abundante de pDCs tanto no KC quanto no carcinoma espinocelular, sem diferença estatisticamente significativa.39
Imiquimode é agonista seletivo do TLR7, via ativação do fator de transcrição NF‐kB e produção de citocinas inflamatórias, como IFN tipo 1, e é utilizado no tratamento de alguns tumores cutâneos.40 Carcinomas basocelulares (CBCs) tratados com imiquimode apresentaram pDCs ativadas produtoras de IFN‐α no infiltrado peritumoral.41 Posteriormente, Ogawa et al. demonstraram a correlação entre o número de pDCs recrutadas nas lesões de queratoses actínicas (QA) e efeito terapêutico do imiquimode nesses casos.40
A presença das pDCs também foi descrita no melanoma, principalmente localizadas ao redor dos vasos e próximas às células tumorais, tanto nos casos primários quanto nas metástases. Porém, essas pDCs não estão ativadas, há falta de sinalização TLR7 e TLR9 no ambiente tumoral, não há a produção de IFN tipo I, e foram associadas ao crescimento tumoral. Ao contrário, melanomas em regressão apresentam pDCs ativadas, indicando possível atividade antitumoral. O tratamento de tumores cutâneos (QA, CBCs superficiais, doença de Bowen e inclusive lentigo maligno melanoma) com imiquimode (agonista de TLR7 e TLR9) ativa as pDCs a produzirem IFN tipo 1.42
Analogamente, Karouni et al. descreveram que, no sarcoma de Kaposi (SK), pDCs estão presentes em 90% dos casos, porém com expressão diminuída de MxA, podendo indicar supressão pelo herpes vírus associado ao sarcoma de Kaposi (HVSK), por meio de proteínas virais que inibiriam as vias de sinalização responsáveis pela ativação das pDCs.
Os principais achados das pDCs nas doenças dermatológicas estão resumidos na tabela 1.43
Doenças dermatológicas e células dendríticas plasmocitoides (pDCs)
| Doenças dermatológicas | pDCs |
|---|---|
| Lúpus eritematoso | LES: pDCs circulantes reduzidas3,11–13 |
| LD: grande quantidade de pDCs produtoras de IFN‐α3,11–13 | |
| LSA, LD: distribuição superficial3 | |
| LT, RHM: distribuição ao redor dos vasos profundos3 | |
| pDCs localizadas preferencialmente na epiderme nos pacientes com DM e na derme nos casos de lúpus11 | |
| Líquen plano | pDCs dispostas similarmente ao infiltrado linfocitário em faixa na junção dermoepidérmica16,17 |
| pDCs aumentadas no líquen plano oral18 | |
| Líquen estriado | pDCs presentes no infiltrado inflamatório |
| Distribuição periécrina das pDCs19 | |
| Dermatite atópica | pDCs circulantes aumentadas em relação aos controles |
| Menor recrutamento de pDCs nas lesões de DA comparado ao de outras dermatoses, como lúpus eritematoso e psoríase20,21 | |
| Erupção polimorfa à luz | Wackernagel et al.:22 pDCs ausentes |
| Rossi et al.:23 pDCs aumentadas nas lesões de EPL, principalmente na derme. Os autores atribuem a diferença à metodologia com inclusão de teste fotoprovocativo | |
| Psoríase | pDCs presentes no infiltrado linfocitário T na derme das placas de psoríase e na pele perilesional24 |
| Redução das pDCs no sangue periférico de pacientes com psoríase24 | |
| Helioterapia: redução do número de pDCs e da expressão de MxA25 | |
| Forte expressão de quemerina e presença de pDCs na derme da pele perilesional26 | |
| Pitiríase liquenoide | Forte expressão de MxA nas lesões de PL (produção local de IFN tipo 1)27,28 |
| Presença de pDCs na pele em todos os casos (PLEVA e PLC)29 | |
| Doença do enxerto versus hospedeiro | Presença de pDCs nos fragmentos de pele dos pacientes com DEVH aguda, forte expressão de MxA, sinalizando produção local de IFN tipo 130 |
| Redução de pDCs séricas nos pacientes com DEVH aguda31 | |
| Presença de células CD123+na mucosa oral de pacientes com DHVS crônica não foi superior32 | |
| Verrugas | Saadeh et al.:33 pDCs ativadas nas verrugas virais inflamadas, contrário ao encontrado por Tomasini et al.3 (possível diferença no critério histológico para verruga inflamada) |
| Redução das pDCs no sangue periférico e nas lesões cutâneas, ausência de produção de IFN tipo 1 (MxA sem expressão) em pacientes com síndrome WHIM34 | |
| Micoses profundas | pDCs encontradas em 37% dos fragmentos de pele em pacientes com Cromoblastomicose (CBM) e em 50% dos espécimes de pacientes com Paracoccidioidomicose (PCM), porém ausentes nos casos de lacaziose35 |
| Hanseníase | Massone et al.:36 ausência de expressão de CD123, exceto expressão focal em 2 casos de eritema nodoso hansênico |
| Hirai et al.:37 pDCs no infiltrado inflamatório e ao redor dos vasos. Número de pDCs maior nos casos tuberculoides em relação aos casos virchowianos. | |
| Tumores cutâneos | Queratoacantoma: presença de pDCs em 100% dos casos38 |
| CEC: presença de pDCs em 90% dos casos38 | |
| QA: correlação entre a quantidade de pDCs recrutadas nas lesões durante o tratamento com imiquimode e o efeito terapêutico da droga40 | |
| CBC: presença de pDCs ativadas produtoras de IFN‐α no infiltrado peritumoral durante o tratamento com imiquimode41 | |
| Melanoma: pDCs dispostas ao redor dos vasos, próximas às células tumorais, porém não ativadas. Presença associada ao crescimento tumoral. PDCs ativadas nos casos de melanoma em regressão42 | |
| SK: pDCs presentes em 90% dos casos, porém expressão reduzida de MxA (possível supressão das pDCs pelo HVSK)43 |
CBC, carcinoma basocelular; CBM, cromoblastomicose; CEC, carcinoma espinocelular; DA, dermatite atópica; DEVH, doença do enxerto versus hospedeiro; DM, dermatomiosite; EPL, erupção polimorfa à luz; HVSK, herpes vírus associado ao sarcoma de Kaposi; LD, lúpus discoide; LES, lúpus eritematoso sistêmico; LSA, lúpus subagudo; LT, tumid lúpus; PCM, paracoccidioidomicose; pDCs, células dendríticas plasmocitoides; PL, pitiríase liquenoide; PLC, pitiríase liquenoide crônica; PLEVA, pitiríase liquenoide e varioliforme aguda; QA, queratose actínica; RHM, reticulo‐histiocitose multicêntrica; SK, sarcoma de Kaposi; WHIM, verrugas, hipogamaglobulinemia, infecções e mielocatexia.
Sabe‐se atualmente que as pDCs são o elo entre a imunidade inata e adaptativa. Essas células não são residentes na pele, portanto sua presença pode indicar seu papel (tanto central quanto adjuvante) nos processos inflamatórios, autoimunes, neoplásicos e infecciosos. São necessários mais estudos sobre as pDCs, que poderão levar a novos alvos terapêuticos.
Suporte financeiroEsse trabalho foi financiado pelo Fundo de Apoio à Dermatologia do Estado de São Paulo, Sebastião Sampaio (FUNADERSP)−Projeto 52‐2017.
Contribuição dos autoresNatasha Favoretto Dias de Oliveira: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Claudia Giuli Santi: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Celina Wakisaka Maruta: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Valeria Aoki: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Dias de Oliveira NF, Santi CG, Maruta CW, Aoki V. Plasmocytoid dendritic cells in dermatology. An Bras Dermatol. 2021;96:76–81.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.