Há poucos estudos na literatura comparando a eficácia de tratamentos tópicos na micose fungoide (MF) em estágio inicial.
ObjetivosAvaliar a eficácia clínica, os efeitos colaterais e a adesão ao tratamento com bexaroteno tópico e propionato de clobetasol tópico em pacientes com MF em estágio inicial.
MétodosQuarenta pacientes com MF em estágio IA‐IB foram incluídos no estudo. Vinte pacientes foram tratados com gel de bexaroteno a 1% e 20 pacientes foram tratados com pomada de propionato de clobetasol a 0,05%.
ResultadosNo grupo bexaroteno, 11 pacientes (55%) tiveram resposta clínica completa (RCC) e cinco pacientes (25%) tiveram resposta parcial (RP), enquanto no grupo propionato de clobetasol, dez pacientes (50%) tiveram RCC e nove pacientes (45%) tiveram RP. A mediana da duração da remissão foi de 10,5 meses no grupo bexaroteno e quatro meses no grupo propionato de clobetasol. O período de remissão foi estatisticamente significantemente maior no grupo tratado com bexaroteno (p=0,032). Os sintomas de irritação foram estatisticamente significantemente mais comuns no grupo tratado com bexaroteno (p=0,001).
Limitações do estudoA limitação do estudo foi o desenho retrospectivo.
ConclusãoTanto o bexaroteno tópico quanto o propionato de clobetasol tópico foram considerados eficazes na MF. Os sintomas de irritação foram mais comuns no tratamento com bexaroteno tópico. Além disso, o período de remissão com o bexaroteno tópico foi significantemente maior.
A micose fungoide (MF) é o tipo mais comum de linfoma cutâneo de células T (LCCT) primário. As manifestações dermatológicas da MF são manchas e/ou placas nos estágios iniciais da doença, e tumores ou eritrodermia nos estágios avançados.1 As lesões iniciais são manchas e placas eritematosas e descamativas, normalmente localizadas nas áreas do corpo protegidas do sol.2
De acordo com o sistema de estadiamento TNMB (tumores, nódulos, metástases, sangue, do inglês blood) revisado para MF e síndrome de Sézary, da International Society of Cutaneous Lymphoma/European Organization for Research and Treatment of Cancer (ISCL/EORTC), os estágios IA, IB e IIA são considerados MF em estágio inicial.3 Terapias direcionadas à pele, como corticosteroides tópicos, bexaroteno tópico, cloridrato de mecloretamina tópico, carmustina tópica, irradiação de feixe de elétrons, UVB de banda estreita e PUVA (psolareno+UVA) são utilizadas na MF em estágio inicial.4 Entre esses tratamentos, os corticosteroides tópicos são agentes de tratamento frequentemente utilizados em MF. Eles exibem atividade antineoplásica induzindo apoptose em linfócitos e inibindo a adesão de linfócitos ao endotélio e a adesão intercelular.5,6 Além disso, o bexaroteno é agonista seletivo do receptor retinoide X que exerce seu efeito antineoplásico por meio da modulação da proliferação celular, diferenciação e apoptose pela regulação da expressão gênica.7,8 Entretanto, há um número limitado de estudos comparando a eficácia, os efeitos colaterais e o perfil de segurança dessas modalidades de tratamento em MF e as diretrizes de tratamento não têm recomendações definitivas em relação a uma modalidade de tratamento preferencial.9
O objetivo do presente estudo foi avaliar e comparar a eficácia clínica, os efeitos colaterais e a adesão ao tratamento com gel tópico de bexaroteno a 1% e pomada tópica de propionato de clobetasol a 0,05% em pacientes com MF em estágio inicial.
MétodosParticipantes e protocoloUma revisão retrospectiva de prontuários foi realizada na unidade de dermato‐oncologia do Departamento de Dermatologia de um hospital terciário. O estudo foi aprovado pelo Comitê de Ética Local (número de aprovação: 3966). O estudo foi realizado de acordo com a versão mais recente da “Declaração de Helsinque” e “Diretrizes para Boas Práticas Clínicas”.
Os prontuários médicos dos pacientes com MF acompanhados no Ambulatório de Dermato‐oncologia entre setembro de 2020 e setembro de 2023 foram compilados e analisados. Pacientes com diagnóstico definitivo de MF com base na correlação clinicopatológica e aqueles em monoterapia foram incluídos no estudo. Foram incluídos indivíduos com MF em estágio IA e IB, não havendo pacientes com MF foliculotrópica entre os selecionados. Os critérios de exclusão foram terapia tópica para MF no último mês, tratamento sistêmico nos últimos dois meses e retinoides orais nos últimos quatro meses. Pacientes que estavam grávidas, amamentando ou menores de 18 anos também não foram incluídos no estudo. Foi pedido às mulheres em idade fértil que apresentassem teste de gravidez negativo antes do início da terapia. Além disso, homens e mulheres foram informados sobre a necessidade de usar métodos contraceptivos eficazes durante todo o período de tratamento.
Características demográficas e clínicas dos pacientes, como idade, sexo, duração da doença e estadiamento clínico foram registradas. O sistema de classificação TNMB foi usado para realizar o estadiamento dos pacientes.3,10 Pacientes com MF estágio IA‐IB foram tratados com gel de bexaroteno a 1% duas vezes ao dia (grupo bexaroteno) ou pomada de propionato de clobetasol a 0,05% duas vezes ao dia (grupo propionato de clobetasol). Os dados de todos os pacientes foram compilados após serem acompanhados por pelo menos dois anos. Os pacientes em ambos os grupos foram tratados por um mínimo de 16 semanas e foram avaliados clinicamente pelo mesmo dermatologista a cada quatro semanas. A resposta clínica foi determinada utilizando critérios oncológicos padrão. Resposta clínica completa (RCC; 100% livre, remissão cutânea completa), resposta parcial (RP; melhora ≥ 50%, mas <100%), doença estável (DE; <50% de melhora ou nenhuma mudança) e doença progressiva (DP; doença mais avançada do que na linha basal em ≥ 25%) foram usadas para avaliar a resposta clínica.11 Além disso, o tempo de resposta clínica, a taxa de recorrência, o tempo até a recorrência e a adesão ao tratamento foram observados. A presença de efeitos adversos, na forma de eritema, vesículas, crostas, áreas hipo ou hiperpigmentadas, sensação de queimação ou prurido foram registradas. Em caso de ocorrência de efeito colateral limitante do tratamento, o intervalo entre as doses foi estendido ou o tratamento foi descontinuado. Em caso de DE ou DP após pelo menos 16 semanas de terapia, o tratamento foi trocado.
Análise estatísticaTodas as análises foram realizadas com o IBM Statistical Package for the Social Sciences (SPSS) versão 21.0. A distribuição de normalidade das variáveis contínuas foi verificada com o teste de Kolmogorov‐Smirnov. Os dados com distribuição não paramétrica foram expressos como mediana (intervalo interquartil) e as variáveis categóricas foram expressas por número (porcentagem). Amostras independentes foram comparadas com o teste U de Mann‐Whitney e o teste de Kruskal‐Wallis. O teste qui‐quadrado de Pearson e o teste exato de Fisher foram usados para variáveis categóricas. Valores de p bilaterais menores que 0,05 foram considerados estatisticamente significantes.
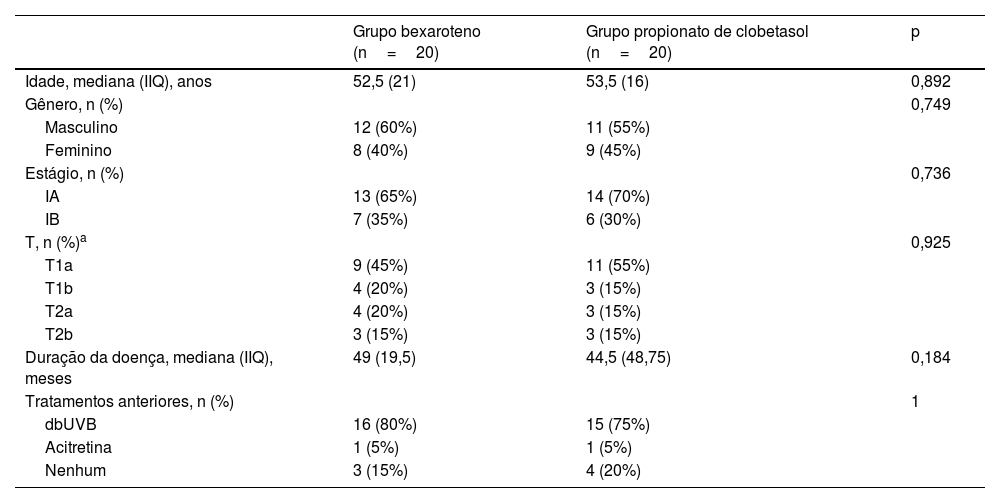
ResultadosUm total de 40 pacientes com MF estágio IA‐IB foi incluído no estudo. Dos 40 pacientes, 20 (50%) foram tratados com gel de bexaroteno a 1% e 20 (50%) foram tratados com pomada de propionato de clobetasol a 0,05%. Não houve diferenças significantes em relação à idade, proporção de gênero e características clínicas para cada variável entre os grupos de pacientes (p>0,05; tabela 1).
Características demográficas e clínicas dos pacientes
| Grupo bexaroteno (n=20) | Grupo propionato de clobetasol (n=20) | p | |
|---|---|---|---|
| Idade, mediana (IIQ), anos | 52,5 (21) | 53,5 (16) | 0,892 |
| Gênero, n (%) | 0,749 | ||
| Masculino | 12 (60%) | 11 (55%) | |
| Feminino | 8 (40%) | 9 (45%) | |
| Estágio, n (%) | 0,736 | ||
| IA | 13 (65%) | 14 (70%) | |
| IB | 7 (35%) | 6 (30%) | |
| T, n (%)a | 0,925 | ||
| T1a | 9 (45%) | 11 (55%) | |
| T1b | 4 (20%) | 3 (15%) | |
| T2a | 4 (20%) | 3 (15%) | |
| T2b | 3 (15%) | 3 (15%) | |
| Duração da doença, mediana (IIQ), meses | 49 (19,5) | 44,5 (48,75) | 0,184 |
| Tratamentos anteriores, n (%) | 1 | ||
| dbUVB | 16 (80%) | 15 (75%) | |
| Acitretina | 1 (5%) | 1 (5%) | |
| Nenhum | 3 (15%) | 4 (20%) |
Os dados foram expressos como mediana (intervalo interquartil) em variáveis contínuas não paramétricas e n (%) em variáveis categóricas.
Foram utilizados o teste U de Mann‐Whitney, o teste qui‐quadrado de Pearson, o teste exato de Fisher e o teste de Kruskal Wallis.
IIQ, intervalo interquartil.
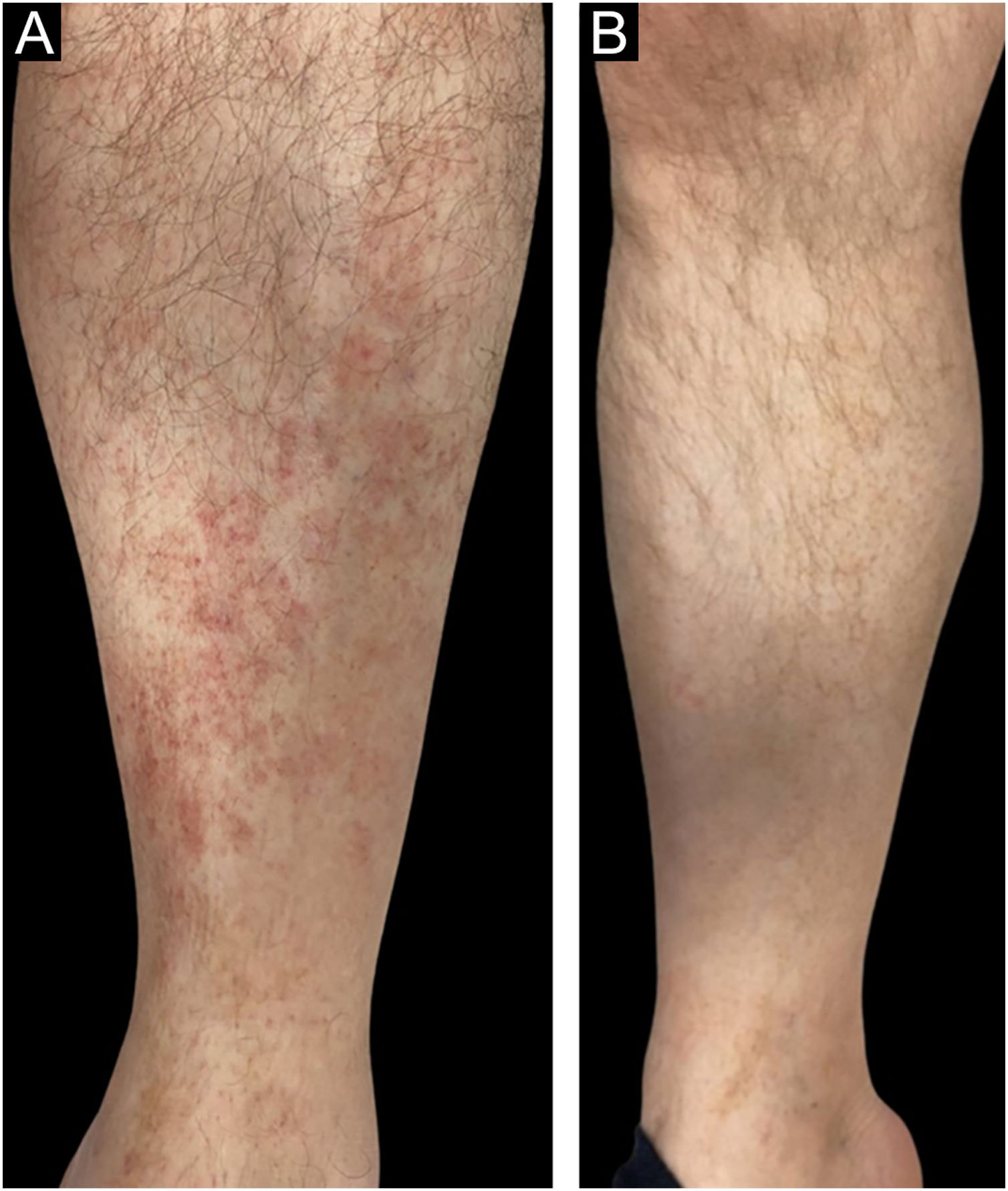
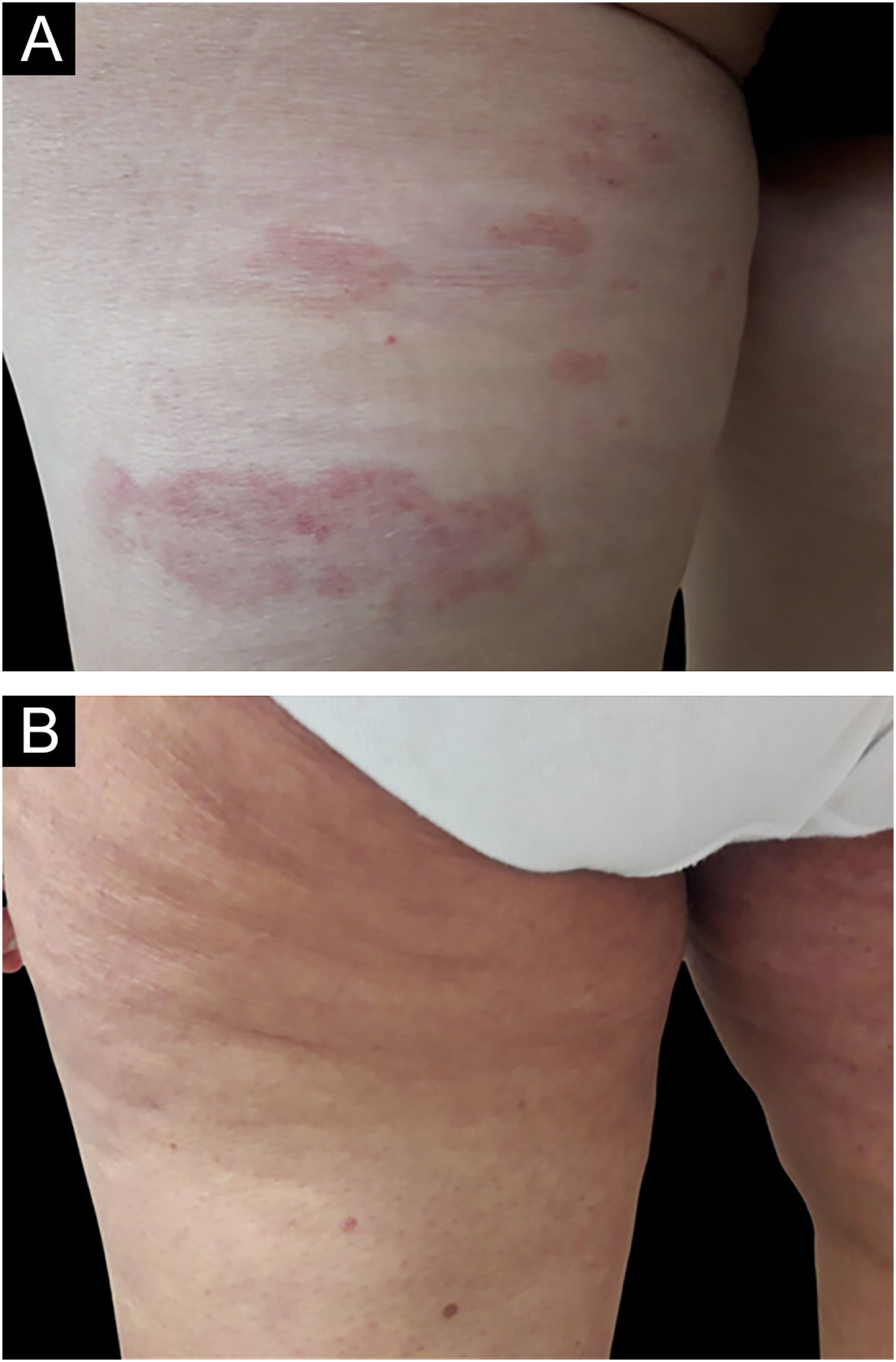
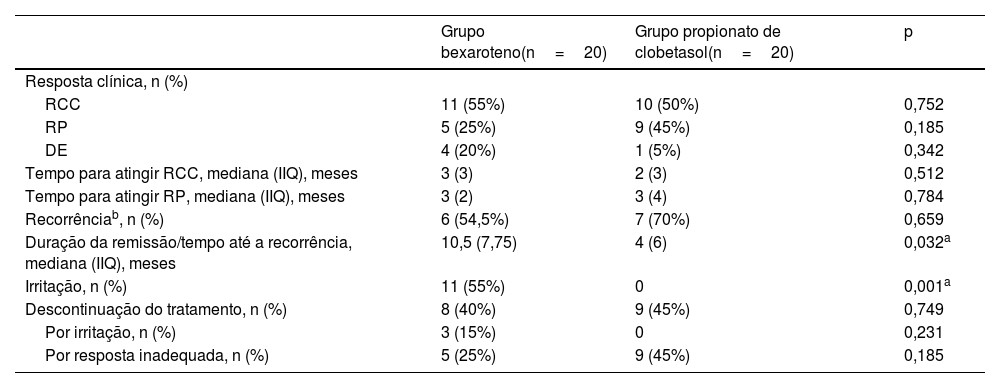
No grupo bexaroteno, 11 pacientes (55%) apresentaram RCC, cinco pacientes (25%) apresentaram RP e quatro (20%) apresentaram DE, enquanto no grupo propionato de clobetasol, dez pacientes (50%) apresentaram RCC, nove (45%) apresentaram RP e um paciente (5%) apresentou DE (figs. 1–2). DP não foi observada em nenhum dos grupos de tratamento. Não houve diferença estatisticamente significante entre os grupos bexaroteno e propionato de clobetasol em termos de RCC, RP e DE (p=0,752, p=0,185, p=0,342, respectivamente; tabela 2).
Comparação da resposta clínica, taxas de recorrência e descontinuação do tratamento nos grupos bexaroteno e propionato de clobetasol
| Grupo bexaroteno(n=20) | Grupo propionato de clobetasol(n=20) | p | |
|---|---|---|---|
| Resposta clínica, n (%) | |||
| RCC | 11 (55%) | 10 (50%) | 0,752 |
| RP | 5 (25%) | 9 (45%) | 0,185 |
| DE | 4 (20%) | 1 (5%) | 0,342 |
| Tempo para atingir RCC, mediana (IIQ), meses | 3 (3) | 2 (3) | 0,512 |
| Tempo para atingir RP, mediana (IIQ), meses | 3 (2) | 3 (4) | 0,784 |
| Recorrênciab, n (%) | 6 (54,5%) | 7 (70%) | 0,659 |
| Duração da remissão/tempo até a recorrência, mediana (IIQ), meses | 10,5 (7,75) | 4 (6) | 0,032a |
| Irritação, n (%) | 11 (55%) | 0 | 0,001a |
| Descontinuação do tratamento, n (%) | 8 (40%) | 9 (45%) | 0,749 |
| Por irritação, n (%) | 3 (15%) | 0 | 0,231 |
| Por resposta inadequada, n (%) | 5 (25%) | 9 (45%) | 0,185 |
Os dados foram expressos como mediana (intervalo interquartil) em variáveis contínuas não paramétricas e n (%) em variáveis categóricas.
Teste U de Mann‐Whitney, teste qui‐quadrado de Pearson e teste exato de Fisher foram usados.
RCC, resposta clínica completa; IIQ, intervalo interquartil; RP, resposta parcial; DE, doença estável.
A mediana de tempo necessária para atingir RCC foi de três meses (IIQ:3) no grupo bexaroteno e dois meses (IIQ:3) no grupo propionato de clobetasol. A mediana de tempo necessária para atingir RP foi de três meses (IIQ:2) no grupo bexaroteno e três meses (IIQ:4) no grupo propionato de clobetasol. Não houve diferença estatisticamente significante entre os grupos bexaroteno e propionato de clobetasol em termos de tempo necessário para atingir RCC e RP (p=0,512, p=0,784, respectivamente; tabela 2).
A taxa de recorrência foi avaliada apenas em pacientes que atingiram RCC. A recorrência ocorreu em seis (54,5%) de 11 pacientes que atingiram RCC no grupo bexaroteno e em sete (70%) de dez pacientes que atingiram RCC no grupo propionato de clobetasol. Não houve diferença estatisticamente significante entre os grupos bexaroteno e propionato de clobetasol em termos de recorrência (p=0,659; tabela 2).
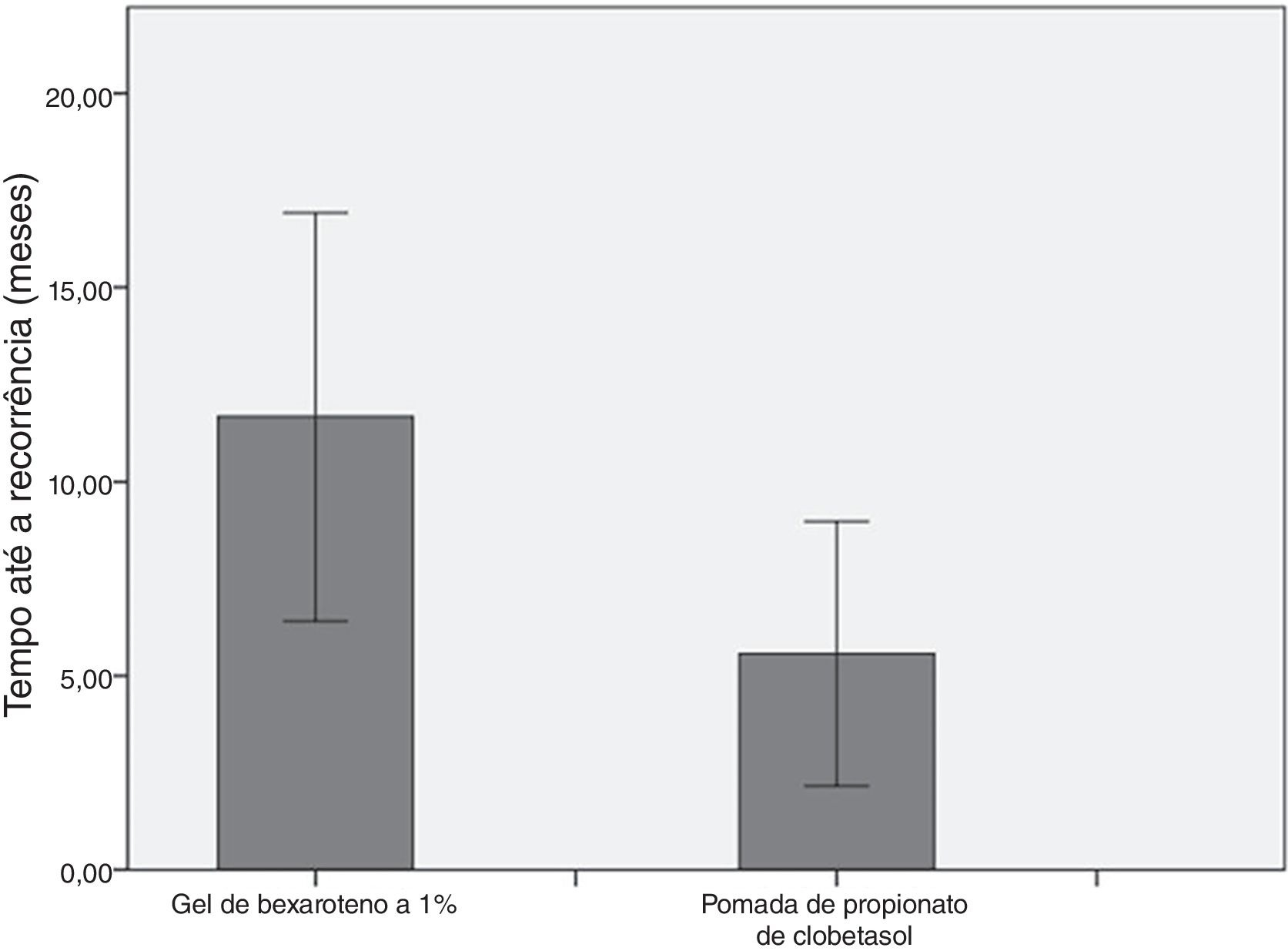
A duração mediana da remissão/mediana de tempo até a recorrência foi de 10,5 meses (IIQ:7,75) no grupo bexaroteno e quatro meses (IIQ:6) no grupo propionato de clobetasol. O período de remissão foi estatisticamente significantemente maior no grupo bexaroteno (p=0,032; tabela 2, fig. 3).
Sintomas de irritação, como sensação de queimação, ardor, prurido, eritema e lesões eczematosas foram observados apenas no grupo bexaroteno. Onze de 20 pacientes (55%) no grupo bexaroteno apresentaram sintomas de irritação durante todo o período de tratamento (p=0,001). Os sinais de irritação foram confinados às áreas cutâneas onde o gel de bexaroteno foi aplicado. Efeitos colaterais cutâneos de corticosteroides tópicos, como atrofia, hipo ou hiperpigmentação e estrias, não foram observados no grupo propionato de clobetasol. Não houve diferença entre os grupos em termos de adesão ao tratamento (p=0,749). No grupo bexaroteno, três (15%) pacientes descontinuaram o tratamento por irritação e cinco (25%) por resposta inadequada, enquanto no grupo propionato de clobetasol, nove (45%) pacientes descontinuaram o tratamento por resposta inadequada (tabela 2).
Quando os pacientes com MF foram avaliados mais detalhadamente de acordo com o estágio T com base na presença de manchas e manchas/placas,12 não houve diferença estatisticamente significante em termos de RCC, RP e DE entre os grupos T1a vs. T1b e T2a vs. T2b tanto no grupo bexaroteno quanto no grupo propionato de clobetasol (RCC p=1, RP p=1, DE p=1 para T1a vs. T1b no grupo bexaroteno; RCC p=1, RP p=1, DE p=1 para T2a vs. T2b no grupo bexaroteno; RCC p=0,209, RP p=1, DE p=0,214 para T1a vs. T1b no grupo propionato de clobetasol; RCC p=0,40, RP p=0,40 para T2a vs. T2b no grupo propionato de clobetasol).
DiscussãoA MF é doença que requer tratamento de longo prazo e seguimento após o diagnóstico. Agentes tópicos e terapias direcionadas à pele são preferidos no tratamento de primeira linha de MF em estágio inicial por dois motivos principais.9 Em primeiro lugar, resultados eficazes podem ser alcançados por terapias direcionadas à pele, minimizando os efeitos colaterais tóxicos. Além disso, tratamentos agressivos não demonstraram melhorar a sobrevida em MF.13 Entretanto, essas opções podem não estar sempre disponíveis, dependendo das instalações hospitalares e do local de residência e/ou pode ser necessária a troca para outro tratamento em decorrência de efeitos colaterais, resposta clínica inadequada e doença refratária.
O presente estudo avaliou a eficácia clínica do bexaroteno e do propionato de clobetasol tópicos em 40 pacientes com MF em estágio IA e IB. Não houve diferença na eficácia clínica e na taxa de recorrência entre os grupos bexaroteno e propionato de clobetasol, mas o período de remissão foi significantemente maior no grupo bexaroteno. Por outro lado, os sintomas de irritação foram significantemente maiores no grupo bexaroteno. Que seja de conhecimento dos autores, este é o primeiro estudo comparando a eficácia e tolerabilidade do bexaroteno e do propionato de clobetasol tópicos no tratamento de MF.
Há um número limitado de estudos investigando a eficácia do bexaroteno ou do propionato de clobetasol tópicos na literatura. Em estudo preliminar, a segurança e a eficácia de dois géis retinoides tópicos (ácido retinoico 9‐cis vs. bexaroteno) foi avaliada em seis pacientes com LCCT estágio I. Nas 18 lesões índice, a resposta completa foi alcançada em 56%, e a RP foi alcançada em 22% no grupo bexaroteno.14 No presente estudo, as taxas de RCC e RP no grupo bexaroteno foram semelhantes aos achados desse estudo preliminar (RCC: 55%, RP: 25%, respectivamente). Em relação ao propionato de clobetasol, Zackheim et al.15 conduziram estudo prospectivo para determinar a eficácia dos corticoides tópicos na MF com 79 pacientes (51 T1, 28 T2). Os pacientes aplicaram corticosteroides tópicos de classe I a III duas vezes ao dia. Dos 51 pacientes em estágio T1, 63% atingiram remissão completa, 31% atingiram RP, e a taxa de resposta total (RCC+RP) foi de 94%. Nos 28 pacientes em estágio T2, 25% atingiram remissão completa, 57% atingiram RP, e a taxa de resposta total (RCC+RP) foi de 82%.15 No presente estudo, em pacientes com MF T1, dois tiveram 50% de RCC e 45% de RP, e a taxa de resposta total foi de 95%, o que está de acordo com os achados do estudo de Zackheim et al.15
No ensaio de fase I e fase II do gel de bexaroteno, 67 pacientes com MF em estágio inicial (41 IA, 20 IB, cinco IIA, um IIB) foram incluídos. Em 67 pacientes, 21% atingiram RCC e 42% atingiram RP, enquanto 21% tiveram DE e 16% DP de acordo com a Avaliação Global do Médico (PGA, do inglês Physician's Global Assessment). A mediana do tempo projetado para atingir RCC e RP foi de 20,1 semanas e a duração mediana projetada da resposta desde o início da terapia foi de 99 semanas. A mediana da durabilidade da resposta (do início da resposta até a recorrência) foi de 61,1 semanas.11 No presente estudo, 55% dos pacientes atingiram RCC no grupo bexaroteno e isso foi considerado maior em comparação com o ensaio de fase I/II. Possíveis razões para essa diferença podem ser listadas da seguinte maneira: i) no presente estudo, havia apenas pacientes em estágio IA e IB; não foram incluídos pacientes em estágio IIA e IIB; ii) no ensaio de fase I/II, 35,8% dos pacientes eram refratários ou intolerantes a tratamentos anteriores; entretanto, não houve pacientes refratários ou intolerantes no presente grupo de estudo. Enquanto a mediana do período de remissão em 14 pacientes que atingiram RCC no ensaio de fase I/II foi declarado como sendo oito semanas, a duração mediana da remissão de pacientes que atingiram RCC foi de 10,5 meses no presente estudo. Da mesma maneira, a diferença entre os períodos de remissão pode ser explicada pela inexistência de pacientes em estágio avançado ou refratário. Além disso, no ensaio de fase I/II, 52% dos 42 pacientes responsivos ao tratamento continuaram o tratamento com gel de bexaroteno a 1%, enquanto 31% usaram gel a 0,5% e 17% usaram gel a 0,1%. Pode‐se sugerir que essa diferença nas concentrações do medicamento também pode afetar as taxas e a duração da remissão.
No ensaio de fase III do gel de bexaroteno a 1%, 50 pacientes com LCCT em estágio inicial refratário ou persistente (25 IA, 22 IB, dois IIA, um IIB) foram incluídos. Em 50 pacientes, 2% atingiram RCC e 42% atingiram RP, enquanto 36% tiveram DE e 16% apresentaram DP de acordo com o PGA.16 Quando os achados do ensaio de fase III foram avaliados em comparação com o presente estudo, no ensaio de fase III, a taxa de RCC com bexaroteno foi menor, enquanto as taxas de RP e DE foram maiores, e 16% dos pacientes apresentaram DP. Mas, diferentemente do presente estudo, pacientes refratários ou persistentes foram incluídos no ensaio de fase III, e também havia pacientes em estágio IIA e IIB. Como resultado do ensaio de fase III, os pacientes em estágio IIA e IIB foram relatados como não responsivos ao tratamento. A presença de pacientes refratários e em estágio avançado no ensaio de fase III pode ter causado menores taxas de RCC.
O presente estudo apresentou outros achados significantes. No grupo de pacientes que atingiu RCC, a mediana do tempo até a recorrência foi de 10,5 meses no grupo bexaroteno e quatro meses no grupo propionato de clobetasol. A mediana do tempo até a recorrência com bexaroteno foi significantemente maior do que no grupo tratado com propionato de clobetasol. Sintomas de irritação foram observados em 55% dos pacientes no grupo bexaroteno, e três (15%) pacientes descontinuaram o tratamento em decorrência de irritação. No ensaio de fase I/II, quatro (6%) pacientes descontinuaram o gel de bexaroteno, três deles por efeitos colaterais cutâneos e um deles por neuralgia do trigêmeo.11 No ensaio de fase III, em 50 pacientes, 94% apresentaram pelo menos um efeito adverso relacionado ao tratamento e 26% deles apresentaram efeitos adversos moderadamente graves e graves. No geral, o efeito adverso mais comum foi a dermatite irritativa.16 No presente estudo, os sintomas de irritação também foram o efeito colateral mais comum relacionado ao bexaroteno, em concordância com os achados dos estudos de fase.
O presente estudo apresenta diversas limitações, e a principal é seu desenho retrospectivo. Além disso, pacientes em estágio IIA não foram incluídos no presente estudo, apesar de serem classificados na categoria de estágio inicial, porque a fototerapia e os tratamentos sistêmicos são preferidos no tratamento clínico desses pacientes pelos autores.
ConclusãoTanto o gel tópico de bexaroteno a 1% quanto a pomada tópica de propionato de clobetasol a 0,05% foram considerados opções eficazes e bem toleradas na MF em estágio inicial. Embora os sintomas de irritação decorrentes do bexaroteno tópico tenham sido significantemente mais comuns do que do propionato de clobetasol tópico, isso não afetou a adesão ao tratamento. Considerando a fácil acessibilidade, a relação custo‐efetividade, os efeitos colaterais cutâneos limitados e controláveis dos corticosteroides, pode‐se sugerir que os corticosteroides tópicos estarão à frente do bexaroteno tópico no algoritmo de tratamento da MF em estágio inicial. Entretanto, o bexaroteno tópico também é opção de tratamento alternativa eficaz com um período de remissão mais longo. Mais estudos prospectivos randomizados controlados com número maior de pacientes são necessários para abordar de maneira completa a eficácia e o perfil de segurança das opções de tratamento direcionado à pele na MF.
Suporte financeiroNenhum.
Contribuição dos autoresAslı Aksu Çerman: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Pinar Ozdemir Cetinkaya: Elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Birgul Ozkesici Kurt: Elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Artun Kırker: Obtenção dos dados; aprovação da versão final do manuscrito.
İlknur Altunay: Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
ORCID IDs: Aslı Aksu Çerman: 0000‐0003‐3979‐7486, Pinar Ozdemir Cetinkaya: 0000‐0001‐5286‐3260, Birgül Özkesici Kurt: 0000‐0003‐3121‐5816, Artun Kırker: 0000‐0001‐7320‐0431, İlknur Altunay: 0000‐0002‐1354‐7123.
Trabalho realizado na University of Health Sciences, Şişli Hamidiye Etfal Training and Research Hospital, Departamento de Dermatologia, Seyrantepe, İstambul, Turquia.
Como citar este artigo: Çerman AA, Cetinkaya PO, Kurt BÖ, Kırker A, Altunay İ. Comparison of the efficacy of treatment with clobetasol propionate or bexarotene in early‐stage mycosis fungoides. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.04.011