A alopecia areata é uma doença altamente frequente com grande impacto na qualidade de vida e diversas opções de tratamento com pouca evidência confirmatória.
ObjetivoDivulgar as recomendações de dermatologistas brasileiros com experiência no tratamento da alopecia areata.
MétodosOito especialistas de diferentes centros universitários com experiência em alopecia areata foram indicados pela Sociedade Brasileira de Dermatologia para a elaboração de um consenso sobre seu tratamento. A partir de metodologia DELPHI adaptada, os elementos relevantes foram considerados; a seguir, fez‐se análise da literatura recente e produção do texto. O consenso sobre o manejo da alopecia areata foi definido com a aprovação de pelo menos 70% do painel.
Resultados/ConclusõesCorticoterapia injetável intralesional foi considerada a primeira opção para doença localizada no adulto. Nos quadros extensos com sinais de atividade, a corticoterapia sistêmica deve ser considerada, podendo ser usada em conjunto com imunossupressores (poupadores de corticoides). Imunossensibilizante (difenciprona) é opção para casos extensos estáveis. Avaliação de efeitos colaterais é tão importante quanto a taxa de repilação.
A alopecia areata (AA) é uma doença autoimune que tem como alvo os folículos pilosos na fase anágena e causa alopecia não cicatricial. Geralmente, a AA se manifesta antes dos 40 anos, sem predileção por sexo ou etnia. O risco de desenvolvimento de AA ao longo da vida é estimado em 2%.1 Em um inquérito feito pela Sociedade Brasileira de Dermatologia, a AA foi responsável por 1,2% de todos os atendimentos dermatológicos. Entre as causas de queda de cabelos, foi apenas menos frequente do que a alopecia androgenética e o eflúvio telógeno.2
A maioria dos estudos que subsidiam os tratamentos para AA não apresenta alto nível de evidência científica.3 O objetivo deste trabalho é orientar o tratamento e o seguimento do paciente com AA com base nas recomendações de um grupo de experts brasileiros.
MétodosOito dermatologistas de diferentes hospitais universitários, com experiência em AA, foram indicados pela Sociedade Brasileira de Dermatologia para a elaboração de um consenso sobre tratamento da doença. A metodologia usada foi a DELPHI adaptada.
A primeira etapa constituiu na definição da estrutura do texto e dos tópicos a serem abordados. Em seguida, os temas foram divididos entre os participantes, que fizeram a revisão bibliográfica e a redação do texto. Posteriormente, todas as seções e recomendações sobre o tratamento da AA foram revistas e discutidas entre todos os membros. O consenso foi definido com a aprovação de pelo menos 70% do painel.
Considerações prévias ao tratamentoEstão resumidas na tabela 1.
Considerações prévias ao tratamento da alopecia areata
| • Doença crônica de curso imprevisível |
| • Acometimento de áreas extensas, longo tempo de evolução e início em idade precoce estão associados a pior prognóstico |
| • Exames complementares não são obrigatórios para diagnóstico e avaliação de comorbidades |
De acordo com a extensão e topografia de acometimento, a AA é clinicamente classificada em diferentes padrões, conforme a tabela 2.4–6
Formas clínicas da alopecia areata (AA)
| AA em placas | Áreas circunscritas de alopecia, denominadas de “placas”, ovais ou arredondadas; únicas ou múltiplas. Embora a lesão elementar não seja propriamente uma placa, o termo ficou consagrado pela livre tradução de patch, do inglês. |
| AA total | Alopecia que compromete todo o couro cabeludo |
| AA universal | Alopecia que compromete todo o corpo |
| AA ofiásica | Alopecia em faixa nas regiões laterais e occipital do couro cabeludo |
| AA ofiásica invertida (tipo sisaifo) | Alopecia na área frontoparietal, poupando as regiões laterais e occipital |
| AA difusa | Diminuição global da densidade, sem placas |
| AA difusa aguda e total | Perda difusa, progressiva e rápida dos cabelos, geralmente evoluindo para AA total em cerca de três meses |
Com o intuito de definir os diversos tipos de tratamento para cada paciente, neste consenso foi considerada doença extensa aquela que afeta mais de 50% do couro cabeludo ou aquela com acometimento de mais de 25% do couro cabeludo e rápida evolução ou com alto impacto na qualidade de vida do paciente.
PrognósticoAA é uma doença crônica de curso imprevisível. É possível ocorrer remissão espontânea, bem como evoluir para formas não responsivas aos tratamentos.4 Cerca de 50% dos pacientes com AA apresentam repilação espontânea nos primeiros seis meses e 70% apresentam repilação no primeiro ano, embora possa recorrer meses ou anos após a remissão.7
As formas extensas da doença geralmente não respondem bem ao tratamento. Cerca de 7% dos pacientes evoluem para os subtipos de alopecia total (AT) ou alopecia universal (AU).7 As taxas de recuperação em longo prazo da AT e AU são menores do que 10%.7 Os pacientes com subtipo “difuso agudo e total” têm prognóstico favorável, independentemente do tratamento.6 Os fatores associados a pior prognóstico estão resumidos na tabela 3.7–9
Fatores de pior prognóstico na alopecia areata (AA)
| • Início da doença na infância |
| • Duração do episódio > 1 ano |
| • Área extensa ou ofiásica |
| • Acometimento ungueal |
| • Associação com atopia |
| • Associação com doenças autoimunes, principalmente endócrinas |
| • História familiar de AA |
| • Associação com doenças genéticas, como a síndrome de Down |
Neste consenso, considerou‐se episódio agudo aquele com até seis meses de duração e episódio crônico aquele com duração superior a seis meses. Não se sabe se o tratamento rápido do episódio agudo diminui a chance de desenvolvimento de doença crônica.8 A presença de sinais de atividade (tabela 4) auxilia na decisão terapêutica. O tempo de intervalo entre os episódios é imprevisível e eles podem, até mesmo, não voltar a ocorrer. Não é recomendado tratamento de manutenção permanente para prevenir recaídas.8
Exames complementaresO diagnóstico da AA é feito com base na avaliação clínica e dermatoscópica; o exame anatomopatológico pode ser feito nos casos duvidosos. Não é obrigatória a realização de exames complementares. A depender da suspeita clínica, podem ser requisitados: hemograma, glicemia de jejum, FAN, VDRL, TSH, T4 livre, anti‐TPO, antitireglobulina, 25‐OH vitamina D, vitamina B12, zinco, ferritina e proteína C‐reativa.
Aspectos psicossomáticosUma boa conversa com o paciente portador de AA começa pela discussão de seus aspectos emocionais, inclusive fatores desencadeantes e chances de repilação. O impacto psicológico e social dos cabelos vai além de seu significado biológico. Efeitos negativos da AA no bem‐estar social e emocional e na saúde mental foram evidenciados por índices de qualidade de vida. Considerar a AA como “só uma queda de cabelo” não leva em consideração o impacto negativo que a doença pode ter na vida do paciente.
Autoimagem, relacionamento interpessoal, trabalho e atividade escolar podem ser afetados pela AA, mesmo em pacientes com doença localizada. Mais da metade dos pacientes acredita que a doença tem grandes consequências em suas vidas.10 Reconhecer os aspectos emocionais desse distúrbio “cosmético” propicia um atendimento integral ao paciente.11
Diagnósticos psiquiátricos como depressão, transtorno de ansiedade, distúrbios de ajuste e paranoicos foram relatados em até 78% dos pacientes.12,13 AA é a segunda dermatose mais referendada aos psiquiatras por dermatologistas, superada apenas pela psoríase.14
A eficácia isolada de antidepressivos, psicoterapia, técnicas de relaxamento, terapia individual ou de grupo no tratamento de AA não foi avaliada por ensaios clínicos.11 A hipnoterapia demonstrou melhoria no crescimento do cabelo e no índice de qualidade de vida em dermatologia, com respostas variadas e alta recidiva.15 Mais da metade dos pacientes com AA acredita que seu comportamento poderia determinar a melhora ou piora da doença.10 Para entender e responder às dificuldades que a AA crônica pode apresentar, os pacientes constroem seus próprios modelos de sua condição. Informações recebidas de várias fontes, inclusive médicos, parentes, amigos, internet e noções sociais e culturais existentes sobre saúde e doença, moldam esse modelo. Tais crenças motivam o tratamento. Se o sistema de crenças é inadequado, baixa adesão e abandono do tratamento são frequentes.11
Os grupos de apoio podem desempenhar um papel definitivo no enfrentamento de AA. Os parceiros do grupo ajudam os pacientes a encontrar a própria identidade. Compartilhar experiências com outras pessoas com a mesma doença pode ser um elo fundamental para o tratamento. Os pais devem sempre ser o foco na AA pediátrica. Eles podem emitir a seus filhos a mensagem de que eles não são “normais” ou “bonitos”. Os grupos de apoio ajudam os pais a aprender a comunicar aos filhos que são especiais e iguais para eles, com ou sem cabelos. Reuniões regulares de pacientes com AA e seus familiares podem ser um recurso inestimável para eles. Estratégias positivas de enfrentamento de dificuldades diárias, como aplicação de próteses e situações de desconforto, são compartilhadas, além de atualizações em pesquisa com um olhar para o futuro da doença. Os aspectos psicossomáticos estão resumidos na tabela 5.
Aspectos psicossomáticos na alopecia areata
| • Entender as consequências psicossociais negativas e identificar o paciente que precisa de apoio psicológico é função do dermatologista |
| • A cooperação entre médicos e psicoterapeutas tem efeito positivo no tratamento e na qualidade de vida do paciente |
| • Informações e esclarecimentos são as melhores estratégias para aumentar a adesão ao tratamento |
| • Grupos de apoio devem ser estimulados |
Uma das etapas essenciais no tratamento da AA é a explicação ao paciente sobre a natureza e o curso da doença, bem como das terapias disponíveis. Faz‐se uma discussão realista das expectativas.4 Devido à eficácia variável dos tratamentos e seus respectivos efeitos colaterais, os clínicos têm um papel importante, tornam o paciente mais consciente dos aspectos positivos e negativos de cada opção.4
Deve ficar claro para o paciente que nenhuma das terapias comprovadamente modifica o curso da doença em longo prazo.4 Tratar AA não é algo mandatório; consequentemente, a decisão deve ser compartilhada com o paciente.1 Ficar sem tratamento é uma opção legítima para muitos.8 Considerações terapêuticas estão resumidas na tabela 6.
Essa via de administração transpõe a barreira epidérmica, disponibilizando a substância diretamente na área inflamada.16–18 Com isso, minimiza os possíveis efeitos adversos pertinentes à corticoterapia sistêmica, mas apresenta, no entanto, maior penetração do fármaco se comparada à via tópica.18 Pacientes com placas de alopecia isoladas, de pequenas dimensões (< 3cm), curta duração ou que ocupam menos de 25% do couro cabeludo são os melhores candidatos à infiltração intralesional.5,16,19 Ainda não há estudos clínicos randomizados que atestem a eficácia dessa modalidade terapêutica.20
Cerca de 60% a 75% dos pacientes com AA em placas submetidos à infiltração de corticosteroides apresentam crescimento dos cabelos, taxa que varia com a gravidade da doença; a percepção da resposta clínica ocorre, em geral, após seis semanas do início do tratamento.19,21,22 A corticoterapia intralesional pode ser aplicada no couro cabeludo, sobrancelhas, barba e demais áreas pilosas corporais.5,16 Embora seja um importante pilar do tratamento da AA, a concentração e a dose total ideais da substância a serem aplicadas continuam a ser debatidas.23
O acetonido de triancinolona (AcT) é o corticoide sintético injetável mais usado no mundo.4,24 No Brasil, o AcT disponível está restrito em bula ao uso intraocular e, por isso, a forma mais difundida passou a ser o hexacetonido de triancinolona (HT), seu derivado menos solúvel e com maior risco de atrofia cutânea.18 Classicamente, é usada a concentração de 2,5 a 10mg/mL de triancinolona para o couro cabeludo e 2,5−5mg/mL para a face e demais áreas corporais.3,25 Um estudo‐piloto demonstrou que concentrações menores, como 2,5mg/mL, mostraram‐se tão eficazes quanto concentrações maiores, e com menor risco de atrofia.26 Uma opção ao HT no tratamento intralesional da AA é a betametasona (dipropionato de betametasona 5mg/mL + fosfato dissódico de betametasona 2mg/mL).18 Já foi relatada também boa resposta com acetato de hidrocortisona 25mg/mL.16
A infiltração de 0,05−0,1mL por ponto se dá no plano intradérmico ou porção superior do tecido subcutâneo, com espaçamento de 0,5−1cm entre as puncturas e intervalo de quatro a seis semanas entre as sessões.4,8,21 Recomenda‐se a diluição com soro fisiológico ou glicosado, misturado ou não à lidocaína.18 O acréscimo de lidocaína pode aumentar o risco de floculação do fármaco, caso o anestésico tenha metilparabeno, propilparabeno ou fenol como componentes de seu veículo, o que pode aumentar a chance de atrofia.18
Dor é um fator limitante, sobretudo em crianças ou pacientes que apresentem formas extensas de AA.4,22 O uso de anestésicos tópicos, vibração ou resfriamento local antes da aplicação pode ser útil para minimizar o desconforto do procedimento.18,27 Dispositivos sem agulha também são uma opção. Lembrar que o aparelho deve ser esterilizado antes do uso.4 Essas medidas complementares podem viabilizar a infiltração em crianças e até mesmo em adultos que, a princípio, rejeitem a terapia intralesional. O tratamento deve ser suspenso caso não se perceba melhoria após seis meses do início das infiltrações.4,20 Pacientes não respondedores aos glicocorticoides podem apresentar resistência em razão da baixa expressão de tiorredoxina‐redutase 1 na bainha radicular externa do folículo piloso.20,24
Efeitos adversos incluem dor e hemorragia nos sítios das puncturas, cefaleia, atrofia cutânea local reversível, discromia, absorção sistêmica e, bem mais raramente, anafilaxia.8,17 Atrofia é comum e pode ser minimizada com a aplicação de pequenos volumes do fármaco, concentrações mais diluídas, puncturas mais espaçadas e evitando injeções superficiais fora do plano correto de administração da droga.20 Aumento da pressão intraocular e catarata já foram relatados em pacientes submetidos a múltiplas sessões de corticoterapia intralesional para AA das sobrancelhas.16 As considerações sobre corticoterapia intralesional estão resumidas na tabela 7.
Corticoterapia tópicaA corticoterapia tópica é amplamente usada no tratamento de todas as formas de AA, embora sua eficácia clínica seja controversa em virtude das limitadas evidências.4 Habitualmente é usada de maneira isolada apenas na AA limitada, uma vez que sua eficácia é aparentemente menor nas formas mais avançadas da doença.19 No entanto, seu uso e possíveis benefícios abrangem todos os subtipos de AA, inclusive em associação com terapia sistêmica nos casos extensos.
Diferentes corticosteroides locais já foram usados na AA com respostas variáveis.20 Estudos comparativos, entretanto, revelaram que corticoides de muito alta potência, como clobetasol, são significativamente mais efetivos do que outros de menor potência, como a hidrocortisona.22,28 Entre as vantagens dessa modalidade terapêutica estão o menor efeito colateral em relação à via sistêmica, maior adesão do paciente e a possibilidade de seu uso em diversos veículos.3 Clobetasol já demonstrou resultado positivo quando usado em espuma, creme ou pomada.3,21 Quando aplicado sob oclusão, parece ter sua eficácia aumentada, com resultados promissores até em formas graves da doença, como AA total e universal, embora possa aumentar a chance de aparecimento de efeitos colaterais.21,24
Os efeitos adversos mais comuns são foliculite, atrofia cutânea local, estrias, erupção acneiforme, telangiectasias, discromia e raramente supressão adrenal.4,20 Recomenda‐se lavagem do local após 12 horas da aplicação a fim de reduzir a incidência de foliculite; a posologia de até cinco vezes por semana parece prevenir o aparecimento de atrofia.4 As recomendações sobre corticoterapia tópica estão resumidas na tabela 8.
Inibidores tópicos da calcineurinaEstudos preliminares em modelos animais sugeriram que o tacrolimo pudesse ser uma substância promissora para o tratamento de AA em humanos. No entanto, tacrolimo 0,1% pomada duas vezes ao dia por seis meses mostrou‐se ineficaz na repilação em pacientes de AA.4,29 Embora sem dados de literatura que comprovem sua eficácia, tacrolimo tópico é quase tão frequentemente usado quanto minoxidil para o tratamento da AA, especialmente na região da face e em crianças.29
Pimecrolimo creme 1% também não demonstrou eficácia superior ao placebo.30 Assim como tacrolimo, pimecrolimo não parece ser uma boa opção terapêutica para AA, sobretudo em pacientes não responsivos a terapias prévias. As recomendações sobre imunomoduladores tópicos estão resumidas na tabela 9.
Minoxidil tópicoO mecanismo de ação pelo qual o minoxidil estimula o folículo piloso ainda não foi totalmente esclarecido. Vasodilatação, angiogênese, abertura de canais de potássio e estímulo à proliferação das células da papila dérmica folicular são alguns dos mecanismos propostos.31,32 A partir da premissa de que possa aumentar a duração da fase anágena do ciclo piloso, o minoxidil parece ter aplicação razoável tão logo a repilação se inicie, com o intuito de aumentar a espessura e o comprimento do pelo novo.
Recente metanálise considerou o minoxidil 5% superior ao placebo, quando usado em AA em placas. Essa evidência foi classificada como de moderada qualidade.33 O uso concomitante com antralina tópica ou corticoterapia intralesional parece fornecer resultados superiores aos tratamentos isolados.29 Efeitos colaterais esperados são hipertricose, dermatite de contato e prurido.20
Embora controverso, o minoxidil tópico tem sido amplamente aplicado na prática clínica como terapia adjuvante na AA. A concentração habitual de uso em adultos é de 5%, varia de uma a duas aplicações diárias. As recomendações sobre minoxidil tópico estão resumidas na tabela 10.
Imunoterapia tópicaA imunoterapia tópica (ITT) é feita com agentes desencadeantes de dermatite de contato alérgica. São usados no tratamento da AA com o intuito de diminuir a inflamação linfocítica do folículo anágeno. O mecanismo não está bem esclarecido, mas se acredita que esteja relacionado ao desvio do processo inflamatório do bulbo para o local onde está sendo induzido o novo processo inflamatório pelas medicações. Desse modo, o folículo consegue se recuperar.34,35
Ao entrar em contato com a pele do paciente, o sensibilizante desencadeia reação de hipersensibilidade tardia (tipo IV), origina linfócitos de memória. Assim, após nova exposição, o sistema imunológico produzirá resposta inflamatória mediada por células T.
No Brasil, o agente sensibilizante mais usado para essa finalidade é a difenciprona (DFCP), disponível apenas em farmácias de manipulação. Deve ser formulada em acetona, portanto altamente volátil, e mantida em recipientes sob proteção da luz (frasco âmbar).
Após a exposição inicial à DFCP, toda a cascata imunológica para suscitar memória leva entre duas a três semanas. Somente após esse período a substância será reconhecida como alérgeno, causará dermatite.
A DFCP é indicada principalmente em caso extensos. A resposta clínica satisfatória pode variar entre 30%−48%, mas, se considerada qualquer resposta, pode chegar até 72,2%.34,36,37 O uso da substância é dividido em três fases: inicial, seguimento e manutenção. Cada fase tem suas peculiaridades, que serão discutidas a seguir.
Fase I (inicial ou de sensibilização)Nessa fase, usa‐se DFCP a 2% diluída em acetona. Aplica‐se uma pequena quantidade com cotonete embebido numa área de 2 × 2cm. O processo de sensibilização pode causar hipocromia ou hipercromia local e por isso sugere‐se que a aplicação seja feita em uma área pouco visível, como couro cabeludo atrás da orelha. Recomenda‐se não expor ao sol ou lavar a região por 48 horas.
Fase II (seguimento)Após duas a três semanas da fase I, pode‐se iniciar a fase II. Nessa etapa, aplica‐se DFCP semanalmente em concentração baixa, aumenta‐se gradualmente. Esse é o momento mais delicado da ITT, pois é necessário estabelecer a menor concentração de DFCP que cause um processo inflamatório cutâneo. Não se deve iniciar a aplicação com a mesma concentração da fase inicial, pois há grande chance de causar uma inflamação exacerbada que leve a complicações, como bolhas.
A medicação deve ser aplicada na metade do couro cabeludo em quantidade suficiente para umedecer levemente a pele. Uma extremidade de um cotonete embebido é suficiente para espalhar a medicação em uma metade do couro cabeludo.
Sugere‐se, então, iniciar com baixa concentração e aumentar progressivamente a cada duas semanas: 0,01%; 0,02%; 0,05%; 0,1%; 0,2%; 0,5%; 1% e 2%. A velocidade da progressão fica a critério médico e pode ser feita ainda mais lentamente, utilizando concentrações intermediárias entre as recomendadas. A concentração ideal provoca eritema, descamação, prurido e desconforto de intensidade leve a moderada nas primeiras 48 horas após a aplicação; isso significa que foi suficiente para desencadear processo inflamatório. Assim, se o paciente não relatar sinal/sintoma em duas aplicações, é possível aumentar a concentração na terceira sessão.
Após atingir a concentração ideal, o tratamento deve ser mantido semanalmente. Em casos de falta de resposta por seis meses, pode‐se tentar outro tratamento. No entanto, alguns autores relatam necessidade de persistir com o tratamento por até 12−24 meses para observar repilação.37 Caso ocorra repilação, o tratamento deve ser mantido até que se atinja cobertura cosmética aceitável e ausência de sinais de atividade.
Fase III (desmame/manutenção)Após repilação cosmética, sugere‐se reduzir a frequência das aplicações para quinzenal seguida de mensal e, por fim, suspensão do tratamento. Em casos em que, após suspensão da medicação, ocorrer reativação da doença, deve‐se avaliar a manutenção do tratamento quinzenal ou mensalmente.
As complicações mais frequentes são hiperpigmentação, hipopigmentação, eczema intenso, bolhas, linfonodomegalia, foliculite e sintomas gripais.36 A recomendações sobre ITT estão resumidas na tabela 11.
AntralinaO uso da antralina também visa a desviar o processo inflamatório para longe do bulbo, porém provoca uma dermatite de contato irritativa, e não alérgica. No Brasil, a antralina só está disponível para manipulação. Sua concentração pode variar de 0,5%−2,0% diluída em creme lanette ou solução.
Seu uso em crianças é justificado pela ausência de efeitos colaterais sistêmicos. Apresenta repilação em 71% dos casos de alopecia em placas.38 O tempo médio para resposta inicial é de três meses e o resultado completo, de 15 meses.38
O medicamento é aplicado no local afetado, adentra até 1cm da área aparentemente sã. O paciente é orientado a lavar o local e retirar bem o produto após 30 minutos. Repete‐se o procedimento diariamente. O tempo de contato com a pele é aumentado em 15 minutos, a cada três dias. Ou seja, inicia‐se com 30 minutos, depois se aumenta para 45 minutos, 60 minutos, 75 minutos e assim por diante até o tempo máximo de 2 horas. O objetivo é causar eczema leve. Quando não ocorrer reação após 2 horas, o tempo de contato pode ser prolongado, em alguns casos por toda a noite.
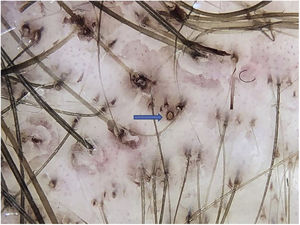
A antralina é uma substância de cor marrom escura e com odor característico. Com a frequência das aplicações, pigmenta os óstios foliculares, simula pontos pretos. Porém, à dermatoscopia, fica clara a diferença entre um ponto preto no centro do óstio e a pigmentação marrom regularmente distribuída na orla do óstio folicular pela antralina (fig. 1). Uma das armadilhas de falha terapêutica pode ser evidenciada quando não se observa pigmentação dos óstios, que pode ter três causas principais: irregularidade da aplicação, tempo curto de contato com o couro cabeludo ou medicamento de qualidade inadequada.
Trata‐se de uma terapia segura, porém devem‐se tomar alguns cuidados para evitar complicações. Como o objetivo é causar irritação local, deve‐se seguir sistematicamente a ordem de aumento do tempo de contato da medicação com a pele, evitar uma irritação exacerbada.
O uso da antralina leva à hiperpigmentação da área tratada, porém a coloração voltará ao normal após a interrupção do tratamento. As recomendações sobre a antralina estão resumidas na tabela 12.
Corticosteroides sistêmicosDiversas formas de administração sistêmica de corticosteroides (CT) já foram descritas para tratamento da AA. O pulso oral de prednisolona 200mg uma vez por semana por três meses apresentou taxa de resposta de 40% em pacientes com mais de 40% do couro cabeludo acometido ou mais de 10 placas no couro cabeludo ou corpo.39 Outros regimes incluem prednisolona 80mg/dia por três dias consecutivos a cada três meses e, para pacientes resistentes a outras modalidades terapêuticas, megapulso de 15mg/kg, por dois dias a cada três semanas.40,41
Não há consenso na literatura sobre dose e tempo de uso da corticoterapia oral diária na AA. A prednisona pode ser usada em doses que variam de 0,1−1mg/kg/dia. Sugere‐se iniciar com doses maiores (0,5−1mg/kg/dia) com redução gradual (ao longo de 6−12 semanas) após atingir repilação.
Embora não descrito em diretrizes para AA e apesar de apresentar custo mais elevado, este consenso considera o deflazacorte como melhor opção de CT oral devido a seu perfil de segurança mais favorável. A substância tem alto índice terapêutico, a potência oscila entre 70%−90% da prednisona e apresenta menor impacto no metabolismo do cálcio em relação a qualquer outro corticosteroide sintético. Além disso, apresenta comparativamente pequeno efeito no metabolismo dos carboidratos, retenção hídrica e hipocalemia.42 Sugere‐se iniciar com dose diária de 0,5mg/kg tanto para adultos quanto crianças e lenta redução após repilação.
Os CT de longa duração podem ser administrados por via intramuscular ou intravenosa em opção ao uso oral. A aplicação de 40mg de AcT intramuscular uma vez ao mês por seis meses mostrou‐se superior à prednisolona em pulsoterapia (80mg por três dias consecutivos a cada três meses) e à dexametasona (0,5mg/dia por seis meses) em um ensaio clínico randomizado comparativo.40
Assim como para o uso intralesional, também se recomenda o AcT em detrimento do HT para o uso intramuscular em função do maior risco de desenvolvimento de atrofia e telangiectasias em longo prazo.43 Os autores sugerem, como segunda opção, a substituição pela combinação do dipropionato de betametasona 5mg/mL (ação rápida) com fosfato dissódico de betametasona 2mg/mL (ação prolongada).18 A tabela 13 apresenta a equivalência de dose dos diversos CT.44
Equivalência dos corticosteroides
| Substância | Dose equivalente (mg) | Potênciaanti‐inflamatória | Potência mineralocorticoide | Meia‐vida (h) |
|---|---|---|---|---|
| Cortisol (hidrocortisona) | 20 | 1 | 1 | 8−12 |
| Cortisona | 25 | 0,8 | 0,8 | 8−12 |
| Prednisona/ prednisolona | 5 | 4 | 0,8 | 12−36 |
| Deflazacorte | 7,4 | 4 | 0,5 | 2 |
| Metilprednisolona | 4 | 5 | 0,5 | 12−36 |
| Triancinolona | 4 | 5 | 0 | 12−36 |
| Betametasona | 0,75 | 25 | 0 | 26−72 |
| Dexametasona | 0,75 | 25 | 0 | 36−72 |
| Fludrocortisona | _ | 10 | 125 | 12−36 |
Adaptado de Caplan et al, 2007.44
As taxas de resposta com CT sistêmico são altas, porém muitos pacientes apresentam recaídas com a redução da dose ou logo após a retirada da medicação. Para aqueles que respondem aos CT, mas que se tornam corticodependentes, a associação de outra medicação sistêmica pode ser útil para poupar o uso dos CT.
Para todas as modalidades de corticoterapia de longa duração, é importante classificar e monitorar o paciente em relação ao risco de efeitos colaterais, além de oferecer informação a respeito de interações e vacinação.44–47 A recomendações sobre os CT sistêmicos estão resumidas na tabela 14.
ImunossupressoresMetotrexatoO metotrexato (MTX) é um quimioterápico inibidor competitivo da deidrofolato redutase. Seu uso em baixas doses em doenças inflamatórias como a AA requer suplementação de ácido fólico. Entre as vias independentes, a supressão da via de sinalização JAK/STAT parece ser o principal mecanismo de ação.48
Doses iniciais de 5−10mg/semana são progressivamente aumentadas, em 4−6 semanas, até 20−25mg. Como o MTX via oral em doses superiores a 15 mg pode apresentar absorção errática, a opção injetável deve ser considerada nesses casos. Combinações com CTs orais e intralesionais foram relatadas. Na maioria dos casos, uma dose mínima de MTX, variável de 7,5−12,5mg/semana, é necessária na manutenção.49,50
Melhores respostas são observadas em homens, pacientes com mais de 40 anos, com menos de cinco anos de doença, que atingiram doses acumuladas de 1.000−1.500mg e que receberam CT além do MTX.50,51 Recorrência pode acontecer durante o tratamento e após a suspensão da medicação. Uso prolongado é necessário.
O MTX em conjunto com baixas doses de prednisona mostrou repilação de fios terminais em até 96% dos pacientes com AA.49 Repilação total foi demonstrada em 15%−64% dos pacientes.51
Pancitopenia é a toxicidade mais comum quando se usa MTX em baixa dose. Pacientes com insuficiência renal, hipoalbuminemia, que usam doses erroneamente elevadas ou usam outros medicamentos que interagem com o MTX (p. ex., anti‐inflamatórios) apresentam maior risco.52,53 Pneumonite intersticial e alteração da função hepática foram relatadas.51 A suplementação de ácido fólico reduz os efeitos colaterais do MTX, especialmente os gastrintestinais. Diversas doses e frequências de administração são descritas, variam de 5mg/semana até 1−5mg/dia. Mesmo em doses diárias, o ácido fólico não interfere na eficácia do MTX.54 A suplementação de ácido folínico é reservada para os casos de toxicidade pelo medicamento.54
CiclosporinaA ciclosporina é um agente imunossupressor capaz de inibir a ativação da célula T auxiliar, suprimir a produção de interferon gama e reduzir o infiltrado inflamatório perifolicular. A alta recorrência e incidência elevada de efeitos colaterais em longo prazo limitam seu uso. Ela é o único imunossupressor com estudo controlado, duplo cego, randomizado que evidencia resposta na AA.55
Dose de 2mg/kg/dia dividida em três tomadas é usada inicialmente, com aumento progressivo até 5mg/kg/dia.56 A repilação varia de 25% até 76,6% quando associada a CT sistêmicos e intralesionais.56,57
Seu uso é limitado pelas altas taxas de recorrência após a suspensão desse medicamento e pelos efeitos colaterais, especialmente nefrotoxicidade, imunossupressão e hipertensão arterial. A nefrotoxicidade, em geral por vasoconstrição pré‐renal, apesar de relatada, foi reversível em pacientes com AA.56,57
AzatioprinaA azatioprina é um antimetabólico com poucos relatos de uso na AA. Doses iniciais de 0,5−1mg/kg/dia podem ser aumentadas até 2−3mg/kg/dia de acordo com a tolerância do paciente.58 Na dose de 2,5mg/kg/dia, pode ser considerada na AA recalcitrante. Foi observada alguma repilação em 43% dos pacientes em quatro a seis meses.58 Efeitos gastrintestinais, elevação de enzimas hepáticas, pancreatite e supressão medular são os efeitos colaterais mais frequentes.
Melhores respostas podem ser observadas em associação com CT sistêmicos, injetáveis ou mesmo ao MTX. A associação com MTX deve ser feita com cuidado, por causa do aumento dos efeitos colaterais.59 As recomendações sobre imunossupressores estão resumidas na tabela 15.
Imunossupressores na alopecia areata (AA)
| • O uso de imunossupressores na AA cresceu nos últimos 20 anos |
| • Esses medicamentos foram progressivamente incluídos na rotina do dermatologista por experiência em estudos não controlados |
| • O metotrexato é a melhor opção, devido à necessidade de uso prolongado com segurança |
| • Ciclosporina deve ter seu uso limitado a períodos curtos, devido aos efeitos colaterais; é a única substância do grupo avaliada em estudos randomizados |
| • Azatioprina, isoladamente, não demonstrou boa resposta |
| • Apesar dos efeitos colaterais, esse grupo de medicamentos deve ser considerado na decisão compartilhada com o paciente nos casos de doença extensa |
| • A associação com corticoides sistêmicos e intralesionais potencializa os resultados |
Atualmente, entende‐se a fisiopatogenia da AA baseada nas células T citotóxicas CD8+ que expressam o ligante NKG2D. Esses linfócitos são os responsáveis por iniciar e manter o processo de inflamação autoimune contra o folículo piloso e são ativados e perpetuados por meio de IFN‐γ e IL‐15, que por sua vez usam a via de sinalização JAK‐STAT.60
Os inibidores da JAK são medicamentos do tipo pequenas moléculas, aprovadas para uso em mielofibrose, policitemia vera, trombocitose essencial, artrite reumatoide e psoriásica e foram estudados em pacientes com AA refratários a outros tratamentos.
O ruxolitinibe, inibidor da JAK 1 e 2, foi investigado em 12 pacientes com AA moderada a grave (média SALT 65,6) na dose de 20 mg duas vezes por dia, durante três a seis meses de tratamento, que foram seguidos por três meses após a suspensão do medicamento. Nove dos 12 pacientes (75%) apresentaram melhoria, com repilação média de 92%, sem efeitos adversos graves. Em três meses após o término do tratamento, todos os pacientes apresentaram algum grau de perda da repilação.61 Outros relatos de caso também foram publicados.62
O tofacitinibe inibe JAK1/2 e mais intensamente JAK3. É o inibidor da JAK com mais casos publicados na literatura em variados esquemas de tratamento, como 5mg duas vezes ao dia, aumento da dose para 10mg duas vezes ao dia e, se não houver resposta, associação com prednisona 300mg uma vez ao mês.63–65 Uma metanálise recente incluiu 14 estudos, seis ensaios clínicos e oito estudos observacionais, com 275 pacientes. Repilação aceitável ou completa foi de 54% (95% IC 46,3%−61,5%) e a taxa de resposta parcial, de 26,1% (20,7%−32,2%). Aproximadamente 25% dos pacientes apresentaram recidiva após descontinuação, no tempo de acompanhamento.66
De modo geral, a resposta ao tratamento com inibidores da JAK não se correlacionou com características demográficas, gravidade da doença e duração da AA, assim como não há ainda preditores de resposta.67 As complicações mais comuns são infecções leves, principalmente do trato respiratório superior e trato urinário. Dislipidemia, leucopenia, aumento de enzimas hepáticas, cefaleia, queixas gastrintestinais, fadiga, acne e ganho de peso também foram reportados. Até o momento, não há relatos de neoplasias, reativação de tuberculose ou hospitalização por eventos adversos no tratamento da AA. Os dados de segurança em longo prazo ainda são limitados.67
Os inibidores da JAK tópicos ainda não estão disponíveis em formulações‐padrão e os relatos da literatura baseiam‐se em apresentações manipuladas, com resultados variáveis; atualmente, não são recomendados.67
O tratamento com inibidores da JAK ainda está pautado em evidência de baixa qualidade, predominantemente relatos de casos, estudos retrospectivos e ensaios clínicos não cegos e não controlados com placebo. O desenvolvimento de inibidores da JAK potencialmente mais seletivos e o aprimoramento de formulações tópicas abrem perspectivas promissoras. As recomendações quanto ao uso dos inibidores da JAK estão resumidas na tabela 16 e os cuidados pré‐tratamento, na tabela 17.
Inibidores da JAK na alopecia areata
| • Ruxolitinibe e tofacitinibe oral se mostraram eficazes em pacientes refratários a outros tratamentos |
| • Altas taxas de recidiva após a suspensão |
| • Efeitos colaterais geralmente leves, porém ainda há poucos dados sobre segurança de longo prazo |
| • Uso limitado pelo alto custo |
JAK, Janus quinase.
Cuidados recomendados antes de iniciar o tratamento com inibidores da JAK
| • Não indicados em gestantes e lactantes |
| • Avaliar risco de neoplasia |
| • Verificar interações medicamentosas |
| • Exames pré‐tratamento: hemograma completo, função renal, transaminases e bilirrubinas (inicialmente, a cada 2‐4 semanas; depois a cada 3 meses); lipidograma (repetir a cada 3 meses) |
| • Atualizar vacinas |
| • Sorologias para hepatites B, C e HIV |
| • Quantiferon ou PPD |
| • Radiografia de tórax |
| • Tratamento de tuberculose latente, se indicado |
JAK, Janus quinase.
Os tratamentos mencionados a seguir apresentam pouca evidência de resultados e devem apenas ser considerados na ausência de resposta às terapias‐padrão.
HidroxicloroquinaUm antimalárico com ação anti‐inflamatória e efeito imunomodulador. Os estudos sobre a hidroxicloroquina na AA são controversos e seus resultados, divergentes.68,69 Quando usada, a dose sugerida é de 5mg/kg/dia e atenção especial à toxicidade ocular deve ser dada, em caso de uso prolongado da substância. Intolerância gastrintestinal e cefaleia são os efeitos colaterais mais comumente referidos. Não se recomenda o uso da hidroxicloroquina para tratamento da AA.
ZincoEstudo randomizado que incluiu pacientes com AA em placas, duplo cego e com cross‐over dos pacientes que usavam sulfato de zinco na dose de 5mg/kg/dia, dividida em três tomadas, evidenciou superioridade do zinco em relação ao placebo.70 Em outro estudo placebo controlado que incluiu pacientes com AT e AU não houve melhoria na comparação do grupo tratamento com o grupo controle.71 Os autores consideram que o sulfato de zinco poderia ser usado nos casos menos graves e preferencialmente associado a outras terapias. Pode ser usado mesmo se o paciente apresentar níveis séricos normais de zinco.
Sulfassalazina/mesalazinaA sulfassalazina é uma pró‐droga composta por ácido 5‐aminossalicílico (5‐ASA) associado à sulfapiridina. Enquanto o 5‐ASA é o responsável pela eficácia da sulfassalazina, a sulfapiridina é a responsável pela maioria dos efeitos colaterais: cefaleia, anorexia, náuseas e vômitos, que ocorrem em 10%−45% dos pacientes. Mesalazina contém apenas 5‐ASA de liberação lenta e por essa razão costuma ser mais bem tolerada do que a sulfassalazina. O 5‐ASA funciona tanto como imunomodulador quanto imunossupressor e é usado em diversas condições autoimunes, como retocolite ulcerativa, doença de Crohn e psoríase. Estudo aberto não controlado demonstrou taxas de repilação com a sulfassalazina (1,5g 2×/dia) entre 25% e 68% dos pacientes com AA refratária, de maneira isolada ou em combinação com corticoterapia, atuou como agente poupador de corticoide. Entretanto, o perfil de efeitos colaterais permanece um limitador.72 Recentemente, foi relatada repilação com mesalazina (15−30mg/kg/dia em duas doses diárias) associada ou não à corticoterapia oral ou minoxidil/betametasona tópicos no tratamento de cinco crianças e adolescentes (2−17 anos) com AA refratária e grave.73 Acompanhamento com dosagem de G6PD, hemograma, bioquímica e hepatograma são fundamentais para monitorar os possíveis efeitos adversos.
Sinvastatina/ezetimibeOs dados a respeito da eficácia da combinação sinvastatina 40mg/ezetimibe 10mg em dose única diária no tratamento da AA são limitados e controversos.74–77 Os relatos positivos apresentam melhores taxas de repilação e menor recaída em pacientes com início recente e bom prognóstico de AA.74,75
Minoxidil oralO uso de minoxidil via oral na AA teve seu primeiro relato na literatura em 1987, em monoterapia com a dose de 5mg, 2×/dia, em 65 pacientes, inclusive homens e mulheres. Repilação satisfatória ocorreu em 18% dos pacientes.78 Apesar da dose alta, hipertricose facial foi observada em apenas 17% dos pacientes. Recentemente, a associação de minoxidil (2,5mg/dia para mulheres e 2,5mg, 2×/dia, para homens) e tofacitinibe (5mg, 2×/dia) mostrou‐se positiva e com baixa incidência de efeitos colaterais.79
Excimer laser/luzAs terapias baseadas em luz mais estudadas na AA são o excimer laser e excimer luz de 308nm, que têm propriedades imunossupressoras possivelmente por indução da apoptose de células T. Uma recente revisão incluiu oito estudos clínicos e relatos de casos, com 94 indivíduos tratados, com eficácia de 36,9%−100%, com repilação igual ou maior do que 50%.80 Uma metanálise que incluiu apenas quatro estudos controlados, com uso de excimer laser em placas de AA não previamente tratadas, confirmou a eficácia do tratamento.81 Os principais efeitos colaterais da terapia são eritema leve, dor durante a aplicação, hiperpigmentação, formação de bolhas, prurido e descamação.82 O custo elevado é a principal desvantagem do tratamento. O excimer laser e a excimer luz podem ser opções de tratamento para casos refratários, especialmente quando há atrofia induzida por CT ou dermatite de contato por outras terapias.
PUVAA fotoquimioterapia com psoraleno mais ultravioleta A (PUVA) foi investigada em diversos esquemas terapêuticos em estudos das décadas de 1980 e 1990, com taxas de eficácia diversas. Pelo caráter crônico e recidivante da AA, essa modalidade terapêutica não é recomendada por risco de grandes doses cumulativas de UVA em longo prazo, com possibilidade de malignidade cutânea como efeito adverso. Mais recentemente, houve interesse no tratamento com UVA‐1, que tem maior penetração na pele e possivelmente maior eficácia e pode ser uma alternativa no tratamento da AA.83
DapsonaDevido a sua baixa eficácia e perfil de efeitos colaterais, não há justificativa para uso da dapsona na AA.84,85
Plasma rico em plaquetas (PRP) e microagulhamentoPequenos ensaios clínicos sugeriram um potencial benefício do PRP e microagulhamento na AA, porém o real benefício dessas técnicas ainda não foi estabelecido.86,87 Não se recomenda o uso dessas modalidades para o tratamento da AA. Até a presente data, o uso do PRP para fins dermatológicos é vetado pelo Conselho Federal de Medicina.
Próteses e camuflagensAs opções de disfarce cosmético devem ser encorajadas. Apesar de poucos trabalhos terem quantificado o benefício na qualidade de vida dos pacientes, a orientação desses recursos é considerada boa prática.88,89 Existem inúmeras opções de próteses de cabelos parciais ou totais e extensões e apliques removíveis ou fixos. As camuflagens podem ter forma de fibras capilares, sprays, ceras e pós‐pigmentados. A tricopigmentação pode ser feita no couro cabeludo e área de sobrancelhas. Cílios, unhas postiças e próteses de sobrancelhas também podem ser usados.
Tratamento em situações especiaisAlopecia areata em criançasA condução de casos de AA em crianças poderia nem ser considerada uma situação especial, já que é causa tão comum de queda de cabelos na infância e adolescência – até 60% dos casos iniciam‐se nas duas primeiras décadas de vida.90
Em crianças, costumam‐se usar os CT tópicos, preferencialmente de média a alta potência (mometasona 1% a clobetasol 0,05%), como primeira opção terapêutica. Quando existe contraindicação ou falta de resposta aos CT tópicos, podem‐se usar antralina, DFCP e minoxidil ou optar por tratamento expectante.38,91
A administração de medicamentos sistêmicos pode ser cogitada em casos extensos ou em franca atividade. Deve‐se sempre levar em consideração o momento de vida e o grau de desenvolvimento da criança. É importante a atenção quanto aos possíveis efeitos adversos, especialmente alterações de crescimento, metabólicas e da competência imunológica. Entre as opções disponíveis, há preferência pelos CT sistêmicos e MTX. A tabela 18 apresenta as principais recomendações para o tratamento da AA em crianças.
Recomendações para tratamento de crianças com alopecia areata (AA)
| • AA localizada: corticoterapia tópica (sob oclusão, quando possível) ou antralina 0,5%−1%, em terapia de curto contato |
| • AA extensa: corticosteroide sistêmico por via oral ou pulsoterapia, e/ou metotrexato 0,2−0,4 mg/kg/semana, em casos com sinais de atividade. Imunoterapia com difenciprona em casos sem sinais de atividade ou com contraindicação/falta de resposta aos imunossupressores |
A barba é o segundo local mais frequentemente acometido pela AA, atrás apenas do couro cabeludo.5 Não existem ensaios clínicos controlados e randomizados que avaliem tratamento nessa região. A abordagem mais frequente é o uso de terapias locais, começando com CT tópicos, seguidos por CT intralesionais, ou diretamente o uso de CT intralesionais, terapia que apresenta a maior evidência de eficácia para AA localizada e de curta duração.92,93 A dose de 2,5mg/mL de triancinolona é a mais adequada para o tratamento da face. Entre outros tratamentos descritos para a região, encontram‐se minoxidil tópico, imunoterapia, terapia fotodinâmica, laser erbium glass fracionado 1550nm, fototerapia PUVA ou UVB de banda estreita. Recomendações para tratamento da área da barba estão resumidas na tabela 19.
Alopecia areata de supercílios e cíliosO acometimento dos supercílios e cílios causa grande impacto na qualidade de vida, pois interfere diretamente na fisionomia facial. Os únicos agentes indicados para a hipotricose ou alopecia na região de cílios, independentemente de sua etiologia, são os análogos de prostaglandinas, especialmente a solução de bimatoprosta 0,03%.94,95 Alguns estudos testaram o medicamento em pacientes adultos e pediátricos, com resultados variáveis, o que provavelmente é decorrente de quadros com diferentes gravidades e, portanto, diferentes prognósticos da AA.96 Parece ser agente seguro e potencialmente eficaz para o tratamento da região. Importante atentar para risco de hiperpigmentação palpebral e escurecimento da íris.
Nos supercílios, além da possibilidade de uso do bimatoprosta 0,03%, existe a opção dos CT tópicos e intralesionais.94 Usar preferencialmente CT de média potência, com cuidado para não escorrer para pálpebras e olhos (veículo creme, em vez de solução). A infiltração intralesional de triancinolona deve ser feita na dose de 2,5mg/mL para minimizar o risco de atrofia cutânea. Minoxidil tópico também é opção, assim como no couro cabeludo. Recomendações para tratamento dos cílios e supercílios estão resumidas na tabela 20.
Recomendações para tratamento da alopecia areata dos supercílios e cílios
| • Cílios: solução de bimatoprosta 0,03% uma vez/dia. Usar por um ano para avaliar resposta |
| • Supercílios: corticosteroide tópico de média potência em creme (ou alta potência em dias alternados) ou triancinolona intralesional 2,5 mg/mL. Bimatoprosta 0,03% ou minoxidil tópico são opções |
O intervalo entre as visitas dependerá do regime de tratamento escolhido para cada paciente. Aqueles tratados com DFCP necessitarão de visitas semanais ou quinzenais; aqueles submetidos às infiltrações intralesionais deverão vir a cada quatro a seis semanas. Pacientes em tratamento tópico domiciliar podem vir a cada dois ou três meses; já os que recebem tratamentos sistêmicos terão intervalos dependentes da substância escolhida e das condições de saúde do paciente. Na consulta inicial e pelo menos trimestralmente, os pacientes devem ser submetidos a fotos clínicas padronizadas que documentem diferentes regiões do couro cabeludo (topo, laterais, região occipital). Fotos dermatoscópicas das áreas de alopecia são recomendadas. A classificação em um dos métodos descritos para estimativa de extensão (SALT score, SALT II, ALODEX, Alopecia Areata Progressive Index) e a avaliação do comprometimento ungueal e do acometimento de pelos corporais deve constar no prontuário do paciente. Outros instrumentos como questionários de qualidade de vida podem ser adaptados para o uso na AA.97
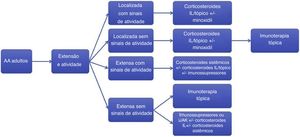
Considerações finaisO tratamento da AA é complexo e com poucos estudos comparativos que demonstrem evidências confirmatórias. Este consenso visa a fornecer orientação básica para o manejo da AA na prática diária, com foco na realidade brasileira. As recomendações aqui apresentadas estão resumidas na figura 2.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Müller Ramos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Alessandra Anzai: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Bruna Duque‐Estrada: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Daniel Fernandes Melo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Flavia Sternberg: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Leopoldo Duailibe Nogueira Santos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Lorena Dourado Alves: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Fabiane Mulinari‐Brenner: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Ramos PM, Anzai A, Duque‐Estrada B, Melo DF, Sternberg F, Santos LDN, et al. Consensus on the treatment of alopecia areata – Brazilian Society of Dermatology. An Bras Dermatol. 2020;95:39–52.
Trabalho realizado na Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.