Dermatofibroma é um dos tumores benignos de tecidos moles cutâneos mais frequentes, geralmente localizado nas extremidades. As lesões costumam apresentar‐se como nódulos cutâneos firmes, acastanhados, elevados e solitários. Na histopatologia, o dermatofibroma é caracterizado pela proliferação de células fusiformes, fibroblásticas e histiocitoides, uniformes em padrão estoriforme.1,2 Existem subvariantes de dermatofibroma que são observadas com menos frequência. Esses são os subtipos lipidizado, aneurismático, hemossiderótico, celular, de células claras, atrófico, epitelioide e esclerótico.2,3 Raramente, também pode se apresentar apenas na forma subcutânea, sem comprometer as camadas mais superficiais da pele.4
O dermatofibroma comum é observado com frequência enquanto as variantes raras correspondem a 20% dos dermatofibromas avaliados histopatologicamente.2 Subtipos diferentes do dermatofibroma comum podem ter manifestações clínicas diferentes e podem causar dificuldade no diagnóstico diferencial. Assim, o presente estudo objetivou a avaliação clínicopatológica de casos diagnosticados como dermatofibroma. Foi feita avaliação aprofundada de variantes pouco frequentes, de seu diagnóstico diferencial e de como conseguir o diagnóstico dermatológico correto dessas variantes.
Foram avaliados retrospectivamente os prontuários médicos de 239 casos de dermatofibroma de 232 pacientes com diagnóstico clínico e histopatológico em uma clínica dermatológica entre os anos de 2012 a 2021. Pacientes com diagnósticos clínicos ou histopatológicos suspeitos ou que não tinham fotografia clínica foram excluídos do estudo. As seguintes características foram registradas:
Características demográficas: idade, gênero.
Características clínicas: tipo de dermatofibroma, localização e cor das lesões.
Características histopatológicas: subtipo do dermatofibroma.
Método estatístico: média, desvio padrão, mediana, valor mínimo, máximo, frequência e valores de razão foram utilizados na estatística descritiva dos dados. A distribuição das variáveis foi medida com o teste de Kolmogorov‐Smirnov. O teste U de Mann‐Whitney foi usado na análise de dados quantitativos independentes. O teste qui‐quadrado foi usado para analisar dados qualitativos independentes, e o teste exato de Fisher foi usado quando as condições do teste qui‐quadrado não foram atendidas. O programa SPSS 28.0 foi usado na análise estatística.
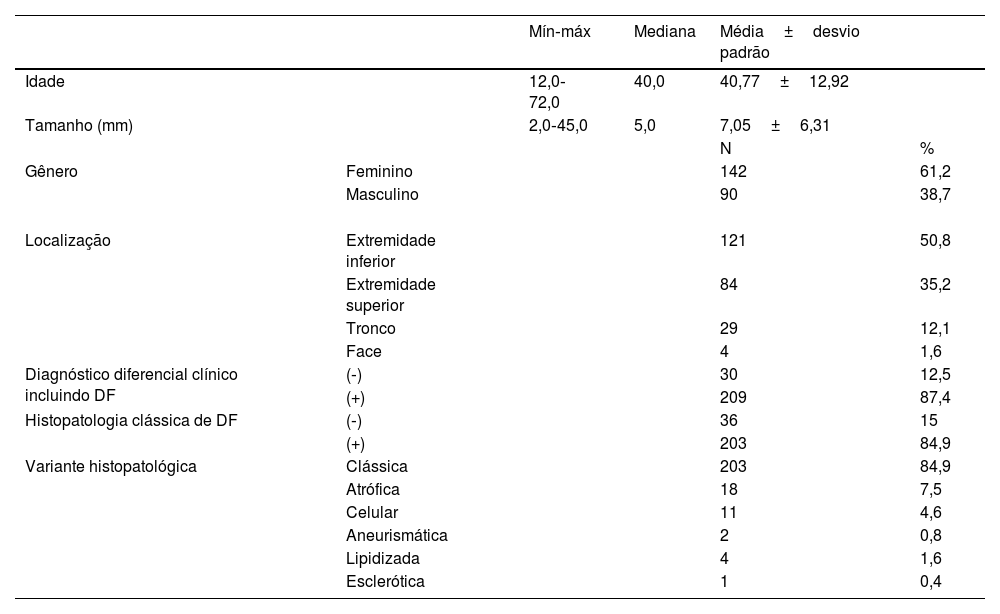
Os resultados de 239 casos de dermatofibroma de 232 pacientes foram incluídos no presente estudo. As características demográficas, clínicas e histopatológicas dos pacientes são mostradas na tabela 1. Um total de 61,2% dos pacientes eram mulheres e 38,7% eram homens, com média de idade de 40,7±12,9 anos. O local mais comum de envolvimento foi a extremidade inferior (50,8%), seguido pelo envolvimento da extremidade superior, com 35,2%. As lesões tinham tamanho médio de 7±6,3mm. Na histopatologia, 84,9% dos casos eram de subtipos comuns, seguidos por 7,5% de atróficos, 4,6% celulares, 1,6% lipidizados, 0,8% aneurismáticos e 0,4% escleróticos (figs. 1‐3).
Características clínicas e histopatológicas de pacientes com dermatofibroma
| Mín‐máx | Mediana | Média±desvio padrão | |||
|---|---|---|---|---|---|
| Idade | 12,0‐72,0 | 40,0 | 40,77±12,92 | ||
| Tamanho (mm) | 2,0‐45,0 | 5,0 | 7,05±6,31 | ||
| N | % | ||||
| Gênero | Feminino | 142 | 61,2 | ||
| Masculino | 90 | 38,7 | |||
| Localização | Extremidade inferior | 121 | 50,8 | ||
| Extremidade superior | 84 | 35,2 | |||
| Tronco | 29 | 12,1 | |||
| Face | 4 | 1,6 | |||
| Diagnóstico diferencial clínico incluindo DF | (‐) | 30 | 12,5 | ||
| (+) | 209 | 87,4 | |||
| Histopatologia clássica de DF | (‐) | 36 | 15 | ||
| (+) | 203 | 84,9 | |||
| Variante histopatológica | Clássica | 203 | 84,9 | ||
| Atrófica | 18 | 7,5 | |||
| Celular | 11 | 4,6 | |||
| Aneurismática | 2 | 0,8 | |||
| Lipidizada | 4 | 1,6 | |||
| Esclerótica | 1 | 0,4 |
DF, dermatofibroma.
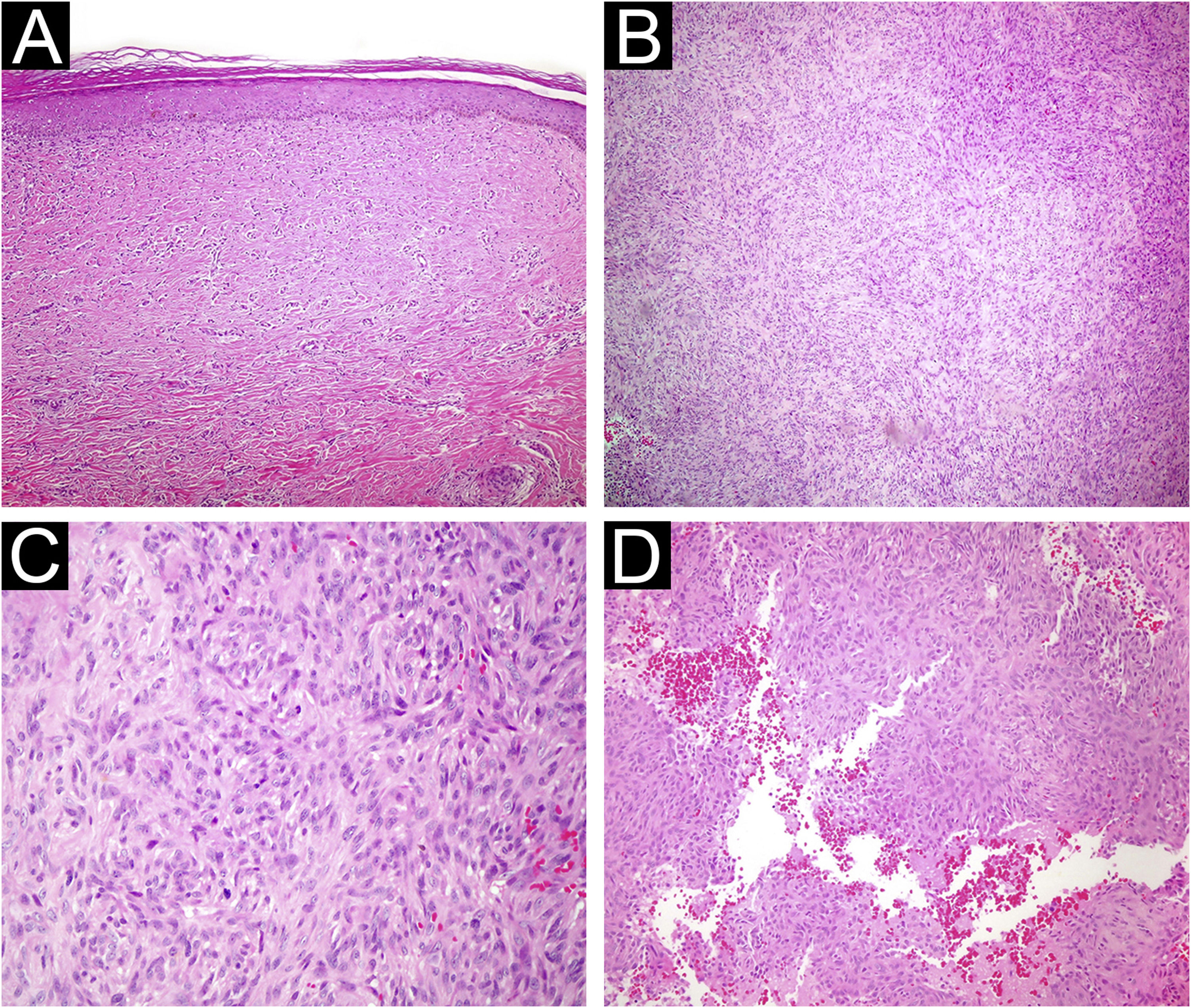
(A) Dermatofibroma atrófico. A lesão é hipocelular e exibe hialinização acentuada (Hematoxilina & eosina, 200×). (B) Dermatofibroma celular com celularidade acentuada (Hematoxilina & eosina, 100×). (C) Dermatofibroma celular mostrando mitoses proeminentes (Hematoxilina & eosina, 400×). (D) Histiocitoma fibroso aneurismático. Espaços císticos repletos de hemácias são observados dentro da lesão (Hematoxilina & eosina, 200×).
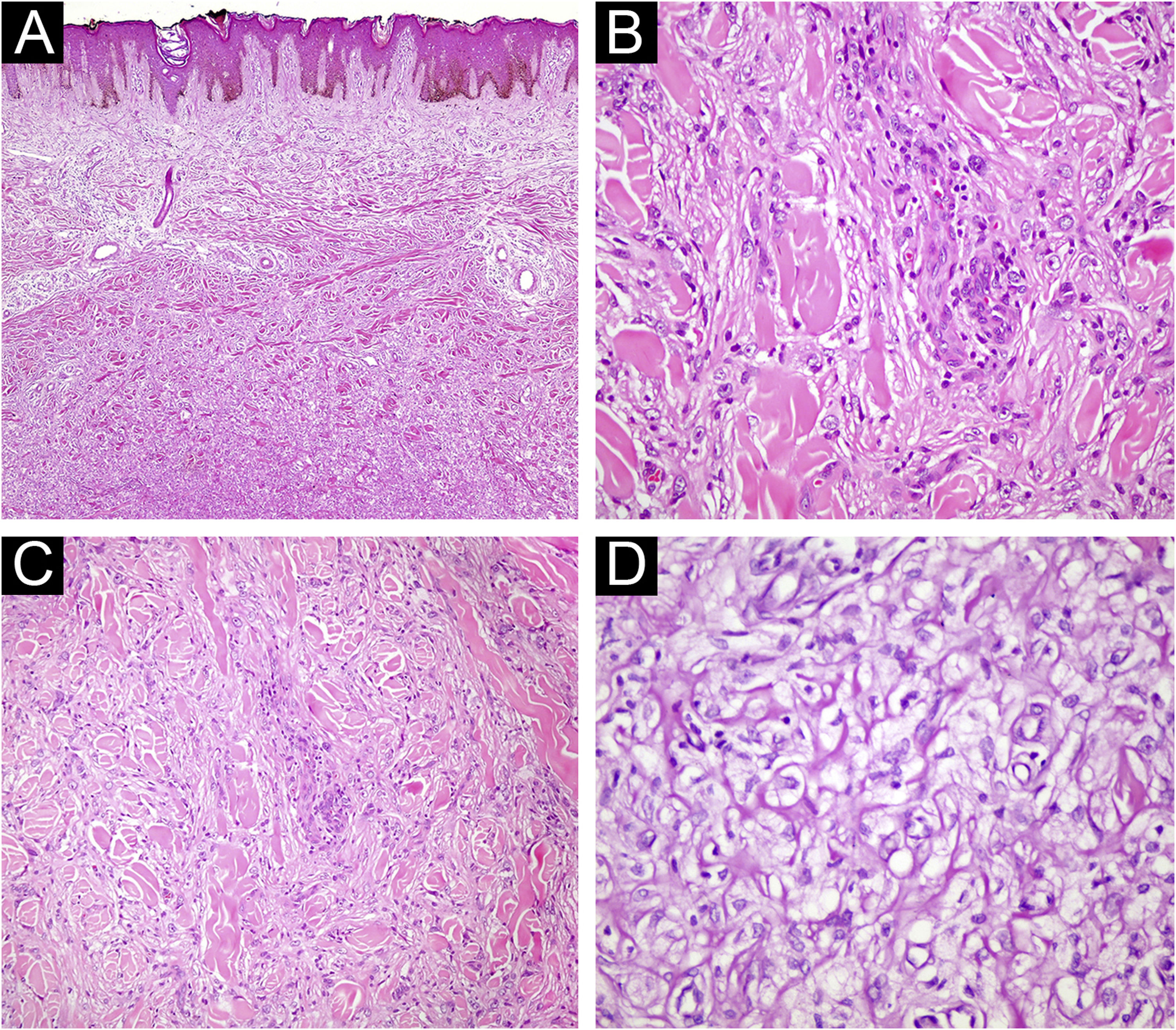
(A) Histiocitoma fibroso com características atípicas. Pleomorfismo nuclear acentuado é evidente (Hematoxilina & eosina, 200×). (B) Histiocitoma fibroso com características atípicas. Núcleos pleomórficos são observados (Hematoxilina & eosina, 400×). (C) Histiocitoma fibroso lipidizado. Hialinização significante é perceptível na lesão (Hematoxilina & eosina, 40×). (D) Aspecto espumoso no citoplasma de células do dermatofibroma (Hematoxilina & eosina, 400×).
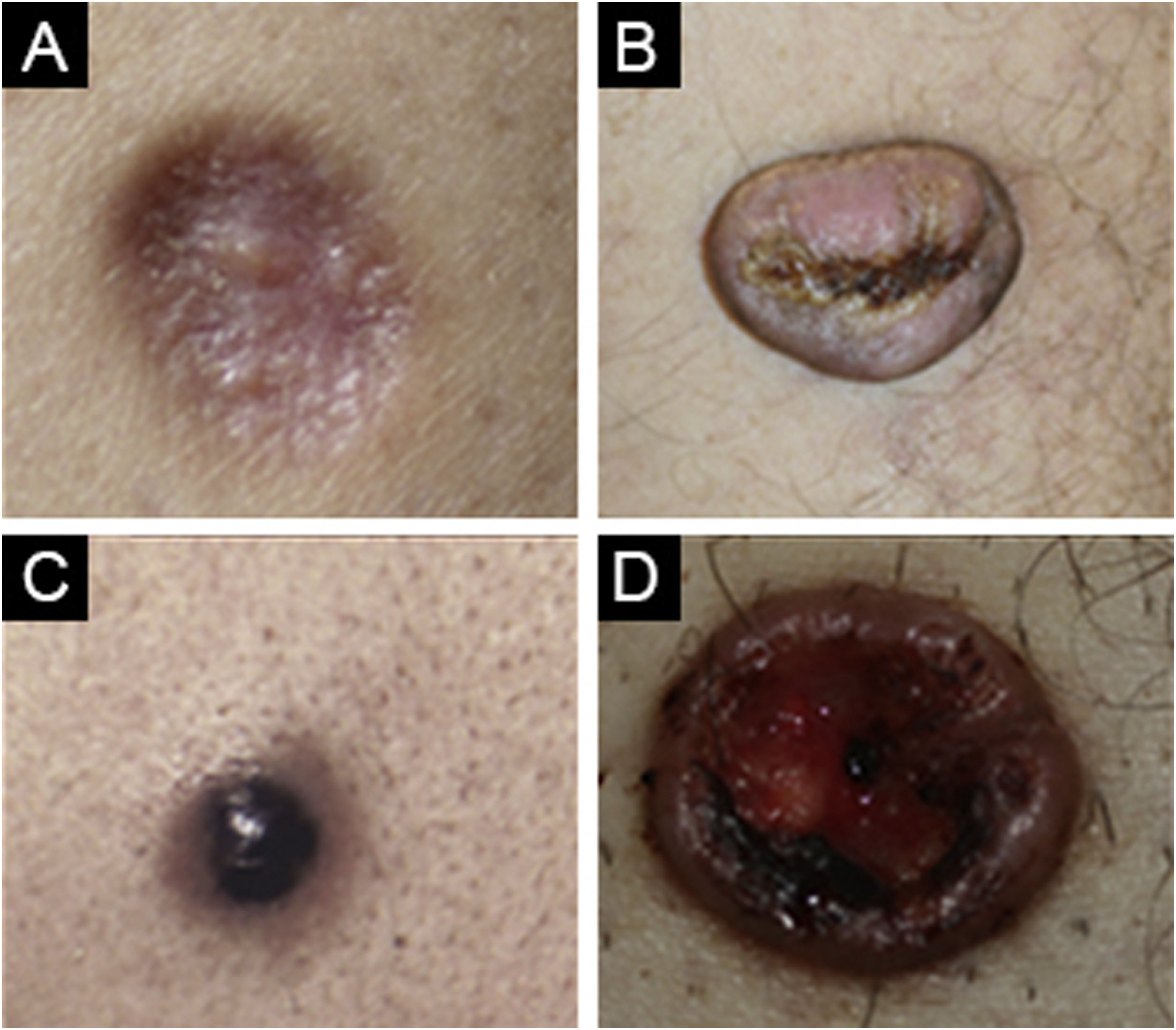
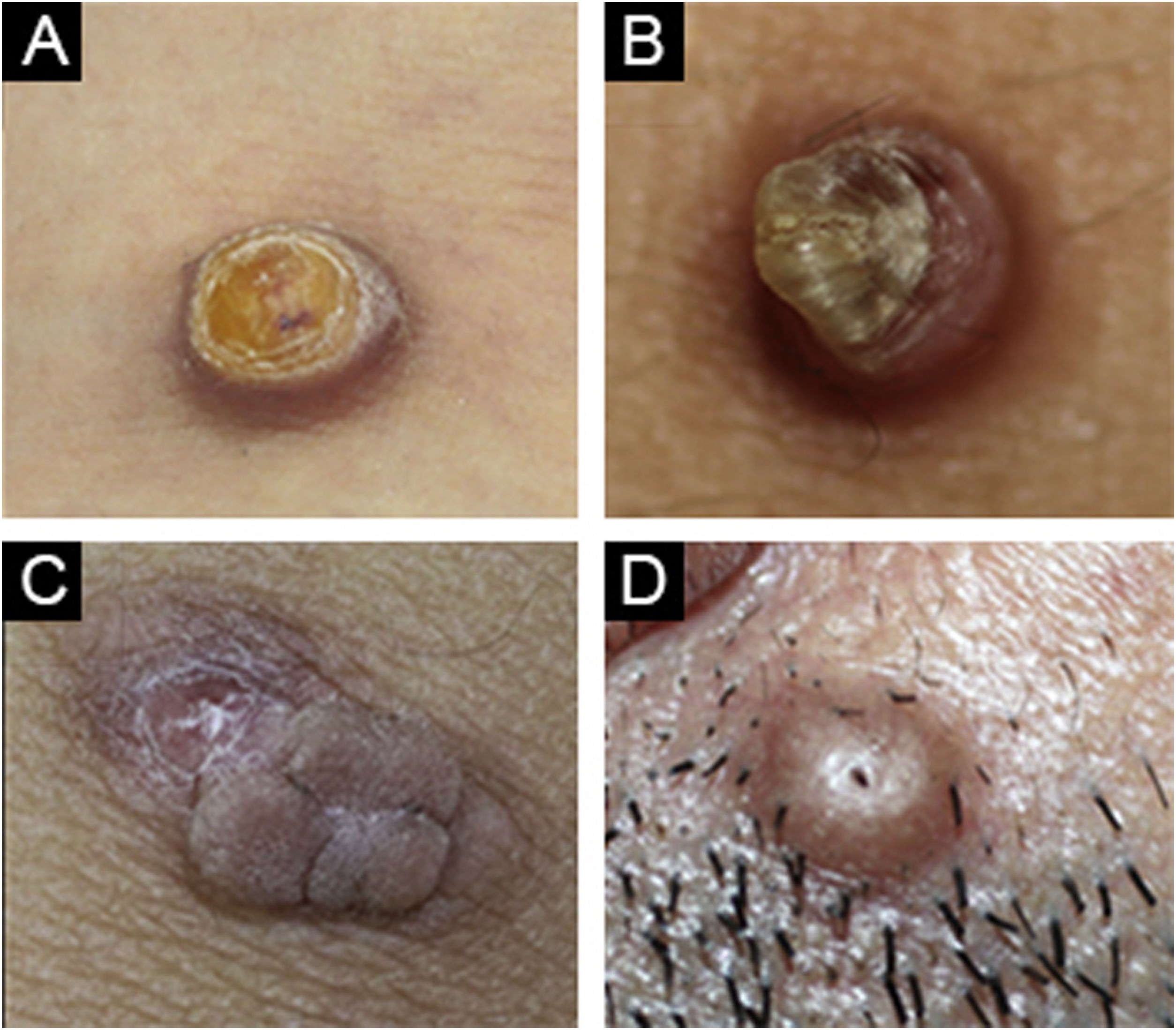
O dermatofibroma foi considerado o primeiro diagnóstico em 87,4% dos casos, enquanto em 12,5% dos casos ele não estava entre os diagnósticos preliminares Os diagnósticos diferenciais mais comumente considerados foram granuloma por corpo estranho, prurigo nodular, pilomatricoma, queloide e dermatofibrosarcoma protuberans (DFSP) em ordem decrescente (fig. 4).
(A) Caso de dermatofibroma celular com pré‐diagnóstico de poroma écrino. (B) Caso de dermatofibroma comum com pré‐diagnóstico de ceratoacantoma. (C) Caso de dermatofibroma celular com pré‐diagnóstico de acrocórdon com irritação cutânea. (D) Caso comum de dermatofibroma com pré‐diagnóstico de tricofoliculoma.
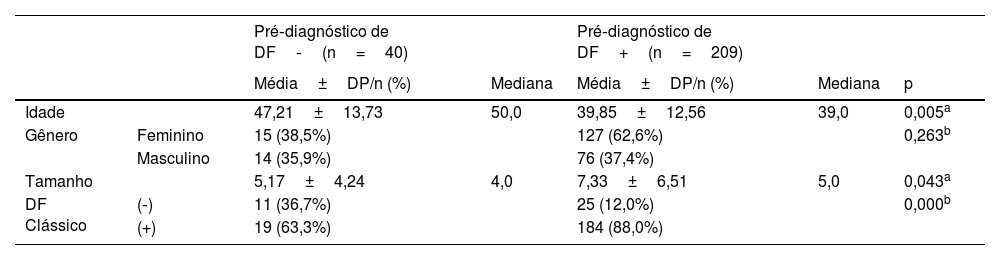
A idade, o gênero dos pacientes e o tamanho da lesão não diferiram significantemente (p >0,05) entre os grupos com e sem histopatologia clássica (HP). A idade dos pacientes no grupo com diagnóstico diferencial de DF foi significantemente menor (p <0,05) em comparação com o grupo sem DF no diagnóstico diferencial. A distribuição por gênero não diferiu significantemente entre os grupos com e sem diagnóstico diferencial de DF (p >0,05). O tamanho da lesão foi significantemente maior no grupo com pré‐diagnóstico de DF do que no grupo sem pré‐diagnóstico de DF (p <0,05). A taxa de padrão histopatológico comum no grupo com diagnóstico diferencial de DF foi significantemente maior (p <0,05) do que no grupo sem diagnóstico diferencial de DF (tabela 2).
Diagnóstico de dermatofibroma de acordo com variáveis clínicas
| Pré‐diagnóstico de DF‐(n=40) | Pré‐diagnóstico de DF+(n=209) | |||||
|---|---|---|---|---|---|---|
| Média±DP/n (%) | Mediana | Média±DP/n (%) | Mediana | p | ||
| Idade | 47,21±13,73 | 50,0 | 39,85±12,56 | 39,0 | 0,005a | |
| Gênero | Feminino | 15 (38,5%) | 127 (62,6%) | 0,263b | ||
| Masculino | 14 (35,9%) | 76 (37,4%) | ||||
| Tamanho | 5,17±4,24 | 4,0 | 7,33±6,51 | 5,0 | 0,043a | |
| DF Clássico | (‐) | 11 (36,7%) | 25 (12,0%) | 0,000b | ||
| (+) | 19 (63,3%) | 184 (88,0%) |
O dermatofibroma é um dos tumores benignos de pele mais comuns encontrados na prática clínica. Embora seu diagnóstico seja relativamente simples na forma comum, o diagnóstico pode ser desafiador nos casos em que a histopatologia evidencia subtipos raros. No presente estudo, variantes raras foram observadas a uma taxa de 15%. Foi relatado na literatura que dermatofibromas podem imitar muitas lesões diferentes, exibindo diferentes cores e vários espectros clínicos. Granuloma por corpo estranho, prurigo nodular e pilomatricoma foram os diagnósticos diferenciais mais comuns na prática clínica dos autores.
Em um estudo que incluiu 30 histiocitomas fibrosos aneurismáticos, frequentemente foram considerados no diagnóstico inicial: nevo intradérmico, leiomioma ou tumor vascular benigno. Trombose focal e deposição de hemossiderina foram considerados os fatores que afetam a cor da apresentação.5 De maneira similar, no presente estudo, um caso de histiocitoma fibroso aneurismático apresentou‐se com coloração preta e causou dificuldades no diagnóstico diferencial.
O dermatofibroma lipidizado pode ter a forma de um grande nódulo amarelo exofítico, geralmente ao redor do tornozelo, e pode ser clinicamente confundido com xantogranuloma juvenil. O dermatofibroma lipidizado costuma afetar a extremidade inferior, enquanto o xantogranuloma juvenil afeta a região da cabeça e pescoço.2,6 Todos os casos de dermatofibroma lipidizado no presente relato estavam localizados nas extremidades inferiores.
A diferenciação entre dermatofibroma celular e DFSP é muito relevante. Uma de suas características distintivas é que ele pode afetar clinicamente diferentes localizações, como face, mãos e pés, além das extremidades.7 A imunomarcação com antígeno de célula progenitora humana (CD34) varia entre 50% e 100% no DFSP, enquanto a imunomarcação focal com CD34 pode ser detectada em <20% no DF.8 Em estudo recente, foi observado necrose do tecido adiposo e infiltrado linfocítico em todos os casos de dermatofibroma celular, e sua ausência em casos de DFSP pode ser útil no diagnóstico histopatológico.9 Enquanto o dermatofibroma foi considerado o diagnóstico inicial em 87,0% dos casos, em 12,5% dos casos ele não estava entre os diagnósticos. E, 17,0% deles eram casos de dermatofibroma celular. Portanto, é essencial considerar o diagnóstico diferencial com DFSP ou outras neoplasias malignas.
A principal limitação do presente estudo é seu desenho retrospectivo. Entretanto, ter as fotografias de todos os pacientes tornou a avaliação clínica possível. A ausência de outros subtipos histopatológicos raros de dermatofibroma pode ser outra limitação do presente estudo.
O dermatofibroma é um dos tumores benignos de tecidos moles mais comuns com diagnóstico direto. Por outro lado, reconhecer as variantes raras do dermatofibroma pode ajudar os clínicos a diferenciá‐lo dos imitadores.
Contribuição dos autoresDilara Ilhan Erdil: Aprovação da versão final do manuscrito; revisão crítica da literatura, obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística, concepção e planejamento do estudo.
Cem Leblebici: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Duygu Erdil: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Vildan Manav: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Vefa Aslı Erdemir: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Ayşe Esra Koku Aksu: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Suporte financeiroNenhum.
Conflito de interessesNenhum.
Como citar este artigo: Erdil Dİ, Leblebici C, Erdil D, Manav V, Erdemir VA, Aksu AE. Dermatofibroma: clinicopathological analysis of 239 cases. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.03.012
Trabalho realizado no Departamento de Dermatologia, İstanbul Training and Research Hospital, Istambul, Turquia.