A terapia convencional com corticosteroides sistêmicos para o penfigoide bolhoso (PB) foi contestada em virtude de eventos adversos graves. O dupilumabe surgiu como opção alternativa para a terapia de pacientes com PB.
ObjetivosAvaliar a eficácia da monoterapia com dupilumabe e sua combinação com corticosteroides de dose média/baixa para o tratamento do PB.
MétodosForam analisados 13, 24 e 32 pacientes com PB tratados, respectivamente, com monoterapia com dupilumabe (grupo Dupi), dupilumabe combinado com corticosteroides (grupo Dupi+CS) e monoterapia com corticosteroides (grupo CS), retrospectivamente para vários parâmetros clínicos e laboratoriais.
ResultadosNo grupo Dupi, os escores do Bullous Pemphigoid Disease Area Index (BPDAI) total, erosão/bolha, urticária/eritema e escore NRS prurido foram todos reduzidos significantemente após duas a quatro semanas de tratamento. No entanto, o escore BPDAI de mucosa não foi alterado significantemente ao final do tempo de tratamento prolongado. Todos os parâmetros clínicos acima e muitos parâmetros laboratoriais (incluindo nível sérico de autoanticorpos anti‐BP180 [IgG], contagem e porcentagem de eosinófilos no sangue) foram significantemente reduzidos nos grupos Dupi+CS e CS após o tratamento, e nenhuma diferença estatística foi encontrada nas taxas de redução desses parâmetros entre os dois grupos. Entretanto, o grupo Dupi+CS usava menores doses, basais e cumulativas, de prednisona no momento do controle da doença e apresentava menos efeitos adversos relatados do que o grupo CS.
Limitações do estudoSeu desenho retrospectivo e o pequeno tamanho da amostra clínica do grupo Dupi.
ConclusõesPara pacientes com PB, a monoterapia com dupilumabe com base no tratamento da dermatite atópica pode melhorar significantemente as lesões cutâneas e os sintomas de prurido, mas pode ser ineficaz para lesões da mucosa oral. A combinação de dupilumabe e corticosteroides de dose média/baixa pode atingir o mesmo efeito da terapia com corticosteroides, e exibe segurança superior.
Penfigoide bolhoso (PB), a doença bolhosa subepidérmica autoimune cutânea mais comum, ocorre frequentemente em idosos e normalmente se manifesta como bolhas tensas sobre pele eritema‐edematosa, acompanhadas de prurido intenso.1,2 Os autoanticorpos do PB têm como alvo principalmente dois componentes hemidesmossômicos, BP180 e BP230; os autoanticorpos anti‐BP180 foram reconhecidos como os principais autoanticorpos patogênicos no PB.1 Corticosteroides e imunossupressores são os dois medicamentos mais comumente empregados para o tratamento do PB, 3 mas seu uso prolongado em idosos é frequentemente acompanhado por reações adversas significantes, como hiperglicemia, osteoporose e infecções.4 Estudos recentes descobriram que a resposta inflamatória mediada por células T helper 2 (Th2) desempenha papel na patogênese do PB.5,6
As citocinas relacionadas a Th2, IL‐4 e IL‐5, que são importantes para a quimioatração, maturação e atividade funcional dos eosinófilos, estavam reguladas positivamente nas lesões cutâneas de pacientes com PB e reguladas negativamente após o tratamento com corticosteroides.5,7–9 Além disso, os eosinófilos podem participar da manutenção das reações do tipo Th2 produzindo IL‐4, IL‐5 e IL‐13.10,11 O dupilumabe, anticorpo monoclonal que bloqueia o receptor α da IL‐4, pode regular negativamente a via de sinalização relacionada a Th2.12,13 O dupilumabe foi aprovado pela Food and Drug Administration (FDA) para o tratamento de dermatite atópica moderada a grave, e o tratamento bem‐sucedido do PB refratário com dupilumabe foi relatado em casos esporádicos.14–28
No presente estudo, para investigar mais a fundo a eficácia do dupilumabe no PB, foi utilizado um total de 69 pacientes com PB, incluindo 13 pacientes tratados com monoterapia com dupilumabe, 24 pacientes tratados com dupilumabe combinado com corticosteroides e 32 pacientes tratados com corticosteroides, para realizar análises retrospectivas comparando seus efeitos terapêuticos e as alterações de vários parâmetros clínicos e laboratoriais.
MétodosPacientes e controlesCritérios diagnósticos para PB: 1) bolhas acentuadamente pruriginosas na pele; 2) imunomarcação com IgG e/ou C3c linear ao longo da zona da membrana basal (ZMB) na imunofluorescência direta (IFD); 3) imunomarcação com IgG no lado epidérmico da pele humana normal submetida à técnica salt‐split skin com NaCl 1M na imunofluorescência indireta (ssIIF); 4) ensaio de imunoabsorção enzimática (ELISA) positivo para IgG de BP180 NC16A e/ou BP230 (MBL, Nagoya, Japão,> 9 U/mL). O diagnóstico de PG foi confirmado se o primeiro critério e pelo menos dois dos últimos três critérios fossem atendidos. Os critérios de exclusão incluíram PB induzido por medicamentos, pacientes com PB que foram acompanhados por menos de três meses e aqueles que usaram outros agentes biológicos no período de seis meses antes do tratamento com dupilumabe.
Sessenta e nove pacientes com PB diagnosticados entre junho de 2021 e junho de 2023 no Hospital for Skin Diseases, Institute of Dermatology, Chinese Academy of Medical Sciences & Peking Union Medical College foram incluídos no presente estudo, dos quais 13 foram tratados com monoterapia com dupilumabe (grupo Dupi), 24 pacientes foram tratados com dupilumabe combinado com corticosteroides (grupo Dupi+CS) e 32 foram tratados com monoterapia com corticosteroides (grupo CS). Além disso, todos os pacientes receberam inicialmente prescrição de creme de propionato de clobetasol a 0,05% para ser aplicado duas vezes ao dia na área da pele lesionada e interromperam quando as lesões cutâneas cicatrizaram. No presente estudo, os principais motivos relatados pelos pacientes para o tratamento com dupilumabe incluem: 1) alguns pacientes não toleram terapia com corticosteroides de longo prazo ou em grandes doses em virtude de doenças subjacentes (idade avançada, hipertensão, diabetes, doença renal, hepatite, tuberculose etc.); 2) o tratamento tradicional se mostrou ineficaz; 3) alguns pacientes se recusaram a se submeter a terapia com corticosteroides. Com base no regime de dupilumabe para o tratamento de dermatite atópica,29 os pacientes no grupo Dupi e no grupo Dupi+CS receberam inicialmente 600mg de dupilumabe (dose de indução) e depois 300mg a cada duas semanas por injeção subcutânea.
No presente estudo, todos os pacientes com PB foram acompanhados por três a 12 meses. Amostras de sangue total foram coletadas de todos os pacientes com PB no início do estudo, duas a três semanas após o tratamento e um a três meses após o tratamento. O Bullous Pemphigoid Disease Area Index (BPDAI) e o escore da Escala Numérica de Avaliação (NRS, do inglês Numeric Rating Scale) de prurido foram realizados no início do estudo e duas a quatro semanas após o tratamento. O BPDAI foi determinado por um painel de especialistas em PB e é composto por escore para o grau de erosões/bolhas (variação, 0–120 pontos), urticária/eritema (variação, 0–120 pontos) e erosões/bolhas em mucosa (variação, 0–120 pontos); escores mais altos indicam maior atividade da doença.30 O escore total do BPDAI (variação, 0–360 pontos) é a soma de três componentes, incluindo erosões/bolhas do BPDAI, urticária/eritema do BPDAI e erosões/bolhas na mucosa do BPDAI. O prurido foi avaliado pelo escore NRS de prurido, que varia de 0 (sem prurido) a 10 pontos (prurido insuportável).30
Em cada seguimento, a ocorrência de doença controlada, remissão completa durante a redução gradual, recorrência e eventos adversos foram avaliados. A doença é considerada controlada no momento em que novas lesões ou prurido cessam de aparecer e as lesões estabelecidas começam a cicatrizar.30 O período de controle da doença é o período da linha de base até seu controle. A remissão completa durante a redução gradual é definida como a ausência de lesões não transitórias enquanto o paciente está recebendo mais do que a terapia mínima.30 A recorrência é definida como o aparecimento de três ou mais novas lesões por mês (bolhas, lesões eczematosas ou placas urticariformes) ou pelo menos uma grande lesão eczematosa (10cm de diâmetro) ou placa urticariforme que não cicatriza em uma semana, ou a extensão de lesões estabelecidas ou prurido diário em paciente que havia apresentado doença controlada.30 Além disso, como o presente estudo não envolve redução da dosagem de dupilumabe, o conceito de remissão completa com medicamento é usado exclusivamente no grupo Dupi, significando a ausência de lesões não transitórias.
As alterações de todos os parâmetros clínicos e laboratoriais foram avaliadas pela taxa de redução, ou seja a porcentagem de diminuição nos parâmetros após o tratamento em comparação com antes do tratamento.
O presente estudo foi aprovado pelo Comitê de Ética do Instituto de Dermatologia do Hospital for Skin Diseases, Chinese Academy of Medical Sciences e Peking Union Medical College (2017‐KY‐022). O consentimento informado por escrito foi obtido de todos os pacientes e controles envolvidos.
Imunofluorescência diretaPara a IFD, amostras de pele de pacientes com PB foram incluídas em composto adequado na temperatura ideal para core. Criosecções (6μm de espessura) dessas amostras foram incubadas por 35 minutos a 37°C com anticorpo anti‐IgG humano produzido em ovelha conjugado com isotiocianato de fluoresceína (FITC; ZF0306, ZSGB‐BIO, Pequim, China) ou anticorpo anti‐C3c humano produzido em coelho conjugado com FITC (ZF0301, ZSGB‐BIO, Pequim, China), ambos em diluição de 1:100 com solução salina tamponada com fosfato (PBS). Esse material foi analisado de forma independente por pelo menos dois dermatologistas treinados utilizando microscópio para fluorescência (Eclipse 50i, Nikon, Tóquio, Japão).
Imunofluorescência indireta na técnica salt‐split skin com NaCl 1MAmostras de pele de indivíduos normais foram lavadas com solução salina asséptica e, em seguida, colocados em tubo de centrífuga selado de 50mL com 1 moL/L de NaCl (20°–30°C) por cerca de 24 horas, até que a superfície da pele ficasse enrugada, o que indicava que houvera separação entre epiderme e derme. Essa pele submetida à técnica salt‐split skin foi então incluída em ornitina carbamil‐transferase e o material congelado foi submetido a cortes de 6μm de espessura.31,32 Amostras de soro dos pacientes com PB foram diluídas a 1:40 com PBS e incubadas com os cortes histológicos de pele submetidos à técnica salt‐split skin a 37°C por 30 minutos. Após lavagem completa com PBS (10mM, Ph 7,3), os cortes histológicos foram incubados com anticorpo anti‐IgG humano produzido em ovelha conjugado com FITC (GTX26866, GeneTex, San Antonio, EUA) em diluição de 1:500 com PBS a 37°C por 30 minutos. Essa imunofluorescência foi avaliada por pelo menos dois dermatologistas treinados.
ELISA para detecção de vários autoanticorpos IgG em soros de pacientesAnticorpos IgG contra BP180 NC16A, BP230, desmogleína 1 (Dsg1) e Dsg3 foram mensurados pelo teste MESACUP BP180/BP230/Dsg1/Dsg3 (MBL, Nagoya, Japão) de acordo com as instruções do fabricante. As amostras de soro foram diluídas para 1:101. Os valores de corte para anticorpos anti‐BP180 NC16A, BP230, Dsg1 e Dsg3 (IgG) em amostras de soro foram 9 U/mL, 9 U/mL, 20 U/mL e 20 U/mL, respectivamente.
Exame de sangue de rotinaO exame de sangue de rotina de pacientes com PB foi analisado usando o sistema de análise celular Coulter (UniCel DxH 600, Beckman Coulter, Califórnia, EUA). O hemograma completo e a porcentagem de eosinófilos foram analisados no presente estudo, e os valores de corte foram 0,02∼0,52*109/L e 0,4∼8,0%, respectivamente.
IgE totalO nível de IgE total sérica, que foi incluído em painel de triagem de alérgenos nutricionais e inalantes, foi realizado utilizando o Immuno CAP (Phadia/Thermofisher, Uppsala, Suécia). O valor de corte para IgE total em amostras de soro foi de 60 KU/L.
Análises estatísticasO teste signed‐rank de Wilcoxon, o teste U de Mann‐Whitney, o teste de Kruskal‐Wallis e o teste exato de Fisher foram conduzidos dependendo do tipo de análise. O teste de Steel‐Dwass foi usado para comparações post‐hoc pareadas entre três subgrupos após teste significante de Kruskal‐Wallis. Todos os dados foram apresentados como média±DP para fins descritivos. Os valores de p foram bilaterais e realizados com os testes estatísticos apropriados utilizando o software GraphPad Prism 9.4.0 e o software R 4.1.2.33 Uma diferença estatisticamente significante foi considerada presente com p <0,05.
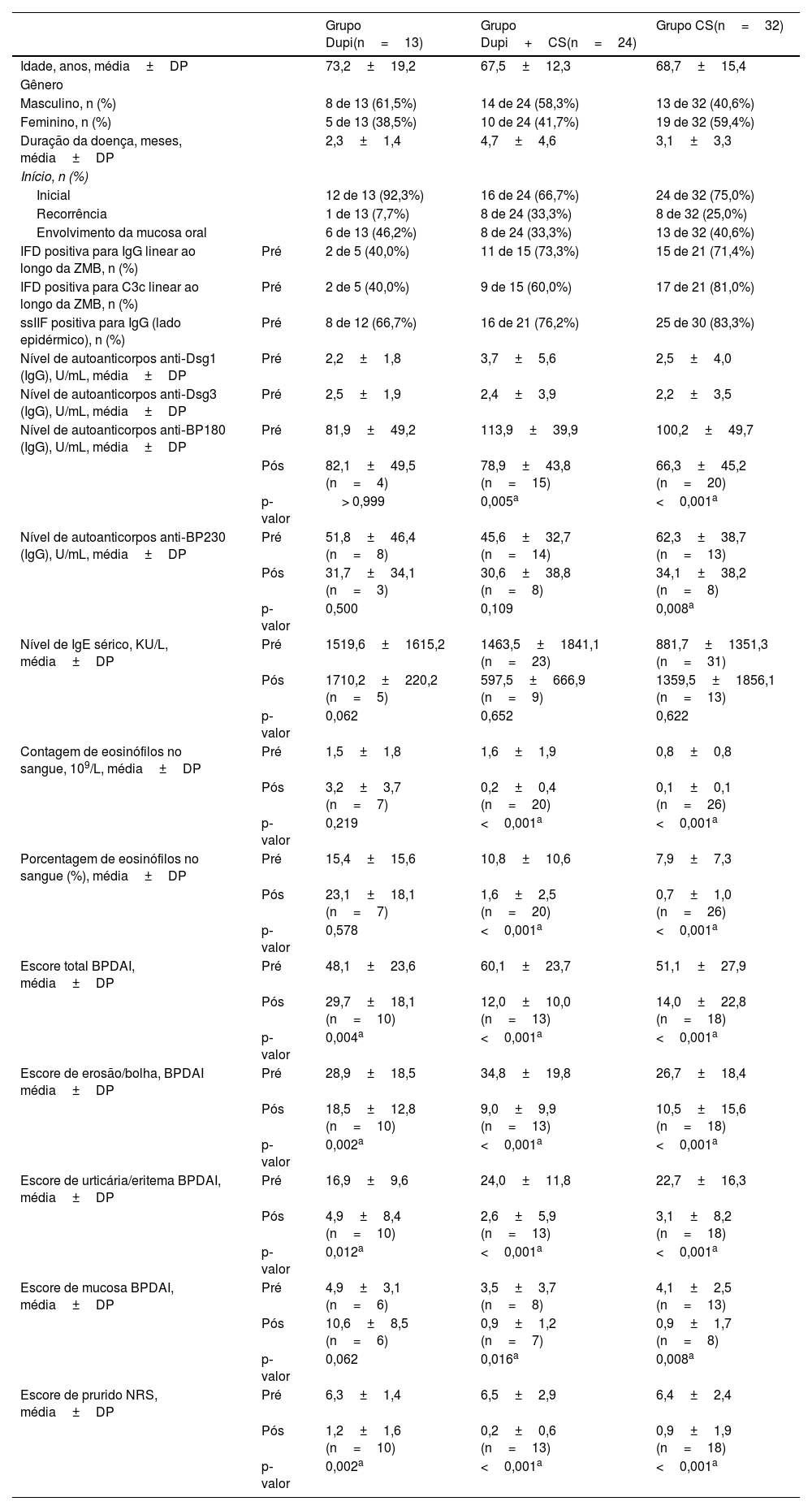
ResultadosCaracterísticas clínicas e laboratoriais de pacientes com PBNo presente estudo, foram incluídos 69 pacientes com PB, dos quais 13 foram tratados com monoterapia com dupilumabe (grupo Dupi), 24 com dupilumabe combinado com corticosteroides (grupo Dupi+CS) e 32 pacientes tratados com monoterapia com corticosteroides (grupo CS). A média de idade dos pacientes com PB nos grupos Dupi, Dupi+CS e CS foi de 73,2, 67,5 e 68,7 anos, respectivamente; e a proporção de pacientes masculinos nesses três grupos foi de 61,5%, 58,3% e 40,6%, respectivamente. As características clínicas e imunológicas de todos os pacientes na linha de base são mostradas na tabela 1.
Características clínicas e laboratoriais de pacientes com PB
| Grupo Dupi(n=13) | Grupo Dupi+CS(n=24) | Grupo CS(n=32) | ||
|---|---|---|---|---|
| Idade, anos, média±DP | 73,2±19,2 | 67,5±12,3 | 68,7±15,4 | |
| Gênero | ||||
| Masculino, n (%) | 8 de 13 (61,5%) | 14 de 24 (58,3%) | 13 de 32 (40,6%) | |
| Feminino, n (%) | 5 de 13 (38,5%) | 10 de 24 (41,7%) | 19 de 32 (59,4%) | |
| Duração da doença, meses, média±DP | 2,3±1,4 | 4,7±4,6 | 3,1±3,3 | |
| Início, n (%) | ||||
| Inicial | 12 de 13 (92,3%) | 16 de 24 (66,7%) | 24 de 32 (75,0%) | |
| Recorrência | 1 de 13 (7,7%) | 8 de 24 (33,3%) | 8 de 32 (25,0%) | |
| Envolvimento da mucosa oral | 6 de 13 (46,2%) | 8 de 24 (33,3%) | 13 de 32 (40,6%) | |
| IFD positiva para IgG linear ao longo da ZMB, n (%) | Pré | 2 de 5 (40,0%) | 11 de 15 (73,3%) | 15 de 21 (71,4%) |
| IFD positiva para C3c linear ao longo da ZMB, n (%) | Pré | 2 de 5 (40,0%) | 9 de 15 (60,0%) | 17 de 21 (81,0%) |
| ssIIF positiva para IgG (lado epidérmico), n (%) | Pré | 8 de 12 (66,7%) | 16 de 21 (76,2%) | 25 de 30 (83,3%) |
| Nível de autoanticorpos anti‐Dsg1 (IgG), U/mL, média±DP | Pré | 2,2±1,8 | 3,7±5,6 | 2,5±4,0 |
| Nível de autoanticorpos anti‐Dsg3 (IgG), U/mL, média±DP | Pré | 2,5±1,9 | 2,4±3,9 | 2,2±3,5 |
| Nível de autoanticorpos anti‐BP180 (IgG), U/mL, média±DP | Pré | 81,9±49,2 | 113,9±39,9 | 100,2±49,7 |
| Pós | 82,1±49,5 (n=4) | 78,9±43,8 (n=15) | 66,3±45,2 (n=20) | |
| p‐valor | > 0,999 | 0,005a | <0,001a | |
| Nível de autoanticorpos anti‐BP230 (IgG), U/mL, média±DP | Pré | 51,8±46,4 (n=8) | 45,6±32,7 (n=14) | 62,3±38,7 (n=13) |
| Pós | 31,7±34,1 (n=3) | 30,6±38,8 (n=8) | 34,1±38,2 (n=8) | |
| p‐valor | 0,500 | 0,109 | 0,008a | |
| Nível de IgE sérico, KU/L, média±DP | Pré | 1519,6±1615,2 | 1463,5±1841,1 (n=23) | 881,7±1351,3 (n=31) |
| Pós | 1710,2±220,2 (n=5) | 597,5±666,9 (n=9) | 1359,5±1856,1 (n=13) | |
| p‐valor | 0,062 | 0,652 | 0,622 | |
| Contagem de eosinófilos no sangue, 109/L, média±DP | Pré | 1,5±1,8 | 1,6±1,9 | 0,8±0,8 |
| Pós | 3,2±3,7 (n=7) | 0,2±0,4 (n=20) | 0,1±0,1 (n=26) | |
| p‐valor | 0,219 | <0,001a | <0,001a | |
| Porcentagem de eosinófilos no sangue (%), média±DP | Pré | 15,4±15,6 | 10,8±10,6 | 7,9±7,3 |
| Pós | 23,1±18,1 (n=7) | 1,6±2,5 (n=20) | 0,7±1,0 (n=26) | |
| p‐valor | 0,578 | <0,001a | <0,001a | |
| Escore total BPDAI, média±DP | Pré | 48,1±23,6 | 60,1±23,7 | 51,1±27,9 |
| Pós | 29,7±18,1 (n=10) | 12,0±10,0 (n=13) | 14,0±22,8 (n=18) | |
| p‐valor | 0,004a | <0,001a | <0,001a | |
| Escore de erosão/bolha, BPDAI média±DP | Pré | 28,9±18,5 | 34,8±19,8 | 26,7±18,4 |
| Pós | 18,5±12,8 (n=10) | 9,0±9,9 (n=13) | 10,5±15,6 (n=18) | |
| p‐valor | 0,002a | <0,001a | <0,001a | |
| Escore de urticária/eritema BPDAI, média±DP | Pré | 16,9±9,6 | 24,0±11,8 | 22,7±16,3 |
| Pós | 4,9±8,4 (n=10) | 2,6±5,9 (n=13) | 3,1±8,2 (n=18) | |
| p‐valor | 0,012a | <0,001a | <0,001a | |
| Escore de mucosa BPDAI, média±DP | Pré | 4,9±3,1 (n=6) | 3,5±3,7 (n=8) | 4,1±2,5 (n=13) |
| Pós | 10,6±8,5 (n=6) | 0,9±1,2 (n=7) | 0,9±1,7 (n=8) | |
| p‐valor | 0,062 | 0,016a | 0,008a | |
| Escore de prurido NRS, média±DP | Pré | 6,3±1,4 | 6,5±2,9 | 6,4±2,4 |
| Pós | 1,2±1,6 (n=10) | 0,2±0,6 (n=13) | 0,9±1,9 (n=18) | |
| p‐valor | 0,002a | <0,001a | <0,001a | |
Dupi, dupilumabe; CS, corticosteroides; pré, pré‐tratamento; pós, pós‐tratamento; ZMB, zona da membrana basal; IFD, imunofluorescência direta; IFI, imunofluorescência indireta usando pele humana normal; ssIIF, IFI usando pele humana normal submetida à técnica salt‐split skin com NaCl 1M; BPDAI, Bullous Pemphigoid Disease Area Index; NRS, escala de avaliação numérica. Anticorpos IgG contra BP180 NC16A, BP230, desmogleína 1 (Dsg1) e Dsg3 foram medidos por MBL, Nagoya, Japão de acordo com as instruções do fabricante e os valores de corte nas amostras de soro foram 9 U/mL, 9 U/mL, 20 U/mL e 20 U/mL, respectivamente. A contagem e a porcentagem de eosinófilos no sangue foram medidas utilizando o sistema de análise celular Coulter (UniCel DxH 600, Beckman Coulter, Califórnia, EUA) e os valores de corte foram 0,02∼0,52*109/L e 0,4∼8,0%, respectivamente. O nível de IgE total sérica foi medido por Immuno CAP (Phadia/Thermofisher, Uppsala, Suécia) e o valor de corte em amostras de soro foi de 60 KU/L. Valor de p, pós‐tratamento vs. pré‐tratamento. As análises estatísticas foram realizadas com o teste signed‐rank de Wilcoxon.
Nos grupos Dupi, Dupi+CS e CS as taxas de positividade de IgG linear na ZMB na IFD foram de 40,0% (dois de cinco casos), 73,3% (11 de 15 casos) e 71,4% (15 de 21 casos), respectivamente; as taxas de positividade na IFD para deposição de C3c linear na ZMB foram de 40,0% (dois de cinco casos), 60,0% (nove de 15 casos) e 81,0% (17 de 21 casos), respectivamente; as taxas de positividade de IgG no lado epidérmico da clivagem na ssIIF foram de 66,7% (oito de 12 casos), 76,2% (16 de 21 casos) e 83,3% (25 de 30 casos), respectivamente (tabela 1).
Por ELISA, todas as amostras de soro (69 casos) de pacientes com PB nos três grupos foram positivas para autoanticorpos anti‐BP180 e/ou anti‐BP230 (IgG) na linha de base. Os dados sobre o nível sérico total de IgE, contagem de eosinófilos e porcentagem de eosinófilos no sangue em pacientes com PB dos três grupos também foram coletados (tabela 1).
O BPDAI foi utilizado para medir a atividade da doença do PB. A média do escore BPDAI total nos três grupos na linha de base foi de 48,1, 60,1 e 51,1, respectivamente (tabela 1). Além do escore BPDAI total, outros escores, incluindo escore BPDAI de erosão/bolha, escore BPDAI de urticária/eritema, escore BPDAI de mucosa e escore NRS de prurido também foram resumidos na tabela 1. No presente estudo, houve seis de 13 (46,2%), oito de 24 (33,3%) e 13 de 32 (40,6%) pacientes com lesões na mucosa oral nos grupos Dupi, Dupi+CS e CS, respectivamente; a média do escore BPDAI de mucosa na linha de base foi de 4,9, 3,5 e 4,1, respectivamente (tabela 1). Entre esses pacientes, 0% (0 de cinco casos), 42,9% (três de sete casos) e 25% (três de 12 casos) foram positivos para detecção do vírus herpes simplex tipo 1 na mucosa oral, respectivamente. Esses pacientes também foram submetidos à detecção de fungos na superfície erosada da mucosa oral, mas todos foram negativos.
Para os grupos Dupi+CS e CS, a dose mediana de prednisona oral usada na linha de base foi de 40mg (variação: 10–75mg) e 50mg (variação: 20–80mg), respectivamente; a dosagem cumulativa mediana de prednisona no momento do controle da doença foi de 225mg (variação: 30–675mg) e 280mg (variação: 90–960mg), respectivamente; e o período médio de tempo para iniciar a redução gradual foi de sete dias (variação: 5–28 dias) e 14 dias (variação: 7–28 dias), respectivamente.
Diferenças clínicas e laboratoriais entre pré‐tratamento e pós‐tratamento nos três grupos de pacientes com PBAs diferenças clínicas e laboratoriais entre pré‐tratamento e pós‐tratamento nos três grupos de pacientes com PB foram resumidas na tabela 1.
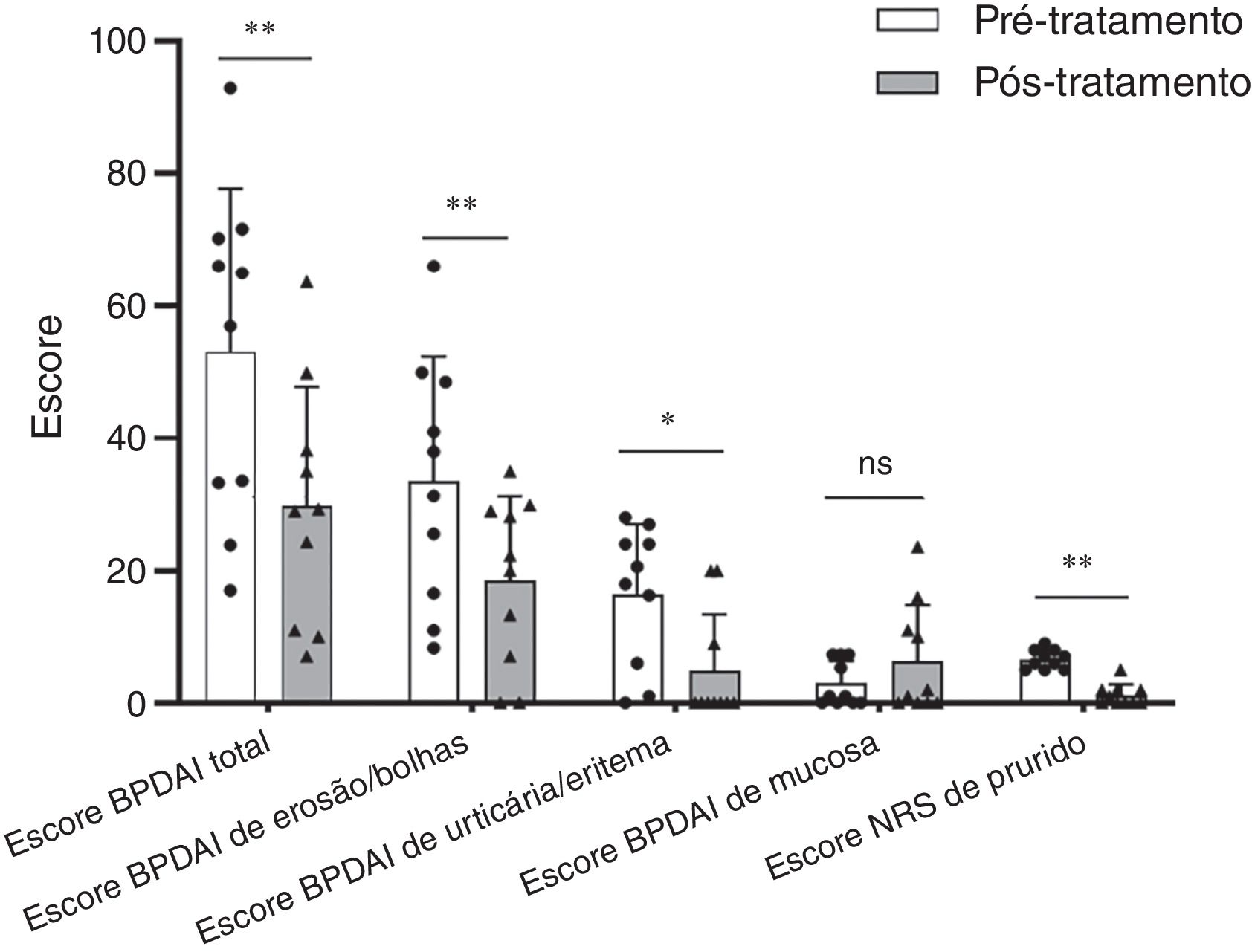
No grupo Dupi, os escores BPDAI total (p <0,01), de erosão/bolha (p <0,01), de urticária/eritema (p <0,05) e o escore NRS de prurido (p <0,01) foram todos reduzidos significantemente após duas a quatro semanas de tratamento, mas não houve diminuição significante no escore BPDAI de mucosa após duas a quatro semanas de tratamento (tabela 1 e fig. 1). O nível médio de IgE total sérico aumentou de 1246,6 KU/L na linha de base para 1710,2 KU/L após duas a três semanas de tratamento (n=5). Os níveis séricos médios de autoanticorpos (IgG) anti‐BP180 (n=4) e anti‐BP230 (n=3) foram alterados de 85,5 U/mL e 8,8 U/mL na linha de base para 82,1 U/mL e 31,7 U/mL após um a três meses de tratamento, respectivamente. A contagem e a porcentagem de eosinófilos no sangue não foram reduzidas significantemente após duas a três semanas de tratamento (tabela 1).
Comparação de parâmetros clínicos antes e depois de duas a quatro semanas de tratamento no grupo Dupi de pacientes com PB. Cinco escores clínicos para avaliação de pacientes com PB. As análises estatísticas foram realizadas com o teste signed‐rank de Wilcoxon. * p <0,05; ** p <0,01; ns, não significante.
No grupo Dupi+CS, todos os parâmetros clínicos, incluindo os escores BPDAI total (p <0,001), erosão/bolha (p <0,001), urticária/eritema (p <0,001), mucosa (p <0,05) e o escore NRS de prurido (p <0,001) foram reduzidos significantemente após duas a quatro semanas de tratamento (tabela 1). O nível sérico de autoanticorpos anti‐BP180 (IgG) foi reduzido significantemente (p <0,01) após um a três meses de tratamento (tabela 1). A contagem e a porcentagem de eosinófilos no sangue foram reduzidas significantemente (ambas p <0,001) após duas a três semanas de tratamento (tabela 1). No entanto, não houve diminuição significante no nível sérico total de IgE após duas a três semanas de tratamento, e nenhuma diminuição significante no nível sérico de autoanticorpos anti‐BP230 (IgG) foi observada após um a três meses de tratamento (tabela 1).
No grupo CS, todos os parâmetros clínicos, incluindo os escores BPDAI total (p <0,001), erosão/bolha (p <0,001), urticária/eritema (p <0,001), mucosa (p <0,01) e o escore NRS de prurido (p <0,001) foram reduzidos significantemente após duas a quatro semanas de tratamento (tabela 1). Os níveis séricos dos autoanticorpos (IgG) anti‐BP180 (p <0,001) e anti‐BP230 (p <0,01) foram reduzidos significantemente após um a três meses de tratamento (tabela 1). A contagem e a porcentagem de eosinófilos no sangue foram reduzidas significantemente (ambas p <0,001) após duas a três semanas de tratamento (tabela 1). No entanto, nenhuma diminuição significante no nível sérico total de IgE foi observada após duas a três semanas de tratamento (tabela 1).
Comparação das características clínicas e laboratoriais entre os três grupos de pacientes com PBAs análises de diferenças nas taxas de redução das características clínicas e laboratoriais após o tratamento correspondente entre os três grupos de pacientes com PB foram resumidas nas figuras 2, 3, S2 e S3.
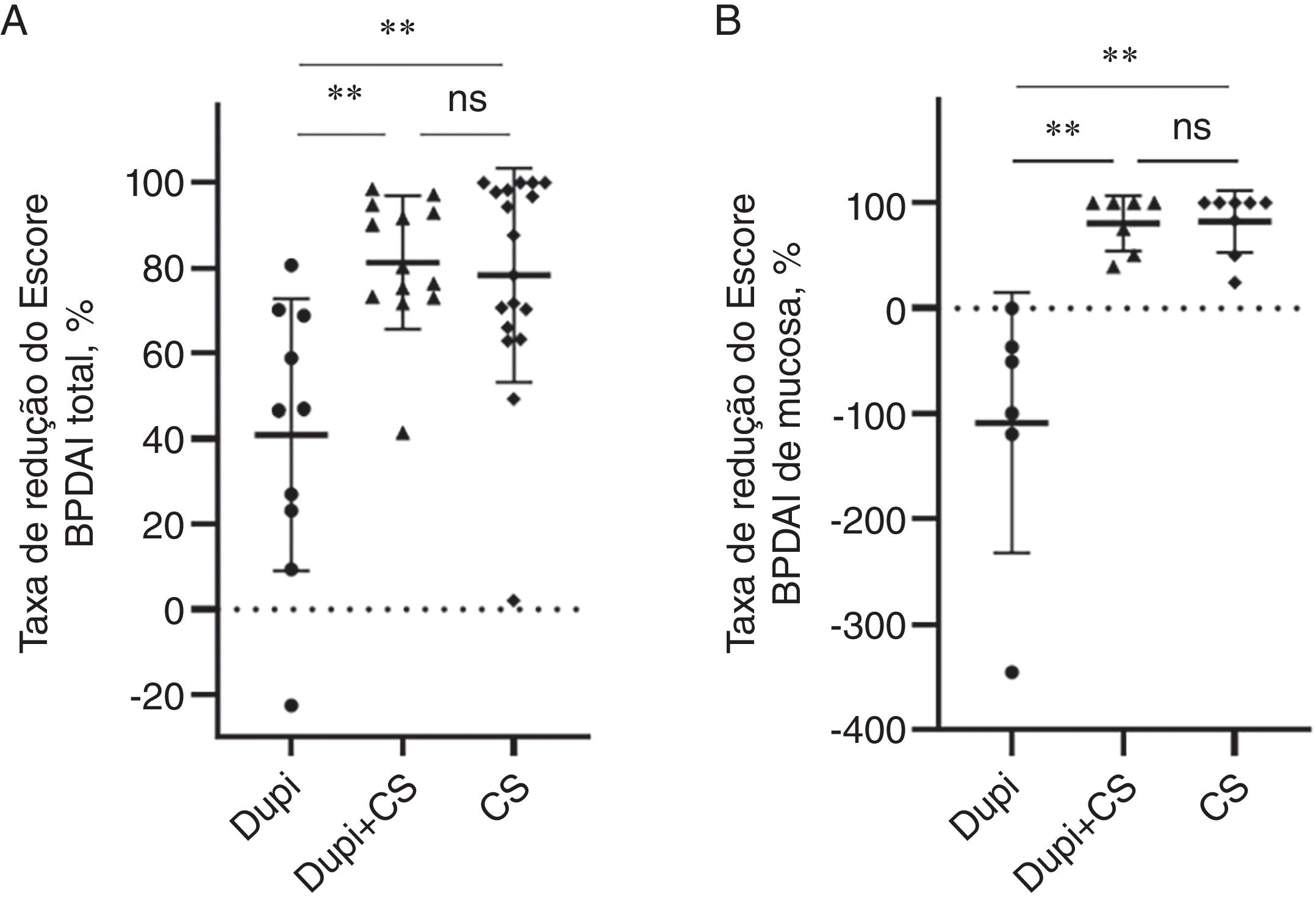
Para os indicadores clínicos, as taxas de redução dos escores BPDAI total e da mucosa no grupo Dupi foram significantemente menores do que aquelas nos grupos Dupi+CS (ambos p <0,01) e CS (ambos p <0,01), respectivamente, sem diferença significante entre os dois últimos grupos (fig. 2A e 2B). Não houve diferenças significantes nas taxas de redução dos escores BPDAI erosão/bolha, eritema e do escore NRS de prurido entre os três grupos (figs. S1–S2).
Comparação das taxas de redução de dois parâmetros clínicos após duas a quatro semanas de tratamentos correspondentes entre os grupos Dupi, Dupi+CS e CS. (A–E) Taxas de redução do Escore BPDAI total (A) e do Escore BPDAI de mucosa (B). As análises estatísticas foram realizadas com o teste de Steel‐Dwass para comparações post‐hoc pareadas entre três grupos após teste significante de Kruskal‐Wallis. **p <0,01; ns, não significante.
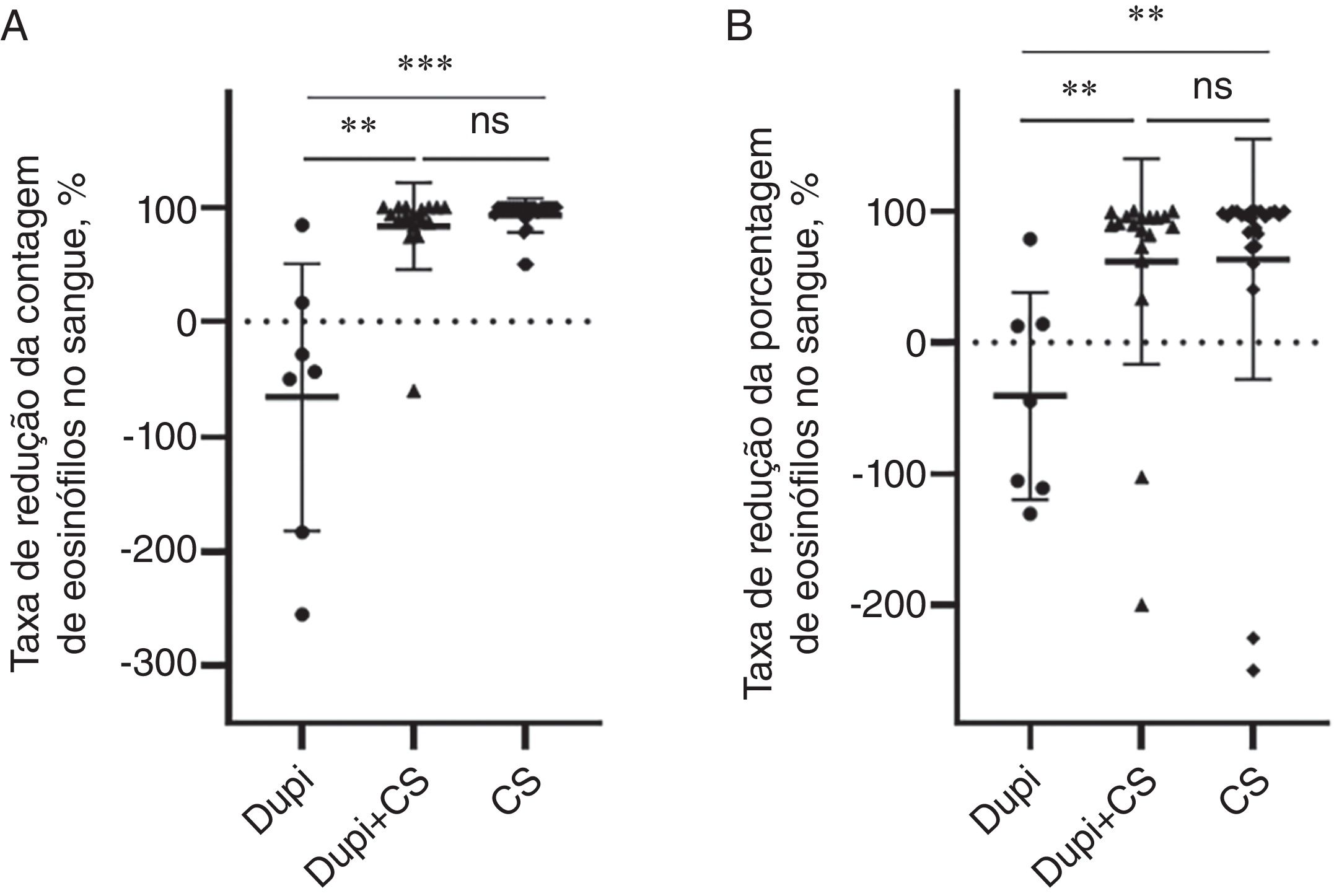
Para parâmetros laboratoriais, as taxas de redução da contagem e porcentagem de eosinófilos no sangue no grupo Dupi foram significantemente menores do que aquelas nos grupos Dupi+CS (ambas p <0,01) e CS (p <0,001, p <0,01), respectivamente, sem diferença significante entre os dois últimos grupos (fig. 3A e 3B). Entretanto, não houve diferenças significantes nas taxas de redução dos níveis séricos de IgE total, autoanticorpos anti‐BP180 e anti‐BP230 (IgG) entre os três grupos (figs. S3–S4).
Comparação das taxas de redução do nível de eosinófilos no sangue após tratamentos correspondentes entre os grupos Dupi, Dupi+CS e CS. (A‐B) Taxas de redução da contagem de eosinófilos no sangue (UniCel DxH 600, Beckman Coulter, Califórnia, EUA, 0,02∼0,52*109/L) após duas a três semanas de tratamento (A), e porcentagem de eosinófilos no sangue (UniCel DxH 600, Beckman Coulter, Califórnia, EUA, 0,4∼8,0%) após duas a três semanas de tratamento (B). As análises estatísticas foram realizadas com o teste de Steel‐Dwass para comparações post‐hoc pareadas entre três grupos após teste significante de Kruskal‐Wallis. ** p <0,01; *** p <0,001; ns, não significante.
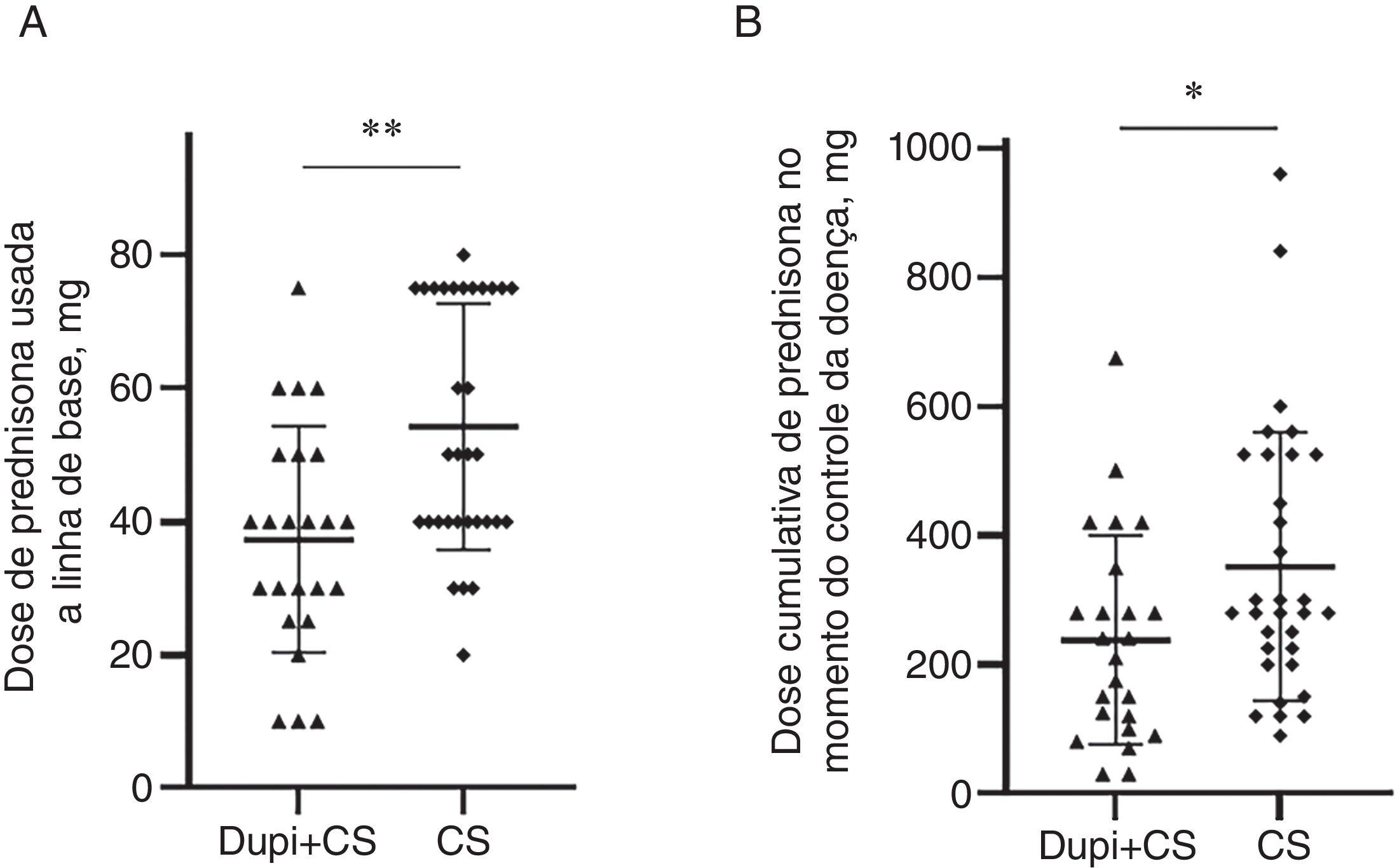
No grupo Dupi, apenas cinco de 13 casos atingiram o controle da doença, e o período médio desse controle foi de 14,8 dias (9–21 dias); dentre eles, dois pacientes atingiram remissão completa com medicamento na semana 8. Não houve diferenças significantes no período de controle da doença, porcentagem de pacientes que atingiram remissão completa durante a diminuição gradual na semana 8 e taxas de recorrência em um ano entre os grupos Dupi+CS e CS (figs. S5–S6). Entretanto, a dose de prednisona no início do estudo (37,3±16,9mg vs. 54,2±18,4mg; p <0,01) e a dose cumulativa de prednisona no momento do controle da doença (238,1±162,3mg vs. 351,7±207,9mg; p <0,05) administrada no grupo Dupi+CS foram significantemente menores do que aquelas no grupo CS, respectivamente (fig. 4A e 4B).
Comparação das doses de prednisona administradas entre os grupos Dupi+CS e CS. (A) Dose de prednisona usada na linha de base. (B) Dose cumulativa de prednisona no momento do controle da doença. As análises estatísticas foram realizadas com o teste U de Mann‐Whitney e o teste exato de Fisher. *p <0,05; **p <0,01.
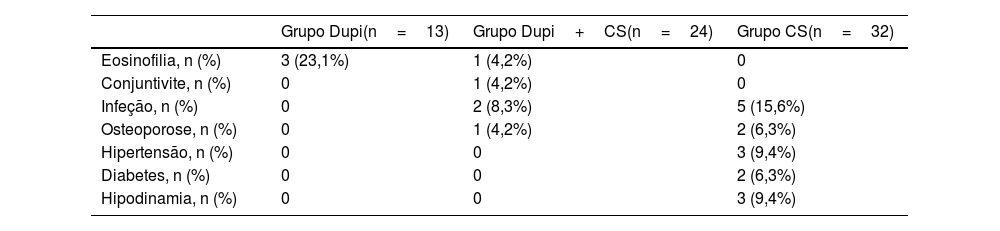
Como resumido na tabela 2, ocorreram 23 eventos adversos durante o período de seguimento. Quatro pacientes apresentaram eosinofilia transitória no sangue periférico, incluindo três (23,1%, três de 13 casos) no grupo Dupi e um (4,2%, um de 24 casos) no grupo Dupi+CS. Um paciente (4,2%, um de 24 casos) no grupo Dupi+CS apresentou conjuntivite após duas injeções de dupilumabe. Comparados com os pacientes no grupo CS (15,6%, cinco de 32 casos), os pacientes no grupo Dupi+CS (8,3%, dois de 24 casos) apresentaram risco geral reduzido de infecções (incluindo infecções graves ou oportunistas). Mais casos de osteoporose (6,3%, dois de 32 casos), hipertensão (9,4%, três de 32 casos), diabetes (6,3%, dois de 32 casos) e hipodinamia (9,4%, três de 32 casos) foram observados no grupo CS. Nenhum óbito ocorreu durante o período de seguimento. Nenhum paciente nos grupos Dupi e Dupi+CS teve o tratamento descontinuado por eventos adversos.
Resumo dos eventos adversos
| Grupo Dupi(n=13) | Grupo Dupi+CS(n=24) | Grupo CS(n=32) | |
|---|---|---|---|
| Eosinofilia, n (%) | 3 (23,1%) | 1 (4,2%) | 0 |
| Conjuntivite, n (%) | 0 | 1 (4,2%) | 0 |
| Infeção, n (%) | 0 | 2 (8,3%) | 5 (15,6%) |
| Osteoporose, n (%) | 0 | 1 (4,2%) | 2 (6,3%) |
| Hipertensão, n (%) | 0 | 0 | 3 (9,4%) |
| Diabetes, n (%) | 0 | 0 | 2 (6,3%) |
| Hipodinamia, n (%) | 0 | 0 | 3 (9,4%) |
Dupi, dupilumabe; CS, corticosteroides.
No presente estudo, os pacientes com PB foram tratados com monoterapia com dupilumabe principalmente pelos seguintes motivos: 69,2% (nove de 13 casos) dos pacientes com PB escolheram usar o tratamento com dupilumabe em virtude de doenças subjacentes mal controladas (como diabetes, doença renal e osteoporose); 23,1% (três de 13 casos) dos pacientes com PB se recusaram a usar terapia com corticosteroides orais; e 7,7% (um de 13 casos) dos pacientes com PB tiveram resposta ruim à terapia tradicional com corticosteroides.
Embora o número de casos no grupo Dupi tenha sido relativamente pequeno, comparando vários parâmetros clínicos antes e depois do tratamento pode‐se inferir que o dupilumabe pode melhorar as lesões cutâneas e os sintomas de prurido do PB, mas pode ser ineficaz para o tratamento de lesões da mucosa oral (figs. 1A e S7–S8). Em relação a essa questão, há alguns pontos a serem considerados: 1) há evidências crescentes de que células B produtoras de anticorpos, perfis mistos Th1 e Th2 autorreativos, o sistema complemento e certos fatores inflamatórios estão envolvidos na patogênese do PB,34–37 e o dupilumabe pode inibir efetivamente a resposta inflamatória Th2, mas pode ter pouco efeito em outras vias imunológicas e inflamatórias, o que pode ser o motivo pelo qual a monoterapia com dupilumabe não pode controlar completamente o PB; 2) atualmente, não há relatos de casos em que o dupilumabe se mostrou ineficaz ou eficaz no tratamento de danos à mucosa em outras doenças; 3) embora tenha sido descartada a possibilidade de pênfigo associado, não foram conduzidos testes para autoanticorpos relacionados ao penfigoide da membrana mucosa (PMM), o que significa que não se descarta a possibilidade de que os pacientes do presente estudo com PB possam também ter PMM, e atualmente não há literatura sobre uso do dupilumabe no tratamento de PMM. Portanto, a razão pela qual o dupilumabe é ineficaz no tratamento de lesões da mucosa oral de PB ainda não está clara, e mais investigações são necessárias.
No presente estudo, a maioria dos pacientes com PB no grupo Dupi+CS não apresentava condições adequadas para uso em longo prazo de corticosteroides em altas doses em virtude de doenças subjacentes, mas o tratamento com corticosteroides em doses médias/baixas não conseguiu controlar a doença rapidamente. As condições desses pacientes foram rapidamente controladas após a adição de dupilumabe ao tratamento, o que pode atingir o efeito da terapia suficiente com corticosteroides. Entretanto, em comparação com o grupo CS, o grupo Dupi+CS recebeu menor dose basal e dose cumulativa de prednisona no momento do controle da doença e houve menos efeitos adversos relatados. Dois estudos anteriores descobriram que o período de controle da doença de pacientes com PB tratados com dupilumabe combinado com corticosteroides foi significantemente menor do que o de pacientes com PB tratados em monoterapia com corticosteroides, e as taxas de redução do escore total do BPDAI e do escore NRS de prurido foram significantemente maiores na terapia combinada do que na monoterapia com corticosteroides após duas semanas de tratamento.25,28 Portanto, tanto os resultados da literatura quanto os do presente estudo sugerem que a combinação de dupilumabe e doses médias ou baixas de corticosteroides pode ser superior à terapia com corticosteroides.
No presente estudo, o nível sérico de autoanticorpos (IgG) anti‐BP180 foi significantemente reduzido nos grupos Dupi+CS e CS após um a três meses de tratamento, o que foi consistente com estudo anterior que demonstrou que os níveis séricos de autoanticorpos (IgG) anti‐BP180 nos grupos Dupi+CS e CS foram significantemente reduzidos após quatro semanas de tratamento.28 Esses resultados indicaram que tanto a monoterapia com corticosteroides quanto sua combinação com dupilumabe podem suprimir significantemente a produção de autoanticorpos (IgG) anti‐BP180 em pacientes com PB. Em relação ao nível sérico de autoanticorpos (IgG) anti‐BP230, ele foi reduzido significantemente no grupo CS após um a três meses de tratamento, mas não no grupo Dupi+CS no presente estudo. Entretanto, Yang J et al. descobriram que não houve alteração significante no nível sérico de autoanticorpos anti‐BP230 (IgG) nos grupos Dupi+CS e CS após quatro semanas de tratamento.28 Os autores consideram que as diferentes conclusões podem decorrer de diferentes períodos de seguimento no estudo atual e em estudos anteriores. Embora os dados da amostra tenham sido relativamente pequenos no grupo Dupi, pode‐se inferir que a monoterapia com dupilumabe não pode suprimir significantemente a produção de autoanticorpos anti‐BP180 e anti‐BP230 (IgG) em pacientes com PB.
A maioria dos estudos relatou que níveis mais altos de autoanticorpos IgE séricos estão associados a manifestações clínicas mais graves de PB.38 Além disso, o nível sérico total de IgE de pacientes com PB em estágio de remissão foi significantemente menor do que em estágio avançado.39 No presente estudo, o nível sérico total de IgE no grupo Dupi aumentou após duas a três semanas de tratamento, embora nenhuma diferença estatística significante tenha sido observada em virtude do tamanho relativamente pequeno da amostra (n=5). Entretanto, os níveis séricos totais de IgE nos grupos Dupi+CS e CS não foram alterados significantemente após duas a três semanas de tratamento. Yang J et al. descobriram que os níveis séricos totais de IgE diminuíram significantemente no grupo Dupi+CS após quatro semanas de tratamento, e nenhuma alteração significante foi observada no grupo CS.28 Os autores consideram que as diferentes conclusões podem ter sido causadas por diferentes períodos de seguimento do grupo CS no estudo atual e em estudos anteriores.
Estudos descobriram que o nível de eosinófilos está elevado no sangue periférico de mais de 50% dos pacientes com PB não tratados, o que provou estar positivamente correlacionado com a gravidade da doença e do prurido.40 Os resultados do presente estudo indicaram que tanto a monoterapia com corticosteroides quanto sua combinação com dupilumabe podem reduzir significantemente o nível de eosinófilos no sangue de pacientes com PB após duas a três semanas de tratamento, mas a monoterapia com dupilumabe não pode reduzir significantemente o nível de eosinófilos no sangue.
Os dados do presente estudo, especialmente os resultados da comparação dos efeitos do tratamento e efeitos adversos dos três grupos, sugeriram que: 1) para pacientes que têm apenas lesões cutâneas e cujas condições não são adequadas para tratamento com corticosteroides tradicionais devido a terapia imunossupressora por doenças subjacentes, a monoterapia com dupilumabe pode ser considerada; sua vantagem é ser segura e não agravar a evolução de doenças subjacentes, e a desvantagem é o fato de ser cara e de que maioria dos pacientes pode melhorar após o tratamento, sem contudo atingir o controle completo da doença; (2) para pacientes nos quais os tratamentos tradicionais são ineficazes ou cujas condições são inadequadas para altas doses de corticosteroides em virtude de doenças subjacentes e que são incapazes de atingir o controle da doença com doses médias ou baixas de corticosteroides, o dupilumabe combinado com corticosteroides pode ser considerado; a vantagem dessa estratégia terapêutica é que a maioria dos pacientes pode controlar rapidamente a doença e atingir a remissão completa; a desvantagem é que o tratamento é caro para uso em longo prazo.
ConclusãoO presente estudo fornece evidências da prática diária de que a monoterapia com dupilumabe com base no regime para o tratamento de dermatite atópica pode melhorar significantemente as lesões cutâneas e os sintomas de prurido do PB, mas pode ser ineficaz para o tratamento de lesões da mucosa oral em pacientes com PB. A combinação de dupilumabe e doses médias ou baixas de corticosteroides pode controlar o PB de modo rápido e seguro, e exibe segurança superior em comparação com a terapia com corticosteroides. Os achados do presente estudo fornecem orientação útil sobre a aplicação clínica do dupilumabe no tratamento de pacientes com PB, especialmente para pacientes resistentes à terapia com corticosteroides ou cujas condições não são adequadas para terapia com corticosteroides em altas doses.
Suporte financeiroEste trabalho recebeu suporte financeiro do Projeto de Pesquisa Científica da Jiangsu Provincial Health Commission (ZD2021035), National Key R&D Program of China (2022YFC3601800) e Education Fund Item of Liaoning Province (LJKMZ20221843).
Contribuição dos autoresGuirong Liang: Obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Hua Qian: Participação efetiva na orientação da pesquisa.
Chao Sun: Obtenção dos dados ou análise e interpretação dos dados.
Hanmei Zhang: Obtenção dos dados ou análise e interpretação dos dados.
Zhiliang Li: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Suo Li: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Ke Jing: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Chenjing Zhao: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Yuan Wang: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Ruiyu Xiang: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Xiaoguang Li: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Suying Feng: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Conflito de interessesNenhum.
Como citar este artigo: Liang G, Qian H, Sun C, Zhang H, Li Z, Li S, et al. Dupilumab, corticosteroids and their combination for the treatment of bullous pemphigoid. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.04.012
ORCID IDs: Guirong Liang: 0009‐0000‐9414‐2891, Hua Qian: 0009‐0000‐7085‐9388, Chao Sun: 0000‐0002‐4585‐3344, Hanmei Zhang: 0000‐0001‐9206‐7330, Zhiliang Li: 0000‐0002‐8560‐9207, Suo Li: 0000‐0003‐4764‐5976, Ke Jing: 0000‐0001‐5374‐6955, Chenjing Zhao: 0000‐0002‐3084‐4891, Yuan Wang: 0000‐0002‐4120‐4873, Ruiyu Xiang: 0000‐0002‐3211‐8922, Xiaoguang Li: 0000‐0001‐6419‐5693, Suying Feng: 0000‐0002‐1045‐9064.
Trabalho realizado no Instituto de Dermatologia, Hospital for Skin Diseases, Chinese Academy of Medical Sciences & Peking Union Medical College, Nanjing, Jiangsu, China.