Nas últimas décadas, um aumento alarmante do número de casos de esporotricose tem sido relatado nas regiões Sul e Sudeste do Brasil, principalmente no estado do Rio de Janeiro, considerada hiperendemia de longa duração associada à transmissão por felinos. Segundo classificações fenotípicas, as espécies de Sporothix recuperadas de gatos foram identificadas como S. brasiliensis em 96,5% dos casos estudados. Esse achado tem sido também demonstrado em humanos, o que confirma a transmissão zoonótica associada a essa espécie predominante no Brasil. A transmissão zoonótica do fungo e sua importante virulência, no contexto da hiperendemia no Rio de Janeiro, têm transformado a abordagem à doença, que em sua forma clássica encontrava‐se restrita a certos grupos profissionais e a regiões muito específicas no território brasileiro, em um problema de saúde pública e de interesse científico. Pois, as manifestações atípicas e reações de hipersensibilidade são cada vez mais frequentes, constituindo uma nova faceta da esporotricose, que merece atenção da comunidade médica e dos demais profissionais da área de saúde.
A esporotricose, descrita em 1898 por Benjamin Schenck,1 é micose subcutânea ou de implantação de caráter subagudo ou crônico que tem como agentes fungos dimórficos do gênero Sporothrix.2,3
Embora mais frequente em climas tropicais e subtropicais principalmente em ambientes úmidos, a doença tem sido descrita ao redor do mundo, com séries de casos publicadas em todos os continentes e em diferentes climas e populações. Os fungos do gênero Sporothrix encontram‐se na natureza, principalmente no solo. A infecção costuma resultar da inoculação do fungo através de espinhos, estilhas ou pequenas injúrias ocasionadas durante atividades como agricultura, jardinagem, caça, horticultura, carpintaria, entre outras,2,3 ou por transmissão zoonótica – esta última forma ganhando notoriedade nas últimas décadas.4 As espécies patogênicas mais relevantes são S. schenckii strictu sensu, S. brasiliensis, S. globosa e S. mexicana.5
A transmissão zoonótica encontra‐se mais frequentemente relacionada a cães e felinos; os gatos domésticos são os principais reservatórios, apresentando cultura positiva em lesões cutâneas, cavidade nasal, oral e nas unhas, o que reafirma a hipótese da possibilidade de transmissão tanto por arranhadura ou mordida do animal como por contato com secreções repletas de microrganismos infectantes.3
Nas últimas décadas, um aumento alarmante do número de casos tem sido relatado nas regiões Sul e Sudeste do Brasil, principalmente no estado do Rio de Janeiro, e tem sido considerado uma hiperendemia de longa duração associada à transmissão felina.4 As espécies de Sporothix recuperadas de gatos foram positivas para S. brasiliensis em 96,5% dos casos estudados. Esse achado tem sido também demonstrado nos humanos, o que confirma a transmissão zoonótica associada a essa espécie predominante no Brasil.4,6
No modelo murino conduzido por Arrillaga‐Moncrieff et al. em 2009, S. brasiliensis foi descrita como a espécie mais virulenta em termos de mortalidade, dano tissular e disseminação sistêmica entre as espécies estudadas (S. globosa e S. mexicana).7Sporothix brasiliensis tem sido relacionada com apresentações atípicas como esporotricose disseminada em pacientes imunocompetentes, acometimento conjuntival ou de mucosas e reações de hipersensibilidade.6 Embora apresente maior virulência, S. brasiliensis não parece ter maior resistência a antifúngicos, já que seu crescimento pode ser inibido com baixas concentrações de itraconazol,8 o fármaco de escolha, com tratamentos de menor duração.7 A transmissão zoonótica do fungo e sua importante virulência, no contexto da hiperendemia no Rio de Janeiro, têm transformado a abordagem à doença, que em sua forma clássica encontrava‐se restrita a certos grupos profissionais e a regiões muito específicas no território brasileiro, em um problema de saúde pública e de interesse científico, já que as manifestações atípicas e reações de hipersensibilidade são cada vez mais frequentes, constituindo uma nova faceta à esporotricose, que merece atenção da comunidade médica e dos demais profissionais da área de saúde.
Epidemiologia – aspectos peculiares da transmissão zoonóticaA esporotricose é micose universal, ou seja, ocorre em todo o mundo, porém é endêmica principalmente em regiões de clima tropical e subtropical. Ocasionalmente, ocorrem surtos ou epidemias, em geral de curta duração. É classificada como micose de implantação, por ter como rota de transmissão classicamente descrita a inoculação do fungo nos tecidos subcutâneos por traumatismo em indivíduos que trabalham com o manejo de plantas e solo.3
A transmissão zoonótica já foi descrita envolvendo gatos, cães, ratos, esquilos, tatus e aves.3,4,8,9 A espécie S. brasiliensis é associada com a transmissão zoonótica por pequenos traumas, em geral arranhadura ou mordedura de felinos. Os gatos permanecem infectados, alguns assintomáticos, por muitos meses, servindo de reservatório para o fungo. A transmissão gato‐gato e gato‐humano perpetua a transmissão, provocando a expansão territorial dos casos.4,8
A transmissão inter‐humana é rara e improvável pela pequena quantidade de fungo presente nas lesões.3 Porém, a exposição repetida e próxima à lesão aberta já foi relatada como possível forma de contágio inter‐humanos.10,11.
A esporotricose em gatos foi descrita no Brasil pela primeira vez na década de 1950.12,13 Em 1955, Almeida et al. descreveram um possível caso de arranhadura de gato como responsável pela inoculação do fungo em um paciente em São Paulo.14 Em 1989, Larsson et al. descreveram um caso de esporotricose em felino do litoral norte de São Paulo transmitida para três pessoas por arranhadura.15
Atualmente, existem relatos de casos em felinos e humanos em quase todos os estados do Brasil4,16–22 e os casos de transmissão zoonótica já estão presentes em outros países da América do Latina como Argentina, Paraguai e Panamá.23 Estados menos urbanizados onde a forma de transmissão clássica por S. schenckii é descrita há anos, com grande relevância nessas localidades, como Amazonas e Pará, também parecem estar observando uma alteração na clínica e epidemiologia.22,23 A esporotricose, nos últimos anos, é responsável por internações e óbitos em todo o Brasil.24
O Rio de Janeiro é o estado com o maior número de casos relatados na literatura; a transmissão zoonótica por felinos é descrita nesse estado desde a década de 1990,4 com um caráter progressivamente mais grave nas últimas décadas, principalmente quando ocorre coinfecção com HIV/AIDS.25,26
Em 2010, Silva analisou a distribuição espacial da esporotricose humana no estado do Rio de Janeiro, a partir de dados dos 1.848 pacienteis atendidos no Instituto Nacional de Infectologia (INI/Fiocruz), entre 1997 e 2007. Foi descrita uma concentração de casos caracterizando um possível “cinturão da esporotricose” nos limites entre a capital e os municípios da baixada fluminense, região com menor índice de urbanização.27 Posteriormente, nova análise no mesmo centro de pesquisa sugeriu o espalhamento progressivo dessa micose para o restante do município, particularmente para a Zona Oeste, e também para todas as regiões do estado do Rio de Janeiro.28
Até 2011, os dados epidemiológicos desse estado eram provenientes apenas de algumas publicações, principalmente do grupo do INI/Fiocruz. Em 2011, foi iniciada a notificação da doença; em 2013, a esporotricose foi classificada como doença de notificação compulsória em todo o estado do Rio de Janeiro, e o atendimento foi descentralizado.29 Essa medida foi de suma importância para a melhoria da vigilância epidemiológica e da implementação de medidas para controle da esporotricose, além de fornecer subsídios para a realização de estudos clínicos e epidemiológicos que propiciam o entendimento da dinâmica espacial da doença ao longo dos anos.28
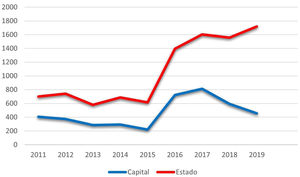
Considerando‐se as notificações realizadas à Secretaria Estadual da Saúde do Rio de Janeiro, o número de casos de janeiro 2011 a setembro de 2020 é de 10.313 (fig. 1). A capital concentrou 42,4% (4.369) das notificações no mesmo período. O número total tende a ser subdimensionado, tendo em vista a subnotificação, o subdiagnóstico e alguns casos de cura espontânea antes do atendimento médico.
No ano de 2019, foram notificados 1.720 casos em todo o estado do Rio de Janeiro, o que corresponde a uma incidência de 9,96 para cada 100 mil habitantes. É possível observar uma dissociação no aumento do número de notificações do estado e da capital a partir de 2015, representando, possivelmente, a interiorização da hiperendemia além dos limites descritos previamente. A queda de notificações na capital a partir de 2017 deve ser analisada mais detalhadamente em futuros estudos, pois parece não estar de acordo com o relatado na literatura e a prática clínica dos autores.
Outros estados (Pernambuco, Minas Gerais, Paraíba) e municípios também iniciaram a notificação compulsória após o surgimento de surtos de casos em felinos e humanos.24 Em fevereiro de 2020, uma portaria do Ministério da Saúde determinou a inclusão da doença na lista nacional de notificação compulsória de doenças, agravos e eventos de saúde pública.30 Entretanto, no mesmo ano, a medida foi revogada.31
Para o controle da hiperendemia são necessárias medidas mais robustas provindas do poder público com a colaboração do setor de saúde e da população em geral, levando‐se em conta uma abordagem “One Health”. A castração e o tratamento precoce dos felinos poderiam reduzir a transmissão entre os animais e dos animais para os humanos. Além disso, medidas educativas para garantir a posse responsável e a utilização de equipamentos de proteção individual poderiam contribuir para a prevenção da transmissão zoonótica. O investimento em estudos para o desenvolvimento de vacina para a esporotricose para animais e/ou humanos também deve ser incentivado como medida de controle da hiperendemia.23 Além disso, a inclusão da micose nas listas de doenças negligenciadas traria maior evidência para essa hiperendemia em constante expansão, com geração de maiores recursos destinados a estudos científicos de grande porte a fim de conter a propagação da doença.
Na atual situação de pandemia pelo SARS‐CoV‐2 simultaneamente a uma hiperendemia de esporotricose, os autores notaram atraso no diagnóstico da esporotricose, recebendo diversos pacientes com meses de evolução. O atraso no início do tratamento desencadeia aumento no número de infecções secundárias e pode, ainda, levar a sequelas mais graves pelo tempo de doença mais prolongado. Ressaltamos a importância da teledermatologia no início do tratamento, manejo desses pacientes e orientação de colegas da atenção básica. São necessários estudos para avaliar o real impacto da pandemia sobre a esporotricose.
Aspectos clínicos – formas clássicas, coinfecção com HIV, formas atípicas e fenômenos de hipersensibilidadeA esporotricose é doença multifacetada que pode mimetizar outras dermatoses. As variações desse espectro clínico têm sido atribuídas a fatores como modo de inoculação, tamanho e profundidade do inóculo, imunidade do hospedeiro, virulência e termo tolerância da cepa/linhagem.3,6,32 Sampaio e Lacaz propuseram a classificação da doença em quatro categorias: cutâneo‐linfática (a forma mais comum), cutânea localizada (20%), disseminada (cutânea ou sistêmica) e extracutânea (mucosa, óssea, ocular, articular, visceral).33 Existem outras classificações igualmente válidas com pequenas diferenças, mas os autores optaram por adotar essa classificação.
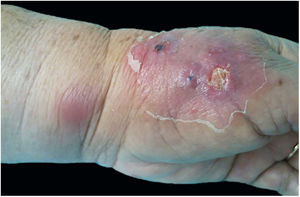
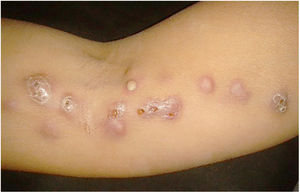
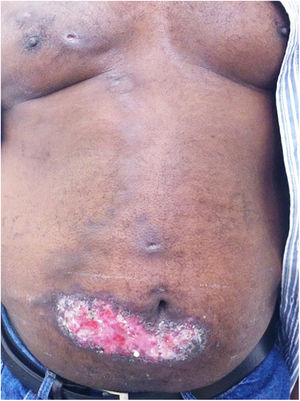
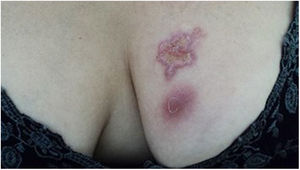
A forma cutâneo‐linfática (figs. 2, 3, 4 e 5) é a mais frequente – pode ocorrer em mais de 75% dos casos. Acomete principalmente mãos e antebraços nos adultos, embora em crianças a face seja um local comum, responsável por mais de 92% dos casos pediátricos. É caracterizada inicialmente por pápula, nódulo ou goma que ulcera (cancro de inoculação), surgindo então novos nódulos ou gomas ao longo de um ou até mesmo mais de um trajeto linfático até a cadeia ganglionar regional (cordão linfático centrípeto). Pode ocorrer adenopatia regional discreta; os sintomas sistêmicos, quando presentes, são geralmente leves. A bilateralidade da doença é rara e, quando ocorre, sugere múltiplos pontos de inoculação. Na hiperendemia por transmissão zoonótica do Rio de Janeiro é comum a inoculação de mais de um sítio pela arranhadura ou mordedura de gatos.4
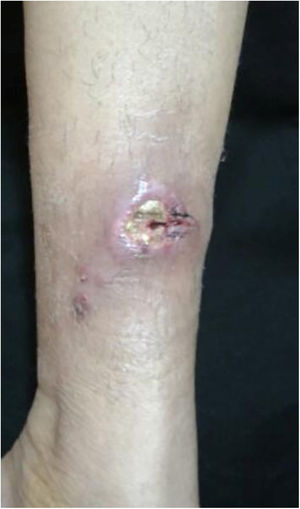
A forma cutânea localizada ou fixa acomete principalmente face, pescoço, tronco e pernas; a face é o local de eleição (fig. 6).33 Geralmente, não há disseminação linfática durante o curso da doença, que denota uma boa resposta imunológica do hospedeiro, e a lesão restringe‐se ao sítio de inoculação. Caracteriza‐se por lesão papulosa, papulotuberosa ou placa verrucosa com ou sem ulceração; pode ou não ser acompanhada de lesões satélites. Essas formas com “lesões satelitoides” ou “herpes‐like” tendem à cronicidade e usualmente não apresentam tendência à resolução espontânea. As lesões também podem assemelhar‐se a ceratoacantomas, celulite facial, pioderma gangrenoso, prurigo nodular, lúpus vulgar, sarcoma de partes moles, carcinoma basocelular, erisipeloide ou rosácea. Além disso, a apresentação verrucosa impõe o diagnóstico diferencial com paracoccidioidomicose, leishmaniose, cromomicose e tuberculose (que compõem o acrônimo PLECT).33,34
A forma disseminada é rara e pode ser tanto cutânea quanto sistêmica. Ambas decorrem da inoculação, ingestão ou inalação do fungo. A primeira (esporotricose disseminada cutânea – EDC) caracteriza‐se por múltiplas lesões papulo‐pustulo‐folículo‐crostosas, associadas a placas ou úlceras em locais não contíguos em quaisquer áreas do tegumento cutâneo, sem acometimento extracutâneo. Ocorre por disseminação hematogênica.
A forma disseminada sistêmica (EDS) caracteriza‐se por dois ou mais sistemas acometidos – principalmente sistema nervoso central (SNC), pulmão, osteoarticular e medula óssea –, além de febre e comprometimento do estado geral. Vale a pena lembrar que há controvérsias no meio científico quanto à divisão da forma disseminada em cutânea (EDC) e sistêmica (EDS), uma vez que pode ocorrer acometimento de órgãos internos na maioria dos casos.34–36
É de conhecimento comum que a forma disseminada está quase sempre associada a algum tipo de imunossupressão (alcoolismo, diabetes mellitus, sarcoidose, tuberculose, transplantados, malignidade, terapias imunossupressoras, AIDS).34 Em um estudo retrospectivo (1990‐2015) que incluiu 24 casos de EDC, Bonifaz et al. encontraram o diabetes descompensado e o alcoolismo crônico como os fatores predisponentes mais frequentes para essa forma clínica de esporotricose. Essas condições justificam a deterioração imunológica relacionada à resposta imune celular, especialmente à disfunção macrofágica.37
A forma extracutânea é rara, de diagnóstico difícil pela ausência de lesões cutâneas e frequentemente associada à inalação de esporos e à disseminação hematogênica em pacientes imunossuprimidos. Os ossos são as estruturas mais frequentemente acometidas, responsáveis por 80% dos casos de doença extracutânea, com destaque para tíbia, ossos da mão, rádio e ulna. O acometimento articular manifesta‐se principalmente por meio de monoartrite com edema, derrame sinovial e limitação funcional, podendo afetar joelhos, cotovelos, tornozelos ou punhos; os joelhos são o sítio mais comum. É importante insistir na comprovação diagnóstica precoce por meio da cultura do líquido sinovial ou biópsia sinovial, visto que pode ocorrer osteomielite se não houver tratamento adequado da infecção.34,35
A esporotricose pulmonar é rara e assemelha‐se clinicamente à tuberculose. Pode apresentar‐se como infecção primária por meio da inalação de esporos, na qual manifesta‐se com um padrão cavitário ou por disseminação, este caracterizado por padrão não cavitário. A forma pulmonar primária é a mais comum, pela inalação de conídios. Linfadenopatia hilar e derrame pleural podem estar presentes. A análise citológica e a cultura do escarro induzido revelam o patógeno na maioria dos casos.38
A esporotricose com envolvimento do SNC é extremamente rara, associada, na maioria dos casos, à imunossupressão. O exame do líquido cefalorraquidiano (LCR) denota pleocitose, hiperproteinorraquia e hipoglicorraquia. A cultura do LCR é mandatória para estabelecer o diagnóstico correto.39
A localização mucosa pode ser primária por inoculação direta (esporotricose mucosa primária – EMP) ou secundária à forma disseminada; EMP é a forma mais comum. Embora qualquer membrana mucosa possa ser afetada pela esporotricose, a mucosa ocular é mais comumente envolvida, causando episclerite, uveíte, coroidite, lesão retrobulbar, conjuntivite que, quando acompanhada de linfadenopatia regional, recebe o nome de síndrome oculoglandular de Parinaud, que não é incomum. Quando o ducto lacrimal é afetado, pode ocorrer dacriocistite como sequela.35
Coinfecção esporotricose e HIVEmbora pacientes infectados pelo HIV tenham risco aumentado de desenvolvimento de infecções fúngicas profundas e disseminadas, a esporotricose é encontrada com menor frequência que outras micoses. Quando ocorre a coinfecção, é mais frequentemente disseminada e com contagem de células T CD4+muito baixa.36 O quadro clínico da esporotricose no paciente com AIDS é bastante variável, produzindo úlceras, lesões acneiformes, placas endurecidas ou crostas em sua apresentação.34,39,40 Além disso, podem desenvolver manifestações sistêmicas que incluem lesões ósseas graves, envolvimento do pulmão e baço, além de meningite principalmente pelo neurotropismo relacionado a S. brasiliensis, levando à sepse e morte. Curiosamente, apesar de ser um grupo vulnerável, os relatos de EDS em pacientes transplantados não são tão frequentes.41
Em um período em que o uso de imunobiológicos para diversas doenças autoimunes está em ascensão, é importante levar em consideração a presença de uma hiperendemia e orientar profissionais e pacientes quanto ao contato com os animais doentes e, quando possível, aguardar o tratamento da micose para iniciar medicamentos que possam provocar uma imunossupressão.
É importante destacar que a esporotricose pode eclodir como apresentação da síndrome inflamatória de reconstituição imunológica (SIRI) em vigência à terapia antirretroviral para o tratamento da AIDS ou, na forma disseminada, ser a primeira manifestação da imunossupressão.25,39
Um aumento no número de casos, hospitalizações e óbitos de pacientes com esporotricose coinfectados com HIV foi documentado no Rio de Janeiro, o que pode ser explicado por uma aceleração na propagação em área urbana da esporotricose nos últimos anos, atingindo mais essa população vulnerável.25,26 Ressaltamos a importância de uma triagem de HIV mais ampla e de profissionais cada vez mais cientes da possibilidade de coinfecção e da gravidade desse quadro.
Freitas et al, recuperaram informações de 3.618 pacientes diagnosticados com esporotricose, dos quais 48 eram coinfectados pelo HIV registrados entre 1987 e março de 2013 no INI/Fiocruz, centro de referência nacional em doenças infecciosas. Nesse estudo, observou‐se que a infecção pelo HIV com baixa contagem de células CD4+agrava a esporotricose, uma vez que esses pacientes apresentaram doença disseminada mais grave, necessidade de internação 42 vezes maior e risco de óbito 45 vezes maior por essa micose do que indivíduos não infectados pelo HIV. Em razão de sua apresentação agressiva, a esporotricose induziu o teste de HIV e subsequente diagnóstico em 19/48 pacientes.25
Isso deve‐se ao fato de que o HIV modifica claramente a história natural da esporotricose e está associado a amplo espectro dessa micose. As células T CD4+têm papel fundamental no controle da esporotricose, e essas células são exatamente o principal alvo da infecção pelo HIV.
Em outra busca retrospectiva na base de dados do INI/Fiocruz entre 1999 e 2015, foram diagnosticados com esporotricose 3.917 pacientes, dos quais 75 foram hospitalizados e 11 evoluíram a óbito. A infecção pelo HIV estava presente em 29 pacientes (38,7%), com uma contagem média de células CD4+de 52 células/μL. O tempo de internação foi maior entre os pacientes com esporotricose/HIV, bem como o odds ratio para hospitalizações (55,7; intervalo de confiança de 95% [95% IC]: 32,0‐96,9) e óbitos (69,8; 95% IC: 20,8‐234,5), quando comparado a indivíduos não infectados pelo HIV.26
Formas atípicasNos últimos anos, após várias mudanças na taxonomia do S. schenckii e com o advento da hiperendemia zoonótica do Rio de Janeiro, surgiram novas observações sobre os aspectos clínicos da esporotricose, o que os autores deste artigo chamam da “nova faceta da esporotricose”. Diversas apresentações, até então incomuns, foram identificadas. Nesse contexto, as diferentes espécies do complexo Sporothrix parecem estar associadas a certas manifestações clínicas da esporotricose e a apresentações atípicas da micose.6,7
Na hiperendemia zoonótica do Rio de Janeiro, que ocorre desde a década de 1990 e tem o contato com felinos infectados como principal fonte de transmissão, os pacientes infectados por S. brasiliensis apresentam um número estatisticamente significativo maior de reações de hipersensibilidade e disseminação da doença.4,42–47
Em estudo transversal com 50 pacientes com diversas formas clínicas de esporotricose, Almeida‐Paes et al. revelaram um quadro clínico distinto nas infecções causadas por S. brasiliensis em comparação com pacientes com S. schenckii. A espécie S. brasiliensis foi associada a infecção cutânea disseminada sem doença de base, reações de hipersensibilidade e infecção da mucosa, enquanto pacientes com S. schenckii apresentaram doença menos grave e mais frequentemente localizada, demonstrando associação direta entre apresentações clínicas incomuns de esporotricose humana, incluindo doença grave em indivíduos imunocompetentes com a infecção por S. brasiliensis,6 o que sugere maior virulência dessa espécie.
Síndrome de SweetA síndrome de Sweet cursa com o surgimento de placas ou nódulos eritematosos. Na histopatologia, apresenta um infiltrado neutrofílico denso sem a presença de vasculite leucocitoclásica, com boa resposta a corticoides, acompanhada ou não de febre e leucocitose com neutrofilia. Recentemente, de Lima et al. descreveram 10 casos de síndrome de Sweet em pacientes com esporotricose. Esses pacientes cumpriam os critérios histopatológicos para o diagnóstico, além de ter cultura compatível com Sporothrix sp. Após anamnese cuidadosa, foi descartada a possibilidade de tratar‐se de uma farmacodermia. A incidência dessa síndrome nos 379 pacientes com esporotricose foi de 2,9%. Todos os casos de síndrome de Sweet estudados foram associados à infecção por S. brasiliensis.43 Em outra série de casos publicada em 2011, a síndrome de Sweet foi mais frequente em pacientes adultos do sexo feminino e que foram tratadas com corticoide e itraconazol com sucesso.44
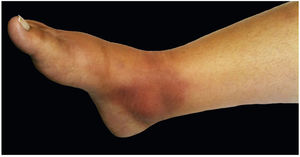
Eritema nodosoO eritema nodoso caracteriza‐se pelo aparecimento súbito de nódulos eritematosos na região anterior das pernas, acompanhados de febre, artralgia e mialgia. Essa síndrome clínica pode ser secundária à esporotricose (fig. 7), o que se deve, provavelmente, a um mecanismo de hipersensibilidade à infecção, como descrito em outras micoses, principalmente sistêmicas, tais como coccidioidomicose, histoplasmose e paracoccidiomicose. Nestas, a presença do eritema nodoso representa um fator de bom prognóstico. Em 2002, Gutierrez‐Galhardo et al. apresentaram uma série de três casos de eritema nodoso associado a esporotricose de transmissão zoonótica no estado do Rio de Janeiro. Dois dos pacientes apresentaram nódulos acompanhados de lesões ulceradas nos membros inferiores, e um apenas nódulos. Todos apresentaram histopatologia compatível com eritema nodoso.42 Outro caso, publicado em 2013, abordou uma paciente de 28 anos e imunocompetente que apresentou nódulos eritematosos em membros inferiores associados a lesões típicas de esporotricose, confirmada na cultura. O quadro resolveu‐se com o uso de anti‐inflamatórios não esteroides e itraconazol.45
Eritema multiformeEritema multiforme é doença aguda, geralmente restrita, que se apresenta com lesões (única ou múltiplas) que acometem a pele em seu polo minor e mucosa em seu polo major. Associa‐se a uma resposta inflamatória relacionada a infecções em 90% dos casos; o herpes simplex vírus tipo 1 é sua etiologia mais frequente, seguido por herpes simplex tipo 2 e Mycoplasma pneumoniae. Em 10% dos casos está associado ao uso de fármacos, em especial anti‐inflamatórios não esteroides.45
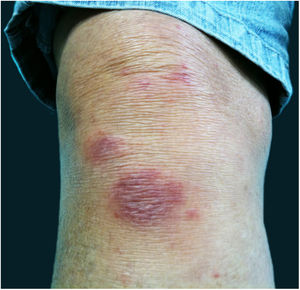
O eritema multiforme tem sido relacionado a infecções por histoplasmose, coccidiomicose e alguns casos de dermatofitose e esporotricose (fig. 8). O quadro é baseado na presença de eritema multiforme diagnosticado pela clínica e histologia em vigência de esporotricose.46
ArtriteO acometimento osteoarticular é a forma mais comum de esporotricose extracutânea, comumente por meio da inoculação traumática de materiais contaminados na pele. As formas ósseas estão geralmente relacionadas a pacientes imunossuprimidos, tais como etilistas ou pacientes com HIV/AIDS.48 A artrite pode se apresentar como reação de hipersensibilidade associada a esporotricose, em indivíduos sem imunossupressão. Orofino et al. relataram o caso de uma paciente previamente hígida que, após contato com gato doente, apresentou edema, eritema e dor à mobilização em ambos os cotovelos, associado a lesões ulceradas com cultura positiva para Sporothrix. A paciente apresentou exames laboratoriais de rotina dentro de parâmetros normais, com exceção da velocidade de hemossedimentação (VHS), que se encontrava levemente elevada, e radiografia sem alterações. Após tratamento com iodeto de potássio, as lesões desapareceram, assim como o acometimento articular.49
A artrite na esporotricose é usualmente monoarticular, frequentemente envolve o joelho, punho, cotovelo ou tornozelo e se manifesta com edema e sinais inflamatórios, normalmente sem sintomas sistêmicos. Os exames laboratoriais costumam ser normais, com exceção da VHS. Ultrassonografia e radiografia também não se encontram alteradas. O diagnóstico é realizado a partir da anamnese, das manifestações clínicas e da resposta ao tratamento antifúngico, levando em conta que o padrão ouro para o diagnóstico da esporotricose é o isolamento do fungo a partir de material extraído de uma lesão.48
As reações de hipersensibilidade na esporotricose estão provavelmente relacionadas ao contato frequente com antígenos fúngicos no ambiente, relacionados à hiperendemia no estado do Rio de Janeiro.6 Essa exposição constante poderia provocar uma estimulação intensa do sistema imune das pessoas que estão em contato frequente com gatos infectados, e que tendem a ter uma grande quantidade de células fúngicas nas lesões.5 Cada exposição pode gerar um gatilho e culminar com uma infecção subclínica ou reinfecção e provocar hipersensibilidade. Ainda não se sabe se a reação de hipersensibilidade está condicionada a resposta à infecção do hospedeiro, predisposição genética, tamanho do inóculo ou virulência da cepa.6,7
Foi observado também que os pacientes que apresentaram reações de hipersensibilidade tiveram resolução do quadro de esporotricose de maneira mais rápida do que aqueles que não as apresentaram. Desses, uma grande porcentagem apresentou a forma cutânea fixa. Isso pode significar que as reações de hipersensibilidade denotam maior resposta imune desses pacientes ao S. brasiliensis (uma vez que a forma fixa decorre de uma boa resistência) e possivelmente tem um papel protetor, como observado na coccidiomicose.6,7
Diante disso, são necessários estudos aprofundados relacionando a biologia molecular que incluam os aspectos clínicos da infecção causada por S. brasiliensis com a finalidade de desenvolvimento de novas terapêuticas espécie‐específicas e, não menos importante, direcionadas aos aspectos imunológicos das espécies circulantes, contribuindo para a profilaxia da doença por meio da vacinação de animais e dos seres humanos.
Diagnóstico – exame micológico, histopatologia, testes sorológicos e testes molecularesNa situação de hiperendemia, com poucos recursos disponíveis, é aceitável o diagnóstico clínico e epidemiológico para iniciar o tratamento. Porém, o diagnóstico definitivo depende da comprovação da presença do fungo na amostra.
Os exames clássicos, de baixo custo e accessíveis, incluem o exame microscópico direto (EMD) e a cultura do material coletado por meio de fragmentos ou líquido de exsudatos de lesões cutâneas. Nos casos de acometimento extracutâneo, podem ser examinadas amostras como escarro, urina, sangue, líquido sinovial e cefalorraquidiano.50
O EMD com hidróxido de potássio a 10% ou com dimetilsulfóxido torna possível observar com microscópio óptico o fungo na forma de levedura, que se assemelha a um “charuto”, porém essas estruturas raramente podem ser observadas em razão da paucicelularidade fúngica e do pequeno diâmetro (2‐6 μm) do fungo. Esse exame tem baixa especificidade porque existem outros fungos leveduriformes morfologicamente semelhantes.50
A cultura é mais sensível e específica que o EMD. Deve ser realizada em ágar de glicose Sabouraud ou Mycosel a 25°C. O tempo de crescimento é variável; começa a ser visível entre três e sete dias, porém algumas amostras levam um tempo maior de crescimento, entre quatro e cinco semanas.3,50 Na prática diária, os autores recomendam não descartar o tubo de cultura em um prazo menor que 30 dias, ao observar que certas amostras provindas do Rio de Janeiro levaram mais tempo para positivar.
As colônias iniciais são lisas e úmidas, de cor creme com centro mais escurecido. Com o passar do tempo, geralmente cerca de sete dias, vão escurecendo – ou seja, tornam‐se marrons a negras em razão da produção de melanina caraterística dos fungos demáceos (fig. 9). É importante enfatizar que esse fungo não é considerado um fungo demáceo, apesar de poder apresentar pigmento negro com a maturidade.3
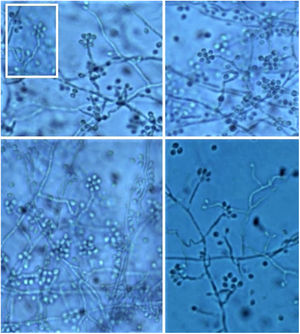
É necessário realizar o estudo micromorfológico para reconhecer as formas filamentosas que cresceram à temperatura ambiente (25°C), observando‐se micélios de hifas finas, hialinas, septadas e ramificadas, reproduzindo‐se por meio de conídios unicelulares, ovais ou piriformes arranjados ao longo da hifa em forma de cachos ou em arranjo floral semelhante a margarida (fig. 10).3
No entanto, os cultivos a 35‐37°C precisam de meios enriquecidos como o ágar de infusão de cérebro e coração, ágar sangue ou chocolate para que as colônias cresçam entre cinco a sete dias. Tem um aspeto cremoso de cor amarela ou marrom. Na microscopia da cultura, podemos identificar as leveduras reproduzindo‐se por brotamento. Essa conversão do fungo produtor de conídios da forma filamentosa a 25°C (em temperatura ambiente) para leveduriforme a 37°C (em tecidos do hospedeiro) confirma o diagnóstico.3
Apesar de a cultura ser um exame considerado padrão ouro para o diagnóstico de esporotricose, ela não tem a capacidade de diferenciar entre as espécies do complexo Sporothrix, que apresentam virulência e suscetibilidades diferentes aos tratamentos antifúngicos. Arrillaga‐Moncrieff et al. observaram que S. brasiliensis e S. schenckii são espécies mais virulentas em comparação a S. globosa e S. mexicana, que demonstraram pouca ou nenhuma virulência no modelo murino.7 Todavia, nos casos mais graves ou de resposta terapêutica pobre, seriam necessários testes mais específicos para diferenciar entre as diversas espécies.51,52
HistopatologiaO estudo anatomopatológico dos tecidos infectados com esporotricose apresentam as mesmas limitações do EMD, por apresentarem poucos elementos fúngicos e de pequeno tamanho, o que dificulta sua detecção, e apresenta baixa sensibilidade. Com a finalidade de incrementar a visualização das estruturas fúngicas, utiliza‐se colorações de ácido periódico de Schiff (PAS) ou prata metenamina (Grocott), que facilitam a visualização de células leveduriformes semelhantes ao “charuto”. Além disso, a ausência de fungos está relacionada com a resposta do hospedeiro e o tempo de evolução da infeção. Nos casos mais agudos, apresentam caraterísticas histopatológicas de uma atividade inflamatória importante, com presença de neutrófilos ou abscessos e predomínio de macrófagos; no entanto, as lesões mais crônicas ou com uma resposta imunológica mais bem desenvolvida se caracterizam pela formação de granulomas epitelioides ou tuberculoides, presença de linfócitos, necrose caseosa ou fibrinoide e fibrose.51,53
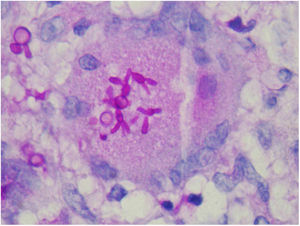
O achado de corpos asteroides ou fenômeno Splendore‐Hoeppli consiste em um material eosinofílico que envolve a célula fúngica. Provavelmente representa um depósito de imunoglobulina aderido à parede do microrganismo, porém não é específico da esporotricose (fig. 11).53
Testes sorológicosOs testes sorológicos facilitam o diagnóstico e o acompanhamento dos casos que apresentam manifestações sistêmicas em que a coleta do material para análise é difícil, ou nas formas atípicas de esporotricose, quando a suspeita diagnóstica é contundente e a cultura é constantemente negativa. As primeiras técnicas de imunoeletroforese, aglutinação e imunodifusão utilizando fração antigênica eram pouco sensíveis e específicas, e foram substituídas por testes imunoenzimáticos, especialmente ELISA (enzyme linked immuno sorbent assay) e Western blotting, mais sensíveis e rápidos.5 Exemplificando, quando comparamos os títulos de anticorpos mensurados no LCR como superiores aos títulos de anticorpos no soro, auxilia ao diagnóstico de meningite esporotricótica. Porém, não existe uma associação entre a gravidade e a distribuição das lesões com a quantidade ou o tipo de antígeno reconhecido. Além disso, os exames sorológicos ainda são pouco disponíveis na rotina da prática clínica.54–56
Testes molecularesAs limitações dos métodos tradicionais de diagnóstico levaram ao desenvolvimento, nos últimos anos, de alguns métodos de diagnóstico a nível molecular para identificar cada espécie de Sporothrix spp. por meio do sequenciamento em “código de barra” de seus genes específicos, melhorando a especificidade, a precisão e a sensibilidade do diagnóstico.52
Os genes codificadores de proteínas consideradas marcadores para identificação, taxonomia, tipagem e epidemiologia de espécies de Sporothrix são: beta‐tubulina (BT2), o fator de alongamento 1α (EF‐1α), o ITS1 e ITS2 (internal transcript spacer) e a calmodulina (CAL). A CAL foi relatada como o melhor marcador e o locus mais informativo filogeneticamente, considerado o padrão ouro.57
Na literatura existem vários estudos com as técnicas utilizadas. Entre eles, as mais empregadas foram: a restriction fragment length polymorphism (RFLP) de diferentes genes alvos, PCR nested, random amplified polymorphic DNA (RAPD), sequenciamento do DNA da região de transcrição interna do rRNA (ITS), reação em cadeia da polimerase (PCR) com alvo no gene da enzima topoisomerase II, amplified fragment length polymorphism (AFLP), e M13 PCR fingerprinting. A maioria dos estudos realizados com essas técnicas apresentam algumas limitações: foram realizadas em isolados de cultura e poucas em amostras clínicas, as técnicas são complexas e demoradas.57–62
Em 2012, Oliveira et al. descreveram a aplicação do PCR fingerprinting utilizando o primer universal T3B para distinguir entre as espécies do complexo Sporothrix schenckii (S. brasiliensis, S. globosa, S. mexicana e S. schenckii) e confirmados por análises de sequência parcial do gene CAL.61 Posteriormente, em 2015, utilizaram a mesma metodologia e foi acrescida a distinção das cepas S. pallida e S. luriei. Essa técnica tem as vantagens de ser simples, confiável, rápida e de baixo custo; é um sistema de identificação ideal para utilização em laboratórios clínicos de micologia que não disponham de recursos para o sequenciamento de DNA.62
Em 2019, Zhang et al. desenvolveram um PCR multiplex em tempo real, baseado também no sequenciamento do gene da CAL, com taxas de detecção positivas de 100% para S. brasiliensis, S. schenckii, S. globosa. Esse é um teste promissor para comercialização de um kit que seja eficaz, rápido, preciso e altamente sensível.60
A relevância do reconhecimento das espécies de Sporothrix se deve às diferentes caraterísticas que cada uma elas apresenta, principalmente a maior virulência do S. brasiliensis, seguido do S. schenckii e S. globosa, que desenvolvem as formas clínicas mais graves. Além disso, possibilita o rastreamento das rotas de transmissão da doença durante epizootias e zoonoses no Brasil, além de vincular genótipos específicos a perfis de suscetibilidade antifúngica, assim como faz ligações entre achados clínicos de esporotricose felina com a esporotricose humana.63
Outros examesExistem testes intradérmicos que utilizam esporotriquina ou antígeno peptido‐rhamnomanana (PRM), que ajudam na detecção da hipersensibilidade tardia, porém não são sensíveis nem específicos.51 Os estudos de imagem são solicitados quando há a suspeita de envolvimento sistêmico específico, como radiografia ou tomografia computadorizada (p. ex., na esporotricose pulmonar ou esporotricose osteoarticular), que darão suporte ao manejo, porém não atuam especificamente no aparato diagnóstico da doença‐infecção‐esporotricose.
Tratamento ‐ arsenal terapêutico disponível, intervenção cirúrgica e manejo das reações de hipersensibilidadeApesar de haver relatos de regressão espontânea da forma clássica da esporotricose, isso não ocorre com a esporotricose zoonótica até o presente momento. Na maioria dos casos, o tratamento farmacológico é imprescindível.64 O prognóstico da esporotricose em sua forma clássica é excelente quando instituído o diagnóstico e iniciado o tratamento precocemente. Entretanto, na forma zoonótica temos visto casos que se arrastam por meses ou até anos, apesar do tratamento adequado.26,39,48
O arsenal terapêutico farmacológico para o tratamento da esporotricose é limitado. A escolha terapêutica é basicamente pautada por baixo custo, facilidade na administração, perfil de segurança e o sítio e a extensão da infecção (se localizada ou disseminada).64 A duração do tratamento é variável. Para casos leves, leva em média dois a três meses, e pode atingir até um ano nas formas disseminadas ou sistêmicas. A terapêutica deve ser mantida até a cura clínica – ou seja, até a ausência de sinais que indiquem atividade de doença, tais como presença de pus, exsudação e crostas nas lesões cutâneas.
ItraconazolO itraconazol é utilizado como fármaco de primeira linha de tratamento dos casos localizados ou cutânea disseminada de esporotricose, por promover grande eficácia clínica, segurança e poucos efeitos colaterais, além de conveniência posológica.36,64
A dose varia segundo a gravidade e resposta terapêutica, de 100 a 400mg/dia em uma ou duas tomadas VO até a cura clínica, variando de três a seis meses, podendo chegar a um ano nos casos osteoarticulares e nas formas disseminadas. O tratamento com 100mg/dia é eficaz na maioria dos casos leves, inclusive nas formas atípicas.3,42 Doses mais elevadas são geralmente recomendadas para mau respondedores ou recaídas; entretanto, são acompanhadas de maior frequência de efeitos adversos: cefaleia, distúrbios gastrintestinais, hipercolesterolemia, hipertrigliceridemia, alterações da função hepática e edema periférico – os dois primeiros são os efeitos mais relatados. Em crianças, a dose recomendada é de 5mg/kg/dia.35,50 No acometimento ósseo, a dose recomendada é de 400mg/dia.48
Pode ser administrado de maneira contínua ou intermitente. Song et al., em estudo prospectivo randomizado, compararam a terapia diária oral (200 mg) com a terapia de pulso de itraconazol (400 mg/dia por 7 dias/mês), com 25 pacientes com diagnóstico de esporotricose cutânea em cada grupo. Embora os pacientes que receberam terapia contínua oral tenham mostrado maior taxa de cura após 48 semanas (95,8%×81,8%), os resultados não foram estatisticamente significativos. Essa modalidade ainda não faz parte dos consensos; são necessários mais estudos acerca da pulsoterapia na terapêutica da esporotricose.65
O hemograma, a bioquímica e os testes de função hepática completos devem ser realizados antes do tratamento e após três a quatro semanas. Se os níveis séricos estiverem dentro dos limites normais, os testes só devem ser repetidos no final do tratamento.35
Sua maior desvantagem é a interação medicamentosa decorrente de seu metabolismo dependente do sistema citocromo P450, também comum a outros medicamentos, tais como fenitoína, sinvastatina e agentes hipoglicemiantes orais. Logo, sua administração é contraindicada concomitante a fármacos também metabolizados por essa enzima em razão da toxicidade potencialmente grave. O itraconazol é hepatotóxico e teratogênico, e não pode ser usado em pacientes com doenças hepáticas ou em mulheres grávidas (categoria de risco C).
Iodeto de potássioO iodeto de potássio, que historicamente foi o tratamento de escolha da esporotricose, é uma opção eficaz e de baixo custo, o que é de grande valia em áreas endêmicas de países em desenvolvimento e nos casos não respondedores ao itraconazol. Entretanto, não é efetivo para formas extracutâneas de esporotricose.64
Usualmente, é administrado VO em solução saturada de iodeto de potássio. Na solução saturada, cada gota contém 0,07g; na solução concentrada, 0,05g de iodeto de potássio. A dose recomendada em adultos é de cinco gotas, três vezes/dia, aumentando gradativamente três gotas por dose diariamente até alcançar a mais alta dose bem tolerada, que fica em torno de 30‐40 gotas, três vezes/dia. A administração com suco de frutas ou leite pode mitigar efeitos gastrintestinais indesejados. Para a população pediátrica, recomenda‐se iniciar três gotas, três vezes/dia, aumentando um gota/kg por dose até o máximo de 25 gotas, três vezes/dia.50
Estudo recente demonstrou que o iodeto de potássio, sob a forma de solução saturada, administrado em dose e frequência reduzidas, pode ser usado como alternativa efetiva e segura para o tratamento da esporotricose cutânea. Doses de 1‐2g/dia para crianças e 2‐4g/dia para adultos, administradas três vezes/dia, são eficazes para curar a maioria dos pacientes.66
O mecanismo de ação do iodeto de potássio na esporotricose ainda é desconhecido, apesar de sua ação já ser conhecida na inibição da formação de granulomas, fagocitose das células de Sporothrix, bem como na resposta imune. Esse efeito imunomodulador também faz com que seja útil nas apresentações imunorreativas de esporotricose. Seu uso é limitado por seus efeitos adversos, que incluem distúrbios gastrintestinais, gosto metálico, coriza, rash, aumento das glândulas salivares e distúrbios tireoidianos. Seu uso prolongado, principalmente em pacientes que já apresentam algum defeito na regulação da função tireoidiana, pode levar à interrupção da produção endógena dos hormônios da tireoide, fenômeno conhecido como efeito Wolff‐Chaikoff. Por esse motivo, é contraindicado em pacientes com disfunção tireoidiana, bem como em gestantes (categoria D) e lactantes. Em caso de toxicidade, a dose deve ser reduzida até que não haja mais efeitos adversos.66
TerbinafinaA terbinafina na dose de 250 mg/dia pode ser utilizada nas formas cutâneas de esporotricose, com taxa de cura maior ou igual ao itraconazol 100 mg/dia.67 Pode ser prescrita nos casos não responsivos ao itraconazol ou quando este não é bem tolerado ou contraindicado, bem como em pacientes que fazem uso de estatinas, uma vez que tem baixa ligação ao citocromo P450, não interferindo na biodisponibilidade de outros fármacos, ao contrário do itraconazol. Por esse motivo, também é útil na terapêutica de pacientes idosos com comorbidades.67 É um medicamento considerado categoria B em gestantes.
FluconazolO fluconazol pode ser usado como alternativa para as formas resistentes de esporotricose na dose de 400 mg/dia durante três a seis meses. Como a experiência com fluconazol na terapia da esporotricose é limitada e demonstra efetividade moderada, ele é considerado uma opção de tratamento de segunda linha em pacientes intolerantes ao itraconazol. O fluconazol é contraindicado na gestação por seu potencial teratogênico.64
Anfotericina BA anfotericina B é o fármaco de escolha no tratamento de pacientes severamente comprometidos, como os casos de esporotricose disseminada, pulmonar, meníngea ou em pacientes imunodeprimidos. Também pode ser indicada para esporotricose osteoarticular extensa ou casos não responsivos ao itraconazol.64
A dose recomendada de anfotericina B é de 0,5 a 1 mg/kg/dia até que seja alcançada resposta clínica favorável, seguida de itraconazol 400mg/dia como terapia de manutenção. Após a estabilização clínica, recomenda‐se trocar a medicação para o itraconazol 200 mg/dia por um tempo mínimo de 12 meses.64
Na literatura não há dados substanciais para a escolha da formulação lipídica da anfotericina em detrimento da desoxicolato, com exceção de que a formulação lipídica poderia ser preferida nos casos de meningite. Existem dados em animais observando que concentrações mais elevadas são alcançadas no tecido cerebral com a formulação lipídica da anfotericina B, quando comparada à forma desoxicolato. No entanto, a relevância dessa descoberta para o tratamento da esporotricose meníngea ainda é desconhecida. Além disso, em suas formulações lipídicas é possível utilizar doses maiores (3‐5 mg/kg/dia) com menor toxicidade.64
TermoterapiaA aplicação diária de calor local sobre a lesão de pele, utilizando compressas mornas ou dispositivos que emitem ondas infravermelhas, é recomendada no tratamento de pequenas lesões, além de ser uma forma de tratamento mais aceitável em gestantes e pacientes intolerantes a antifúngicos orais. Pode‐se combinar a termoterapia com o tratamento farmacológico; recomenda‐se aplicar o calor local durante 15 minutos até 1 hora várias vezes ao dia, até a completa resolução do quadro ou até a introdução do tratamento medicamentoso.3,64
Intervenção cirúrgicaNa esporotricose pulmonar, em casos segmentares ou naqueles não responsivos ao tratamento, a lobectomia pode ser considerada.38 A combinação de ressecção cirúrgica e anfotericina B nesses casos é considerada a melhor abordagem terapêutica, superior a essas medidas isoladamente.64
A criocirurgia com nitrogênio líquido pode ser utilizada como complemento terapêutico nos casos refratários de esporotricose (forma fixa ou cutâneo‐linfática). Esse método deve ser recomendado principalmente quando as lesões são crostosas e infiltradas, bem como nos casos isolados de lesões localizadas em pacientes imunocompetentes.68 Eletrocirurgia69 e remoção cirúrgica constituem outras opções terapêuticas válidas em casos selecionados com lesões que não responderam à terapia convencional farmacológica. Todos os métodos terapêuticos descritos podem ser usados como monoterapia ou como tratamento adjuvante. Em geral, a resposta terapêutica é mais eficaz quando se associam duas modalidades terapêuticas, principalmente quando envolve método cirúrgico associado.
Manejo das reações de hipersensibilidadeAs reações de hipersensibilidade relatadas na literatura foram tratadas, em sua maior parte, com corticoide oral em diferentes doses, dependendo da extensão do quadro e da intensidade dos sintomas. A mais frequente delas, a síndrome de Sweet, apresentou ótima resposta à corticoterapia.43 Alguns autores citam melhora do quadro clínico apenas com o uso correto do tratamento antifúngico. Gutierrez‐Galhardo et al. demonstraram evolução favorável do eritema nodoso associado à esporotricose com o tratamento padrão para a micose (itraconazol 100 mg/dia).42 Da mesma maneira, o uso de anti‐inflamatórios não esteroides também é relatado para tratar reações mais leves.45
PerspectivasPesquisas recentes de dois importantes componentes da parede celular do fungo, glicoproteínas 60 kDa e 70 kDa, mostram que estes funcionam como fator de virulência e têm importante papel na adesão e na imunomodulação do fungo. O anticorpo monoclonal P6E7 IgG1 contra gp70 é potencialmente útil para a terapia da doença porque mostrou uma redução significativa na carga fúngica do hospedeiro, evitando, assim, a adesão de Sporothrix aos componentes da matriz extracelular. Essa forte proteção torna‐o forte candidato para uma vacina terapêutica contra esporotricose.35
Suporte financeiroNenhum.
Contribuição dos autoresRegina Casz Schechtman: Concepção e planejamento; elaboração e redação; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Eduardo Mastrangelo Marinho Falcão: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Marciela Carard: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito
Maria Salome Cajas Garcia: Elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito
Diana Stohmann Mercado: Elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Roderick James Hay: Concepção e planejamento do estudo; Revisão crítica da literatura; elaboração e redação do manuscrito; Revisão crítica do manuscrito; Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Ao Dr. Leonardo Pereira Quintella por, gentilmente, ceder a foto do exame histopatológico.
Como citar este artigo: Schechtman RC, Falcão EMM, Carard M, García MSC, Mercado DS, Hay RJ. Sporotrichosis: hyperendemic by zoonotic transmission, with atypical presentations, hypersensitivity reactions and greater severity. An Bras Dermatol. 2022;97:1–13.
Trabalho realizado no Instituto de Dermatologia Professor Rubem David Azulay, Santa Casa da Misericórdia do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.