A alopecia areata (AA) é uma alopecia autoimune não cicatricial com prevalência geral de cerca de 2%.1 O tratamento da AA moderada a grave é desafiador. Estudos retrospectivos demonstraram que o tofacitinibe pode induzir o crescimento do cabelo em pacientes com AA moderada a grave.2–7 Embora a segurança e a eficácia do tofacitinibe em AA grave tenham sido confirmadas nesses estudos, a durabilidade do tratamento não foi amplamente documentada.
Neste estudo de coorte retrospectivo, aprovado pelo Comitê de Ética institucional do Massachusetts General Brigham, foram exploradas sistematicamente a eficácia, segurança e a durabilidade em longo prazo do tofacitinibe para o tratamento da AA. Os autores também estavam interessados em avaliar o impacto da descontinuação temporária do tofacitinibe no curso da AA durante a pandemia de COVID‐19.
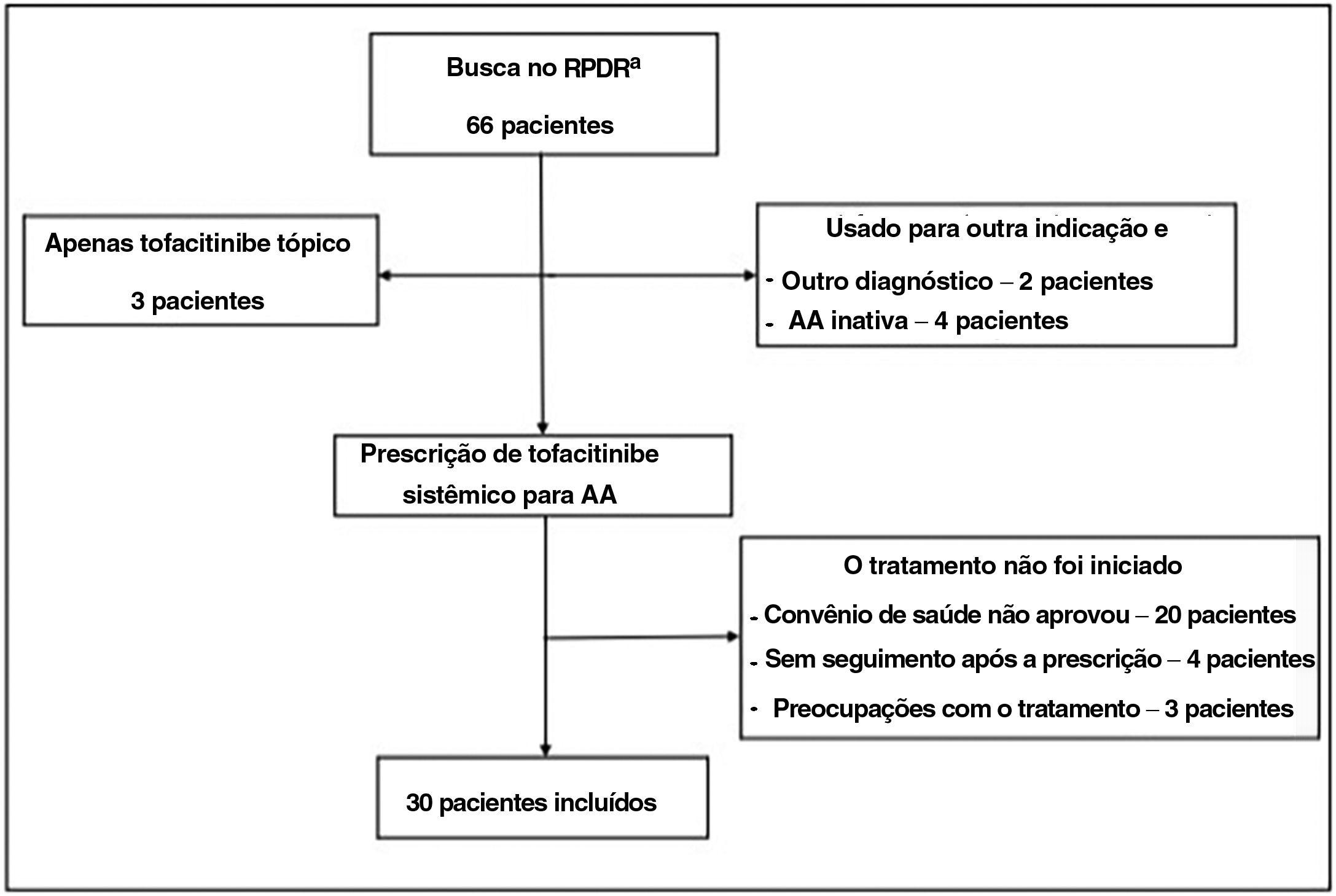
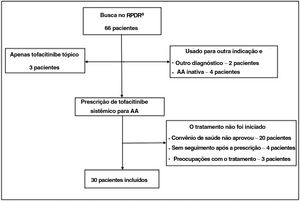
Utilizando registro centralizado de dados clínicos de vários sistemas hospitalares, foram identificados pacientes com AA que receberam tofacitinibe até fevereiro de 2021. Os pacientes elegíveis tiveram diagnóstico de AA e receberam tofacitinibe sistêmico por um período mínimo de três meses (fig. 1).
O diagnóstico de AA foi confirmado pela revisão dos prontuários dos pacientes. Todos os pacientes apresentavam AA há pelo menos seis meses e eram acompanhados por dermatologista. As informações sobre a gravidade ou proporção do envolvimento do couro cabeludo, quando disponíveis, foram coletadas das anotações do dermatologista. A maioria dos pacientes excluídos nunca iniciou tratamento com tofacitinibe (falta de cobertura ou preocupações de segurança). Outros não estiveram em consulta após a prescrição de tofacitinibe, estavam tomando tofacitinibe para outra indicação e não apresentavam AA concomitante.
A resposta ao tratamento foi categorizada como completa (crescimento quase total ou total) e não completa (parcial ou mínima), com base nas anotações dos profissionais. Foram avaliadas as características demográficas e da doença entre respondedores completos e não completos utilizando os testes de Mann‐Whitney e exato de Fisher (SPSS 20.2, IBM, Armonk, NY).
O presente estudo incluiu 30 pacientes com AA; 60% tinham alopecia areata total ou universal e 20%, alopecia areata ofiásica (tabela 1). Em quatro pacientes a AA foi potencialmente desencadeada por agente anti‐TNF, usado para tratar doença inflamatória adicional. Todos os pacientes haviam recebido esteroides tópicos ou intralesionais anteriormente e 21 haviam recebido outras terapias sistêmicas.
Características dos pacientes e da doença que podem afetar a resposta completa
| Todos os pacientes(n = 30) | Respondedores completos(n = 20) | Respondedores não completos(n = 10) | p‐valor | |
|---|---|---|---|---|
| Idadea, anos | 34 (12‐63) | 31 (14‐64) | 54 (17‐64) | 0,25 |
| Sexo feminino | 23 (76,7) | 16 (80,0) | 7 (70,0) | 0,66 |
| Raça/Etnia | ||||
| Caucasiano, não hispânico | 22 (73,3) | 16 (80,0) | 6 (60,0) | 0,02 |
| Afro‐americano, não hispânico | 4 (13,3) | 0 | 4 (40,0) | |
| Asiático, não hispânico | 1 (3,3) | 1 (5,0) | 0 | |
| Hispânico | 3 (10,0) | 3 (15,0) | 0 | |
| IMC, kg/m2a | 23,5 (17,6‐41,1) | 23,0 (17,8‐40,6) | 23,9 (17,6‐41,1) | 0,96 |
| Envolvimento do couro cabeludo(%) | 100 (10‐100) | 90 (10‐100) | 100 (todos) | 0,03 |
| Duração da doençaa, anos | 5,0 (0,5‐45) | 4,5 (0‐28) | 8,5 (2‐45) | 0,14 |
| Duração do episódio atuala, anos | 1,0 (0,5–21) | 1 (0‐7) | 3,5 (1‐21) | < 0,001 |
| Outras doenças autoimunes | 15 (50,0) | 13 (65,0) | 2 (20,0) | 0,05 |
| Doença da tireoide | 6 (20,0) | |||
| DII | 3 (10,0) | |||
| Artrite | 2 (6,7) | |||
| Vitiligo | 2 (6,7) | |||
| Psoríase | 1 (3,3) | |||
| Dermatite atópica | 1 (3,3) | |||
| Dermatose neutrofílica | 1 (3,3) | |||
| Alterações ungueais (n = 24) | 6 (20,0) | 2 (11,1) | 4 (66,7) | 0,02 |
| Terapias sistêmicas anteriores | ||||
| Esteroides sistêmicos | 20 (66,7) | 13 (65,0) | 7 (70,0) | 1,00 |
| Metotrexato | 6 (20,0) | 4 (20,0) | 2 (20,0) | 1,00 |
| Ciclosporina | 2 (6,7) | 2 (10,0) | 0 | 0,54 |
| Duração do tratamento, meses | 18,6 (3,1–68,9) | 28,3 (6,1‐68,9) | 6,2 (3,1‐29,6) | < 0,001 |
Na presente amostra, longa duração do episódio atual de AA, aumento da proporção de envolvimento do couro cabeludo e presença de alterações ungueais e outras doenças autoimunes foram significativamente associados a resposta deficiente. Enquanto todos os pacientes hispânicos foram respondedores completos, todos os pacientes afro‐americanos foram respondedores não completos. Todos os quatro pacientes considerados como tendo AA desencadeada por anti‐TNF‐α tiveram resposta completa ao tofacitinibe após a descontinuação do agente anti‐TNF‐α.
Vinte pacientes obtiveram resposta completa ao tofacitinibe (tabela 2). Quatro tiveram alguns episódios de exacerbação leve a moderada que responderam a injeções intralesionais de esteroides ou a dose aumentada de tofacitinibe (10mg, 2×/dia). Dez pacientes tiveram resposta nula, mínima ou parcial ao tofacitinibe.
Resposta ao tofacitinibe sistêmico
| Duração do tratamento, meses | 18,6 (3,1–68,9) |
| Tratamento com duração superior a 12 meses | 19 (63,3) |
| Tratamento com duração superior a 30 meses | 10 (33,3) |
| Resposta ao tratamento | |
| Completo/quase completo | 20 (66,7) |
| Parcial | 6 (20,0) |
| Mínimo/sem resposta | 4 (13,3) |
| Tempo até a primeira resposta, semanas | 12,0 (4,3–61,0) |
| Repilação total alcançada, semanas | 32,9 (19,6–176,1) |
| Duração da resposta, semanas | 77,9 (5,3–273,3) |
| Necessidade de terapia adicional | |
| Injeção intralesional de esteroides | 7 (23,3) |
| Diminuição gradual da prednisona | 2 (6,7) |
| Aumento da dosagem de tofacitinibe (10mg BID)a | 16 (53,3) |
| Minoxidil oral (2,5mg, 1×/dia) | 1 (3,3) |
A maioria dos pacientes recebeu terapia de longo prazo. Dezenove pacientes completaram um ano de terapia, e dez pacientes foram tratados por mais de dois anos e meio. Os sinais iniciais de crescimento capilar foram observados em 12 (4‐61) semanas.
Sete pacientes descontinuaram o tofacitinibe por duas a quatro semanas. Nenhum apresentou piora significativa e continuou a responder quando o tofacitinibe foi reiniciado. Dois outros pacientes, respondedores iniciais, após a descontinuação do tofacitinibe em decorrência da falta de cobertura pelo convênio, perderam imediatamente todo o cabelo que havia crescido.
A tabela 3 mostra as informações de segurança para a presente coorte. Dois pacientes tiveram infecção grave com necessidade de internação hospitalar, incluindo um paciente hospitalizado por infecção do trato urinário (ITU) e que apresentava doença de Crohn fistulizada e um paciente obeso com COVID‐19 grave. Dois pacientes descontinuaram o tratamento em razão de eventos adversos: erupção cutânea aguda e aumento progressivo das enzimas hepáticas e lipídios. Com exceção de um carcinoma basocelular diagnosticado durante o quinto ano de tofacitinibe, não houve relatos de outras neoplasias. Não houve relatos de trombose ou tuberculose. Quatro pacientes descontinuaram o tofacitinibe por ausência de resposta ou resposta mínima.
Segurança – Eventos adversos (EA) observados durante as consultas dermatológicas
| EA | Número de pacientes | Comentários |
|---|---|---|
| Infecção grave | 2 | Ambos internados no hospital por causa de ITU complicada e pneumonia por COVID‐19, respectivamente |
| COVID | 3a | Apenas um foi hospitalizado e recebeu alta posteriormente. |
| Infecção por HPV | 3 | |
| Herpes zoster | 1 | |
| Tuberculose | 0 | |
| Aumento de lipídios | 11b | Um descontinuou a terapiac |
| TFH aumentadas | 2 | Um descontinuou a terapiac |
| Erupção acneiforme | 3 | Leve |
| Erupção maculopapular | 1 | Descontinuou |
| TVP ‐ Trombose | 0 | |
| Nova neoplasia maligna | 1 | Um CBC |
O presente estudo retrospectivo demonstrou que o tofacitinibe é opção de tratamento eficaz para AA. A terapia contínua de longo prazo produz resposta estável e durável. Mesmo para os pacientes que suspenderam temporariamente a terapia, a resposta foi mantida ou restaurada.
Uma análise retrospectiva de 90 pacientes demonstrou que, entre 65 pacientes com duração do episódio atual de 10 anos ou menos, 20% foram respondedores completos (> 90% de alteração no escore SALT).6 Em outros estudos, resposta maior que 50% de alteração no escore SALT foi demonstrada em 32% a 56% dos pacientes,2,3,7,8 e 90% de alteração em 28% dos pacientes.7 A proporção de respondedores completos no presente estudo foi muito maior (67%), possivelmente relacionada ao tempo de seguimento muito maior. Alguns dos pacientes do presente estudo atingiram o crescimento completo somente após dois anos de terapia.
Entre os fatores que podem afetar a resposta ao tratamento incluem‐se aumento da proporção de envolvimento do couro cabeludo, maior duração do episódio atual, presença de alterações ungueais ou outras doenças autoimunes que foram significativamente associados a uma resposta não completa na presente amostra. Houve também associação significativa entre etnia e resposta, com todos os pacientes afro‐americanos entre os respondedores não completos e todos os pacientes hispânicos entre os completos. Em outros estudos, o subtipo de AA, a duração do episódio atual e da doença e a idade ao primeiro episódio foram associados à eficácia. O envolvimento ungueal e a presença de outras doenças autoimunes não foram avaliados nesses estudos.2,7 A etnia não havia sido avaliada em estudos anteriores.
Entre os pacientes que descontinuaram temporariamente o tofacitinibe, todos tiveram queda de cabelo mínima ou transitória. Três pacientes descontinuaram a terapia por algumas semanas devido à COVID‐19. Nenhum teve perda de cabelo significativa. Por outro lado, dois pacientes perderam todo o cabelo regenerado, após a interrupção do tratamento por falta de cobertura do convênio. Em um estudo prospectivo, cerca de 1/3 dos pacientes estava disponível aos três meses de seguimento após a descontinuação do tofacitinibe e perda de cabelos estava presente em todos eles após mediana de dois meses.2
Os dados de segurança nesta coorte foram promissores. Estudos retrospectivos recentes analisando a segurança do tofacitinibe para outras indicações apoiam um perfil de segurança positivo do tofacitinibe em longo prazo.9,10 Esses estudos retrospectivos, juntamente com os dados de segurança positivos do presente estudo, fornecem perspectiva de segurança melhor em relação ao tratamento em longo prazo da AA com tofacitinibe na prática clínica.
As limitações do presente estudo incluem viés de seleção, tempos de seguimento variáveis, falta de controles e pequeno tamanho da amostra.
O tofacitinibe oral pode ser tratamento eficaz em longo prazo para AA em pacientes cuidadosamente selecionados.
Suporte financeiroNenhum.
Contribuição dos autoresXinaida Taligare V. Lima: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Melissa Bambery: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Maria Beatrice Alora: Aprovação da versão final do manuscrito; revisão crítica da literatura; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Conflito de interessesXinaida Taligare V. Lima atua como palestrantes da Abbvie.
Melissa Bambery não possui conflito de interesses relevante.
Maria Beatrice Alora foi investigadora da Abbvie, Janssen, Celgene, Eli Lilly, Pfizer, Inc., Novartis, e Concert Pharmaceuticals.
Como citar este artigo: Lima XTV, Bambery M, Alora MB. A retrospective study of oral tofacitinib therapy for alopecia areata. An Bras Dermatol. 2023;98:222–5.
Trabalho realizado utilizando os sistemas de registros do Massachusetts General Brigham Hospital, Boston, Massachusetts, Estados Unidos.