O granuloma anular pode ser desencadeado por vários fatores. Entre eles estão as vacinações, que têm sido descritas como uma causa infrequente de granuloma anular. Relatamos o primeiro caso de granuloma anular generalizado em uma mulher de 57 anos, que apresentou as lesões cutâneas 12 dias após a vacinação pneumocócica.
A ocorrência de granuloma anular (GA) desencadeada por vacinação é rara, e o mecanismo pelo qual ele é desencadeado pode ser explicado pelo trauma da inoculação ou pelo mecanismo imunológico envolvido na vacinação.1–3
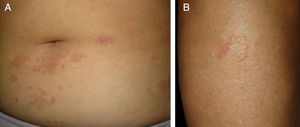
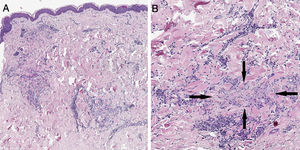
Relato do casoUma mulher de 57 anos de idade com história médica de hipotireoidismo, hipercolesterolemia e hipertensão arterial apresentou história de lesões cutâneas assintomáticas no abdômen e membros inferiores por três meses. O exame físico revelou múltiplas pápulas violáceas‐eritematosas firmes, agrupadas em um padrão anular e distribuídas ao longo do abdômen e das extremidades inferiores (fig. 1). A vacina pneumocócica conjugada 13‐valente (VPC13) foi identificada como possível fator desencadeador, uma vez que havia sido administrada 12 dias antes do início das lesões cutâneas. Foi realizada biópsia de pele da lesão abdominal. O exame histopatológico revelou focos de inflamação crônica intersticial e necrobiose de colágeno com um infiltrado linfo‐histiocitário associado (fig. 2).
A paciente foi diagnosticada com GA generalizado após vacinação pneumocócica com base na aparência clínica das lesões, nos achados histopatológicos e na relação temporal entre a vacinação e as lesões cutâneas. O tratamento com creme de furoato de mometasona foi iniciado; entretanto, não houve melhora aparente após um mês de uso do medicamento. As lesões finalmente se resolveram espontaneamente dois meses após seu aparecimento inicial.
DiscussãoApenas 13 casos de GA após vacinação foram relatados na literatura. As vacinas relatadas como causadoras de GA foram a do bacilo Calmette‐Guérin (BCG) (oito casos), seguida pela vacina contra o vírus da hepatite B (VHB) (dois casos) e pelas vacinas contra influenza, tétano e difteria‐tétano (um caso cada).1–10 Uma associação entre a vacina pneumocócica e GA não havia sido descrita anteriormente (tabela 1).
Casos de granuloma anular desencadeados por vacinação
| Autores | Ano | Vacina | Dose | Sexo | Idade | Localizado/generalizado | Tempo de latência | Tratamento | Resolução | Recorrência na revacinação |
|---|---|---|---|---|---|---|---|---|---|---|
| Houcke‐Bruge C et al. | 2001 | BCG | 1 dose | Masculino | 3 anos | Generalizado | 1 mês | Não | Completa,3 meses | |
| BCG | 1 dose | Feminino | 2 anos | Local distante do local de vacinação | 2 meses | Não | Completa,3 meses | |||
| Kakurai M et al. | 2001 | BCG | 1 dose | Masculino | 12 anos | Generalizado | 5 dias | Não | Completa,7 meses | |
| Nagase K et al. | 2011 | BCG | 1 dose | Masculino | 5 meses | Generalizado | 1 mês | Creme hidratante,3 meses | Completa,3 meses | |
| Lee SW et al. | 2011 | BCG | 1 dose | Feminino | 3 meses | Generalizado | 1 mês | Corticosteroides tópicos,1 mês | Completa,1 mês | |
| Nomiyama T et al. | 2013 | BCG | 1 dose | Feminino | 6 meses | Generalizado | 1 mês | Corticosteroides tópicos, 1 mês | Completa,1 mês | |
| Yoon NY et al. | 2014 | BCG | 1 dose | Masculino | 3 meses | Generalizado | 7 semanas | Ceftriaxona por 8 dias e hidroxizina profilática por 3 semanas | Completa,3 semanas | |
| Yang SY et al. | 2018 | BCG | 1 dose | Masculino | 3 meses | Localizado | 2 meses | Não | Completa,18 meses | |
| Wolf F et al. | 1998 | Vírus da hepatite B | 4 doses(0 meses,1 mês,2 meses,12 meses) | Feminino | 51 anos | Generalizado | 1 mês após a última vacina | Dapsona 50 mg/dia4 meses | Completa,4 meses(recorrência subsequente) | Revacinação em 5 anos (tempo de latência de 3 semanas) |
| Criado PR et al. | 2004 | Vírus da hepatite B | 2 doses(0 meses,1 mês) | Feminino | 58 anos | Generalizado | 2 meses após a última vacina | Corticosteroides tópicos | Melhoria parcial, 3 meses | |
| Baykal C et al. | 2002 | Tétano | 1 dose | Feminino | 6 anos | Generalizado | 2 meses | Acetonido de triancinolona 10 mg/mL a cada 4 semanas, intralesional (3 sessões) | Completa,3 meses(recorrência subsequente) | Revacinação (tempo de latência de 3 dias) |
| Baskan EB et al. | 2005 | Difteria e toxoide tetânico | 1 dose | Feminino | 8 anos | Generalizado | 1 semana | Corticosteroides tópicos | Sem melhora | |
| Suzuki T et al. | 2014 | Influenza | 1 dose | Feminino | 76 anos | Localizado | 1 mês | Não | Sem seguimento |
Vacina BCG, vacina Bacilo Calmette‐Guérin; VPC13, vacina pneumocócica conjugada 13‐valente.
A ocorrência de GA desencadeado por vacinação foi relatada como mais elevada em mulheres (61,54%, oito casos) do que em homens (38,46%, cinco casos). A forma clínica mais frequentemente descrita de GA desencadeado por vacinação foi a generalizada (76,92%, 10 casos), enquanto a forma localizada ocorreu em apenas três casos (23,08%). As idades dos pacientes afetados variaram de 3 meses a 76 anos (média, 16,74 anos; mediana, 3 anos). A latência entre a vacinação e o aparecimento de GA variou de 5 dias a 2 meses (média, 1,22 meses; mediana, 1 mês).
O GA apresentou resolução completa na maioria dos casos relatados (10 casos).1,2,4–7 Entretanto, uma melhora parcial foi observada em um caso, enquanto nenhuma melhora foi observada em outro caso.3,8 Em geral, o tempo médio de resolução foi de 4,37 meses nos casos completamente resolvidos (mediana, 3 meses). O GA apresentou recorrência após a revacinação com as vacinas de HBV e tétano em dois casos, com uma latência de três semanas em ambos os casos.7,10 A latência até a recorrência foi, portanto, mais curta nos casos com revacinações.
O mecanismo desencadeador do GA é desconhecido. A ativação imunológica após a vacinação explicaria a presença de células‐T ativadas no infiltrado linfocítico do GA, sugerindo a existência de uma resposta imune mediada.
O GA desencadeado pela vacinação pode ter uma patogênese imunológica, porque o GA generalizado foi observado na maioria dos casos. A hipótese de inoculação traumática é menos convincente, porque o GA localizado exclusivamente no local da vacinação foi observado em poucos casos.6,9
A curta latência entre a vacinação e o aparecimento do GA, relatado como sendo de cerca de um mês na maioria dos casos, apoia a relação causal entre a vacinação e o GA. A recorrência após revacinações e a latência mais curta concomitante apoiam ainda mais esse argumento. Após a cessação da estimulação imunológica, o GA apresentou resolução completa na maioria dos casos, incluindo este aqui relatado.1,2,4–7,10 É interessante o fato de que a maioria dos casos ocorreu em pacientes jovens, provavelmente porque a frequência de vacinação é maior nesses indivíduos. Entretanto, também foram observados casos em pacientes mais velhos.
Em conclusão, a maioria dos casos relatados de GA pós‐vacinação é da forma generalizada, o que indica uma possível patogênese imunológica. Resolução completa ocorreu em alguns meses após a vacinação na maioria dos casos, e houve recorrência na revacinação.
Suporte financeiroNenhum.
Contribuição dos autoresMiguel Fernando García‐Gil: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Marcial Álvarez‐Salafranca: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Alejandro Martínez García: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Mariano Ara‐Martín: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: García‐Gil MF, Álvarez‐Salafranca M, Martínez García A, Ara‐Martín M. Generalized granuloma annulare after pneumococcal vaccination. An Bras Dermatol. 2021;96:59–63.
Trabalho realizado no Hospital Clínico Universitario Lozano Blesa, Zaragoza, Espanha.