O Brasil vive atualmente um momento preocupante com a reemergência e expansão da febre amarela silvestre. O Ministério da Saúde, entre julho/2017 a fevereiro/2018, notificou 1.286 casos humanos da doença, com 353 confirmados e 98 óbitos, em que a Região Sudeste foi a mais afetada.1
A importância epidemiológica da doença advém de seu elevado potencial de disseminação, do risco de reurbanização e de sua gravidade clínica, com taxa de letalidade que pode chegar a até 50% entre os casos graves.1
Considerando a impossibilidade de eliminação dos mosquitos vetores e da ausência de tratamento medicamentoso para a doença, a estratégia mais eficaz para o combate à febre amarela está baseada na vacinação de bloqueio da população nas áreas de risco. Em 2016, fracionamento das doses e vacinação em grande escala foram usados na República Democrática do Congo e interromperam a epidemia.
A vacina, apesar de se tratar de um vírus vivo atenuado, é considerada eficaz e segura; porém, eventos adversos graves e até fatais têm sido notificados.2 Entre as contraindicações da vacina, estão os portadores de doenças autoimunes e de doenças imunodepressoras ou que usam terapias imunossupressoras/imunomoduladoras.3
A psoríase é uma doença inflamatória, de base genética e com participação da imunidade inata (autoinflamatória) e adquirida (autoimune). Tem prevalência de 1%–2% na população mundial e muitos pacientes fazem uso de drogas potencialmente imunossupressoras como metotrexato, ciclosporina e agentes biológicos (anti‐TNF, anti‐Th17, anti‐IL17). De acordo com esses fatores, a indicação da imunização e o risco de efeitos adversos graves devem ser avaliados e comparados com o risco de contrair a doença naqueles pacientes que vivem em áreas onde a vacinação está indicada.
Considerando que muitas vacinas podem desencadear ou piorar doenças autoimunes, qual seria o impacto da vacina da febre amarela na evolução clínica da psoríase?
Relatamos aqui um estudo retrospectivo observacional transversal feito por meio da revisão de prontuários de 63 pacientes com psoríase que receberam a vacina contra a febre amarela de maneira inadvertida e independente de indicação médica em 2017, nos estados do Rio de Janeiro, São Paulo, Espírito Santo, Minas Gerais e Bahia.
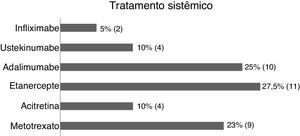
Na amostra (63 pacientes), 52,3% eram mulheres; 84,1% procedentes do estado do Rio de Janeiro; e a idade média foi de 46,4 anos (DP±17,42) (tabela 1). Estavam sem tratamento da psoríase 1,5%; 34,9% em tópico exclusivo; e 63,4%, sistêmico (metotrexato 22,5%; acitretina 10%; etanercepte 27,5%; adalimumabe 25%; ustekinumabe 10% e infliximabe 5% (fig. 1).
Descrição epidemiológica da amostra (n=63)
| No de pacientes (%) | |
|---|---|
| Sexo | |
| Feminino | 33 (52,3%) |
| Masculino | 30 (47,6%) |
| Idade | |
| ≤ 15 anos | 6 (9,5%) |
| 16–30 anos | 4 (6,3%) |
| 31–60 anos | 41 (65%) |
| > 60 anos | 12 (19%) |
| Procedência | |
| Rio de Janeiro | 53 (84,%) |
| Espírito Santo | 4 (6,3%) |
| Minas Gerais | 4 (,5%) |
| São Paulo | 1 (1,5%) |
| Bahia | 1 (1,5%) |
Receberam a primeira dose 92% dos casos e 96,8% (61 pacientes) não apresentaram efeitos adversos. Dois pacientes referiram reação pós‐vacinal: cefaleia (usando acitretina) e vasculite (usando tópico). Não houve alteração no curso clínico da psoríase pós‐vacinação em 93,6% dos pacientes; 4,7% relataram melhoria (etanercepte, adalimumabe e tópico) e 1,5% relataram pioria das lesões (acitretina) (fig. 2).
Na literatura, encontramos artigos que correlacionam doenças reumáticas e a vacina da febre amarela, porém até o momento não há estudos que avaliem o impacto em doentes com psoríase até o momento.
Em 2009, Mota et al. avaliaram 70 pacientes com doenças reumatológicas em uso de imunossupressores vacinados inadvertidamente e não encontraram eventos adversos importantes, embora a vacina estivesse contraindicada devido ao risco aumentado de doença viscerotrópica aguda nesse grupo de pacientes.4 Idades acima dos anos, antecedentes de timectomia e de doenças autoimunes são alguns dos outros fatores implicados na etiologia desse evento adverso3 e acredita‐se que ocorra por disfunção da sinalização entre o sistema inato e adaptativo.2
A potencial associação da vacinação na indução ou exacerbação de doenças autoimunes tem sido questionada, embora se saiba que, apesar de raramente, reações autoimunes às vacinas podem ocorrer em indivíduos predispostos, provavelmente por mimetismo molecular.5
A fisiopatologia da psoríase envolve ativação de células dendríticas, neutrófilos e células T, principalmente CD8+, com consequente produção de IL‐8, TNF‐α e IL‐17. Os tratamentos da psoríase baseiam‐se na imunossupressão/imunomodulação (metotrexato, anti‐TNF‐α e anti‐IL‐17) e procuram reduzir ou anular a produção dessas citocinas. Entretanto, essas mesmas citocinas também estão envolvidas na proteção do indivíduo contra germes intracelulares, como vírus e microbactérias. Assim, essa imunossupressão poderia desencadear infecção vacinal por não ser capaz de promover resposta adequada ao vírus atenuado.
Os eventos adversos em nossa amostra foram leves e raros, sem registro de manifestação grave, hospitalização ou morte nos pacientes com psoríase, nem alteração no curso clínico da psoríase pós‐vacinação, independentemente do tratamento (com ou sem drogas imunossupressoras).
Obviamente, o tamanho da amostra é uma das limitantes do trabalho no conhecimento mais definitivo da prevalência de efeitos adversos e do comportamento da doença após a vacinação para estabelecer condutas ou protocolos para orientação de profissionais da saúde e pacientes, mas trata‐se de registro oportuno e que tem sido ampliado a cada mês pelos autores.
Suporte financeiroNenhum.
Contribuição dos autoresMayara Hamilko de Barros: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
João Carlos Regazzi Avelleira: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Kleiser Aparecida Pereira Mendes: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura.
Conflitos de interesseNenhum.
Como citar este artigo: Hamilko de Barros M, Avelleira JCR, Mendes KAP. Impact of yellow fever vaccine on patients with psoriasis: preliminary results. An Bras Dermatol. 2019;94:757–9.
Trabalho realizado no Instituto de Dermatologia Professor Rubem David Azulay, Santa Casa da Misericórdia do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.