A incidência de infecções por micobactérias não tuberculosas aumenta mundialmente e, até 2017, mais de 190 espécies e subespécies já foram documentadas. O reconhecimento desses agentes etiológicos em doenças que acometem indivíduos imunocompetentes e nas infecções associadas à cuidados médicos, como após procedimentos cirúrgicos e cosméticos, apesar de classicamente associadas à imunossupressão, torna relevante o estudo da epidemiologia e da patogênese desses microrganismos na prática médica. O Mycobacterium lentiflavum é um germe de crescimento lento e raramente acomete a pele. Relata‐se um caso de micobacteriose cutânea por M. lentiflavum em paciente imunocompetente, após injeção subcutânea de composto lipolítico, tratada com claritromicina e levofloxacina.
As micobacterioses atípicas são causadas por espécies heterogêneas de micobactérias e podem ser classificadas por meio de vários critérios, tais como: em micobactérias não tuberculosas de crescimento lento e micobactérias de crescimento rápido, pela produção de pigmento, pela morfologia da colônia e por outros testes bioquímicos.1,2 Além das micobactérias não tuberculosas (MNT), os patógenos obrigatórios do complexo Mycobacterium tuberculosis e o Mycobacterium leprae também integram o gênero Mycobacterium, causando tuberculose e hanseníase, respectivamente.1,2 Com a aplicação de técnicas de biologia molecular, entre elas a cromatografia líquida de alta eficiência (CLAE) de ácidos micólicos, a reação em cadeia da polimerase (PCR), com enzima de restrição, e o sequenciamento genético, novas espécies de MNT têm sido descritas, ampliando o entendimento de sua ecologia, microbiologia e significância na prática médica.3 No cenário clínico, o reconhecimento da espécie é relevante devido à resistência intrínseca das MNT aos esquemas antituberculosos atuais.2
As MNT são geralmente saprófitas de vida livre e já foram isoladas na água, no solo e em objetos, inclusive utensílios e equipamentos de uso médico.4,5 Já foram relatadas infecções por MNT que complicaram procedimentos como cirurgia cardíaca e oftalmológica, lipoescultura/lipoaspiração, mamoplastia, tatuagem, aplicação de toxina botulínica e laser de CO2 fracionado, preenchimento cutâneo, mesoterapia, biópsia de pele, cirurgia de Mohs, pedicure, acupuntura, implante de piercing e escleroterapia de varizes.4–6
Nesse contexto, as espécies de crescimento rápido são as mais frequentemente isoladas, como as do complexo M. fortuitum, M. abscessus e M. chelonae.4,5 Ao contrário das MNT de crescimento rápido, o M. lentiflavum é uma bactéria de crescimento lento, que foi associada a quadros de linfadenite superficial em crianças e a infecções pulmonares, principalmente em imunossuprimidos.7–9 Porém, a micobacteriose cutânea por M. lentiflavum é rara e foi relatada pela primeira vez em paciente infectado pelo vírus da imunodeficiência humana e com contagem de linfócitos T CD4+ de 46mm3, por Montejo et al., em 2006.10
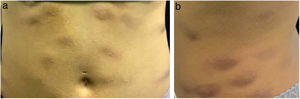
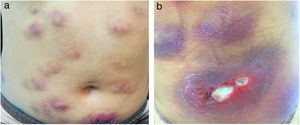
É relatado o caso de uma mulher de 28 anos, hígida, submetida a aplicações subcutâneas de substância composta por óleo de girassol 5%, desoxicolato 6%, sinetrol 5% e cafeína 50mg no abdome e flancos, por profissional não médico, com intervalos semanais entre as sessões. Após a quarta aplicação, apresentou dor, eritema e calor no local das infiltrações (fig. 1 A e B) com piora progressiva da dor, edema e supuração (fig. 2 A e B).
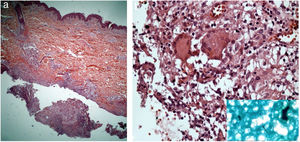
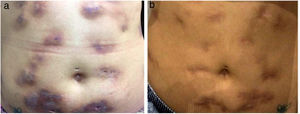
A pesquisa direta e cultura para fungos e bactérias da secreção de lesão no abdome, além de sorologia para HIV, foram negativas. A pesquisa de bacilos álcool‐ácido resistentes (BAAR) foi positiva em duas amostras diferentes. A PCR para M. tuberculosis foi negativa e a radiografia de tórax não mostrou anormalidades. Optou‐se, então, por tratamento empírico para micobacteriose atípica com claritromicina 500mg duas vezes ao dia, associada à levofloxacino 500mg uma vez ao dia, além de desbridamento das lesões. A histopatologia evidenciou inflamação crônica granulomatosa e supurativa, com abscessos em organização, ausência de vasculite e pesquisa negativa para microrganismos específicos (fig. 3 A e B). O polimorfismo de comprimento de fragmentos (RLFP), com enzima de restrição, foi compatível com Mycobacterium lentiflavum. Após dois meses de tratamento, houve melhora parcial do quadro (fig. 4 A), sendo observada remissão completa com cicatrizes atróficas ao final de 8 meses de tratamento (fig. 4 B).
(A) Infiltrado linfo‐histiocitário e granulomatoso superficial e profundo, com focos de supuração e abscessos em organização (Hematoxilina & eosina, 200×). (B) Presença de células gigantes mutinucleadas (Hematoxilina & eosina, 400×). No detalhe, nota‐se bacilo álcool‐ácido resistente na secreção purulenta.
Nenhum.
Contribuição dos autoresRenan Bernardes de Mello: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Dalton Nogueira Moreira: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Ana Carolina Gomes Pereira: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Nicole Ramalho Lustosa: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Mello RB, Moreira DN, Pereira ACG, Lustosa NR. Cutaneous infection by Mycobacterium lentiflavum after subcutaneous injection of lipolytic formula. An Bras Dermatol. 2020;95:511–3.
Trabalho realizado no Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.