O nevo melanocítico congênito (NMC) caracteriza‐se por lesões pigmentadas presentes ao nascimento. A forma gigante (NMCG) apresenta extensão mínima de 20 cm na vida adulta e é rara, presente em 1:20.000 nascimentos. Além de ser uma condição inestética, o NMCG apresenta riscos de morbidades extracutâneas, como as complicações neurológicas. Um exemplo é a proliferação benigna ou maligna de células névicas no sistema nervoso central (SNC), condição chamada de melanose neurocutânea (MNC).1
Relatamos um caso de uma paciente de sexo feminino, acompanhada desde os 2 anos com o diagnóstico de NMCG em “vestimenta”. Sem sintomas neurológicos ou alterações no desenvolvimento psicomotor, porém o exame de RNM de crânio apresentou sinal hiperintenso em T1 na região parietal esquerda, correspondente à MNC.
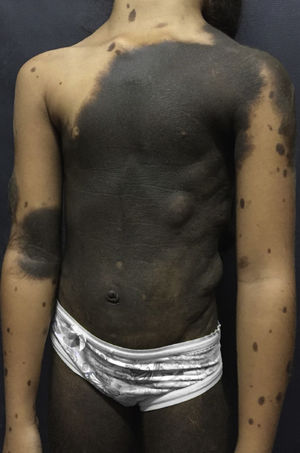
Ao exame dermatológico, placa marrom‐enegrecida com hipertricose, estendendo‐se da região cervical até os joelhos, em “vestimenta”, com múltiplas lesões satélites em face e extremidades (fig. 1). A paciente apresentava no dorso nódulos correspondentes a schawannoma. Aos 10 anos, após perda de seguimento clínico por 3 anos, iniciou quadro súbito de convulsões, paresia em hemicorpo direito, cefaleia e vômitos.
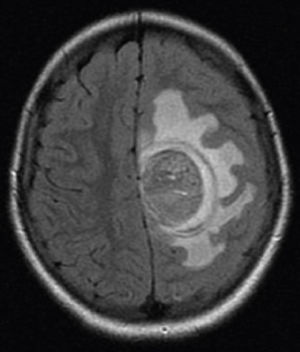
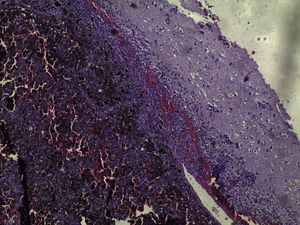
Exame de RNM de crânio demonstrou a presença de lesão única expansiva sólida que media 5×3,5 cm em região frontoparietal esquerda, associado a intenso edema, promovia desvio da linha média (fig. 2). Na análise histopatológica, observa‐se uma neoplasia formada pela proliferação de células atípicas, continha pigmento castanho granular e com núcleos centrais aumentados de volume, hipercromáticos, com nucléolos evidentes, frequentes figuras de mitose, infiltrava preferencialmente a meninge, mas também o parênquima encefálico adjacente, em meio a áreas de necrose e de hemorragia (fig. 3).
O exame de imuno‐histoquímica apresentou forte reatividade para anticorpos S100, HBM45 e Melan A. Exames adicionais de imagem não demonstraram metástase. O diagnóstico final foi de melanoma primário de leptomeninge. A paciente evoluiu a óbito após quatro meses por quadro de hemorragia intracraniana seguida de parada cardiorrespiratória.
O melanoma (MM) primário do SNC é uma doença rara. Representa 1% dos MM e aproximadamente 0,05% das malignidades primárias dos tumores cranianos. Esses podem ser divididos em padrão nodular intraparenquimal e leptomenígeo.2 O MM primário da leptomeninge é extremamente raro, com um caso a cada 20 milhões de indivíduos, demonstra geralmente uma progressão agressiva e resistência à quimioterapia e radioterapia.1,2
O risco de MM cutâneo e extracutâneo estimado ao longo da vida para os indivíduos com múltiplos NMC é em torno de 5%. Esse risco é aumentado para 12% em pacientes com MNC. Essa é caracterizada pela migração e a proliferação errônea de células névicas no SNC a partir de melanoblastos da crista neural em pacientes com NMC.2,3
A MNC implica diversas comorbidades adicionais para esses pacientes que incluem hidrocefalia, convulsões, paralisia de nervos cranianos, distúrbios neuropsiquiátricos e o risco de degeneração maligna das células. A taxa de mortalidade é próxima de 100% para os casos de MM do SNC e 70% dos pacientes com MNC evoluem a óbito antes dos 10 anos.1,3
Os nevos congênitos apresentam um comportamento biológico diferente devido à presença de mutações somáticas em 81% dos casos no gene NRAS dos melanócitos, em detrimento das mutações BRAF, evidenciando que eles são diferentes geneticamente dos nevos desenvolvidos após o nascimento e disparam como um fator de risco para melanoma primário do SNC e cutâneo.4
Tumores com mutações NRAS tendem a um comportamento mais agressivo mesmo em estágios iniciais da doença. Em vista desse microambiente genético diferenciado, terapias alvos têm sido investigadas para melanoma do SNC em pacientes com NMC e a mutação comprovada do protoncogene NRAS. Estudos iniciais demostraram resultados dos inibidores de MEK, o Trametinib, nos controle de sintomas e melhoria da qualidade de vida, um importante passo na descoberta de novos tratamentos para essa condição.3,5
O risco de MNC e consequente malignização do quadro é aumentado na presença de múltiplas lesões névicas satélites, NMCG extenso e a localização paravertebral.1,3
O melanoma do SNC emerge atualmente como o principal fator prognóstico em crianças com NMCG. Nesse cenário, o risco de melanoma cutâneo desempenha um papel menos decisivo dentro das possibilidades terapêuticas de cirurgias excisionais profiláticas. Ganha foco nesse cenário as alterações na RNM, exame que deve ser feito preferencialmente no primeiro ano de vida, pois a incidência de MM de SNC e cutâneo no grupo com o exame alterado é de 12%, em oposição à incidência de MM de 1% no grupo com RNM de SNC normal ao nascer. O seguimento clínico dos pacientes com exames de RNM alterados deve ser anual.3
Suporte financeiroNenhum.
Contribuição dos autoresAdriana Kamilly Leitão Pitman Machado: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Débora Bacellar Cruz Nunes: Elaboração e redação do manuscrito.
Francisca Regina Oliveira Carneiro: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Alena Margareth Darwich Mendes: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Conflitos de interesseNenhum.
Ao serviço de Dermatologia/UEPA.
Como citar este artigo: Machado AKLP, Nunes DBC, Carneiro FRO, Mendes AMD. Primary melanoma of leptomeninge in a patient with giant congenital melanocytic nevus. An Bras Dermatol. 2020;95:404–6.
Trabalho realizado no Serviço de Dermatologia, Universidade do Estado do Pará, Belém, PA, Brasil.