Pouco se sabe sobre a ultraestrutura da Piedraia hortae.
ObjetivoExaminar colônia de P. hortae com microscopia eletrônica de varredura e investigar possíveis contribuições à sua patogenia.
ResultadosEm pequeno aumento, identificam‐se dois aspectos distintos na colônia: uma área compactada e outra área filamentosa. O exame da área filamentosa demonstra hifas aderidas por fina substância reticular. Um achado recorrente é a aderência entre os filamentos fúngicos dispostos em paralelo. Em grande aumento, o aspecto microfibrilar aderindo às hifas entre si fica bem evidente. O exame da área compactada mostra hifas embebidas na matriz reticular formando um biofilme; a colônia fica bem aderida. Com grande aumento, pode‐se observar que as hifas ficam dentro dessa matriz fibrilar, que tem o mesmo aspecto da substância filamentosa que adere as hifas entre si.
Limitações do estudoApenas uma cepa foi examinada.
ConclusõesA formação de biofilme contendo estruturas fúngicas e substância extracelular reticulada é importante na patogênese de Piedra nigra.
Piedra nigra é afecção bem conhecida;1 junto com piedra alba, forma o grupo de duas afecções semelhantes, também denominadas tricomicoses2 ou ectotricomicoses,3 nas quais se formam nódulos nas hastes pilares, escuros e claros, respectivamente, sem envolvimento epidérmico.
A piedra alba é afecção consequente da colonização de algumas espécies do gênero Trichosporon, como Trichosporon cutaneum, Trichosporon ovoides e Trichosporon inkin. Ela ocorre nos pelos da barba, axila e púbis (os cabelos são menos acometidos), variando de branco a castanho‐claro. O gênero Trichosporon engloba fungos filamentosos que podem formar biofilmes complexos.
Historicamente, piedra nigra foi descrita por Paulo Horta,4 o qual discutiu na publicação original a piedra nostras da Europa e a piedra colombica da América do Sul, ambas causadas por fungos não pigmentados, também chamadas de tricomicose nodular ou tricosporia, pois já se cunhara o gênero Trichosporum (na grafia da época).
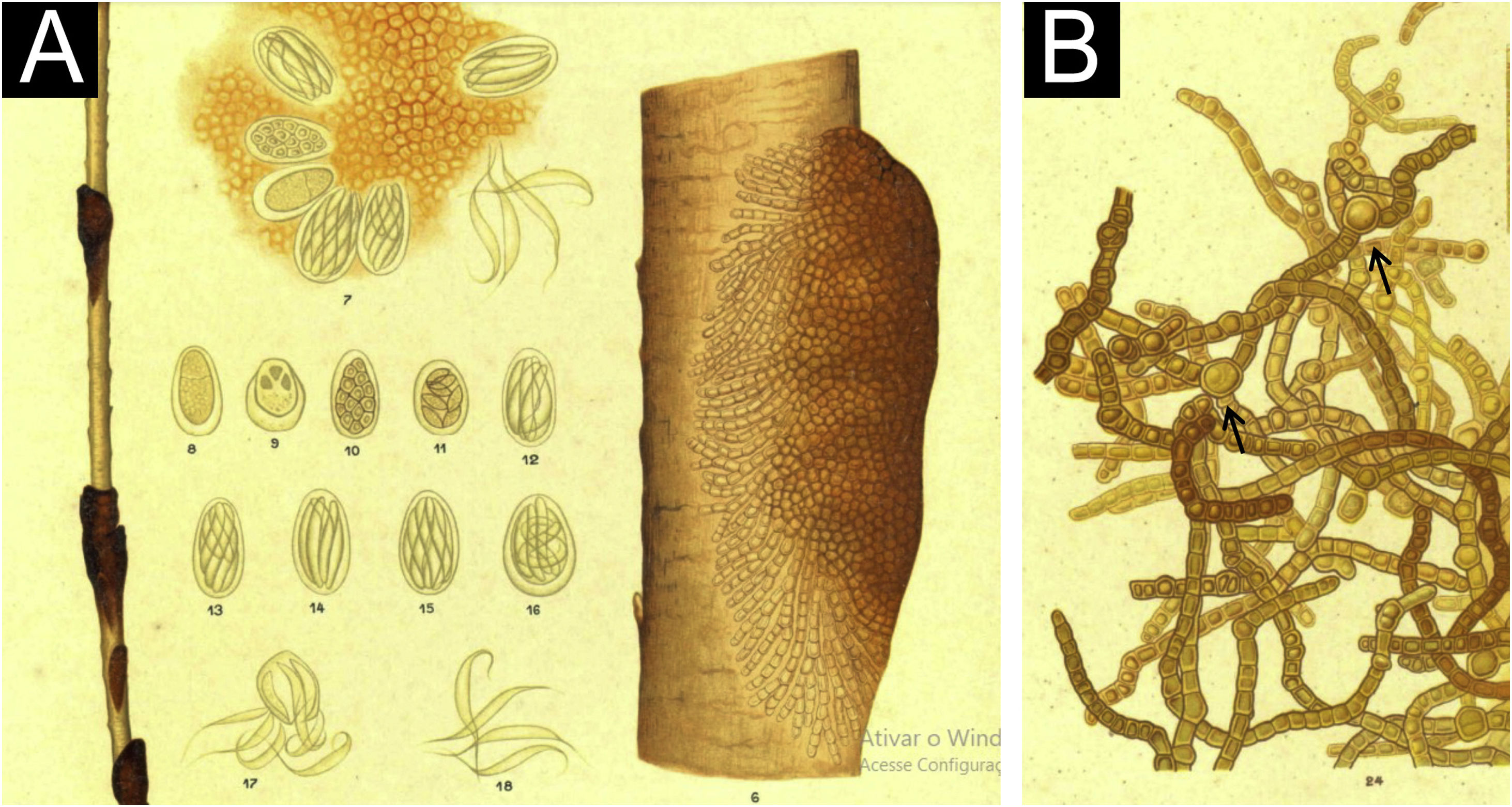
Nessa publicação, Horta descreveu os casos de dois estudantes do sexo masculino,4 jovens, oriundos da Bahia, cujo aspecto clínico era diferente; os nódulos eram escuros (fig. 1A), e as colônias fúngicas eram obtidas a partir desses nódulos. Morfologicamente, o exame do agente mostrava também diferenças, sem as formações de estruturas cocoides leveduriformes descritas com o agente da piedra alba. Além de pigmento, as hifas mostravam dilatações (fig. 1B), clamidósporos, bem como ascósporos (observados dentro de uma estrutura sacular) em vários estágios evolutivos (fig. 1A).
A piedra nigra é endêmica na América do Sul.5‐7 Algumas populações indígenas chegam a ter prevalência de 50%; também há casos descritos na Ásia.8,9Piedra nigra afeta comumente o couro cabeludo.
Examinamos com microscopia eletrônica de varredura (MEV), com microscópio Jeol, JSM ‐ 6610LV no Centro de Microscopia da Região Sul (CEME‐SUL), da Universidade Federal do Rio Grande, uma colônia de Piedraia hortae obtida da micoteca do Instituto de Medicina Tropical de São Paulo, linhagem 499, com objetivo de descrever sua ultraestrutura.
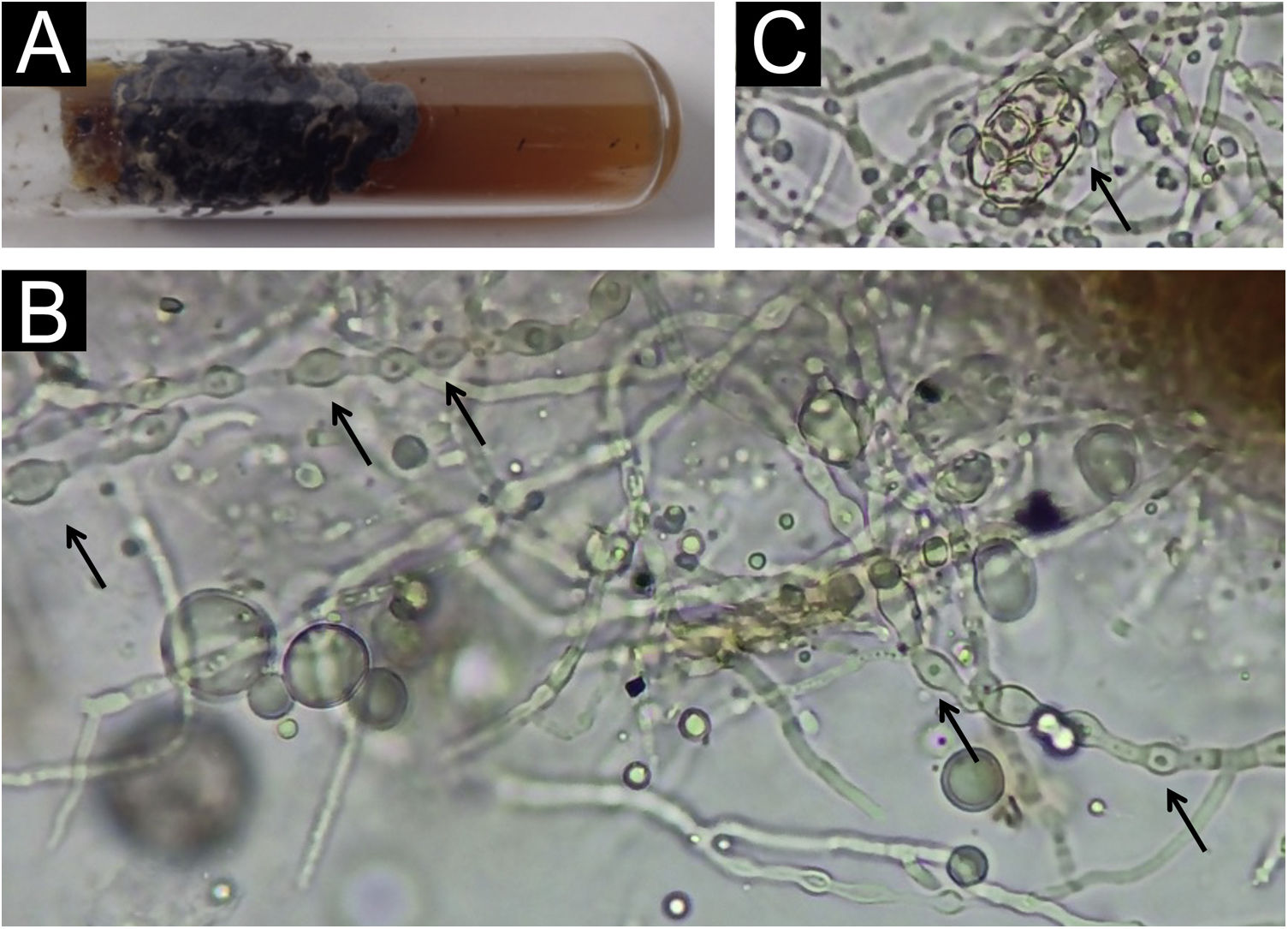
ResultadosA colônia tem o típico aspecto enegrecido (fig. 2A). O exame de microcultura com microscopia óptica evidenciou as hifas com as típicas dilatações (fig. 2B). Ascósporos (fig. 2C) também foram visualizados na microscopia óptica, estrutura semelhante ao desenho 10da figura 1A.
No exame a fresco com hidróxido de potássio, chama a atenção que parte das colônias não se dissolvem, formando grumos amarronzados, os quais são difíceis de focar e examinar pela espessura (fig. 2B).
Com a microscopia eletrônica de varredura em pequenos aumentos, foram identificados dois aspectos distintos da colônia: uma área compactada e uma área filamentosa (fig. 3).
O exame da área filamentosa evidenciou dilatações nas hifas, como vistas na microscopia óptica (fig. 4). O exame detalhado das hifas demostrou também que elas se encontram aderidas por fina substância reticular (fig. 5). Um achado recorrente é a aderência entre os filamentos fúngicos, com paralelização dos filamentos (fig. 6). Em grandes aumentos, o aspecto microfibrilar aderindo as hifas entre si fica bem evidente (figs. 7 e 8).
O exame da área compactada mostra as hifas embebidas na matriz reticular formando biofilme (fig. 9), ficando a colônia bem aderida. Com grandes aumentos, pode‐se observar que as hifas ficam dentro dessa matriz fibrilar (fig. 10), que tem o mesmo aspecto da matriz extracelular que adere as hifas entre si na área filamentosa.
Não encontramos relatos de exame ultraestrutural de colônias de P. hortae; apenas relatos dos nódulos da afecção foram encontrados. Nesses relatos, é referida substância extracelular cimentante,10,11 formadora dos nódulos na haste pilar, juntamente com as hifas e esporos.
Nossos achados demonstram que as estruturas fúngicas produzem substância secretada para o meio extracelular, de aspecto microfibrilar, a qual adere as hifas entre si, e em algumas áreas da colônia (talvez mais antigas) provoca grande compactação, embebendo essas estruturas, formando um biofilme. Não encontramos ascósporos, pois essa técnica examina a superfície da amostra, e os ascósporos são encontrados no interior da colônia ou nódulo da piedra.11
Essa rede fibrilar é o que deve dar resistência e configuração aos nódulos de piedra, tornando possível sua ocorrência no ambiente, em parte hostil, das hastes pilares. É possível também que aja como fator de aderência ao cabelo na disseminação da doença. No exame direto com microscopia óptica, corroborando com essa formação de estruturas resistentes, tem‐se certa dificuldade em dissolver as colônias, que aparecem como grumos acastanhados.
O termo biofilme foi utilizado primeiramente na década de 1970, apesar de observação antiga pelos microbiologistas. É definido como matriz extracelular polimérica com os agentes etiológicos embebidos, tendo função de proteção contra radiação ultravioleta, temperaturas e pH extremos, salinidade e pressão nocivas às bactérias; além disso, podem estar envolvidos na resistência a antibióticos.12 Os biofilmes podem ser formados por polissacarídeos, proteínas ou gorduras.12 Com a técnica de análise morfológica utilizada neste estudo, não é possível afirmar a composição da matriz documentada.
Fungos também podem produzir biofilmes, já demonstrado em espécies que causam onicomicose, como Trichophyton rubrum e Trichophyton mentagrophytes.13,14 Em uma publicação, leve aderência entre as hifas foi descrita com MEV de colônias de Trichophyton mentagrophytes, achado bem mais discreto que o aqui relatado de P. hortae.15
Com relação às piedras, a formação de biofilmes já foi descrita em várias espécies de Trichosporon,16,17 e variação interespécies foi encontrada, podendo‐se classificá‐las em produtoras de biofilmes fracas ou fortes. É possível que cepas com baixa produção de biofilmes não causem piedra alba.
Os achados ultraestruturais da colônia de P. hortae demonstram que a formação de biofilme pela matriz extracelular secretada pelas hifas possa ser importante na patogênese da piedra nigra.
Suporte financeiroNenhum.
Contribuição dos autoresHiram Larangeira de Almeida Jr.: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Thales Moura de Assis: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Eduardo Camargo Faria: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Luiz Roberto Kramer Costa: Aprovação da versão final do manuscrito; concepção e planejamento do estudo, elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Berenice Marques Ibaldo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Agradecemos à micoteca do Instituto de Medicina Tropical de São Paulo ‐ LIM53 e à Viviane Mazo Fávero Gimenes, pelo fornecimento da colônia de Piedraia hortae.
Como citar este artigo: Almeida Junior HL, Assis TM, Faria EC, Costa LRK, Ibaldo BM. Piedraia hortae: biofilm formation and its importance in the pathogenesis of piedra nigra (black piedra). An Bras Dermatol. 2024;99:863–8.
Trabalho realizado na Universidade Católica de Pelotas, Pelotas, RS, Brasil.