Autoanticorpos antidesmogleína 1 e 3 justificam a acantólise nos pênfigos; porém, a patogênese de antidesmogleína 2 é hipotética.
ObjetivoComparar a participação das desmogleínas 1, 2 e 3 pela produção de autoanticorpos séricos, e expressões proteica e gênica na pele/mucosa de pacientes com pênfigo foliáceo e pênfigo vulgar.
MétodosAutoanticorpos foram titulados por ELISA em 202 amostras de pênfigo foliáceo, 131 de pênfigo vulgar, 50 e 57 familiares de pênfigo foliáceo e de pênfigo vulgar, respectivamente, e 114 controles. Expressões proteica e gênica foram determinadas por imuno‐histoquímica e qPCR na pele/mucosa de três pacientes com pênfigo foliáceo e três com pênfigo vulgar.
ResultadosTítulos (densidade óptica) maiores de antidesmogleína 2 resultaram no pênfigo foliáceo e pênfigo vulgar, comparados aos controles (0,166; 0,180; 0,102; respectivamente; p <0,0001). Houve correlação entre títulos de antidesmogleína 2 e antidesmogleína 1 no pênfigo foliáceo (r=0,1680; p=0,0206). Não houve reação cruzada de antidesmogleína 2 com desmogleínas 1 e 3. Houve hiperexpressão proteica da desmogleína 2 na pele íntegra e lesional dos pênfigos, comparada à pele controle. Foram observados grânulos de internalização das desmogleínas 1 e 3, mas não da desmogleína 2, na lesão do pênfigo foliáceo e pênfigo vulgar, respectivamente. Houve hiperexpressão gênica da desmogleína 2 nas mucosas.
Limitações do estudoTamanho amostral pequeno para análise estatística das expressões proteica e gênica.
ConclusãoAutoanticorpos contra desmogleína 2 não são patogênicos nos pênfigos; a hiperexpressão proteica e gênica da desmogleína 2 na pele e nas mucosas pode estar envolvida na reparação da acantólise.
Os pênfigos são doenças bolhosas autoimunes, caracterizados pela produção de autoanticorpos IgG contra as desmogleínas (Dsg) 1 e 3, os quais rompem a adesão dos queratinócitos causando acantólise. No pênfigo foliáceo (PF), a produção de anti‐Dsg1 é responsável pelo acometimento exclusivo da pele; no pênfigo vulgar (PV), a produção de anti‐Dsg3 afeta as mucosas, e, quando a pele está envolvida, são detectados anti‐Dsg1 e anti‐Dsg3.1,2 Tanto o PF quanto o PV são prevalentes no Sudeste do Brasil, e a determinação do perfil HLA dos pacientes com PF e PV confirmou tratar‐se de doenças bolhosas distintas.3,4
A participação da Dsg2 é pouco estudada na patogênese dos pênfigos. Em contraste com as expressões das Dsg1 e Dsg3, que são restritas a epitélios estratificados, a Dsg2 é amplamente expressa em todos os epitélios que contêm desmossomos, incluindo tecidos pulmonar, gastrintestinal, renal e o miocárdio, e em tumores da pele, ovário, pulmão e estômago.5–11 Na pele humana, a Dsg2 é pouco expressa, restringindo‐se à camada basal da epiderme, enquanto sua expressão se assemelha às expressões da Dsg1 e Dsg3 em linhagens de células imortalizadas de carcinoma de células escamosas.12
Para contribuir com a participação da Dsg2 na patogênese dos pênfigos, comparou‐se a produção de autoanticorpos contra as Dsg 1, 2 e 3 em ampla amostragem de pacientes com PF e PV, seus familiares e controles saudáveis, residentes na região nordeste do estado de São Paulo, Brasil, onde ambos PF e PV são prevalentes. Foram determinadas, ainda, as expressões proteica e gênica das Dsg 1, 2 e 3 em amostras de pele e mucosa, obtidas de pacientes com PF e PV.
Materiais e métodosÉticaO Comitê de Ética Humana (CAAE: 56944116.1.0000.5440) aprovou este estudo de acordo com os padrões éticos da Declaração de Helsinque da Associação Médica Mundial. Todos os participantes assinaram o termo de consentimento livre e esclarecido.
População do estudoAmostras de soro de pacientes com PF e PV, diagnosticados por exame clínico, histopatológico, e exames de imunofluorescência direta e/ou indireta; de familiares de primeiro e segundo graus e de controles (CTL), que acompanharam os pacientes durante a consulta ambulatorial, foram obtidas de 1997 a 2016. Cinco grupos foram analisados: 202 pacientes com PF e 131 com PV, 50 familiares do PF (FPF) e 57 FPV, e 114 CTL. Os pacientes virgens de tratamento foram classificados de acordo com a forma clínica – isto é, PF localizado ou generalizado e PV forma mucosa exclusiva ou mucocutânea. Os pacientes com PF e PV foram divididos em cinco subgrupos, de acordo com a atividade da doença e vigência ou não de tratamento no momento da coleta do soro: virgens de tratamento; com lesões ativas e sem tratamento há mais de 60 dias; em tratamento com lesões ativas; em tratamento sem lesões ativas; e em remissão (pacientes sem lesões ativas e sem tratamento imunossupressor há pelo menos 60 dias) – tabela 1.
Dados demográficos, clínicos e resultados de ELISA antidesmogleínas (Dsg) comparando pacientes com PF e PV, familiares do PF e PV (FPF e FPV) e controles (CTL)
| PF | PV | FPF | FPV | Controles | p | |
|---|---|---|---|---|---|---|
| n=202 | n=131 | n=50 | n=57 | n=114 | ||
| Mediana de idade em anos (quartis 25/75) | 35 (21/54)a | 48 (35/62)b | 40 (29/49)c | 30 (19/45)d | 59 (45/71)e | 0,0001a,b |
| > 0,9999a,c | ||||||
| <0,0001a,e | ||||||
| 0,0001b,d | ||||||
| 0,0068b,e |
| n (%) | n (%) | n (%) | n (%) | n (%) | ||
|---|---|---|---|---|---|---|
| 202 | 131 | 50 | 57 | 114 | ||
| Gênero | 0,0033a,b | |||||
| 0,0027b,e | ||||||
| Feminino | 102 (50,2)a | 88 (67,7)b | 36 (72,0)c | 40 (70,2)d | 55 (48,2)e | 0,8150a,e |
| 1,0000c,d | ||||||
| Masculino | 101 (49,8) | 42 (32,3) | 14 (28,0) | 17 (29,8) | 59 (51,8) | 0,0022c,e |
| 0,0088d,e |
| Duração da doença (anos)* | n=199 | n=130 | ||||
|---|---|---|---|---|---|---|
| <1 | 45 (22,6) | 31 (23,8) | NA | NA | NA | 0,8967 |
| 1 a −5 | 87 (43,7) | 86 (66,2) | NA | NA | NA | 0,0296 |
| 6 a −10 | 32 (16,1) | 9 (6,9) | NA | NA | NA | 0,0390 |
| 11 a 15 | 11 (5,5) | 3 (2,3) | NA | NA | NA | 0,2630 |
| > 15 | 24 (12,1) | 1 (0,8) | NA | NA | NA | 0,0001 |
| Forma clínica (pacientes virgens de tratamento)* | n=68 | n=26 | ||||
|---|---|---|---|---|---|---|
| Mucosa exclusiva | NA | 8 (30,8)b | NA | NA | NA | a=0,9636 |
| b=0,3909 | ||||||
| Mucocutânea | NA | 18 (69,2)b | NA | NA | NA | |
| Localizada | 34 (50,0)a | NA | NA | NA | NA | |
| Generalizada | 34 (50,0)a | NA | NA | NA | NA |
| Tratamento na data da coleta de soro* | n=186 | n=127 | ||||
|---|---|---|---|---|---|---|
| Virgens de tratamento | 43 (23,1)a | 20 (15,8)b | NA | NA | NA | a<0,0001 |
| Sem tratamento com lesões ativas | 34 (18,3)a | 11 (8,7)b | NA | NA | NA | b<0,0001 |
| Em tratamento sem lesões ativas | 16 (8,6)a | 24 (18,8)b | NA | NA | NA | |
| Em tratamento com lesões ativas | 80 (43,0)a | 65 (51,2)b | NA | NA | NA | |
| Em remissão | 13 (7,0)a | 7 (5,5)b | NA | NA | NA |
| Anti‐Dsg2 | n=202 | n=131 | n=50 | n=57 | n=114 | <0,0001a,e |
|---|---|---|---|---|---|---|
| Acima do cut‐off | 129 (63,9)a | 87 (66,4)b | 19 (38,0)c | 42 (73,7)d | 31 (27,2)e | <0,0001b,e |
| 0,0012a,c | ||||||
| Abaixo do cut‐off | 73 (36,1) | 44 (33,6) | 31 (62,0) | 15 (26,3) | 83 (72,8) | <0,0001c,d |
| <0,0001d,e | ||||||
| Anti‐Dsg1 | <0,0001a,b | |||||
| <0,0001a,e | ||||||
| Acima do cut‐off | 179 (88,2)a | 67 (51,5)b | 6 (12,0)c | 1 (1,8)d | 4 (3,5)e | <0,0001a,c |
| <0,0001b,d | ||||||
| Abaixo do cut‐off | 23 (11,8) | 64 (48,5) | 44 (88,0) | 56 (98,2) | 110 (96,5) | <0,0001b,e |
| 0,0325c,d | ||||||
| Anti‐Dsg3 | ||||||
| Acima do cut‐off | 9 (4,5)a | 102 (78,5)b | 4 (8,0)c | 0 (0,0)d | 3 (2,6)e | <0,0001a,b |
| <0,0001b,e | ||||||
| Abaixo do cut‐off | 193 (95,5) | 29 (21,5) | 46 (92,0) | 57 (100,0) | 111 (97,4) | <0,0001b,d |
| 0,0446c,d |
NA, não se aplica; Anti‐Dsg1 e anti‐Dsg3, cut‐off <20 U/mL (ELISA, MBL, Japan); Anti‐Dsg2, cut‐off=0,1365 DO (ELISA in house).
As amostras foram testadas com ELISA comercial (MBL, Nagoya, Japão), segundo as recomendações do fabricante (cut‐off=20 U/mL).
Detecção de autoanticorpos IgG contra Dsg2 por ELISA in houseResumidamente, 5 ng/μL da Dsg2 (Leinco, Fenton, EUA) diluídos em solução de carbonato‐bicarbonato (pH 7,4) foram incubados (50 μL/poço) em microplaca de 96 poços (Sigma‐Aldrich, St. Louis, EUA) a 4°C durante a noite. Após quatro lavagens com 0,05% de PBS/Tween e incubação com solução de bloqueio (PBS/Tween 0,05%/leite desnatado 5%) por uma hora, 50 μL de amostras de soro (diluídas a 1:100 em solução de bloqueio), em duplicata, foram adicionadas e incubadas à temperatura ambiente (TA) durante 2 horas. Após quatro lavagens, 50 μL (diluído a 1:5000 em solução de bloqueio) de anticorpo HRP conjugado com IgG anti‐humano (Abcam, Cambridge, EUA) foram incubados em TA por 2 horas. Após quatro novas lavagens, 50 μL de substrato de peroxidase ABTS (ácido 2,2’‐azino‐bis [3‐etilbenzotiazolina‐6‐sulfônico]) foram adicionados e mantidos em TA por 15 minutos no escuro, e a reação foi finalmente interrompida com 50 μL de H2SO4 1M. Os títulos em densidade óptica (DO) foram determinados em leitor de placas ELISA (Biochrom Asys Expert Plus Microplate Reader, Cambourne, UK) a 405nm. Anticorpo comercial anti‐Dsg2 (Abcam, Cambridge, EUA) foi empregado como controle positivo. O valor do cut‐off de 0,1365 DO foi estabelecido por curva ROC (fig. 1 suplementar). Títulos maiores que 0,400 DO foram obtidos em quatro amostras do grupo CTL e foram excluídos do cálculo porque excederam a curva de normalidade.
ELISA de adsorção para especificidade de anti‐Dsg2Para excluir reação cruzada dos anticorpos anti‐Dsg2 com as proteínas Dsg1 e Dsg3, seis amostras de soro do PF e seis do PV com títulos elevados de anti‐Dsg 1, 2 e 3 foram selecionadas. Foram realziados ensaios ELISA para adsorção sérica em série com Dsg2 (Leinco, Fenton, EUA) até que o nível de anti‐Dsg2 ficasse abaixo do valor cut‐off. Posteriormente, o soro remanescente foi colocado em placa de ELISA comercial anti‐Dsg1 e anti‐Dsg3 (MBL, Nagoya, Japão) para comparar os títulos pré‐ e pós‐adsorção.
Amostras de biópsiaAs biópsias de pele e/ou mucosa foram realizadas em três pacientes com PF e três com PV, virgens de tratamento ou com lesões ativas e sem tratamento por mais de 60 dias. As biópsias foram feitas de pele íntegra (PI) perilesional e de lesões bolhosas, assim denominadas: pele lesional (PL) ou mucosa lesional (ML). Como controle, coletou‐se biopsia de mucosa íntegra (MI) de um paciente com PF. Uma amostra de pele de abdominoplastia e a amostra de MI do PF foram usadas como controles na IHQ, e duas amostras de pele de cirurgia de lifting facial (LF) foram usadas como controles no ensaio de qPCR. Biopsias com punch 4mm foram seccionadas em dois fragmentos: um deles foi armazenado em meio Tissue‐Tek (Sakura finetek, Torrance, EUA) para coloração com hematoxilina & eosina e imuno‐histoquímica (IHQ), e o outro foi armazenado em RNAlater® (Life Technologies, Carlsbad, EUA) a −80°C para extração de RNA e subsequente ensaio de qPCR.
Imuno‐histoquímica (IHQ)O sistema de detecção HRP‐Polymer MACH 1 (Biocare Medical, Concord, EUA) foi usado de acordo com as recomendações do fabricante. Os fragmentos congelados foram fixados em acetona (Merck, Darmstadt, Germany) a 4°C por 10 minutos e lavados em PBS Ph 7,4; a peroxidase endógena foi inibida pela incubação com H2O2 0,3% (Labsynth, Diadema, Brasil) por 10 minutos. Em seguida, os fragmentos foram incubados com solução de bloqueio Sniper em TA por 10 minutos, seguido pela adição de 5 μg/mL de anticorpo monoclonal anti‐Dsg1, anti‐Dsg2 e anti‐Dsg3 (Abcam, Cambridge, Reino Unido) por 2 horas. Os cortes foram lavados com PBS por 3 minutos, duas vezes. Em seguida, a sonda foi adicionada por 15 minutos. Os cortes foram lavados em PBS novamente e incubados com o polímero HRP por 30 minutos. Após a lavagem, a reação foi completada com a adição do substrato cromogênico diaminobenzidina por 2 minuots, preparado de acordo com as instruções do fabricante (Biocare Medical, Concord, EUA). A seguir, os cortes foram contrastados com hematoxilina de Harris (Merck Millipore, Burlington, EUA) por 40 segundos e lavados em água corrente. Para a montagem das lâminas, os cortes foram desidratados em banhos crescentes de etanol e diafanizados em banhos de xilol e, a seguir, montadas com Entellan (Merck, Darmstadt, Alemanha) e os cortes cobertos com lamínula para observação em microscópio óptico (Imager‐A1, Zeiss, Alemanha).
Extração de RNA e síntese de cDNARNA total foi extraído de biópsias de pele ou mucosa usando o reagente Trizol, de acordo com as instruções do fabricante (Invitrogen, Carlsbad, EUA). Após a extração, as amostras foram incubadas com DNAse (Promega, Madison, EUA) e quantificadas em espectrofotômetro NanoVue® Plus (GE Healthcare Life Sciences, Chicago, EUA); 40 ng de RNA foram transcritos reversamente com o kit de síntese de cDNA (Promega, Madison, EUA), seguindo as instruções do fabricante.
Reação em cadeia da polimerase quantitativa em tempo real (qPCR) e sequenciamento das Dsg1, Dsg2 e Dsg3SYBR Green qPCR foi realizada em volume final de 22,5 μL, com 12,5 μL de MIX SYBR Green PCR (Promega, Madison, EUA), 0,5 μL de cada primer (10 μM), 6,5 μL de água ultrapura e 2,5 μL de cDNA (1:4), no termociclador Rotor Gene‐Q® (Qiagen, Hilden, Alemanha). Foram utilizadas as sequências de primers que amplificam fragmentos dos genes Dsg1, Dsg2 e Dsg3 e do gene ribossomal humano (18S) como gene endógeno.13–15 As sequências dos primers, o produto amplificado resultante (amplicon) e os parâmetros dos ciclos de amplificação são detalhados na Tabela 1 suplementar. As expressões gênicas relativas de Dsg1, Dsg2 e Dsg3 foram calculadas usando a equação 2 (−ΔcT), tendo o 18S rRNA como gene de referência; ΔcT foi calculado subtraindo o valor do cicle Threshold (cT) do gene alvo (Dsg1, Dsg2 ou Dsg3) do valor de cT do gene de referência (18S).16 Para verificar a especificidade de cada sequência, o amplicon obtido foi purificado (ExoSAP‐IT®), sequenciado (3500 Genetic Analyzer, Applied Biosystems, EUA) e analisado no NCBI BLAST.
Análise estatísticaAs variáveis categóricas foram analisadas por teste Qui‐quadrado (×2) ou teste exato de Fisher quando os dados eram escassos. Kruskall‐Wallis seguido pelo teste de Dunn foi empregado para comparar os títulos de ELISA entre os grupos. O teste de Spearman foi usado para correlacionar os títulos de anticorpos contra as Dsgs, bem como com a duração da doença e a idade dos pacientes. O teste de Friedman foi usado para comparar os títulos de anti‐Dsg2 pré‐ e pós‐adsorção sérica em série. O teste de Wilcoxon foi aplicado para comparar os títulos de anti‐Dsg1 e anti‐Dsg3 pré‐ e pós‐adsorção com Dsg2. A análise de regressão logística multivariada com o SPSS Statistics 17.0 (software IBM SPSS®, EUA) foi utilizada para confirmar os resultados significativos obtidos na análise univariada. A significância foi fixada em α=5%. O software GraphPad Prism 8.1 foi utilizado para as análises estatísticas e para a construção dos gráficos (GraphPad software Inc., La Jolla, EUA).
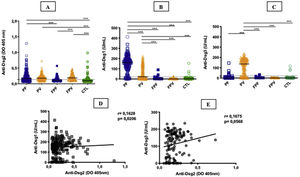
ResultadosA tabela 1 resume os dados demográficos, clínicos e laboratoriais dos grupos estudados. Os grupos PF e PV apresentaram títulos (DO) semelhantes e maiores de anti‐Dsg2 comparados ao grupo CTL (0,166; 0,180; 0,102, respectivamente; p <0,0001) – figura 1A. Ainda, o grupo PF apresentou maiores títulos de anti‐Dsg2 comparado aos grupos FPF (p=0,0046) e FPV (p=0,0004). Esses resultados permaneceram estatisticamente significativos após análise multivariada, corrigida por idade, sexo e títulos de anticorpos contra Dsg1 e Dsg3. Nos grupos de familiares e CTL, observou‐se produção de autoanticorpos contra Dsg1 e/ou Dsg3 (fig. 1B e C). Títulos de anti‐Dsg2 foram mais elevados nos grupos PF e PV virgens de tratamento, comparados ao grupo CTL (p <0,0001), e no grupo PV sem tratamento comparado ao PV em tratamento (p=0,0311; fig. 2 suplementar), permanecendo significativo após análise multivariada (p=0,0500). Os subgrupos PF não diferiram quanto aos títulos de anti‐Dsg2 (dados não mostrados).
Anticorpos IgG contra Dsg1, Dsg2 e Dsg3 nos grupos estudados. A, Anti‐Dsg2 por ELISA in house. PF, PV e FPV apresentaram títulos maiores comparados aos controles (CTL) (p <0,0001); PF e FPV, títulos maiores do que FPF (p=0,0046 e p=0,0004, respectivamente). B, Anti‐Dsg1 por ELISA comercial. PF apresentou títulos maiores comparado a todos os grupos (p <0,0001); PV, títulos maiores do que FPF, FPV e CTL (p <0,0001). C, Anti‐Dsg3 por ELISA comercial. PV apresentou títulos maiores do que todos os grupos (p <0,0001). A linha horizontal em cada coluna significa a mediana; a linha pontilhada, o valor de cut‐off. PF, pênfigo foliáceo; PV, pênfigo vulgar; FPF, familiares do PF, FPV, familiares do PV. Análise estatística: Kruskall‐Wallis seguido pelo teste de Dunn. D, Correlação de Spearman entre títulos de anti‐Dsg2 e anti‐Dsg1 no PF. E, Correlação de Spearman entre títulos de anti‐Dsg2 e anti‐Dsg3 no PV.
A soroprevalência de anti‐Dsg2 nos grupos PF, PV e FPV resultou semelhante (63,9%; 66,4%; 73,7%, respectivamente), e maior que nos grupos FPF e CTL (38%; 27,2%, respectivamente – p <0,0001) – tabela 1.
Não houve correlação significativa dos títulos de anti‐Dsg2 com a duração da doença no PF (p=0,5365) e no PV (r=−0,1629; p=0,0630) – dados não mostrados –, assim como com a forma clínica do PF (p=0,9636) e do PV (p=0,3909) – tabela 1. Não houve diferença significativa dos títulos de anti‐Dsg2 nos subgrupos PF e PV com lesões cutâneas ativas e sem lesões cutâneas (p=0,3790 e p=0,1312, respectivamente) – dados não mostrados.
Houve correlação positiva dos títulos de anti‐Dsg2 com os títulos de anti‐Dsg1 no grupo PF (r=0,1628; p=0,0206), com tendência à correlação positiva com os títulos de anti‐Dsg3 no PV (r=0,1675, p=0,0568) – fig. 1D e E. Considerando os subgrupos virgem de tratamento, e sem tratamento há mais de 60 dias e com lesões em atividade, não houve correlação dos títulos de anti‐Dsg2 com os de anti‐Dsg1 no PF (r=0,2100, p=0,0650), assim como com os de anti‐Dsg3 no PV (r=0,1481, p=0,4264) – dados não mostrados.
Após a adsorção dos soros de pacientes com PF e PV com o peptídeo Dsg2, os títulos de anti‐Dsg1 e de anti‐Dsg3 permaneceram semelhantes à pré‐adsorção (p >0,9999 e p=0,4063, respectivamente), confirmando a especificidade dos anticorpos anti‐Dsg2 (tabelas 2 e 3 suplementares).
Expressão proteica das desmogleínas por IHQA tabela 2 mostra os dados demográficos e sorológicos dos pacientes com PF e PV submetidos à biópsia de pele e/ou mucosa para IHQ.
Dados demográficos, clínicos e títulos de anticorpos anti‐Dsg 1, 2 e 3 por ELISA dos pacientes com PF e PV submetidos à biópsia de pele e/ou mucosa
| Idade | Gênero | Duração da doença (meses) | Forma clínica | Tratamento na data da biópsia | Anti‐Dsg1 (U/mL)a | Anti‐Dsg2 (DO)b | Anti‐Dsg3 (U/mL)a | |
|---|---|---|---|---|---|---|---|---|
| PF1 | 23 | Masculino | 48 | Generalizada | Em tratamento há 30 dias | 99,80 | 0,088 | 1,93 |
| PF2 | 18 | Masculino | 6 | Generalizada | Virgem de tratamento | 193,08 | 0,223 | 4,15 |
| PF3 | 25 | Masculino | 36 | Localizada | Virgem de tratamento | 237,90 | 0,894 | 8,70 |
| PV1 | 61 | Masculino | 24 | Mucocutânea | Sem tratamento há mais de 60 dias | 3,87 | 0,211 | 172,78 |
| PV2 | 50 | Masculino | 4 | Mucocutânea | Virgem de tratamento | 42,16 | 0,213 | 166,91 |
| PV3 | 68 | Masculino | 6 | Mucocutânea | Virgem de tratamento | 167,62 | 0,311 | 163,80 |
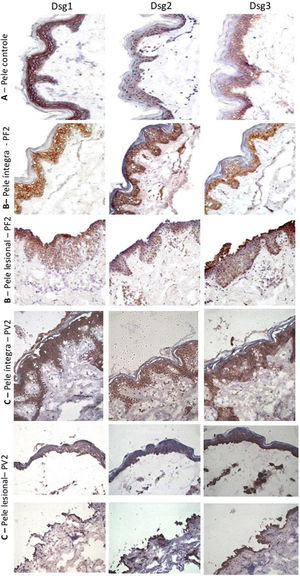
Na amostra de pele controle de abdominoplastia, confirmou‐se a distribuição epidérmica clássica das Dsgs: a Dsg1 esteve expressa em toda a epiderme, com predomínio nas camadas superiores, enquanto as Dsg2 e Dsg3 predominaram nas camadas inferiores. A expressão da Dsg2 foi menos intensa do que a das Dsg1 e Dsg3 (fig. 2A). Diferentemente da amostra de pele controle, a expressão da Dsg2 foi mais intensa em todas as camadas da epiderme nas amostras de PI do PF e PV (fig. 2B e C). Na PL do PF, houve expressão intensa da Dsg2 no assoalho da bolha e, no PV, no teto e no assoalho da bolha, incluindo sua expressão nas células acantolíticas (fig. 2B e C).
Painel de imuno‐histoquímica com expressões de Dsg1, Dsg2 e Dsg3 em amostras de pele (amplificação original de 40×). A, Amostra de pele controle de abdominoplastia mostrando a distribuição típica de Dsg1, Dsg2 e Dsg3 na epiderme. B, PF‐pele íntegra mostrando expressões aumentadas da Dsg2 e Dsg3 em toda a epiderme e PF‐pele lesional mostrando expressões aumentadas da Dsg2 e Dsg3 no teto e no assoalho da bolha acantolítica. C, PV‐pele íntegra mostrando expressões aumentadas da Dsg2 e de Dsg3 em toda a epiderme e PV‐pele lesional mostrando expressões aumentadas da Dsg2 e Dsg3 no teto e no assoalho da bolha e nas células acantolíticas.
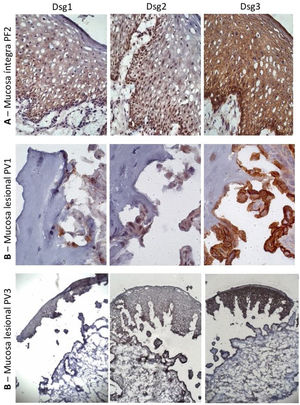
À semelhança da amostra de pele controle, a expressão da Dsg2 na MI do PF foi mais intensa nas camadas inferiores. Ainda, houve predomínio da expressão da Dsg3 em todas as camadas da epiderme, comparada às da Dsg1 e Dsg2 (fig. 3A). Na ML do PV, houve predomínio da expressão da Dsg3 no teto e no assoalho da bolha (fig. 3B e C).
Painel de imuno‐histoquímica com expressões de Dsg1, Dsg2 e Dsg3 em amostras de mucosa. A, PF‐mucosa íntegra mostrando a distribuição típica de Dsg1, Dsg2 e Dsg3 na epiderme (amplificação original de 63×). B, PV‐mucosa lesional mostrando expressão da Dsg2 e Dsg3 circundando a bolha acantolítica (amplificação original de 100× e 40×).
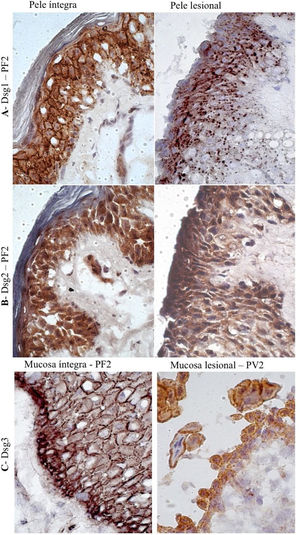
Na PL do PF, grânulos conspícuos intercelulares e intracitoplasmáticos, correspondentes à internalização da Dsg1, foram observados em toda a extensão do assoalho da bolha, da camada basal à camada Malpighiana (fig. 4A). Grânulos intracitoplasmáticos, que poderiam representar a internalização da Dsg2, não foram observados nas amostras lesionais do PF e PV (fig. 4B). Na PL e na ML do PV, grânulos intercelulares finos e esparsos de Dsg3 foram demonstrados (fig. 4C).
Painel de imuno‐histoquímica com expressões de Dsg1, Dsg2 e Dsg3 em amostras de pele e mucosa de pacientes com PF e PV. A, Dsg1 em amostras de pele íntegra e lesional do paciente PF2 mostrando grânulos conspícuos intercelulares e intracitoplasmáticos (internalização da Dsg1), amplamente distribuídos na pele lesional (amplificação original de 100×). B, Dsg2 comparando amostra de pele íntegra e lesional do paciente PF2, confirmando a ausência de grânulos (amplificação original de 100×). C, Dsg3 comparando amostra de mucosa íntegra do paciente PF2 e mucosa lesional do paciente PV3, mostrando grânulos finos intercelulares e intracitoplasmáticos (internalização da Dsg3) na mucosa lesional (amplificação original de 100×).
A tabela 2 detalha os dados demográficos e sorológicos dos pacientes com PF e PV submetidos à biópsia de pele e/ou mucosa para os ensaios de qPCR.
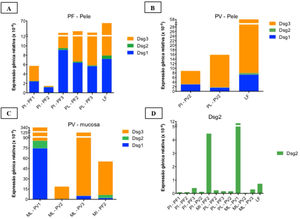
As curvas de amplificação das amostras de cDNA são mostradas na figura 3 suplementar. Os resultados das expressões gênicas relativas de Dsg 1, 2 e 3 são apresentados na figura 5.
Expressões gênicas relativas (×10‐4) de Dsg1, Dsg2 e Dsg3 em amostras de pele e mucosas. A, Pele íntegra (PI) e pele lesional (PL) do PF em comparação à amostra controle de lifting (LF) mostrando predominância da expressão da Dsg3 em comparação às Dsg1 e Dsg2. B, PI e PL do PV e LF. As expressões das Dsg1, Dsg2 e Dsg3 foram menores do que na amostra de LF. C, Mucosa lesional (ML) de PV em comparação com a mucosa íntegra (MI) de PF mostrando predominância da expressão de Dsg3 comparada às Dsg1 e Dsg2. A expressão da Dsg2 está aumentada em amostras da mucosa. D, Comparação da expressão da Dsg2 em todas as amostras PF e PV. As expressões gênicas relativas das Dsg1, Dsg2, Dsg3 foram calculadas usando 2(−ΔcT) e 18S rRNA como gene de referência.
Considerando a amostra de pele controle de LF, houve predomínio da expressão gênica relativa da Dsg3, seguida pelas expressões das Dsg1 e Dsg2 (fig. 5A e B). As expressões gênicas relativas das Dsg1 e Dsg3 foram menores no PV, seguido pelo PF, com distribuição semelhante das Dsgs à amostra de LF (fig. 5A eB).
As expressões das Dsg 1, 2 e 3 apresentaram resultados distintos nas amostras de MI do PF e ML do PV, com predomínio da expressão da Dsg3 (fig. 5C). Já a expressão da Dsg2 mostrou‐se maior na MI do PF e ML do PV, comparada às das amostras de PI e de PL do PF e PV (fig. 5D).
DiscussãoNeste estudo, demonstramos a produção de autoanticorpos IgG séricos contra Dsg2 em grande amostragem de pacientes com PF e PV, comparados aos grupos FPF, FPV e CTL, todos habitantes de região prevalente em PF e PV no Sudeste do Brasil.3 A soroprevalência de anti‐Dsg2 no grupo PF (63% de 202 PF) foi maior quando comparada à do estudo de Flores et al. (40% de 106 PF), o qual foi realizado em região endêmica para PF no Brasil.17 Já a soroprevalência no grupo CTL foi semelhante em ambos (20% e 27%, respectivamente).
Em razão da similaridade proteica das Dsg1, Dsg2 e Dsg3, aventou‐se possível reação cruzada dos anticorpos anti‐Dsg2 com as proteínas Dsg1 e Dsg3.5 No entanto, testes de adsorção não mostraram diferenças nos títulos de anti‐Dsg1 e anti‐Dsg3 quando comparados os resultados pré‐ e pós‐adsorção com a Dsg2, confirmando a produção específica de anti‐Dsg2.
Considerando a especificidade da produção de autoanticorpos contra a Dsg2, alguns questionamentos devem ser considerados: (a) seriam patogênicos?, e (b) seriam produzidos pelo fenômeno de epitope‐spreading?18
Quanto à primeira questão, a discussão dos resultados aponta pela não patogenicidade dos anticorpos anti‐Dsg2 nos pênfigos. Títulos maiores de anti‐Dsg2 foram detectados nos grupos PF, PV e FPV, quando comparados aos grupos FPF e CTL. A produção de anti‐Dsg1 e anti‐Dsg3 por indivíduos saudáveis é conhecida; portanto, a presença de anti‐Dsg2 nos grupos FPF, FPV e CTL não excluiria sua participação na patogênese do PF e PV.19–21 Títulos de anti‐Dsg2 se correlacionaram com os de anti‐Dsg1 no PF (r=0,1628, p=0,0206), também relatado por Flores et al.;17 no entanto, não houve correlação de anti‐Dsg2 com anti‐Dsg3 no PV. Ainda, os títulos de anti‐Dsg2 não se correlacionaram com a forma clínica ou com a atividade da doença nos grupos PF e PV, em contraste com os títulos séricos de anti‐Dsg1 e anti‐Dsg3 que estão associados à gravidade do PF e PV.22,23 Além disso, títulos mais elevados de anti‐Dsg2 nos grupos PF e PV sem tratamento em comparação ao CTL, e nos grupos PV não tratado em comparação com PV em tratamento foram encontrados. Assim, a diminuição de anti‐Dsg2 após o tratamento imunossupressor poderia favorecer a patogenicidade de anti‐Dsg2 no PV; porém, esse resultado não foi confirmado no grupo PF. Finalizando essa discussão, é conhecida a expressão da Dsg2 em outros tecidos além da pele, como tecidos pulmonar, gastrintestinal, renal e no miocárdio.5,8 Desse modo, corroborando para que os anticorpos anti‐Dsg2 não sejam patogênicos, excetuando‐se o esôfago no PV, não se evidencia comprometimento de órgãos internos nos pênfigos.24
Quanto à segunda questão, seria mais plausível considerar que anticorpos anti‐Dsg2 fossem produzidos por fenômeno de epitope‐spreading no PV, visto que as Dsg2 e Dsg3 são mais expressas nas camadas inferiores da epiderme. Ainda, pacientes com PV apresentaram títulos de anti‐Dsg2 mais elevados antecedendo o início do tratamento imunossupressor. Assim, poderíamos supor que a Dsg2 é exposta no início do processo acantolítico, produzido por anti‐Dsg3, com consequente produção de anti‐Dsg2 por fenômeno de epitope‐spreading.18 No entanto, títulos semelhantes de anti‐Dsg2 foram observados no PF e PV. Desse modo, o fenômeno de epitope‐spreading estaria ocorrendo em ambos os processos patogênicos do PF e PV. Retornaremos a essa discussão após considerarmos os resultados de IHQ.
Uma vez que os pacientes com PF e PV produziram anti‐Dsg2, decidimos verificar as expressões proteica e gênica da Dsg2 in situ por IHQ e qPCR, respectivamente, e comparar os resultados com as expressões das Dsg1 e Dsg3. Comparamos PI e PL do PF e PV com pele de abdominoplastia e LF à IHQ e qPCR, respectivamente. A ML do PV foi comparada à MI do PF.
Na amostra controle de abdominoplastia, a expressão proteica das Dsgs confirmou o padrão de distribuição clássico nas camadas da epiderme – a expressão da Dsg2 foi restrita às camadas inferiores. Além disso, as Dsg1 e Dsg3 foram predominantemente expressas nas membranas dos queratinócitos.5,12 Curiosamente, as expressões da Dsg2 e Dsg3 nas amostras de PI do PF e PV foram mais intensas do que na amostra de abdominoplastia, e se estenderam a todas as camadas da epiderme. Na PL do PF e PV, a expressão da Dsg2 foi intensa no teto e no assoalho das bolhas e nas células acantolíticas. Ainda, nas amostras de PL do PF e PV, observamos a presença de grânulos de Dsg1 e de Dsg3 intra e intercelulares nos queratinócitos, respectivamente. Os grânulos de Dsg1 estenderam‐se por toda a camada Malpighiana no assoalho da bolha acantolítica do PF, confirmando a internalização da Dsg1, descrita há 30 anos.25–28 A internalização da Dsg3 na PL do PV foi menos evidente, mas é comumente descrita.29–32 Enquanto a Dsg2 esteve hiperexpressa na PI, sua internalização esteve ausente na PL do PF e PV, representando mais uma evidência de que anticorpos anti‐Dsg2 não têm papel patogênico no processo da acantólise do pênfigo.
Na amostra de LF, a expressão gênica relativa da Dsg2 foi menor do que a das Dsg1 e Dsg3, condizente com a expressão proteica avaliada por IHQ. Com surpresa, a expressão gênica relativa da Dsg2 esteve aumentada na MI do PF e na ML do PV.
O papel da hiperexpressão proteica e gênica da Dsg2 nas amostras de pele/mucosa de pacientes com PF e PV merece atenção. Iwatsuki et al. mostraram que a internalização das Dsg1 e Dsg3 antecedia a acantólise em amostras de pele do PF e PV, e esteve associada à indução da expressão da Dsg2 para compensar a depleção das Dsg1 e Dsg3.13 Ainda, Moll et al. demonstraram forte expressão da Dsg2 em modelo de cultura de pele criado para estudar a cicatrização epitelial.33 Em camundongos transgênicos com superexpressão da Dsg2, Brennan et al. demonstraram hiperproliferação de queratinócitos epidérmicos e diminuição da apoptose, e mostraram que a superexpressão da Dsg2 restringiu a formação de bolhas epidérmicas por IgPF.34,35 Depois, Hartlieb et al. demonstraram que, embora a Dsg2 contribua menos do que a Dsg3 para a coesão dos queratinócitos, a Dsg2 compensou a perda de função da Dsg3.6,36 Mais recentemente, Sigmund et al. demonstraram que a Dsg2 faz ligação heterofílica com a Dsg3 e pode minimizar a perda de adesão entre os queratinócitos no processo da acantólise.37
Somando os nossos resultados aos relatos da literatura, a hiperexpressão da Dsg2 na pele e mucosa do PF e PV parece estar em consonância com os relatos mencionados: a hiperexpressão da Dsg2, para compensar a perda de função das Dsg1 e Dsg3, poderia proteger o processo da acantólise e estar envolvida na reparação tecidual. Além disso, a hiperexpressão da Dsg2 em todas as camadas da epiderme na PI e PL do PF e PV poderia justificar a produção de autoanticorpos contra a Dsg2 pelo fenômeno de epitope‐spreading.
Por fim, embora autoanticorpos anti‐Dsg1 e anti‐Dsg3 sejam relatados em populações normais, os resultados de títulos aumentados de anti‐Dsg2 no grupo FPV deverão ser mais bem avaliados.19–21
Limitações do estudoTamanho amostral pequeno para análise estatística das expressões proteica e gênica da Dsg2 nos tecidos.
ConclusãoNossos resultados permitem concluir que autoanticorpos contra Dsg2 não são patogênicos nos pênfigos, e que a hiperexpressão proteica e gênica da Dsg2 em amostras de pele e mucosas de pacientes com PF e PV pode estar envolvida na proteção contra a acantólise
Declaração de submissão e verificaçãoOs resultados parciais do teste ELISA foram apresentados como pôster “Anticorpos contra desmogleína 2 estão presentes em amostras de pacientes com pênfigo foliáceo e pênfigo vulgar e em familiares e controles de região endêmica” no XXXIV Encontro Anual de Dermatologistas da América Latina, 2016, São Paulo, tendo sido contemplado em terceiro lugar.
Suporte financeiroParcialmente financiado pela FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo) (# 2010/51729‐2) e FAEPA (Fundação de Apoio ao Ensino, Assistência e Pesquisa). TJ recebeu bolsa de doutorado da FAPESP (#2016/09011‐3) e SV recebeu bolsa de Doutorado da CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior).
Contribuição dos autoresMarcela Calixto Brandão Miguel: Contribuiu com obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; análise estatística; revisão crítica da literatura.
Tamiris Amanda Julio: Contribuiu com obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Sebastian Vernal: Contribuiu com a análise dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Natália Aparecida de Paula: Contribuiu com obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Andre Lieber: Contribuiu com o planejamento do estudo, revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Ana Maria Roselino: Contribuiu com a concepção e planejamento do estudo; análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito e participação efetiva na orientação da pesquisa.
Conflito de interessesNenhum.
Agradecemos à Aline Turatti, PhD, pelas contribuições nos experimentos de IHQ e revisão do manuscrito, e à Aline Rafaela da Silva Rodrigues Machado, PhD, pelos experimentos pilotos de ELISA anti‐Dsg2 in house e ELISA comercial anti‐Dsg1 e anti‐Dsg3.
Como citar este artigo: Miguel MC, Julio TA, Vernal S, Paula NA, Lieber A, Roselino AM. Autoantibodies against desmoglein 2 are not pathogenic in pemphigus. An Bras Dermatol. 2022;97:145–56.
Trabalho realizado no Hospital das Clínicas, Divisão de Dermatologia, Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Ribeirão Preto, SP, Brasil.