Entre as doenças consideradas milenares, a tuberculose (TB) é, seguramente, uma delas. O agente etiológico da TB é o Mycobacterium tuberculosis. Essa nefasta infecção bacteriana produz ainda hoje graves consequências socioeconômicas e é grande o desafio para sua completa erradicação. Nos países em desenvolvimento, constitui um dos mais importantes problemas de saúde pública. Segundo a Organização Mundial da Saúde, a infecção causa mais de 4.000 óbitos diariamente; 10,4 milhões de pessoas são acometidas anualmente, e 1,5 milhão morrem por TB todo ano. A doença constitui a maior causa de morbidade e mortalidade em pacientes infectados pelo vírus da imunodeficiência humana. A TB cutânea (TBC) é rara infecção, que representa 1 a 1,5% das formas de TB extrapulmonar, cujos agentes etiológicos são Mycobacterium tuberculosis, Mycobacterium bovis e a forma atenuada do bacilo Calmette‐Guérin (BCG vacina). A TBC pode ser exógena; endógena por contiguidade ou autoinoculação e por disseminação hematogênica; ser induzida pelo bacilo Calmette‐Guérin e manifestar‐se como tubercúlide. O diagnóstico da infecção é realizado por meio de pesquisa direta, cultura, exame histopatológico, teste tuberculínico, reação em cadeia da polimerase, teste de liberação do interferon‐gama e genotipagem. Os medicamentos empregados são isoniazida, rifampicina, pirazinamida e etambutol.
A tuberculose (TB) é doença infecciosa milenar, cosmopolita, causada por Mycobacterium tuberculosis, que ocorre com maior incidência nos países em desenvolvimento e constitui um dos mais graves problemas de saúde pública – é uma ameaça constante à saúde, que incapacita e causa a morte de grande número de pessoas. A TB é considerada pela Organização Mundial da Saúde (OMS) a doença do mundo, com mais de 4.000 mortes diariamente, 10,4 milhões de pessoas infectadas anualmente e 1,5 milhão de mortes por essa infecção todo ano. Com o advento da pandemia HIV/AIDS, a TB tornou‐se a maior causa de morbidade e mortalidade em pacientes infectados pelo HIV.1–3 Em 2018 foram registrados 484.000 de casos de TB no mundo resistentes à rifampicina, dos quais 78% com multirresistência (TBMR).1–8
A China, a Índia e a Indonésia são responsáveis por 45% dos casos de TB no mundo.1,2,9 No Sudeste Asiático e em algumas regiões da África, a taxa de mortalidade representou 85% do total de mortes decorrentes de TB.1,2,9–11
Em 2018, a doença causou 4.490 óbitos no Brasil. Em 2019, foram registrados 73.864 casos novos de TB no país – coeficiente de incidência de 35,0 casos/100 mil habitantes. No Brasil foi detectado gigantesco crescimento de casos novos da coinfecção TB‐HIV entre 2010 e 2018.3–5 O risco de adquirir TB depende da coexistência de fatores condicionantes, como fator genético, idade, sexo, desnutrição, alcoolismo, tabagismo, fatores ambientais, sistema imune do indivíduo – aumento de utilização de medicamentos imunossupressores na terapêutica de doenças autoimunes, de neoplasias, em transplantados – desenvolvimento de TBMR, infecção por HIV, enfermidade pulmonar prévia, além de outras comorbidades.1–10
Estudos relatam que o estado de imunossupressão determinado por HIV/AIDS estabelece condição favorável para contágio e adoecimento de pessoas. A chance de que a infecção pelo bacilo evolua para doença tuberculosa em imunocompetentes é de 10% ao longo da vida, e chega a ser de 10% ao ano em infectados pelo HIV.12
A TB extrapulmonar representa 20% dos casos da doença, que inclui TB pleural, TB osteoarticular, TB geniturinária, TB ocular, Tb abdominal, TB mamária, meningite e pericardite tuberculosas, TB cutânea (TBC), entre outros órgãos comprometidos.9,11,13,14
A TBC é forma rara de micobacteriose, que representa 1 a 2% de todas as formas de TB extrapulmonar.9 O agente etiológico principal é o Mycobacterium tuberculosis e, ocasionalmente, Mycobacterium bovis e bacilo Calmette‐Guérin (BCG vacina, cepa atenuada de M. bovis).3,8–11,15
Em 1826, Théophile Laënnec (1781–1826), o inventor do estetoscópio (1819), descreveu o primeiro caso de TBC no mundo que vitimou o próprio Laënnec. Robert Koch (1843‐1910) identificou e isolou M. tuberculosis somente em 1882.7–9,13
É importante ressaltar que há infecções não causadas pelo complexo M. tuberculosis ou por M. leprae e M. lepromatosis, mas que são produzidas por micobactérias não tuberculosas ou atípicas (MNT), entre as quais se destacam: complexo M. avium (MAC),M. ulcerans, M. marinum, M. haemophilum, M. fortuitum, M. chelonae, M. kansasii, M. abscessus, M. scrofulaceum, M. simiae, M. malmoense, M. xenopi.7–11,13
A TBC é prevalente em adultos jovens, principalmente mulheres; a TBC verrucosa predomina no sexo masculino, e eritema indurado de Bazin, no sexo feminino.8–11,16
Etiologia e patogêneseMycobacterium tuberculosis foi identificado e isolado por Robert Koch em 1882. É um patógeno intracelular obrigatório, aeróbico, reto ou levemente curvo, imóvel, não esporulado, com 1 a 10 μm de comprimento e 0,2 a 0,6 μm de largura, álcool‐ácido resistente, com capacidade de sobrevivência e de multiplicação no interior de macrófagos. Apresenta genoma composto por aproximadamente 4.000 genes, dos quais cerca de 200 são responsáveis por codificar enzimas para o metabolismo de ácidos graxos e outros 170 codificam famílias de proteínas relacionadas com antigenicidade, alguns relacionados ao metabolismo do bacilo e constituintes da parede celular – lipídios, proteínas, carboidratos – porém, a maioria dos genes desempenha importante papel na invasão do sistema imunológico.10,11,13,17,18 A alta concentração de lipídios na parede celular é responsável pela resistência/sobrevivência do micro‐organismo; no entanto, expressa sensibilidade ao calor e à radiação ultravioleta.9–11,18
A pesquisa da TB foi fundamental para o nascimento da imunologia; entretanto, a relação entre ambas tem sido ambivalente desde o início.19
Chen et al. propõem que “proteínas são os antígenos mais importantes do M. tuberculosis e podem induzir resposta imune de células T e outras reações alérgicas, incluindo resposta imune celular hiper‐reativa de início tardio. A necrose caseosa que ocorre na doença é induzida pelos lipoides”.9
Atuam no mecanismo de defesa do hospedeiro contra a bactéria, células dendríticas, macrófagos ativados, que fagocitam e destroem a micobactéria, para apresentação antigênica aos linfócitos, nos quais se processa série de eventos biológicos, destacando‐se a importante função protetora dos linfócitos T CD4+e T CD8+, que secretam citocinas com a finalidade de eliminar o bacilo de Koch (BK).9,13,15 De acordo com Sehgal et al.,.19 podemos considerar o conceito espectral na TBC, com base em parâmetros bacteriológicos, histopatológicos e imunológicos, à semelhança do descrito na hanseníase e na TB pulmonar. Num polo teremos lúpus vulgar (LV), com imunidade celular ativa e imunoglobulina aparentemente normal, e no outro extremo teremos escrofuloderma, com imunidade celular menos ativa e resposta humoral aumentada, evidenciada por níveis séricos elevados de imunoglobulinas e C3 reduzido.20
As células T são responsáveis pela polarização da doença no hospedeiro, uma vez que podem conter o M. tuberculosis, desenvolvendo a forma paucibacilar ou, por meio da supressão imunológica, podem permitir a sobrevivência do patógeno, levando à forma multibacilar. As vias Th1 e Th17 são as principais efetoras envolvidas na patogenia da TB, fazendo a mediação da proteção contra o agente etiológico. O subconjunto de células Treg também participa do processo com importante função, pois mantém as células efetoras da imunidade mediada por células em homeostase.20–22 A defesa contra TB por meio de Th1 tem como componente mais importante a produção da citocina IFN‐γ, que ativa macrófagos e estimula a fagocitose, a maturação do fagossomo, a produção de intermediários reativos de nitrogênio e a apresentação de antígenos. Apesar de o IFN‐γ ser uma das citocinas mais importantes para a resposta protetora contra o M. tuberculosis, não é suficiente para o controle do patógeno.23–25 As células Th17 produzem a IL‐17, que desempenha vultosa função protetora na TB, observada pela sobrevivência dos neutrófilos na fase inicial das infecções, proporcionando controle da carga bacteriana.26–30
A mediação supressora das células Treg ocorre principalmente por meio da secreção da citocina imunossupressora TGF‐β, a qual tem efeito anti‐inflamatório.31–33 Nos pacientes com TBC, as células Treg produzem significativa quantidade de TGF‐β, o qual desempenha importante função na expansão de Treg CD4+, CD25+e também inibe a polarização de células Th17.22
O principal alvo do M. tuberculosis na espécie humana são os pulmões; entretanto, todos os órgãos e sistemas do hospedeiro podem ser infectados pelo micro‐organismo. A maioria da infecção ocorre pela via respiratória – 80% das formas de TB são pulmonares.7–11,15,17 A integridade da pele é muito eficaz para impedir a entrada do BK, mas as soluções de continuidade do tegumento mucocutâneo favorecem a infecção do hospedeiro pelo BK e, portanto, das manifestações tuberculosas cutâneas e/ou mucosas.7,8,11,17
Manifestações clínicas e classificaçãoAs manifestações clínicas da TBC apresentam polimorfismo que pode ser explicado por alguns fatores como a patogenicidade da cepa bacteriana, o estado imune do hospedeiro, tratamento prévio ou fatores locais, entre os quais a proximidade a linfonodos.8–11,17
As lesões polimorfas da TBC incluem pápulas, nódulos, placas infiltradas, úlceras, gomas e lesões verrucosas, cujo diagnóstico diferencial com outras doenças de expressão clínica similar é obrigatório. Esse polimorfismo das lesões levou à propositura de várias classificações complexas e polêmicas.
A carga bacteriana é a base de uma classificação proposta para a doença que é análoga à classificação de Ridley e Jopling para a hanseníase e compreende:
- a)
Forma multibacilar – baixa imunidade ao BK. Inclui cancro tuberculoso, TB orificial, escrofuloderma, TB miliar aguda e goma tuberculosa.
- b)
Forma paucibacilar – alta imunidade ao M. tuberculosis. Inclui TB verrucosa, LV e tubercúlides.
A classificação para a TBC que se baseia em critérios mais robustos – patogênese, anatomopatológico, sistema imune, quadro clínico – e é aceita mundialmente pelos que estudam a micobacteriose será adotada neste trabalho:7–9,11,16,17
- a)
TBC exógena: cancro tuberculoso e TB verrucosa cútis.
- b)
TBC endógena: contiguidade ou autoinoculação (escrofuloderma, TB orificial [TBO] e alguns casos de LV); disseminação hematogênica (LV, TB gomosa [TBG] e TB miliar aguda).
- c)
TBC causada pelo bacilo Calmette‐Guerin (BCG vacina); LV pós‐vacinação.
- d)
Tubercúlides: tubercúlide papulonecrótica; tubercúlide liquenoide (líquen escrofuloso).
- e)
Tubercúlides facultativas: eritema indurado de Bazin; vasculite nodular.
Cancro tuberculoso (CT) ou TB por inoculação primária resulta da penetração direta de M. tuberculosis na pele e/ou mucosas através de traumatismo, feridas, dermatose preexistente, procedimentos cirúrgicos com material contaminado, em pessoas que não têm imunidade inata ou adaptativa ao M. tuberculosis. O indivíduo também adquire a doença por meio de respiração boca a boca, circuncisão, injeções com agulhas hipodérmicas contaminadas, após tatuagens, piercing, locais de aplicações de insulina. A infecção da mucosa oral por M. bovis pode ocorrer por ingestão de leite não pasteurizado e por exodontia. É a forma mais comum em crianças; no entanto, adolescentes e adultos jovens podem ser infectados.7–11,13,34
Manifestações clínicasO CT se manifesta duas a quatro semanas após o contágio como pápula, placa infiltrada ou nódulo que evolui para lesão ulcerosa localizada com maior frequência na face (incluindo conjuntiva), membros superiores (maioria nas mãos) e membros inferiores. A úlcera é indolor, rasa, com fundo granuloso, base infiltrada que pode alcançar alguns centímetros de diâmetro, de difícil cicatrização. Após duas a oito semanas, associa‐se linfangite e linfonodopatia regional, constituindo o complexo primário tuberculoso da pele, similar ao complexo de Ghon do pulmão.7 Os linfonodos podem sofrer liquefação, ulcerar e eliminar material necrótico/necropurulento. Paroniquia resultante da infecção dos quirodáctilos pelo bacilo não é incomum.7
HistopatologiaInfiltrado inflamatório agudo de neutrófilos no início do processo infeccioso seguido, algumas semanas depois, por organização de granuloma associado a necrose caseosa e presença de numerosos bacilos álcool‐ácido resistentes (BAAR) demonstrados pelas colorações de Fite‐Faraco ou Ziehl‐Neelsen.
DiagnósticoConfirmação laboratorial do agente etiológico por pesquisa direta e cultura para BAAR, derivado proteico purificado (PPD), histopatológico, teste de liberação do interferon‐gama (IGRA) e reação em cadeia da polimerase (PCR) para BK.
Diagnóstico diferencialConsiderar MNT, sífilis, bartonelose, esporotricose, leishmaniose.
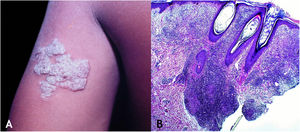
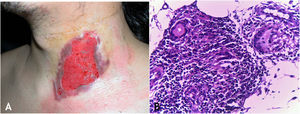
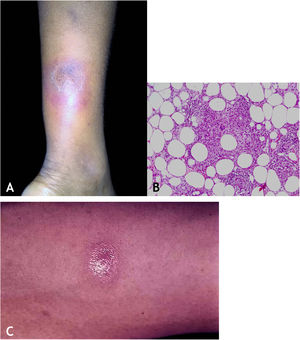
Tuberculose verrucosa cutâneaA TB verrucosa cutânea resulta de inoculação exógena em indivíduos previamente infectados pelo BK com alta imunidade ao micro‐organismo. É a variante paucibacilar mais comum em profissionais da saúde – médicos, patologistas, médicos veterinários, biomédicos, enfermeiros, técnicos de necropsia –, em fazendeiros, açougueiros e excepcional em pessoas com outras atividades (fig. 1A).7–11
No início, a lesão é pápula/papulopústula com halo eritematoso ou nódulo com hiperceratose na superfície, evoluindo para placa verrucosa de crescimento centrífugo, bordas nítidas e presença de focos de secreção purulenta. A lesão em geral é única, localizada preferencialmente nas mãos, mas outras áreas do tegumento podem ser acometidas, como membros inferiores, sobretudo em crianças.7,8,13,16,17 Eventualmente, evolui para cura espontânea com reliquat cicatricial atrófico.
HistopatologiaObserva‐se hiperplasia epitelial pseudoepiteliomatosa hiperceratótica e, na derme, infiltrado inflamatório de linfócitos, abscessos de neutrófilos em associação com granulomas de células epitelioides, células multinucleadas do tipo Langhans e necrose caseosa. BAAR escassos ou de difícil evidenciação (fig. 1B).
DiagnósticoO aspecto clínico é confirmado por baciloscopia, cultura, IGRA, PPD, PCR, anatomopatológico.
Diagnóstico diferencialConsiderar síndrome verrucosa (PLECT) – paracoccidioidomicose, leishmaniose, esporotricose, cromoblastomicose, TB (outras formas), MNT, verrugas, carcinomas, ceratoacantoma, bromoderma, iododerma, líquen plano hipertrófico.
EscrofulodermaEscrofuloderma ou Tuberculosis colliquativa cutis constitui a forma mais frequente de TBC nos países em desenvolvimento, com prevalência em crianças e adultos jovens, mas acometendo também pessoas idosas. Na dependência do sistema imune e de outros fatores condicionantes, pode acometer o hospedeiro tanto como forma multibacilar quanto paucibacilar.
Manifestações clínicasA infecção pelo M. tuberculosis se desenvolve em linfonodos, ossos, articulações, epididimite ou orquiepididimite tuberculosa, e a pele sobrejacente é comprometida por contiguidade pela micobactéria. A coexistência de TB pulmonar é observada na maioria dos casos de escrofuloderma.7–9,11,16,17
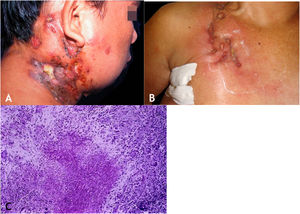
A lesão inicial é nódulo subcutâneo – único ou múltiplo – inicialmente firme, que aumenta progressivamente de tamanho e, após várias semanas, sofre amolecimento e ruptura, resultando em fístulas e ulceração, com eliminação de material necrótico ou necropurulento. São conhecidos como abscessos frios. As cadeias de linfonodos cervicais, axilares, supraclaviculares, inguinais são envolvidos com maior frequência nessa forma de TB (fig. 2A e B)
A. Escrofuloderma – nódulos/gomas e ulcerações nas regiões cervical e mastoidea direita associadas a tuberculose de linfonodos. B. Escrofuloderma – lesões infiltradas e ulceradas na região clavicular direita. C. Escrofuloderma – necrose caseosa circundada por infiltrado granulomatoso em paliçada de macrófagos e células gigantes multinucleadas do tipo Langhans. (Hematoxilina & eosina, 40×).
A epiderme é atrófica ou ulcerada conforme a lesão biopsiada. A derme e o subcutâneo mostram necrose caseosa em cuja periferia há granulomas de macrófagos, células gigantes multinucleadas tipo Langhans e pequena participação de linfócitos. BAAR escassos. Na maioria dos casos, M. tuberculosis é de difícil demonstração pelas colorações específicas (fig. 2C).
DiagnósticoOs achados clínicos são complementados por exames laboratoriais: PPD (reator forte), cultura em meios específicos, histopatologia, IGRA, PCR para BK.
Diagnóstico diferencialConsiderar paracoccidioidomicose, actinomicose, esporotricose, goma sifilítica, MNT, hidradenite supurativa.
Tuberculose orificialA TBO, também conhecida pelas denominações de úlcera tuberculosa aguda e TB ulcerosa cutânea e mucosa, resulta de autoinoculação do M. tuberculosis na mucosa e na pele periorificial em indivíduos com baixa imunidade portadores de TB em órgãos internos – pulmões, urogenital, gastrintestinal, além de outros focos em atividade. Essa rara forma de TBC tem maior incidência em idosos que, em geral, apresentam deficiência imunológica e PPD não reator.7–9,11,16–18,36
Tendo em vista os múltiplos diagnósticos diferenciais que as úlceras genitais suscitam com outras doenças que se expressam por esse tipo de lesão – infecções virais, bacterianas, fúngicas, pré‐cancerosas, neoplásicas e de outras noxas – é imprescindível cuidadosa investigação para acurado diagnóstico.37 TB genital incide com maior frequência em mulheres idosas, menopausadas, quase sempre relacionada a foco tuberculoso em atividade ou reativado, com predomínio das lesões nas trompas de Falópio, no endométrio e rara na região vulvovaginal. No entanto, o desenvolvimento de úlcera dolorosa de etiologia tuberculosa em grande lábio esquerdo em adolescente de 14 anos, virgem, do gênero feminino, é relato excepcional na literatura.37 O registro é alerta para incluir TBO entre os diagnósticos propostos, mesmo quando se trata de adolescentes que ainda não iniciaram atividade sexual.
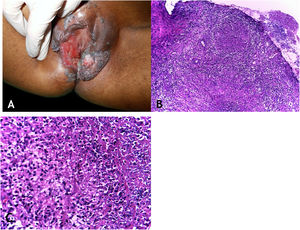
Manifestações clínicasOs locais mais envolvidos pela micobacteriose são a cavidade oral, a genitália externa, trompas de Falópio, endométrio, regiões anal/perianal (fig. 3A).
A. Tuberculose cutânea orificial – lesão úlcerovegetante que compromete grandes e pequenos lábios. B. Tuberculose cutânea orificial – epiderme ulcerada e massivo infiltrado inflamatório granulomatoso dérmico. (Hematoxilina & eosina, 40×). C. Tuberculose cutânea orificial – granuloma associado a necrose caseosa. (Hematoxilina & eosina, 200×). Fotos: Dra. Maraya Bittencourt.
As lesões da cavidade oral podem se estender por contiguidade à faringe e à laringe sob a forma de ulcerações muito dolorosas. A doença inicia por pápula ou nódulo eritematoamarelado evoluindo para ulceração dolorosa de bordas irregulares, base infiltrada, sem tendência para cicatrização, causando pronunciada disfagia orofaríngea.
HistopatologiaUlceração do epitélio de revestimento e derme revelando granulomas com necrose de caseificação. Presença de numerosos BAAR demonstrados pelas colorações específicas (fig. 3B e C).
DiagnósticoAspecto clínico das lesões, exames complementares, investigar TB em outros órgãos, especialmente em pulmões.
Diagnóstico diferencialConsiderar estomatite aftosa recorrente, sífilis e outras infecções sexualmente transmissíveis de expressão clínica ulcerosa, micoses profundas, neoplasias malignas – em especial, carcinoma espinocelular.35
Lúpus vulgarLV é uma forma de TBC crônica, endógena, por contiguidade ou autoinoculação (alguns casos) e por disseminação hematogênica ou linfática, em pessoas com alta ou moderada imunidade a M. tuberculosis, tuberculino‐positivos, paucibacilar, com maior prevalência no sexo feminino em relação ao masculino, comprometendo qualquer faixa etária. A infecção ocorre a partir de foco tuberculoso pulmonar, osteoarticular, linfonodo ou de outro órgão. Excepcionalmente, pode se desenvolver após vacinação pelo BCG.11–13,16,18,36
Manifestações clínicasLV se manifesta por pápula ou nódulo eritemato‐acastanhado de superfície lisa ou ceratósica, consistência gelatinosa que à diascopia revela aspecto de “geleia de maçã”.
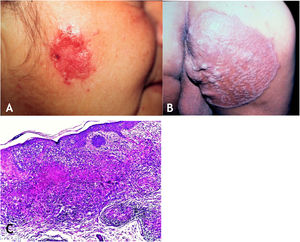
A lesão é em geral única, mas podem ser múltiplas. A localização preferencial é na face – nariz, regiões genianas, mento, orelhas –, mas outras regiões são envolvidas, como a cervical e os membros superiores e inferiores. A lesão inicial tem evolução para placa com expansão centrífuga de centro atrófico que pode ulcerar (fig. 4A e B).
A. Lúpus vulgar – lesão infiltrada, erodida, de bordas nítidas, na região masseterina direita. B. Lúpus vulgar – extensa placa semeada de pápulas/nódulos, áreas cicatriciais, com bordas nítidas e levadas na região glútea direita. C. Lúpus vulgar – derme mostra infiltrado inflamatório granulomatoso associado a focos de necrose caseosa (Hematoxilina & eosina, 40×).
Relatos de casos publicados com diferentes tipos de lesão de LV resultaram em variantes, citadas a seguir: placa psoriasiforme, eczematosa, anular, ulcerativa, vegetante, hipertrófica e cicatricial.9,38 As variantes ulcerativa e vegetante mutilantes causam graves deformidades dos locais envolvidos.7–9,13,17
As mucosas podem ser comprometidas por inoculação direta do M. tuberculosis ou a partir de expansão de lesão cutânea. Degeneração maligna – carcinoma espinocelular, sarcomas, linfoma de Hodgkin – tem sido registrada em pacientes com LV de longa evolução.7,35,39
A doença é de curso crônico e, se não tratada, causa deformidades por destruição de estruturas dos sítios anatômicos comprometidos. A cura espontânea de LV é muito difícil, mas pode ocorrer após vários anos com cicatriz atrófica ou deformante.
HistopatologiaA epiderme pode apresentar atrofia, acantose, hiperplasia epitelial pseudoepiteliomatosa ou ulceração. Na derme, presença de granulomas tuberculoides com células gigantes multinucleadas do tipo Langhans e coroa linfocitária. Necrose de caseificação é de pequena monta e por vezes ausente. BAAR de difícil identificação ou ausente (fig. 4C).
DiagnósticoAspecto clínico e diascopia das lesões cutâneas, PPD reator forte, cultura em meios específicos, histopatológico, IGRA, PCR para M. tuberculosis.
Diagnóstico diferencialConsiderar lúpus eritematoso, sarcoidose, pseudolinfoma cutâneo, leishmaniose, hanseníase, sífilis terciária, paracoccidioidomicose e outros processos patológicos de expressão clínica similar.
Tuberculose miliar agudaTB miliar aguda ou TBC disseminada ocorre por disseminação hematogênica do BK de foco ativo de TB visceral, comumente de pulmões. Tem maior prevalência na infância, em pacientes imunossuprimidos por infecção pelo HIV ou que estejam fazendo quimioterapia, em uso de imunossupressores para doença autoimune e em transplantados. Representa uma forma rara de TBC, porém com risco de morte para esse grupo de pacientes. A coinfecção pelo HIV com contagem de células CD4 abaixo de 100/μL tem contribuído para o aumento do número de casos dessa forma clínica de TB.8–12
Manifestações clínicasAs lesões são polimorfas incluindo pápulas, vesículas, pústulas, nódulos, com distribuição preferencial nos membros superiores e inferiores, tronco, mas podem ser disseminadas, em geral assimétricas. Panarícios, abscessos e ulcerações tem registros na literatura.7–9
HistopatologiaO quadro histomorfológico das lesões iniciais mostra áreas de necrose e abscessos de neutrófilos. À medida que as lesões evoluem, observa‐se adição de histiócitos e formação de granulomas na periferia do infiltrado. Numerosos BAAR podem ser identificados em abscessos neutrofílicos e em trombos vasculares.
DiagnósticoO diagnóstico é estabelecido com base nas lesões dermatológicas, exame físico geral, baciloscopia, cultura em meios específicos, anatomopatológico, IGRA, PCR, exames de imagem.
Diagnóstico diferencialConsiderar MNT, sífilis secundária acneiforme, micoses profundas, sarcoidose, reação a fármaco.
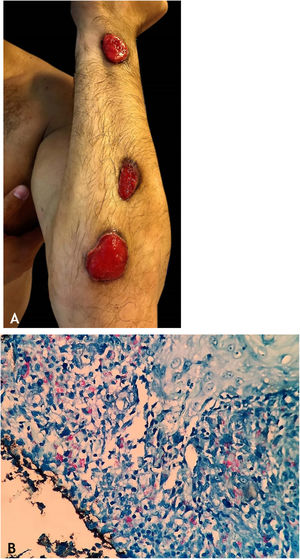
Tuberculose gomosaTuberculose gomosa (TBG) ou abscessos tuberculosos metastáticos é forma de TBC por disseminação hematogênica do M. tuberculosis com origem em foco tuberculoso primário.7–9,11,13,18 TBG tem maior incidência em indivíduos imunossuprimidos e em crianças e adolescentes com desnutrição (fig. 5).7–9,17
As lesões iniciais são nódulos firmes, que evoluem para abscessos e posterior ulceração com drenagem de material necrótico, localizadas no tronco e nos membros superiores e inferiores. Algumas lesões mimetizam as observadas no escrofuloderma. Gomas tuberculosas de aspecto esporotricoide têm sido objeto de vários trabalhos publicados que ressaltam a dificuldade para diagnóstico conclusivo desses casos (fig. 6A).0,16–80,40
HistopatologiaBAAR são evidenciados nas áreas de massiva necrose de caseificação. Os casos de paniculite tuberculosa revelam granulomas com células gigantes multinucleadas, e BAAR são demonstrados por colorações específicas (fig. 6B).
DiagnósticoAspecto clínico das lesões e suporte laboratorial: baciloscopia e cultura para BAAR, anatomopatológico, PPD, IGRA, PCR.
Diagnóstico diferencialConsiderar paniculites de outras etiologias, MNT, micoses profundas (destaque para esporotricose), sífilis.
Tuberculose cutânea pós‐vacinação pelo BCG (bacilo Calmette‐Guerin)A vacina BCG foi desenvolvida por Albert Léon C. Calmette e Jean M. Camille Guérin, e utilizada pela primeira vez em 1921. Deve ser aplicada após o nascimento até antes dos cinco anos de idade, destinada a proteger o indivíduo contra a TB impedindo que a primo‐infecção produzida pelo M. tuberculosis tenha evolução especialmente para formas graves de TB – meningoencefalite e a TB miliar. Em adultos a proteção vacinal é baixa.17,41 A principal hipótese é que BCG induza células T de memória efetora que farão a proteção do indivíduo por 10 a 15 anos. Outro fator seria que o efeito protetor da vacina sofreria variação geográfica.42
Estão em desenvolvimento cerca de 12 vacinas contra TB: BCG recombinante (rBCG), Micobacterium vaccae, vacinas de proteína com adjuvantes, com vetor viral, vacinas de DNA, vacinas baseadas em RNA, além de outras.13,42
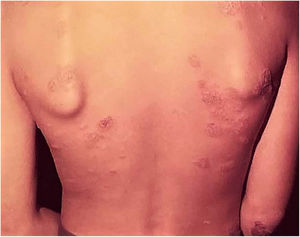
Efeitos adversos ocorrem com quaisquer vacinas utilizadas no mundo, e a vacina BCG não é exceção. Os efeitos adversos da vacina BCG detectados com maior frequência incluem: abscesso subcutâneo frio, linfonodopatia regional supurada, úlcera com diâmetro maior que 1 cm, cicatriz do tipo queloide, fenômeno de Koch, lesões de LV (no local da vacina ou nas proximidades), lesões de escrofuloderma, de tubercúlide‐simile, e osteoartrites. Excepcionalmente, são registradas lesões generalizadas que acometem outros órgãos (fig. 7).41,42
TubercúlidesA maioria dos trabalhos recentes não considera as tubercúlides formas autênticas de TBC, mas um grupo heterogêneo de entidades clínicas que resultam de resposta de hipersensibilidade do hospedeiro a M. tuberculosis. A baciloscopia é geralmente negativa para BAAR nas lesões cutâneas.
As principais formas são: tubercúlide papulonecrótica, líquen escrofuloso (tubercúlide liquenoide) e eritema indurado de Bazin, vasculite nodular.
Tubercúlide papulonecróticaTubercúlide papulonecrótica (TPN) atualmente é forma rara da doença em países industrializados; entretanto, ainda é comum nos países em desenvolvimento com alta prevalência de TB. Crianças, adolescentes e adultos jovens são as vítimas mais frequentes dessa variante de tubercúlide.13,17,18,43
Associação com TB pulmonar, extrapulmonar e linfadenopatia mesentérica tuberculosa com PPD reator tem sido registrada.44 Evidenciação de BAAR é difícil ou está ausente nas lesões cutâneas. No entanto, vários trabalhos identificaram a presença de DNA de M. tuberculosis por PCR em 50% das lesões de TPN.7,11,45 Culturas positivas para o micro‐organismo também são relatadas em lesões cutâneas.45 Na literatura, há relatos de associação de TPN a lúpus eritematoso discoide, eritema nodoso e artrites.13,43
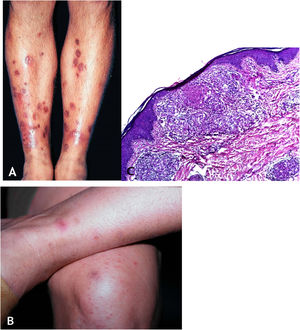
Manifestações clínicasTrata‐se de erupção cutânea, em geral em surtos recorrentes de pápulas eritematosas que evoluem com necrose central e ulceração recoberta por crosta – chamadas lesões em saca‐bocado. A distribuição das lesões é simétrica, preferencialmente nas faces de extensão dos membros superiores (inclusive mãos), membros inferiores e no tronco. Com tratamento ou involução espontânea, resultam cicatrizes varioliformes (fig. 8A e B).
A. Tubercúlide papulonecrótica – lesões “em saca‐bocado” nos membros inferiores. B. Tubercúlide papulonecrótica – lesões papuloeritematosas e papulocrostosas nos membros inferiores. C. Tubercúlide papulonecrótica – atrofia da epiderme e derme subjacente com granulomas com necrose caseosa (Hematoxilina & eosina, 40×).
Epiderme ulcerada e derme com área de necrose em cunha e denso infiltrado inflamatório crônico granulomatoso com escassas células gigantes multinucleadas no entorno. Necrose pode envolver folículos pilosos, e vasculite granulomatosa é alteração detectada em alguns casos (fig. 8C).
DiagnósticoQuadro clínico e exames complementares: PPD reator, histopatológico e PCR para BAAR.
Diagnóstico diferencialConsiderar pitiríase liquenoide e varioliforme aguda, vasculite leucocitoclástica, sífilis secundária, prurigos.
Tubercúlide liquenoide ou líquen escrofulosoÉ forma caracterizada por pápulas liquenoides em indivíduos altamente sensibilizados a M. tuberculosis e/ou suas proteínas. Associação frequente com TB na pleura, pulmão, osteoarticular, linfonodos e de outros órgãos. Crianças e adolescentes constituem os grupos acometidos com maior prevalência, em geral portadores de foco tuberculoso.16,17,36,46 Alguns estudos mostram ocorrência dessa tubercúlide em casos de pós‐vacinação por BCG, bem como infecções por MNT, entre as quais se destaca o complexo M. avium‐intracellulare. No entanto, DNA de M. tuberculosis por PCR já foi demonstrado em alguns casos.7,14,45
Manifestações clínicasErupção papular liquenoide, assintomática, com maior concentração no tronco. São pápulas foliculares e/ou perifoliculares, isoladas ou coalescentes formando placas, com leve descamação na superfície. A involução espontânea ou pelo tratamento específico pode ocorrer.46
HistopatologiaA derme superior revela infiltrado inflamatório granulomatoso composto por células epitelioides associadas a pequeno número de células gigantes do tipo Langhans e escassos linfócitos envolvendo folículos pilosos e glândulas sudoríparas. Em outras áreas da derme, o infiltrado inflamatório linfocitário é perivascular de pequena densidade. Ausência de M. tuberculosis por colorações especificas no material de biopsia e nas culturas para BAAR. Em alguns estudos, foi demonstrado M. tuberculosis por PCR.45
Diagnóstico diferencialConsiderar, necessariamente, líquen plano, líquen nítido, sífilis secundária liquenoide, sarcoidose papulosa.
Eritema indurado de Bazin e vasculite nodularErnest Bazin, dermatologista francês, foi o primeiro a descrever, em 1861, essa forma de tubercúlide que recebeu seu nome.7–11,17,47
Eritema indurado de Bazin (EIB) e vasculite nodular (VN) são doenças incluídas na categoria das paniculites lobulares, cujas manifestações clínicas predominam nas pernas. A identificação de DNA de M. tuberculosis por PCR em lesões cutâneas de alguns casos confirma tratar‐se de etiologia tuberculosa. O termo vasculite nodular ou eritema induratum de Whitfield deve ser reservado ao eritema indurado não associado a TB.47,48
EpidemiologiaEIB e VN predominam no sexo feminino, jovens e de meia‐idade; porém, o sexo masculino pode ser acometido, bem como quaisquer etnias. Países com grande incidência de TB apresentam maior prevalência dessas doenças, e a insuficiência venosa é uma associação frequente. É variante muito rara em crianças, embora haja vários relatos de casos na África do Sul e no Paquistão. Há registro de EIB por vacinação com BCG.13,17
PatogêneseEIB associado à TB é observado em populações em que há prevalência da microbacteriose. Em pacientes com quadro clínico de EIB/VN nos quais não se identifica o agente responsável pelas lesões cutâneas por meio de histopatológico e de cultura, torna‐se obrigatório a utilização de PCR e de primers específicos para diagnóstico acurado. Considera‐se que a maioria dos casos de EIB seja uma reação de hipersensibilidade mediada por células tipo IV, tendo em vista que do processo participam linfócitos T, macrófagos e células de Langerhans. Estudos mostraram nesses casos PPD reator forte e alta positividade do teste IGRA para M. tuberculosis.
VN tem sido associada a várias doenças: hepatites B e C, artrite reumatoide, colite ulcerativa, doença de Crohn, leucemia, hipotireoidismo. Alguns medicamentos estão igualmente associados à VN – propiltiouracil e etanercepte.13,16
Manifestações clínicasCaracterizam‐se por nódulos eritematosos, eritemato‐violáceos, dolorosos, isolados ou agrupados formando placa nodular com evolução para úlcera que drena material necrótico ou necropurulento. A localização preferencial das lesões é na face posterior das pernas (panturrilhas), entretanto, outros locais são acometidos: membros superiores, face, regiões glúteas, coxas e pés. A úlcera apresenta bordas nítidas, elevadas, fundo hemorrágico, crosta e base infiltrada. Regressão da lesão com cicatriz e posterior recidiva são observadas na maioria dos casos. PPD reator nos pacientes portadores de foco tuberculoso (fig. 9A).
HistopatologiaRecomenda‐se fazer biópsia incisional a fim de incluir maior parte possível de tecido adiposo para analisar especialmente o comprometimento do lóbulo adiposo presente no material. Biópsias com punch não conseguem obter tecido adiposo suficiente para análise histopatológica mais acurada.
Os achados microscópicos em EIB/VN são de paniculite granulomatosa lobular ou mista septal/lobular, com infiltrado inflamatório composto por linfócitos, histiócitos epitelioides, plasmócitos e células gigantes multinucleadas do tipo Langhans. Outras alterações histológicas presentes incluem adiponecrose, áreas de necrose caseosa e vasculite comprometendo artérias e veias do tecido adiposo. Observa‐se fibrose em lesões de longa evolução. Em geral, BAARs não são demonstrados pelas colorações específicas (fig. 9B).
DiagnósticoCom base nas manifestações clínicas e em exames complementares: PPD positivo, histopatológico e PCR para DNA‐M. tuberculosis (fig. 9C).
Diagnóstico diferencialConsiderar eritema nodoso, paniculite pancreática, lipodermatosclerose (paniculite esclerosante), paniculite por deficiência de alfa‐1 antitripsina, outras vasculites, em especial a poliarterite nodosa cutânea, sarcoidose e síndrome de Sweet subcutânea.
Diagnóstico da tuberculose cutâneaPesquisa direta de M. tuberculosis ou baciloscopia tem por objetivo detectar o micro‐organismo em esfregaços de material biológico corados por técnicas específicas – a técnica de Ziehl‐Neelsen é a mais empregada em laboratórios. Baixa positividade para BK,<10%.
Cultura em meios sólidos como Löwenstein‐Jensen e Ogawa‐Kudoh do material procedente de lesões tem detecção de crescimento entre 14 a 30 dias – porém, pode ser necessário aguardar até oito semanas. Lesões de TBC mostram baixa positividade para a micobactéria (23% dos casos).
A cultura do BK pelo sistema automatizado e não radiométrico BACTEC MGIT960 torna possível a detecção da micobactéria entre 7 a 15 dias. A desvantagem é o elevado custo da técnica, mas a combinação dessa técnica com a de Löwenstein‐Jensen diminui sensivelmente o tempo de isolamento da micobactéria e aumenta a sensibilidade nos casos de lesões cutâneas.
Teste Xpert®MTB/RIF utiliza técnicas moleculares com amplificação de ácidos nucleicos para detectar BK e de cepas resistentes à rifampicina. O teste aumenta a sensibilidade do diagnóstico.
Teste tuberculínico é inoculação intradérmica de 0,1 mL, equivalente a 2 UT (unidade tuberculina) de um derivado proteico purificado do M. tuberculosis (PPD‐RT23, no Brasil) na face anterior do antebraço esquerdo, para avaliar a resposta imune celular do paciente. Leitura 48‐72 e até 96 horas após a aplicação, realizada com régua milimetrada específica para medir o maior diâmetro transverso da enduração. O paciente é considerado infectado pelo BK quando tiver enduração ≥ 5 mm (fig. 9).
Teste de liberação de interferon‐gama (interferon gamma release assay)
O teste IGRA é empregado para identificar pessoas com infecção latente por M. tuberculosis (ILTB); para identificar indivíduos com maior probabilidade de ter ILTB e/ou maior risco de adoecer; para indicar o tratamento correto; para notificação dos doentes que serão tratados de ILTB e monitoramento do tratamento desses pacientes.
Considerar que PPD tem limitações, entre as quais: reação cruzada com MNT e com vacina BCG; resultados falso‐negativos em doentes imunocomprometidos (p. ex., HIV positivo); possibilidade de erro na aferição da enduração do teste; necessidade de duas ou três leituras após 48‐72‐96 horas.
A população‐alvo desse teste é composta por pacientes HIV positivos, pacientes com insuficiência renal submetidos à hemodiálise e pacientes com artrite reumatoide em terapia com imunobiológicos.
Testes disponíveis no Brasil: QuantiFERON‐TB Gold Plus® (QTF‐G) e o T‐SPOT.TB
Os testes PPD e IGRA devem ser empregados simultaneamente para detectar ILTB. Destacar que esses testes não conseguem diferençar ILTB de infecção ativa.
A PCR é uma técnica molecular que consegue obter a amplificação das sequências específicas dos ácidos nucleicos de DNA e RNA. É uma ferramenta importante na genotipagem de patógenos, em infiltrados linfoides atípicos de células T, na pesquisa de translocações de neoplasias malignas, além de outras entidades clínicas.
Na TBC, o material biológico a ser analisado pode ser tecido fresco ou emblocado em parafina. A sensibilidade geral da PCR encontrada em vários estudos de formas clínicas possibilita diagnóstico mais acurado da microbacteriose.
Histopatologia da TBC – ver as descrições pormenorizadas nas formas clínicas.
Tratamento da TBCOs medicamentos antituberculose isoniazida, rifamicina, pirazinamida e etambutol são o tratamento de primeira linha para todos os tipos de TBC, seguindo o regime padrão de recomendação da OMS para o tratamento de novos casos de TB pulmonar.49 A fase intensiva começa e dura dois meses, seguido da fase de manutenção, por quatro meses.
Doses de medicamentos utilizados na fase intensiva para adultos e adolescentes: rifampicina (450 mg/dia para<50 kg de peso corporal e 600 mg/dia para >50 kg de peso corporal); isoniazida (300 mg/dia), pirazinamida (1.500 a 2.000 mg/dia); etambutol (750 mg/dia para<50 kg de peso corporal e 1.000 mg/dia para >50 kg de peso corporal).
Doses para crianças: rifampicina (10 a 20 mg/kg/dia), isoniazida (10 a 15 mg/kg/dia) e pirazinamida (30 a 40 mg/kg/dia).
Doses de medicamentos utilizadas na fase de manutenção: rifampicina (600 mg/dia para adultos e 10 mg/kg/dia para crianças) e isoniazida (600 mg/dia para adultos e 10 mg/kg/dia para crianças).36
Exérese cirúrgica pode ser considerada em lesões refratárias para correção de deformidades em casos recalcitrantes.50
O tratamento das tubercúlides segue os mesmos regimes recomendados para a verdadeira TBC. Para EIB, um período mais longo de tratamento, como a proposta de manutenção de isoniazida por até dois anos.50 Dapsona, iodeto de potássio e doxiciclina foram relatados como adjuvantes para tratar a inflamação em EIB, enquanto os corticosteroides ou proteína da tuberculina em várias diluições para dessensibilização são usados ocasionalmente.50 Tratamento de LV com isoniazida em monoterapia resultou em altas taxas de cura.51
Há estudos que registram eventual reação cutânea paradoxal em pacientes que estão em tratamento regular para TBC, particularmente em anérgicos tratados para TB miliar. Após semanas ou meses do início da poliquimioterapia surgem lesões cutâneas tumefeitas purulentas cuja cultura para M. tuberculosis em geral é positiva, representando fenômeno imunológico (e não resistência bacteriana) que responde bem à continuidade do tratamento.7
Imunobiológicos e tuberculose latenteNos indivíduos imunocompetentes, o sistema de defesa natural do hospedeiro controla a infecção inicial causada por M. tuberculosis. O portador permanece assintomático e desenvolve a TB latente. Entretanto, na presença de doenças ou medicações que conduzam à imunossupressão, como os imunobiológicos, a TB latente pode ser reativada.52,53
Avanços significativos na compreensão da patogênese de doenças imunomediadas tornaram possível o desenvolvimento de novos fármacos, denominados imunobiológicos, os quais revolucionaram a abordagem terapêutica de inúmeras doenças, como a psoríase. Em particular, a introdução dos inibidores do fator de necrose tumoral alfa (anti‐TNFα) constituiu um dos avanços mais revolucionário no tratamento desse grupo de doenças, pois foram o primeiro alvo no tratamento. Além da eficácia observada, uma das grandes vantagens desses agentes é seu perfil de segurança em relação à ausência de toxicidade em órgãos alvo, como a nefro ou hepatotoxicidade, característica dos tratamentos sistémicos convencionais. No entanto, como o bloqueio ocorre na fase inicial da cascata imunológica, essa classe terapêutica leva a supressão imunológica mais ampla e não tão seletiva – portanto, não tem perfil de segurança imunológico tão intenso.54
O TNF‐α é uma citocina que desempenha papel central no estabelecimento e manutenção da resposta inflamatória contra infecções, e é essencial para a formação do granuloma, o que representa uma função de defesa imprescindível contra patógenos intracelulares, como as micobactérias. A terapia anti‐TNF‐α compromete as respostas imunoinflamatórias fisiológicas mediadas pelo TNF‐α e pode alterar a formação e a manutenção de granulomas, levando a reativação ou disseminação da TB.55
Em pacientes que recebem tratamento com anti‐TNF‐α, o risco relativo de infecção por TB varia de 1,5 a 17%, e é maior com terapia com anticorpo monoclonal anti‐TNF‐α (adalimumabe e infliximabe) do que com terapia com receptor de TNF‐α solúvel (etanercepte).56,57
Na tentativa de buscar melhor o alvo específico a ser bloqueado no tratamento das doenças autoimunes, surgiram os imunobiológicos anti‐interleucinas, mais seletivos e, portanto, com perfil de segurança bem maior. É possível que o bloqueio das anti‐IL não carregue o mesmo risco de reativação de TB que os inibidores de TNF‐α.58 As citocinas relacionadas a Th17 parecem contribuir para a proteção imunológica contra a infecção primária pelo M. tuberculosis, e seus níveis de expressão diminuem em pacientes com TB.58
Apesar do efeito das IL‐17 e IL‐23 no mecanismo de defesa contra a infecção por M. tuberculosis, os dados de segurança disponíveis sobre os imunobiológicos anti‐IL‐17 e anti‐IL‐23 demonstram que esse efeito pode ser menor que o esperado, e isso pode constituir uma vantagem desse grupo de imunobiológicos em relação aos anti‐TNF e anti‐IL‐12/23. No entanto, novos estudos sobre a segurança dos imunobiológicos anti‐interleucinas são necessários para maior elucidação sobre o assunto.59
Diretrizes internacionais recomendam cuidadosa investigação para TB antes do tratamento com medicamentos imunobiológicos.58 A investigação deve ser feita com o emprego simultâneo do PPD e IGRA e radiografia de tórax (PA e perfil), realizados periodicamente.59
Embora PPD seja um teste para avaliar a exposição do indivíduo à TB, nos pacientes com psoríase há possibilidade de resultado falso‐positivo decorrente de patergia. Resposta diminuída ao PPD ocorre na vigência de tratamento com metotrexato, o que dificulta a interpretação do resultado.60
No Brasil, dois esquemas terapêuticos para o tratamento da TB latente são recomendados: um com isoniazida 300 mg/dia por nove meses, e outro com rifampicina 600 mg/dia por quatro meses.58
Os membros da Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (CONITEC), na 86ª reunião (5 de março de 2020) deliberaram que “a matéria fosse disponibilizada em consulta pública com recomendação preliminar favorável à incorporação no SUS da rifapentina (Priftin®), a ser utilizada em conjunto com isoniazida no esquema 3HP, para tratamento de indivíduos com infecção latente pelo Mycobacterium Tuberculosis (ILTB)”.61
Suporte financeiroNenhum.
Contribuição dos autoresArival Cardoso de Brito: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Clivia Maria Moraes de Oliveira: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Deborah Aben‐Athar Unger: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Maraya de Jesus Semblano Bittencourt: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Brito AC, Oliveira CM, Unger DAA, Bittencourt MJ. Cutaneous tuberculosis: epidemiological, clinical, diagnostic and therapeutic update. An Bras Dermatol. 2022;97:129–44.
Trabalho realizado no Serviço de Dermatologia, Universidade Federal do Pará, Belém, PA, Brasil.