O câncer de pele não melanoma é o tipo mais comum de neoplasia maligna no mundo ocidental, e tem como abordagem preferencial a excisão cirúrgica. A conduta adotada frente a excisões incompletas de carcinoma basocelular ainda é controversa.
ObjetivosComparar o número de recidiva tumoral após terapêutica adotada frente ao carcinoma basocelular excisado incompletamente.
MétodosSeleção e análise estatística de prontuários de pacientes que tiveram margens comprometidas após exérese de carcinoma basocelular em hospital terciário no período de 2008 a 2013.
ResultadosForam analisados 120 prontuários. A média de idade dos participantes foi de 69,6 anos; o estudo contou com 60 indivíduos (50%) de cada sexo. O tipo histológico mais prevalente foi o nodular, com média de tamanho de 1,1cm; a localização tumoral de maior incidência foi o nariz. A margem lateral foi a mais frequentemente positiva. O seguimento clínico foi o mais adotado – apenas 40 pacientes foram reabordados cirurgicamente. Houve um total de 34 (28,3%) pacientes com recidiva tumoral; apenas a localização malar influenciou significativamente a incidência de recidiva (p=0,02). O tempo médio de seguimento foi de 29,54 meses, sem diferença significativa entre os seguimentos, embora 32,9% dos pacientes seguidos clinicamente demonstrassem recidiva, contra apenas 20% dos reabordados cirurgicamente.
Limitações do estudo: Tempo de seguimento médio inferior a cinco anos e tamanho da amostra.
ConclusõesA presença de margens comprometidas não implica, necessariamente, em recidiva. Localização, tamanho tumoral, subtipo histológico, tumores epiteliais prévios e condições clínicas do paciente devem ser considerados na escolha da melhor opção de tratamento.
O câncer de pele é a neoplasia maligna mais comum na população ocidental. No Brasil, corresponde a cerca de 30% de todos os tumores malignos registrados.1–3 Dados para o câncer de pele não melanoma (CPNM) fornecidos pelo Instituto Nacional de Câncer (INCA) estimam incidência de 176.930 novos casos em 2020, dos quais 83.770 em homens e 93.160 em mulheres, e de mortalidade de 1,1%.2 O carcinoma basocelular (CBC) corresponde a cerca de 75% dos CPNM, seguido do carcinoma espinocelular (CEC).4–6 O CBC é um tumor maligno de células germinativas foliculares, que acomete principalmente indivíduos a partir da sexta década de vida com histórico de exposição solar crônica. Localiza‐se mais frequentemente na cabeça e no pescoço, seguido de tronco, extremidades e genital.4,7,8 Apresenta crescimento lento, podendo levar à destruição tecidual por seu comportamento localmente agressivo, e baixo potencial metastático, de 0,0028% a 0,55%.9,10 Embora a mortalidade seja baixa, apresenta alta morbidade, e é considerado um dos tratamentos mais onerosos de todos os cânceres avaliados no sistema Medicare nos Estados Unidos.11
A radiação ultravioleta (UV) é aceita como a maior causa de CBC.12 O risco de desenvolver um CBC aumenta com a exposição solar recreacional durante a infância e a adolescência, além da exposição à radiação UV intermitente e intensa (queimaduras solares).13 Outros fatores de risco incluem sexo masculino, pele tipo I e II de acordo com a escala de Fitzpatrick, histórico pessoal de CBC, exposição crônica ao arsênico, exposição à radiação ionizante, imunossupressão duradoura e síndromes genéticas (síndrome do CBC, xeroderma pigmentoso) e histórico familiar. Cicatrizes e ulcerações crônicas são importantes para o desenvolvimento de CBCs em áreas não expostas a raios UV.14
O diagnóstico de CBC é feito por exame clínico, dermatoscopia e exame histopatológico.15 O exame clínico demonstra as características já descritas, como brilho perláceo e presença de telangiectasias, juntamente com crescimento lento, principalmente em locais expostos ao sol e especialmente em indivíduos de pele clara. A dermatocospia identifica as estruturas descritas para o CBC, como vasos arboriformes, telangiectasias finas e curtas, estruturas em raio de roda e folha de bordo, além de glóbulos azul‐acinzentados e ninhos ovoides.16,17 Por fim, o exame histopatológico é essencial para a confirmação diagnóstica e estimativa do risco de recidiva.18
A nomenclatura das apresentações morfológicas do CBC varia conforme cada autor. Basicamente, os seguintes subtipos podem ser distinguidos com base em sua aparência clínica e histológica: CBC nodular, CBC superficial e CBC esclerodermiforme.19 O subtipo nodular é responsável por 50%‐80% de todos os casos de CBC.20 Os subtipos histológicos micronodular, infiltrativo, esclerodermiforme e basoescamoso estão associados a um comportamento mais agressivo, como maiores taxas de recorrência e maior invasão da derme.21
As opções de tratamento para o CBC incluem excisão cirúrgica convencional, cirurgia micrográfica de Mohs, curetagem com ou sem eletrodissecação, criocirurgia, terapia fotodinâmica, radioterapia e terapia medicamentosa com agentes tópicos, orais ou injeções intralesionais.15,22 As opções de tratamento são ditadas pelo tamanho do tumor, localização, subtipo histológico, adesão ao tratamento pelo paciente, comorbidades médicas e resultado cosmético.22
A excisão cirúrgica convencional é o tratamento de escolha para a maioria dos CBCs, e é a terapêutica mais utilizada. Embora para o CBC de baixo risco existam tratamentos diversos, como a terapêutica tópica com imiquimode, a cirurgia também é considerada o padrão‐ouro.18,23 Para tanto, padroniza‐se uma margem peritumoral de pelo menos 4mm de pele clinicamente normal para excisão cirúrgica convencional dos CBCs, a fim de diminuir excisões incompletas.22,23 Para localizações anatômicas nobres, como áreas da face, essa margem pode ser considerada grande, e pode ser diminuída e avaliada durante o intraoperatório pela técnica de Mohs.18 O CBC de alto risco é associado a maior incidência de recidiva local, extensão tumoral subclínica, excisão incompleta e comportamento agressivo.17
Diante de pacientes que obtiveram excisões incompletas de CBC, parte dos autores opta pela reabordagem cirúrgica, enquanto outra parte prefere o seguimento clínico. A abordagem de um tumor com margens comprometidas torna‐se um desafio. Desse modo, estudos que avaliem a evolução da conduta adotada e o prognóstico são de extrema importância, já que podem reduzir a morbidade.
O presente estudo teve como objetivo analisar os casos de CBCs operados em hospital terciário entre 2008 e 2013 que tiveram suas margens comprometidas, identificando o tipo de conduta adotada (seguimento clínico ou reabordagem cirúrgica), a fim de se comparar os resultados obtidos, bem como todos os fatores que possivelmente estariam associados a esses resultados.
MétodosCaracterização e coleta de dadosForam separados para análise os prontuários dos pacientes que obtiveram CBCs excisados incompletamente no período de 2008 a 2013 por meio do programa PathoControl®. As palavras‐chave para busca, além de “basocelular”, foram: “exígua”, “delgada”, “estreita”, “acostada” e “comprometida”, tanto no plural quanto no singular e em letras maiúsculas e minúsculas.
Foram excluídos os prontuários de pacientes que vieram a óbito, dos menores de 18 anos, daqueles operados por outras especialidades que não a dermatologia ou que apresentavam dados incompletos. Os prontuários de pacientes que realizaram apenas biópsia, exérese parcial, seguimento mínimo de menos de três meses ou que obtiveram margens livres de tumor também foram excluídos. Assim, foi analisado um total de 120 prontuários.
As variáveis estudadas incluíram: idade, sexo, localização do tumor, subtipo histológico, tamanho do tumor, tipo de margem comprometida (lateral, profunda e ambas), tipo de seguimento (clínico ou cirúrgico), tipo de reabordagem cirúrgica (convencional ou Mohs), presença ou ausência de tumor residual na reabordagem cirúrgica, ocorrência de recidiva e tempo de seguimento.
Este trabalho foi aprovado no Comitê de ética em pesquisa (CEP) com numero de parecer: 3.515.060.
Análise dos prontuáriosAs variáveis foram analisadas descritivamente, comparando‐se frequências absoluta e percentual, e estatisticamente, comparando‐se a relação entre essas variáveis e a recidiva tumoral. Uma terceira análise levou em consideração o tempo de seguimento dos pacientes, possibilitando estabelecer as relações de tempo livre de doença.
A análise descritiva foi realizada com apresentação de tabelas de frequências para variáveis categóricas e medidas de posição e dispersão para variáveis numéricas. Para a comparação de variáveis numéricas entre os dois grupos, foi utilizado o teste de Mann‐Whitney; para comparação de proporções, considerou‐se o teste Qui‐Quadrado ou o teste exato de Fisher, quando necessário.
Na análise estatística, os valores de p foram obtidos por meio dos testes de Fisher (para grupos com n ≤ 5) e Qui‐Quadrado, todos bicaudados. O tempo livre de recidiva foi analisado por curvas de sobrevivência de Kaplan‐Meier, e os grupos foram comparados utilizando o teste de log‐rank. Todas as análises consideraram um nível de significância estatística dentro de um intervalo de confiança p <0,05. Foi utilizado o programa The SAS System for Windows (Statistical Analysis System – versão 9.4. SAS Institute Inc, 2002–2008, Cary, NC, USA).
ResultadosNo total, foram analisados os prontuários de 120 pacientes, com média de idade de 69,6 anos e mediana de 71,5 anos, variando de 31 a 100 anos. Foram 60 pacientes do sexo masculino (50%) e 60 do sexo feminino (50%).
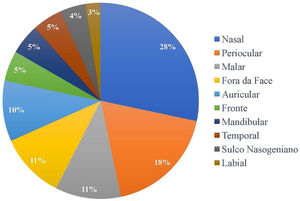
Em relação à localização das lesões, a maior incidência de tumor foi na área nasal, em 34 pacientes (28,33%), seguida de periocular, com 22 pacientes (18,3%) acometidos, e malar, com 13 pacientes (10,8%). Apenas 13 dos 120 pacientes (10,8%) tiveram tumor fora da face, conforme apresentado na figura 1. Quanto à cor dos pacientes analisados, apenas um paciente era pardo (0,8%), e 119 eram brancos (99,2%).
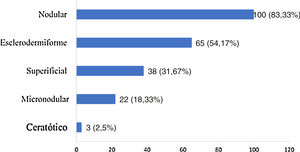
Os tipos histológicos encontrados se sobrepuseram, com um mesmo tumor apresentando diferentes padrões histológicos, totalizando 228 ocorrências. Esses foram agrupados em nodular, superficial, esclerodermiforme, micronodular e ceratótico. Os quatro principais padrões encontrados foram: nodular (83,33% dos tumores), esclerodermiforme (54,17%), superficial (31,67%) e micronodular (18,33%), conforme apresentado na figura 2, em valores absolutos e percentuais.
A média do tamanho do tumor foi de 1,1cm, e a mediana foi de 0,8cm; o menor media 0,3cm e o maior, 5,2cm. O número total de pacientes com descrição do tamanho tumoral no prontuário foi de apenas 50.
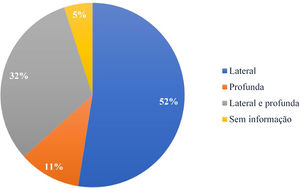
Com relação a comprometimento de margem, a lateral teve maior incidência, com 63 excisões (52,5%), seguida de margem profunda, em 13 (10,8%), e as que tiveram comprometimento de ambas (profunda e lateral), em 38 pacientes (31,7%). A especificação da margem comprometida estava presente em 114 dos 120 laudos anatomopatológicos, conforme apresentado na figura 3.
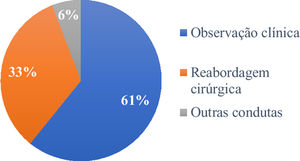
Dos 120 pacientes, 73 (60,8%) tiveram seguimento clínico das margens comprometidas, enquanto 40 (33,3%) foram reabordados cirurgicamente. Os outros sete tiveram tratamentos não cirúrgicos: quatro foram submetidos à radioterapia, dois à criocirurgia e um foi tratado com imiquimode tópico (fig. 4).
Dos 40 pacientes submetidos à reabordagem cirúrgica, em 30 (75%) optou‐se por cirurgia convencional, enquanto 10 (25%) foram submetidos à cirurgia micrográfica de Mohs. Dentre as 40 reabordagens, 23 (57,5%) apresentaram tumor residual, contra 17 (42,5%) sem tumor residual.
Foram comparadas as frequências de ocorrência de recidiva, considerando como variáveis independentes: idade, sexo, localização, tamanho do tumor, tipo de margem acometida, tipo de seguimento (observação ou reabordagem), tipo de reabordagem cirúrgica (convencional ou Mohs) e presença ou não de tumor residual. Não foram comparadas as frequências para cada padrão histológico devido à sobreposição de diferentes subtipos num mesmo tumor. A relação de associação dos fatores tumorais está exposta na tabela 1.
Associação dos fatores com recidiva tumoral
| Recidiva | Total | % Recidiva | p | ||
|---|---|---|---|---|---|
| Sim | Não | ||||
| Idadea(anos) | |||||
| Média±DP | 67,6±13,6 | 70,4±13,6 | 69,6±13,6 | N/A | 0,4540a |
| Mediana (mín–máx) | 71,5 (31,0–85,0) | 71,5 (37,0–100,0) | 71,5 (31,9–100,0) | N/A | |
| Total | 34 | 86 | 120 | ||
| Sexo | |||||
| Masculino | 15 | 45 | 60 | 25 | 0,4178b |
| Feminino | 19 | 41 | 60 | 31,7 | |
| Total | 120 | ||||
| Localização | |||||
| Nasal | 11 | 23 | 34 | 34,3 | 0,5389b |
| Periocular | 6 | 16 | 22 | 27,3 | 0,9028b |
| Malar | 0 | 13 | 13 | 0 | 0,0186c,d |
| Auricular e periauricular | 2 | 10 | 12 | 16,7 | 0,7264c |
| Fronte | 4 | 2 | 6 | 66,67 | 0,0533c |
| Mandibular | 3 | 3 | 6 | 50 | 0,3497c |
| Temporal | 1 | 4 | 5 | 20 | 0,5139c |
| Sulco nasogeniano | 2 | 4 | 6 | 33,3 | 0,5211c |
| Labial | 1 | 2 | 3 | 33,3 | 1,0000c |
| Fora da face | 4 | 9 | 13 | 30,8 | 0,8562c |
| Total | 34 | 86 | 120 | ||
| Tamanhob(cm) | |||||
| Média±DP | 1,5±1,4 | 1,0±0,6 | 1,1±0,9 | N/A | 0,1932a |
| Mediana (mín–máx) | 0,9 (0,3–5,2) | 0,8 (0,3–2,5) | 0,8 (0,3–5,2) | N/A | |
| Total | 14 | 36 | 50 | ||
| Margem comprometida | |||||
| Lateral | 18 | 45 | 63 | 28,6 | 0,4453b |
| Profunda | 5 | 8 | 13 | 38,5 | |
| Lateral e profunda | 8 | 30 | 38 | 21 | |
| Sem informação | 3 | 3 | 6 | 50 | |
| Total | 120 | ||||
| Tipo de seguimento | |||||
| Observação | 24 | 49 | 73 | 32,9 | 0,3481b |
| Reabordagem | 8 | 32 | 40 | 20 | |
| Outras condutas | 2 | 5 | 7 | 28,6 | |
| Total | 120 | ||||
| Tipo de reabordagem | |||||
| Convencional | 6 | 24 | 30 | 20 | 1,0000c |
| Mohs | 2 | 8 | 10 | 20 | |
| Total | 40 | ||||
| Tumor residual | |||||
| Com tumor residual | 5 | 18 | 23 | 21,7 | 1,0000c |
| Sem tumor residual | 3 | 14 | 17 | 17,6 | |
| Total | 40 | ||||
| Total | 34 | 86 | 120 | 28,3 | N/A |
N/A, não se aplica.
Os valores de p foram obtidos
A média de idade entre os pacientes que não apresentaram recidiva foi de 70,4 anos, e a mediana de 71,5 anos (variando de 37 a 100). Já a média entre os que apresentaram recidiva foi de 67,6 anos, e a mediana de 71,5 anos (variando de 31 a 85). Não houve diferença significativamente estatística entre os grupos comparados.
O sexo feminino apresentou maior número de recidivas (55,9%) que o masculino (44,1%), e não foi considerado significantemente estatístico. O paciente pardo não apresentou recidiva, e não foi possível calcular o valor do p.
Do total de 120 casos de excisões incompletas de CBCs, 86 não demonstraram recidiva, contra 34 casos de recidiva. Em relação à localização do tumor, a região malar não apresentou casos de recidiva e foi considerada significantemente estatística (p <0,05), porém as demais regiões não foram significantemente estatísticas. A região auricular ou periauricular não apresentou recidiva em 10 casos (11,6%), e contou com dois casos (5,9%) de recidiva. A região periocular não demonstrou recidiva em 16 casos (18,6%), e recidivou em seis casos (17,6%). A fronte não demonstrou recidiva em dois casos (2,3%) e recidivou em quatro (11,8%). A região mandibular apresentou três casos (8,8%) de recidiva e três casos com ausência de recidiva (3,5%). A região temporal apresentou apenas um caso de recidiva (2,9%), e nos outros cinco casos (5,8%) permaneceu sem recidiva. O sulco nasogeniano não demonstrou recidiva em três casos (3,5%) e recidivou em dois casos (5,9%). Dos três casos da região labial, dois não recidivaram (2,3%), enquanto um (2,9%) recidivou. Fora da face houve quatro casos (11,7%) de recidivas e nove (10,5%) não recidivaram; a região nasal conta com o maior número de recidivas, num total de 11 (32,4%), e 23 casos (26,7%) sem recidivas.
Como estudos afirmam que a agressividade do CBC está relacionada a maiores diâmetros da lesão e extensão subclínica, este estudo optou por utilizar os escassos dados registrados do tamanho médio da lesão (n=50). Entre os pacientes que não obtiveram recidiva, o tamanho médio da lesão foi de 1,0cm e a mediana de 0,8cm (0,3‐2,5). Entre os que apresentaram recidiva, o tamanho médio foi de 1,5cm e a mediana de 0,9cm (0,3‐5,2); entretanto, também não houve diferença estatisticamente significativa entre os grupos.
Não foi encontrada diferença na recidiva em relação ao tipo de margem acometida: lateral, profunda ou ambas. Sobre o tipo de seguimento, apesar da proporção aparentemente maior de recidivas nos pacientes que fizeram seguimento clínico em relação aos que foram reabordados cirurgicamente (32,9% vs. 20%, respectivamente), não houve diferença estatisticamente significativa entre as duas condutas. Também não houve diferença entre os tipos de cirurgia de reabordagem (convencional ou Mohs) ou a presença ou não de tumor residual.
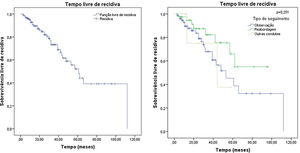
Do total de 120 pacientes, 34 recidivaram e 86 permaneceram livres de tumor, o que significa uma taxa final de recorrência do tumor de 28,3%. O tempo médio de seguimento foi de 29,54 meses, com um desvio padrão de 23,07 meses. A mediana foi de 25 meses, variando de 3 a 112 meses, o que mostra que metade dos pacientes teve um seguimento superior a dois anos. Não houve diferença significativa (p=0,251) no tempo livre de recidiva entre os pacientes que foram observados (seguimento clínico), reabordados (seguimento cirúrgico) ou submetidos a outras condutas. A análise de sobrevivência de Kaplan‐Meier para recidiva é apresentada na figura 5.
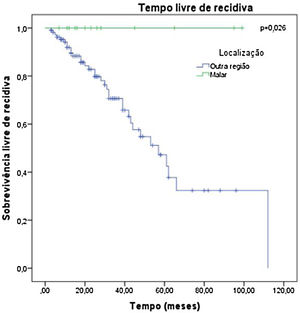
Os fatores estudados foram relacionados ao tempo que cada paciente permaneceu livre de recidiva tumoral, e não houve diferença estatisticamente significativa no tempo livre de doença em relação a nenhum dos fatores estudados, exceto a localização: pacientes com tumor malar, p=0,026 (fig. 6).
DiscussãoA média das idades dos pacientes que apresentaram margem comprometida foi compatível com os achados de outros trabalhos.18,24 Os dados demonstram que, em geral, as lesões se apresentam inicialmente após a sexta década de vida, apesar de ocorrer casos diagnosticados antes dos 30 anos. Porém, casos com margem comprometida tendem a ter uma idade média de ocorrência superior, variando de 66 a 74 anos, conforme os achados na literatura.18,21,25–28 Estudos observaram diferença estatisticamente significativa entre a idade média do grupo de pacientes que apresentou excisão completa e o grupo de pacientes com excisão incompleta; o segundo grupo era o de idade mais elevada.25,28
Neste estudo não foi observada diferença estatisticamente significativa na idade de apresentação entre homens e mulheres, e excisões incompletas não ocorreram preferencialmente em um determinado sexo. No entanto, outro estudo apontou que as mulheres podem apresentar mais margens comprometidas que os homens por terem cirurgias mais conservadoras, a fim de garantir melhor resultado estético.29
A maioria das lesões observadas neste estudo foi inferior a 2cm, denotando a demanda dos pacientes por atendimentos com o diagnóstico correto e precoce dos médicos, como observado em outros trabalhos.25,27 Apesar da controversa influência do tamanho do tumor nas taxas de recidiva, dados da literatura demonstram que existe uma grande variação na extensão subclínica em termos de diâmetro do tumor.22,23 Outro aspecto importante que pode ser definido a partir do tamanho da lesão é a margem cirúrgica. Estudos apontam que uma margem de 4mm parece ser adequada para erradicar lesões primárias de CBC menores que 2cm de diâmetro.30
A região nasal é a que mais frequentemente apresentou margens comprometidas (28%), seguida da periocular (18%). Autores citam uma taxa de margem positiva que varia de 14% a 40% na região nasal e de 11% a 85% na região periocular.18,21,27,30,31 A razão para o maior número de CBCs excisados incompletamente nessas regiões pode ser resultado de margens inadequadas para melhor resultado estético nesses locais.25
Em relação à histologia, constatou‐se a sobreposição de diferentes subtipos histológicos. O tipo nodular foi o de maior incidência (83,33%), seguido pelos tipos esclerodermiforme (54,17%), superficial (31,67%), micronodular (18,33%) e ceratótico (2,5%). Tal achado é concordante com a literatura, em que o CBC nodular é a variante clínica mais comumente relatada, com incidência superior a 85%.18,32–35 Não houve diferença significativamente estatística entre o subtipo histológico e a recidiva, embora a maioria das referências enfatize que tumores com subtipo histológico mais agressivo estejam associados a maior incidência de recidiva.36
Na maioria dos estudos, a margem lateral foi a mais comprometida, similar ao encontrado neste trabalho.18,21,27,30,31 Tal fato poderia ser explicado pela extensão subclínica das lesões, cirurgias em áreas com restrições anatômicas e pela tendência natural do cirurgião em preservar o tecido mais lateralmente que profundamente.21,31,37
No período considerado por este estudo, a conduta preferencialmente adotada foi o seguimento clínico (60,8%) em detrimento da reabordagem cirúrgica (33,3%) e de “outras condutas” (5,8%). Alguns autores defendem a reabordagem cirúrgica na maioria dos casos de margem positiva, enquanto outros sugerem reexcisão para apenas casos recorrentes e subtipos agressivos.27,37 Outra vertente defende uma abordagem conservadora, especialmente em pacientes com múltiplas comorbidades.28
A adoção de seguimento expectante pode ser aceitável em alguns casos de margens cirúrgicas positivas, como após a excisão de CBC em localizações de baixo risco (tronco, extremidades, couro cabeludo e malar), para tipos histológicos de menor agressividade, em pacientes com idade avançada ou comorbidades.28,30,38 Entretanto, a excisão incompleta de CBC, sobretudo na face, pode resultar em maior morbidade se o seguimento adotado for o expectante, pois a recorrência pode exigir fechamentos mais extensos.39 Deve‐se considerar também que a excisão incompleta implica em aumento da demanda nos serviços de assistência especializada e dos custos de um segundo procedimento, em geral de maior complexidade.25,26,40
Nos pacientes em que a reabordagem cirúrgica foi o seguimento adotado, observou‐se presença de tumor residual em 57,5% das reexcisões. Tal incidência apresenta‐se concordante com a literatura, e é comparável à de obtidos por Masud et al., de 62,9%.31
A taxa recidiva total encontrada após excisão tumoral incompleta foi de 28,3%. A maioria dos estudos relatou valores superiores, variando de 38% a 46%.21,41–43 Entretanto, outros autores observaram uma taxa de recidiva de 25%, atribuindo essa ocorrência ao tempo de seguimento inferior aos demais estudos.44 Um estudo observou que 82% das recidivas ocorreram nos primeiros cinco anos, e apenas cerca de 30% dos casos foram diagnosticados no primeiro ano de observação.38 Estima‐se ainda que a excisão de CBC sem controle de margem podem resultar em uma taxa de recorrência em cinco anos de 3,2%‐10,0% para CBC primário e 12,1%‐17% para CBC recorrente.37,43–45
Diante disto, uma limitação do nosso estudo pode ser a duração do período de seguimento (mediana de dois anos). O acompanhamento recomendado a um paciente para observação de recidiva é de cinco anos – a cada três meses durante o primeiro ano, e depois a cada seis meses.46
A média de idade dentre os 34 pacientes que apresentaram recidiva tumoral foi de 67,6 anos, enquanto a dos 86 pacientes que não demonstraram recidiva foi de 70,4, não apresentando diferença estatisticamente significativa. Também não houve diferença de idade entre os grupos observação, reabordagem e outras condutas, em contraste com os achados na literatura, que encontraram maior idade média no grupo de pacientes submetidos a nova cirurgia.25 Fatores como sexo, variáveis inerentes ao tumor ou à técnica cirúrgica não se associaram significativamente à maior recidiva do tumor.
Em geral, padroniza‐se uma margem peritumoral de pelo menos 4mm de pele clinicamente normal para excisão cirúrgica convencional dos CBCs, a fim de diminuir excisões tumorais incompletas.39,41 Porém, as taxas de cura podem declinar no manuseio de tumores de maiores dimensões (> 2cm), subtipos histológicos agressivos e tumores em localizações específicas.13 Quase todas as recidivas em nosso estudo, aproximadamente 83%, ocorreram em áreas nobres, nas quais a margem periférica pode ter sido menor.
Em relação à localização tumoral, a maioria dos CBCs com margens comprometidas está localizada na cabeça e pescoço; as regiões nasal e periocular são os locais onde tumores recorrentes são mais frequentemente localizados, seguidos pela região periauricular.18,25,37 Em concordância com a literatura, observamos que a maior taxa de recidiva foi nas regiões nasal (32,4%), periocular (17,6%) e periauricular (11,6%). Uma metanálise publicada sobre esse assunto encontrou risco relativo de margens positivas 2,24 maior de CBCs na região nasal e periauricular do que no restante do corpo.47 Essa ocorrência poderia ser justificada por essas regiões serem cosmeticamente nobres, o que prejudicaria a escolha da margem adequada.3
As regiões de maior incidência de recidiva não apresentaram associação significativa. O único fator que mostrou associação significativa com menor chance de recidiva foi a localização malar, que não apresentou casos de recidiva (p <0,05).
Em relação à conduta adotada frente às margens comprometidas, principal objetivo deste trabalho, encontrou‐se um total de 32,9% de recidiva em pacientes observados clinicamente, 28,6% dos que foram submetidos a outras condutas contra 20% nos que foram reabordados cirurgicamente, o que poderia sugerir maior sucesso da reabordagem cirúrgica em detrimento de outros seguimentos, quando desconsiderando‐se o tempo de seguimento. Todavia, o valor de p de 0,14 não nos permite afirmar que exista diferença estatisticamente significativa.
Tumores grandes (> 0,8cm) e margens apenas profundas (38,5%) apresentaram mais casos de recidiva, porém sem significância estatística. Um estudo pioneiro realizado por Wetzel et al.36 indica que os CBCs de qualquer subtipo com características histológicas agressivas têm maior profundidade de invasão, estatisticamente significativa, em comparação com os CBCs não agressivos, fator que pode justificar a incidência de recidiva dos pacientes com margem comprometida profunda. Segundo esses autores, a profundidade mediana da invasão de todos os CBCs, independentemente de outras características histológicas e subtipo, foi de 0,79mm, variando de 0,10 a 5,49mm.
Relacionando‐se esses achados, pode‐se justificar a elevada taxa de recidiva quando o tipo de seguimento adotado foi “outras condutas”. Em qualquer terapia tópica, a penetração adequada de um medicamento ao seu alvo pode ser uma preocupação com agentes como o imiquimode e para determinação da dose prescrita da radioterapia.48
Foram observadas também maiores proporções de recidivas da reabordagem convencional em relação à técnica de Mohs. Todas essas características que apresentaram um sugestivo maior risco foram coerentes com os estudos existentes sobre recidiva de CBC.21,41–43 Entretanto, afirmamos que o maior risco é apenas sugestivo porque, embora muitas dessas características sejam comprovadas em outras referências como estando associadas a maiores taxas de recidiva, neste trabalho as análises estatísticas não demonstraram significância – não se pode, portanto, considerar um maior risco real.
Estes resultados foram considerados quanto ao grau de especialidade do cirurgião; foram selecionados apenas prontuários de pacientes excisados cirurgicamente por dermatologistas. Essa diferenciação é bastante comum em outros estudos clínicos em que a intervenção cirúrgica é considerada. Ramdas et al.40 concluíram que os CBCs foram mais frequentemente excisados com margens livres por dermatologistas (93%) do que por cirurgiões plásticos (83%) e cirurgiões gerais (70%).
Se o tipo de seguimento optado para o paciente com margem positiva for a observação clínica, é necessário educar o paciente sobre as possibilidades de profilaxia ativa contra o CBC, principalmente em relação à proteção solar. Além disso, também é necessário informar o paciente sobre a necessidade de autoexame da pele. É de especial importância não apenas pelo monitoramento da recidiva, mas também pelo risco de desenvolvimento de outro CBC, que é 10 vezes maior em pacientes com CBC anterior do que na população em geral.45 Esse risco também é significativamente maior em pacientes idosos, naqueles com múltiplos CBCs e com lesão de diâmetro> 1cm.49
Este estudo, em consonância com algoritmos mundiais, reitera a qualidade do atendimento e do tratamento oferecidos a pacientes portadores de CBC em hospital terciário.
ConclusãoA presença de margens positivas no estudo histológico do tumor não implica necessariamente recidiva. Contudo, uma abordagem individualizada é indicada em tais casos. Fatores diversos devem ser considerados, particularmente localização tumoral, presença de múltiplos tumores e características histológicas, antes de selecionar a melhor opção de tratamento.
Com relação à conduta adotada frente às margens comprometidas, encontrou‐se 32,9% de recidiva em pacientes observados clinicamente contra 20% nos que foram reabordados cirurgicamente. Considerando‐se a localização, o presente estudo evidenciou associação significativa com menor chance de recidiva e também com maior tempo até sua ocorrência na região malar.
Os dados observados oferecem novos elementos para o manejo adequado de pacientes que apresentem margem comprometida após excisão cirúrgica.
Suporte financeiroNenhum.
Contribuição dos autoresMaria Carolina Fidelis: Elaboração e redação do manuscrito.
Rafael Fantelli Stelini: Obtenção, análise e interpretação dos dados.
Leonardo Piropo Staffa: Obtenção, análise e interpretação dos dados.
Aparecida Machado de Moraes: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Renata Ferreira Magalhães: Participação efetiva na orientação da pesquisa.
Conflito de interessesNenhum.
Como citar este artigo: Fidelis MC, Stelini RF, Staffa LP, Moraes AM, Magalhães RF. Basal cell carcinoma with compromised margins: retrospective study of management, evolution, and prognosis. An Bras Dermatol. 2021;96:17–26
Trabalho realizado no Departamento de Dermatologia, Hospital das Clínicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.