Dados sobre nível sérico de vitamina D em pacientes com vitiligo são ambíguos quando comparado aos controles. Foram conduzidas uma revisão sistemática e uma metanálise atualizada para avaliar a associação entre vitamina D e vitiligo.
MétodosEstudos relevantes foram identificados por meio de pesquisa na PubMed e outras bases de dados. O modelo de efeitos aleatórios foi usado para obter as diferenças médias padronizadas e coeficientes de correlação agrupados. Metarregressão e análises de subgrupos foram realizadas para explorar a heterogeneidade. A presença de viés de publicação e a robustez do estudo foram testados utilizando o gráfico de funil e análises de sensibilidade, respectivamente.
ResultadosAo final, esta metanálise incluiu 31 estudos. Em comparação com os controles, os pacientes com vitiligo apresentaram níveis circulatórios de vitamina D significativamente diminuídos (diferença média padronizada=−1,03; p <0,0001). A análise de subgrupo mostrou que pacientes com vitiligo com trabalho interno/urbano apresentaram um nível de vitamina D significativamente mais baixo quando comparados a seu homólogo trabalho externo/rural (diferença média padronizada=−0,45; p=0,03). A análise de sensibilidade indicou que nenhum estudo individual teve influência significativa no resultado geral, sugerindo a robustez desta metanálise.
Limitações do estudoTamanhos variados de amostras e populações de estudo heterogêneas de diferentes países são as limitações deste estudo. Entretanto, a heterogeneidade entre os estudos foi abordada pelo modelo de efeitos aleatórios com metarregressão e análises de sensibilidade.
ConclusõesEsta metanálise mostrou diminuição significativa do nível de vitamina D no vitiligo e sua associação com o tipo de trabalho interno/externo de pacientes com vitiligo. Este estudo enfatiza a necessidade de avaliar o nível da vitamina D para melhorá‐lo no vitiligo.
A vitamina D (Vit‐D) tem uma importância fundamental no organismo, desde a estrutura óssea até a função cerebral, e também é vital para a pele saudável.1 Além disso, desempenha um papel de destaque no sistema imunológico. Sabe‐se que a hipovitaminose D está associada a distúrbios do metabolismo do cálcio e dos carboidratos, câncer, doenças cardiovasculares e várias doenças autoimunes.2 O vitiligo é uma doença cutânea conhecida por ter etiologia metabólica, citotóxica, inflamatória e autoimune, entre vários outros fatores.3,4 Foi relatado que a forma ativa da Vit‐D, 1,25‐di‐hidroxivitamina D3 (1,25[OH]D) está associada à patogênese do vitiligo.1–3 Quando a epiderme é afetada no vitiligo, podem ser evidenciadas alterações nos níveis circulatórios de Vit‐D.2–4
Os estudos disponíveis na literatura são inconsistentes quanto aos níveis de Vit‐D, e a hipovitaminose D ainda é controversa no vitiligo.5–34 Nesta revisão sistemática atualizada e metanálise sobre vitiligo e os níveis de Vit‐D (Estudo ViViD), os níveis circulatórios de Vit‐D e sua associação com variáveis como idade, duração da doença, área de superfície corporal (ASC) afetada e o Vitiligo Activity and Severity Index (VASI) foram estudados em pacientes com vitiligo em comparação com controles. Uma metanálise de subgrupo foi conduzida para estudar os níveis de Vit‐D em relação a sexo, fototipo, tipo de vitiligo, atividade da doença, história do vitiligo, comorbidades autoimunes e tipo de trabalho interno‐externo de pacientes com a doença.
Material e métodosOs critérios da lista de verificação PRISMA (Preferred Reporting Items for Systematic reviews and Meta‐Analysis) foram seguidos na condução e no relato deste estudo. O protocolo do estudo foi registrado na base PROSPERO sob o número de registro CRD42019142156 (https://www.crd.york.ac.uk/PROSPERO/display_record.php?RecordID=142156).
Estratégia de busca de literaturaA pesquisa bibliográfica foi realizada principalmente no banco de dados PubMed/MEDLINE do NCBI, usando as estratégias de pesquisa de palavras‐chave e MESH. A seguinte linha de pesquisa foi desenvolvida: (“vitamin D” (MeSH Terms) OR “vitamin D” (All Fields) OR “ergocalciferols” (MeSH Terms) OR “ergocalciferols” (All Fields)) AND (“vitiligo” (MeSH Terms) OR “vitiligo” (All Fields)). Os outros termos utilizados para Vit‐D foram 25‐Hydroxyvitamin D, 25‐Hydroxycholecalciferol, calcidiol, 1.25‐dihydroxyvitamin D3 e calcitriol. Os bancos de dados do Google Scholar, da Cochrane Library, do Springer's author mapper, o Science Direct, os registros de ensaios clínicos e CINHAL também foram pesquisados em busca de artigos que relatassem níveis circulatórios de Vit‐D em pacientes com vitiligo. Além disso, as referências dos artigos publicados foram pesquisadas manualmente para identificar estudos adicionais. Dois autores realizaram a pesquisa bibliográfica de maneira independente, e quaisquer desacordos foram resolvidos após discussão. Foram feitos esforços para obter dados, se houvesse, de fontes não publicadas. Quando necessário, os autores correspondentes dos respectivos artigos foram contatados por e‐mail para obtenção de dados/esclarecimentos. Todas as pesquisas bibliográficas foram realizadas antes de 5 de setembro de 2019, sem intervalo de tempo especificado, com e sem estudos com seres humanos definidos como limite.
Critérios de seleção dos estudosOs seguintes critérios foram preenchidos para estudos individuais a serem incluídos nesta metanálise: (1) artigos publicados em revistas revisadas por pares; (2) que forneceram dados originais; (3) os sujeitos do estudo eram seres humanos com descrição de vitiligo e controles; (4) estudos em que os níveis circulatórios de Vit‐D em pacientes com vitiligo foram comparados com os controles; (5) que forneceram descrição do método para estimativa dos níveis de Vit‐D; (6) artigos escritos em inglês/chinês com dados claros; (7) estudos com diagnóstico clínico de vitiligo feito por dermatologista. Os critérios de exclusão foram os seguintes: (1) estudos sem grupo controle; (2) relato de outras doenças de pele; (3) os níveis de Vit‐D foram mostrados apenas por pictogramas sem dados; (4) artigos de revisão, comentários e cartas ao editor. Quando algum artigo duplicado era encontrado, apenas um relato recente ou todas as informações relevantes de qualquer um dos estudos eram incluídos.
Extração de dados e avaliação de qualidadeAs informações a seguir foram extraídas de cada um dos estudos incluídos: nomes dos primeiros autores, país, tipo de estudo e ano de publicação, número de indivíduos com vitiligo e controles, indivíduos do sexo masculino e feminino em cada grupo, valores médios/medianas de idade, duração da doença, médias e DP dos níveis de Vit‐D, meio usado para sua medida, método e unidades, tipo e história de vitiligo, atividade da doença, fototipo, comorbidades autoimunes e outras características do estudo. Uma avaliação do escore de qualidade dos estudos incluídos foi realizada de acordo com a Escala Newcastle‐Ottawa (NOS, do inglês Newcastle‐Ottawa Scale).35 A avaliação da qualidade dos estudos variou de 0 a 9 pontos, incluindo três componentes: seleção, comparabilidade e exposição.
Análise estatísticaMetanálises e análises de subgrupos foram conduzidas se houvesse três ou mais estudos relatando os níveis circulatórios de Vit‐D em vitiligo e grupos de controle. Calculamos a diferença média padronizada (DMP) e seu intervalo de confiança (IC) de 95% como uma estatística resumida para a diferença dos níveis de Vit‐D entre pacientes com vitiligo e controles. Além disso, também realizamos uma metanálise das correlações entre Vit‐D e outros parâmetros no vitiligo. O tamanho do efeito para DMP e os valores do coeficiente de correlação agrupados foram apresentados como um escore‐Z. O escore Z com valor de p <0,05 foi considerado estatisticamente significativo.
A heterogeneidade entre os estudos foi examinada pela estatística Q de Cochrane e expressa como as porcentagens de I2. Um valor de p <0,05 ou estatística I2> 50% indicou uma heterogeneidade significativa. Um modelo de efeitos aleatórios foi utilizado para calcular a DMP. A análise de metarregressão foi realizada para identificar a fonte potencial de heterogeneidade usando várias covariáveis, como idade, tamanho da amostra, número de homens/mulheres, duração da doença, método de mensuração da Vit‐D, país e ano de publicação. O risco de viés de publicação foi estudado pela assimetria do gráfico de funil com os testes de Begg e Egger. No entanto, para evitar o risco de viés, os termos de pesquisa gerais foram escolhidos para uma recuperação garantida para a inclusão de artigos relatando os níveis de Vit‐D como um desfecho secundário. No caso de um p <0,05 sugerindo significância estatística, o método trim and fill foi utilizado para corrigir esse viés. Para testar a robustez desta metanálise foi realizada uma análise de sensibilidade com exclusão de um estudo a cada vez (one‐study leave‐out). Todas as comparações foram bicaudais e todas as análises foram conduzidas utilizando‐se o software Review Manager versão 5.3, que apresenta DMP como g de Hedges; a diferença entre as duas médias dividida pelo desvio‐padrão agrupado, com uma correção para o viés da amostra. O MedCalc versão 16.2.0 foi usado para a metanálise de correlações. A metarregressão e o viés de publicação foram realizados, respectivamente, utilizando os softwares OpenMeta e Comprehensive meta‐analysis, versão 3.
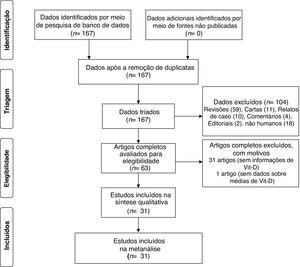
ResultadosForam identificados 167 artigos para os níveis de Vit‐D no vitiligo, dos quais 63 foram recuperados para revisão de resumo e texto completo. Desses, 31 artigos não tratavam dos níveis séricos de Vit‐D no vitiligo e, portanto, foram excluídos. Em outro artigo, nenhum dado foi relatado e, portanto, ele não foi incluído.36 Um estudo, embora não tivesse grupo controle, foi incluído para a análise de subgrupo das diferenças entre homens e mulheres com relação aos níveis de Vit‐D no vitiligo.37 Um estudo de Xu et al. foi considerado duas vezes, pois os níveis de Vit‐D foram relatados em dois grupos separados de vitiligo e controles estudados em diferentes períodos de tempo.33 Ao final, 31 artigos foram incluídos nesta metanálise.5–34 O diagrama de fluxo PRISMA para esta metanálise é mostrado na figura 1. As características detalhadas dos estudos incluídos e os escores de qualidade da NOS são apresentados na tabela 1. Com o escore obtido variando de 4 a 8, a qualidade geral dos estudos foi de média a alta. Dos estudos incluídos, 15 mediram Vit‐D por ELISA, seis por quimioluminescência, dois por RIA, um por LCMS, e esse dado não está claro em sete estudos. Enquanto todos os estudos relataram níveis de calcidiol, um relatou níveis de calcitriol.5 Exceto por dois estudos que utilizaram plasma, todos os demais utilizaram soro para medir os níveis de Vit‐D.13,30 A maioria dos estudos excluiu tratamento anterior para vitiligo, suplementação oral de Vit‐D e qualquer tratamento tópico ou sistêmico que possa afetar os níveis de vitamina D; no entanto, isso não está claro em alguns estudos.8,12,18,28 Em trabalhos em que o tratamento com ultravioleta B de banda estreita (NB‐UVB) e/ou intervenção com Vit‐D foi estudado, apenas os níveis basais de Vit‐D em pacientes com vitiligo em comparação com os controles foram considerados para a metanálise.14,16,20,27,32
Características do estudo
| Estudo/país (período do estudo) (REF) | Tipo do estudo/SKT | Vitiligo | Controles | Pareados | Vitamina D | NOS | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N (M/F) | Idade | Tipo | DD | N (M/F) | Idade (a) | Amostra/ Método | Unidades (alteração) | Vit. D | Vitiligo (n) | Controles (n) | ||||||||
| Def. | Insuf. | Suf. | Def. | Insuf. | Suf. | |||||||||||||
| Aly et al., 2017/ Egito(Nov‐Dez 2015) 5 | Transversal/III, IV | 30 (9/21) | 30,23 | Não segmentar; vulgaracrofacialfocal | 5,83a | 40 (19/21) | 35,38 | Idade, sexo | Soro/ELISA | ng/mL (SI) | (< 10, 10‐30, ≥ 30 ng/mL) | 5 | 25 | 0 | 0 | 34 | 6 | 8 |
| Amon et al., 2018/EUA(Jul 2015‐Jun 2016) 6 | Retrospectivo/NC | 113 (57/56) | 38,2 | NC | ND | 71 (17/54) | 49,2 | NC | Soro/ELISA | ng/mL (SI) | (≤ 20 ng/mL, ND, ND) | 46 | ND | ND | 1 | ND | ND | 5 |
| Beheshti et al., 2014/Irã (Mar‐Jun 2012) 37 | Transversal/III, IV | 100 (42/58) | 28,7 | Vulgar | 5a | Sem Grupo controle | Soro/EIA | nmoL/L | (< 25, 25‐47, 47,7‐144 nmoL/L) | ND | ND | ND | ND | ND | ND | 5 | ||
| Cerman et al., 2014/Turquia(Nov 2012‐Mar 2013) 7 | Transversal/NC | 44 (27/17) | 33,64 | ND | 60,55m | 58 (34/24) | 32,55 | Idade, sexo, IMC | Soro/LCMS | ng/mL (SI) | (≤ 20 ng/mL, ND, ND) | 31 | ND | ND | 19 | ND | ND | 8 |
| Deepthi & Geetharani 2018 /Índia(Dez16‐Maio17) 8 | Dissertação/III, IV | 120 (59/61) | 37,6 | Segmental, vulgar, universal, focal, acrofacial | ≤5a ≥21a | 60 (29/31) | 36,2 | Idade, sexo | Soro/ELISA | ng/mL (SI) | (≤ 20, 20‐30,> 30 ng/mL) | 70 | 28 | 22 | 22 | 12 | 26 | 6 |
| Doss et al., 2015/ Egito(Jun‐Set 2013) 9 | Caso controle/IV | 30 (20/10) | 32,5 | UniversalGeneralizadoLocalizado | 58,4m | 30 (16/14) | 28,0 | Idade, sexo | Soro/ELISA | ng/mL (SI) | (≤ 20, 20‐30, ≥ 30 ng/mL) | 8 | 12 | 10 | 0 | 1 | 29 | 7 |
| El‐Hanbuli et al., 2018/ Egito(Jun‐Set 2016) 10 | Caso controle/IV | 30 (16/14) | 29,53 | ND | 14,87m | 30 (16/14) | 29,53 | Idade, sexo, tipo de pele | Soro/ELISA | ng/mL (SI) | (< 12, 12‐20,> 20 ng/mL) | 20 | 8 | 2 | 0 | 0 | 30 | 7 |
| Farag et al., 2018/ Egito(Mar‐Jun 2016) 11 | Caso controle/III, IV | 50 (18/32) | 28,76 | AcrofacialGeneralizado | 3,5a | 25 (10/15) | 28,16 | Idade, sexo, tipo de pele | Soro/ELISA | nmoL/L (SI) | (< 25, 25‐74, ≥ 75 nmoL/L) | 40 | 10 | 0 | 0 | 23 | 2 | 6 |
| Firjani 2019/ Egito 12 | Caso controle/NC | 21 | ND | ND | ND | 21 | ND | Idade, sexo | Soro/NC | ng/mL (SI) | ND | ND | ND | ND | ND | ND | ND | 4 |
| Hassan et al., 2019/Índia 13 | Caso controle/NC | 100 (39/61) | 28,66 | NC | 3,81a | 100 (40/60) | ND | Idade, sexo | Plasma/CLIA | ng/mL (SI) | (< 20, 20‐30, ≥ 30 ng/mL) | 75 | 15 | 10 | 19 | 35 | 46 | 7 |
| Ibrahim et al., 2018/Egito(Dez 2015‐Dez 2016) 14 | Caso controle/III, IV | 80 (40/40) | 34,27 | NC | ND | 20 (10/10) | 35,20 | Idade, sexo | Soro/ELISA | nmoL/L (SI) | (< 10, 10‐29,> 30 ng/mL) | ND | ND | ND | ND | ND | ND | 7 |
| Karagün et al., 2016/ Turquia(Dez 2013‐Mar 2014) 15 | Caso controle/NC | 50 (28/22) | 30,96 | Generalizado | 2–25a | 47 (30/17) | 31,45 | Idade, sexo, tipo de pele | Soro/NC | ng/mL(SD) | ND | ND | ND | ND | ND | ND | ND | 6 |
| Khodair et al., 2019/ Egito (Mar‐Jun 2018) 16 | Transversal/II‐V | 30 (6/24) | 30,7 | LocalizadoGeneralizado | 4,5a | 30 (10/20) | 30,3 | Idade, sexo | Soro/ELISA | ng/mL (SI) | ND | 0 | 22 | 8 | 0 | 11 | 19 | 6 |
| Khurrum et al., 2016/ Arábia Saudita (Jan 2011‐Dez 2012) 17 | Caso controle/NC | 150 (90/60) | 30,6 | GeneralizadoAcralFocal | 8m | 150 (76/74) | 30,7 | Idade, sexo | Soro/CLIA | ng/mL (SD) | (< 10, 10‐30, ≥ 30 ng/mL) | 137 | 0 | 13 | 136 | 0 | 14 | 8 |
| Liu et al., 2014/China 18 | Caso controle/NC | 86 | 19–56 | ND | NC | 30 | 19–56 | Idade, sexo | Soro/ELISA | nmoL/L (SD) | (< 25, 25‐47,6, 47,4‐250 nmoL/L) | 32 | 44 | 10 | 5 | 19 | 6 | 6 |
| Ochoa‐Ramírez et al., 2019/ México 19 | Caso controle/NC | 173 (81/92) | 18–45 | Disseminado (generalizado, universal), localizado (focal, acrofacial) | ND | 184 | ND | Idade, sexo | Soro/ELISA | ng/mL (SI) | ND | ND | ND | ND | ND | ND | ND | 6 |
| Omidian & Asadian 2018/Irã (Apr 2015‐Mar 2016) 20 | Ensaio clínico/NC | 30 (12/18) | 36,93 | Generalizado | ND | 30 (11/19) | 32,03 | Idade, sexo | Soro/ECL | nmoL/L (SI) | (≤ 10, 10‐29, 30‐100 nmoL/L) | 14 | 13 | 3 | 18 | 10 | 2 | 7 |
| Pillai & Dinachandran 2019/Índia (Jan‐Abr 2018) 21 | Caso controle/NC | 50 (27/23) | 30,96 | Generalizado | 2–25a | 50 (30/20) | 31,45 | Idade, sexo, tipo de pele | Soro/NC | ng/mL (SD) | NA | NA | NA | NA | NA | NA | NA | 7 |
| Prakash & Karthikeyan 2017/Índia (Out 2014‐Maio 2016) 22 | Caso controle/V | 45 (26/19) | 43,78 | VulgarAcrofacialFocal | 51,04m | 45 | ND | Idade, sexo | Soro/ELISA | ng/mL (SD) | (< 20, 20‐30,> 30 ng/mL) | 23 | 22 | 0 | 21 | 21 | 3 | 6 |
| Ramalingam & Tang 2018/ Malásia (Jul‐Dez 2014) 23 | Transversal/I‐IV | 93 (46/47) | 40,43 | Não segmentarsegmentar | 3a | 87 (43/44) | 39,95 | Idade, sexo, etnia, IMC | Soro/NC | ng/mL (SD) | (≤ 20, 20‐30,> 30 ng/mL) | 37 | 29 | 27 | 42 | 23 | 22 | 7 |
| Saleh et al., 2013/Egito (Abr‐Jun 2011) 24 | Caso controle/III‐IV | 40 (18/22) | 34,1 | Não segmentar | 3,5a | 40 (18/22) | 34,2 | Idade, sexo, tipo de pele, ingestão de Vit. D | Soro/RIA | ng/mL (SI) | (≤ 20, 20‐30, ≥ 30 ng/mL) | 39 | 0 | 1 | 5 | 2 | 33 | 7 |
| Saniee et al., 2019/Irã (primavera e verão 2017) 25 | Caso controle/III‐IV | 98 (50/48) | 30,06 | NC | 34,65m | 98 (53/45) | 29,45 | Idade, sexo | Soro/ELISA | ng/mL (SD) | (< 10, 10‐30,> 30 ng/mL) | 17 | 53 | 28 | 17 | 46 | 35 | 6 |
| Sanjay & Raval 2019/ Índia (período de 1 ano) 26 | Transversal/NC | 25 (15/10) | 23,0 | FocalGeneralizadoAcrofacialMucoso | NA | 25 (16/9) | 24,12 | Idade, sexo | Soro/ECL | ng/mL (SD) | NA | NA | NA | NA | NA | NA | NA | 4 |
| Sehrawat et al., 2014/Índia 27 | Estudo clínico/IV‐V | 30 (10/20) | 31,33 | Generalizado | 10,47a | 30 (10/20) | NA | Idade, sexo | Soro/ELISA | nmoL/L (SI) | (< 25, 25‐74, 75‐250 nmoL/L) | 24 | 6 | 0 | 3 | 27 | 0 | 6 |
| Shalaby et al., 2017/Egito(Dez 2014‐Jun 2016) 34 | Caso controle/NC | 40 (30/10) | 28,70 | Não segmentar | 4,7a | 40 (25/15) | 32,95 | Idade, sexo | Soro/ELISA | nmoL/L (SI) | (< 10, 10‐30,> 30 ng/mL) | 8 | 22 | 10 | 0 | 4 | 36 | 6 |
| Sobeih et al., 2016/Egito (Jul‐Dez 2013) 28 | Caso controle/III‐V | 75 | 31,5 | VulgarAcrofacialSegmentar | 5,5a | 75 | NA | Idade, sexo | Soro/ELISA | ng/mL (SL) | NA | NA | NA | NA | NA | NA | NA | 5 |
| Srirama 2016/Índia (período de 4m) 29 | Caso controle/NC | 30 (11/19) | 43,9 | Clínico | 2–5a | 30 (11/19) | 49,8 | Idade, sexo | Soro/CLIA | ng/mL (SL) | (< 20, 20‐30,> 30 ng/mL) | NA | NA | NA | NA | NA | NA | 5 |
| Takci et al., 2015/Turquia (Inverno: Nov 2011‐Fev 2012) 30 | Caso controle/I, III | 44 (24/20) | 34,5 | VulgarGeneralizadoLocalizado | 38,8m | 43 (10/33) | 33,0 | Idade, sexo, tipo de pele | Plasma/RIA | ng/mL (SL) | (< 20, 20‐30,> 30 ng/mL) | 32 | NA | NA | 13 | NA | NA | 7 |
| Ustun et al., 2014/Turquia (b/w 2010‐2011) 31 | Transversal/II, III | 25 (13/12) | 33,9 | Vulgar | 5,36a | 41 (20/21) | 34,7 | Idade, sexo, tipo de pele | Soro/CLIA | ng/mL (SD) | (< 20, 21‐29, 30‐100 ng/mL) | 20 | 5 | 0 | 34 | 6 | 1 | 8 |
| Watabe et al., 2018/Japão (Set 2015‐Jan 2016) 32 | ECR/III, IV | 45 | 50,89 | Vulgar | NC | 45 | Pareado por idade | Idade | Soro/NC | ng/mL (SI) | (< 20, 20‐30,> 30 ng/mL) | 30 | 12 | 3 | 17 | 20 | 8 | 8 |
| Xu et al., 2012/China(Mar‐Mai 2011) 33 | Caso controle/NC | 171 (80/91) | 34,1 | Segmentar,não segmentar; generalizado, universal, focal, halo de nevos | NC | 93 | 34,6 | Idade, sexo | Soro/NC | nmol/L (SD) | (< 25, 25‐75,> 75 nmoL/L) | 57 | 114 | 0 | 57 | 36 | 0 | 7 |
| Xu et al., 2012/China (Set‐Out 2010) 33 | Caso controle/NC | 30 | ND | Segmentar,não segmentar; generalizado, universal, focal, halo de nevos | NC | 20 | NA | Idade, sexo | Soro/NC | nmol/L (SD) | (< 25, 25‐75,> 75 nmoL/L) | 3 | 27 | 0 | 2 | 18 | 0 | 7 |
NC, não claro; ND, não disponível; SD, sem diferença; NOS, Escala Newcastle‐Ottawa; SI, significativamente inferior; DD, duração da doença; SKT, Tipos de pele de Fitzpatrick; a, anos; M, masculino; F, feminino; n, tamanho da amostra; Def, Deficiência; Insuf, Insuficiência; Suf, Suficiência.
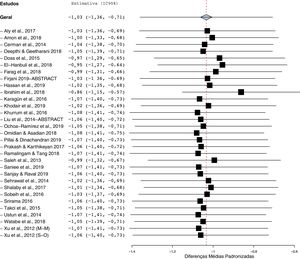
Como mostrado na figura 2, os pacientes com vitiligo apresentavam níveis diminuídos de Vit‐D em comparação com os controles. Com uma heterogeneidade significativa entre os estudos (I2=95%; p <0,00001), a DMP agrupada (IC 95%) obtida com o modelo de efeitos aleatórios foi de −1,03 (−1,35 a −0,71). Esse resultado sugere uma diferença significativa nos níveis médios de Vit‐D entre pacientes com vitiligo e os controles, e o tamanho do efeito geral para a diferença média obtida corrigida para desvios‐padrão e viés de amostra foi estatisticamente significativo (Z=6,22, p=0,00001).
Análises de subgrupo e metarregressãoOs resultados da metanálise de subgrupo com base no país, método de mensuração de Vit‐D, tipo de vitiligo, sexo, fototipo, história de vitiligo, história de comorbidades/autoimune, atividade da doença (progressiva/ativa ou estável), tipo de trabalho (interno ou externo) e a indexação das revistas (PubMed/ Não PubMed) são apresentados na tabela 2. A DMP agrupada foi estatisticamente significativa nos subgrupos “Egito”, “não Egito”, “ELISA”, “interno vs. externo”, “PubMed” e “Não PubMed”. A significância estatística não foi alcançada em todos os outros subgrupos, incluindo diferentes tipos de vitiligo, tipo de pele, atividade da doença, história de vitiligo, AIC e entre os sexos masculino e feminino em pacientes com vitiligo, o que é sugestivo de possível fonte de heterogeneidade. Entre as várias covariáveis utilizadas na metarregressão (tabela 3), a variável “país” produziu um resultado estatisticamente significativo (coeficiente=0,19; p=0,01) indicativo de fonte significativa de heterogeneidade entre os estudos incluídos. Os resultados da metanálise de correlação apresentados na tabela 4 não mostraram associações significativas da Vit‐D com idade, duração da doença, ASC e VASI.
Análise de subgrupos
| Subgrupo | No de estudos | I2 (%) | DMP | IC95% | Efeito geral (Z) | p‐valor |
|---|---|---|---|---|---|---|
| Geral | 31 | 95 | −1,03 | −1,35; −0,71 | 6,22 | <0,00001 |
| País | ||||||
| Egito | 10 | 94 | −2,46 | −3,21; −1,70 | 6,39 | <0,00001 |
| Não Egito | 21 | 90 | −0,43 | −0,69; −0,17 | 3,22 | 0,001 |
| Alemanha | 1 | NA | −1,80 | −2,15; −1,45 | 10,09 | <0,00001 |
| China | 3 | 0 | −0,14 | −0,34; 0,06 | 1,34 | 0,18 |
| Índia | 7 | 88 | −0,63 | −1,08; −0,17 | 2,70 | 0,007 |
| Irã | 2 | 56 | 0,12 | −0,30; 0,55 | 0,56 | 0,57 |
| Japão | 1 | NA | −0,63 | −1,05; −0,20 | 2,91 | 0,004 |
| Malásia | 1 | NA | 0,07 | −0,23; 0,36 | 0,45 | 0,65 |
| México | 1 | NA | 0,65 | −1,13; −0,17 | 2,64 | 0,008 |
| Arábia Saudita | 1 | NA | 0,17 | −0,06; 0,40 | 1,47 | 0,14 |
| Turquia | 4 | 77 | −0,39 | −0,84; 0,06 | 1,71 | 0,09 |
| Método | ||||||
| ELISA | 15 | 95 | −1,72 | −2,27; −1,16 | 6,04 | <0,00001 |
| Não ELISA | 9 | 94 | −0,54 | −1,09; 0,02 | 1,91 | 0,06 |
| QL | 6 | 94 | −0,20 | −0,86; 0,46 | 0,59 | 0,56 |
| RIA | 2 | 94 | −1,42 | −2,86; 0,02 | 1,93 | 0,05 |
| LCMS | 1 | NA | −0,86 | −1,27; −0,45 | 4,11 | <0,0001 |
| ND/NC | 7 | 66 | −0,26 | −0,52; −0,00 | 1,98 | 0,05 |
| Vitiligo | ||||||
| Tipo A vs. B | 4 | 10 | −0,08 | −0,41; 0,25 | 0,48 | 0,63 |
| Tipo A vs. C | 5 | 37 | 0,37 | −0,11; 0,86 | 1,51 | 0,13 |
| Tipo B vs. C | 3 | 22 | 0,22 | −0,53; 0,96 | 0,57 | 0,57 |
| Masculino vs. Feminino | 11 | 80 | 0,24 | −0,09; 0,56 | 1,43 | 0,15 |
| Ativa vs. Estável | 4 | 41 | 0,18 | −0,21; 0,57 | 0,92 | 0,36 |
| SKT‐III vs. IV | 4 | 48 | −0,20 | −0,64; 0,24 | 0,91 | 0,36 |
| VFH‐Positivo vs. Negativo | 5 | 26 | 0,15 | −0,16; 0,46 | 0,93 | 0,35 |
| AIC‐Positivo vs. Negativo | 5 | 64 | 0,04 | −0,48; 0,56 | 0,15 | 0,88 |
| Interno vs. Externo | 3 | 68 | −0,57 | −1,15; 0,01 | 1,94 | 0,05 |
| Interno vs. Externo & U/R | 4 | 60 | −0,45 | −0,86; −0,04 | 2,17 | 0,03 |
| Artigo de Revista indexada | ||||||
| PubMed/MEDLINE | 18 | 96 | −1,37 | −1,86; −0,88 | 5,47 | <0,00001 |
| Não PubMed/MEDLINE | 13 | 90 | −0,59 | −0,96; −0,23 | 3,16 | 0,002 |
DMP, diferença média padronizada; IC, intervalo de confiança; U/R, Urbano ou Rural; SKT, tipo de pele de Fitzpatrick; ND/NC, não disponível/não claro; ELISA, Enzyme Linked Immunsorbant Assay; RIA, Radioimunoensaio; QL, quimiluminescência; LCMS, Espectrometria de Massa por Cromatografia Líquida; I2, Heterogeneidade; Tipo A, Vulgar/generalizado/disseminado; Tipo B, Acrofacial; Tipo C, Focal/localizado.
Análise de metarregressão
| Variáveis | Coeficientes | IC95% | EP | p‐valor |
|---|---|---|---|---|
| Total n | 0,004 | −0,003; 0,012 | 0,004 | 0,253 |
| Vitiligo n | 0,003 | −0,009; 0,016 | 0,006 | 0,612 |
| Controles n | 0,015 | −0,001; 0,031 | 0,008 | 0,059 |
| Vitiligo‐Masculino | 0,009 | −0,015; 0,034 | 0,013 | 0,468 |
| Vitiligo‐Feminino | 0,007 | −0,018; 0,032 | 0,013 | 0,593 |
| Vitiligo‐ Razão M/F | 0,030 | −0,073; 0,134 | 0,053 | 0,566 |
| Controles ‐ Masculino | 0,038 | 0,001; 0,075 | 0,019 | 0,044 |
| Controles ‐ Feminino | 0,031 | −0,007; 0,068 | 0,019 | 0,107 |
| Controles ‐ Razão M/F | 0,030 | −0,073; 0,134 | 0,053 | 0,566 |
| Vitiligo ‐ Idade | 0,042 | −0,056; 0,140 | 0,050 | 0,405 |
| Controles ‐ Idade | 0,012 | −0,105; 0,130 | 0,060 | 0,837 |
| Duração da doença | −0,021 | −0,261; 0,219 | 0,122 | 0,863 |
| Ano | −0,086 | −0,313; 0,140 | 0,116 | 0,455 |
| País | 0,194 | 0,041; 0,347 | 0,078 | 0,013 |
| Método | −0,450 | −1,206; 0,306 | 0,386 | 0,243 |
| NOS | −0,166 | −0,756; 0,425 | 0,301 | 0,583 |
Metanálise de correlações
| Correlação da Vit. D com | Estudos | n | I2 (%) | r | IC95% | Z | p |
|---|---|---|---|---|---|---|---|
| Idade | 6 | 317 | 86,92 | −0,144 | −0,438‐0,178 | −0,874 | 0,38 |
| DD | 7 | 342 | 4,97 | 0,061 | −0,052‐0,173 | 1,057 | 0,29 |
| ASC | 4 | 202 | 0,00 | 0,135 | −0,006‐0,271 | 1,876 | 0,06 |
| VASI | 5 | 220 | 82,68 | −0,197 | −0,494‐0,142 | −1,143 | 0,25 |
Idade, Idade dos pacientes com Vitiligo em anos; DD, duração da doença de Vitiligo; ASC, área da superfície corporal afetada; VASI, Vitiligo Area and Severity Index; I2, Inconsistência; r, coeficiente de correlação agrupado; IC, Intervalo de Confiança.
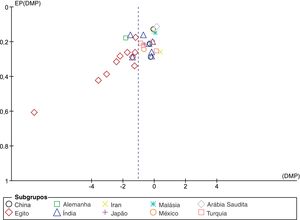
A análise do gráfico de funil com correlação de Begg (p <0,001) e os testes de regressão de Egger (p <0,001) indicam que pode haver um viés de publicação entre os estudos incluídos (fig. 3). No entanto, é improvável que o viés de publicação representasse um efeito significativo sobre esta metanálise, pois a correção desse viés com o método trim and fill validou nossos resultados originais. Com sete estudos a serem cortados, os valores corrigidos (DMP=−1,41, IC 95%: −1,81 a −1,00) ainda indicavam níveis significativamente mais baixos de Vit‐D no vitiligo em comparação com os controles. Além disso, uma análise de sensibilidade com exclusão de um estudo a cada vez (one‐study leave‐out) mostrou que nenhum estudo individual influenciou significativamente o tamanho do efeito combinado. A DMP combinada obtida era estável e permaneceu estatisticamente significativa após a eliminação de qualquer estudo em particular na análise de sensibilidade (fig. 4).
DiscussãoA literatura disponível mostra resultados contrastantes em relação aos níveis de Vit‐D no vitiligo.5–34 Que seja de nosso conhecimento, as duas revisões sistemáticas disponíveis sobre o tópico não são atualizadas e são limitadas em relação ao número de estudos incluídos, subgrupo e análises de metarregressão.2,3 Além disso, em um desses dois estudos, a extração de dados em relação a um estudo incluído estava errada.2,33 E, no outro, tanto o vitiligo adulto quanto o infantil foram incluídos na metanálise.3 Neste estudo atualizado, realizamos uma metanálise incluindo 1.840 pacientes com vitiligo e 1.539 controles de 31 relatos. O resultado de nossa metanálise mostra que a concentração de Vit‐D na circulação é significativamente menor em pacientes com vitiligo em comparação com os controles (DMP=−1,03, p <0,00001).
A forma ativa da Vit‐D e do receptor da vitamina D (RVD) é mediadora de várias funções biológicas importantes, como o metabolismo do cálcio e do fosfato, a formação, o crescimento e a diferenciação óssea. Estudos indicaram que polimorfismos do RVD estão associados aos níveis de Vit‐D e exibem uma predisposição genética para o vitiligo.3,36 Embora a etiopatogênese do vitiligo não esteja completamente esclarecida, a Vit‐D é conhecida por mediar a regulação imunológica e doenças imunes, além de diabetes e doenças cardiovasculares, entre outras.1–3 Também se sabe que o vitiligo está associado a comorbidades autoimunes e, portanto, níveis circulatórios alterados de Vit‐D podem estar associados a pacientes com vitiligo. Os vários fatores que podem influenciar o nível circulatório de Vit‐D incluem tipo de vitiligo, tipo de pele, atividade da doença, história de vitiligo, comorbidades autoimunes, idade, tipo de trabalho em ambientes fechados e ao ar livre, exposição ao sol, variações sazonais e métodos de mensuração de Vit‐D. Em um estudo de coorte, foi relatado que níveis baixos de Vit‐D estão associados a comorbidades autoimunes (odds ratio=10,00), mas não com idade, sexo, raça/etnia, história familiar de vitiligo ou doença autoimune, doença de início recente ou ASC afetada.38
Nossa análise de subgrupo produziu resultados interessantes. Como havia dez estudos do Egito, o máximo para qualquer outro país, realizamos uma metanálise de subgrupo com base em estudos egípcios e não egípcios (21 estudos). Em ambos os casos, a significância estatística foi mantida para um nível diminuído de Vit‐D no vitiligo. Entretanto, quando os países não egípcios foram estratificados adicionalmente, o subgrupo Índia (sete estudos) mostrou uma significância estatística, enquanto os subgrupos de estudos da China (três estudos) e da Turquia (quatro estudos) não produziram uma diferença estatisticamente significativa em níveis de Vit‐D entre seus respectivos grupos de vitiligo e controle (tabela 2). Isso é sugestivo de uma heterogeneidade entre os estudos em decorrência do “país” dos estudos incluídos; os níveis circulatórios de Vit‐D podem variar entre os países por causa de diferentes latitudes, fatores genéticos e alimentares.2,3 Tal fato é comprovado por nossa metanálise de regressão indicando o “país” como uma fonte significativa de heterogeneidade (tabela 3). Nenhuma diferença significativa foi observada quando os níveis de Vit‐D foram comparados entre diferentes tipos de vitiligo não segmentar, presença ou ausência de história de vitiligo e comorbidades autoimunes. Embora os pacientes com vitiligo do sexo feminino e com o fototipo IV tenham apresentado níveis mais baixos de Vit‐D, não houve significância estatística quando comparados aos do sexo masculino e com o fototipo III, respectivamente. A atividade da doença parece ter algum efeito, com o vitiligo estável mostrando níveis mais baixos de Vit‐D em comparação ao vitiligo ativo; nenhum valor de p significativo foi encontrado (tabela 2). Além disso, nenhuma influência significativa de idade, sexo, tamanho da amostra, ano de publicação e duração da doença foi observada na análise de metarregressão. Assim, a metanálise dos coeficientes de correlação também não resultou em associações estatisticamente significativas de Vit‐D com idade, duração da doença, ASC e escore VASI (tabela 4).
É digno de nota que os níveis de Vit‐D foram significativamente mais baixos em pacientes com vitiligo que tinham trabalho interno/urbano quando comparados aos seus equivalentes que exerciam trabalho externo/rural (tabela 2). Esse dado claramente sugere que menos atividade ao ar livre está associada à diminuição dos níveis de Vit‐D no vitiligo, o que indica que o ambiente e, portanto, a intensidade da exposição ao sol, podem influenciar os níveis de Vit‐D. Embora tenha sido possível extrair e resumir os dados na tabela 1, além das diferentes estações/períodos de tempo durante os quais os estudos incluídos foram realizados e as mensurações de Vit‐D foram feitas, esses dados foram insuficientes para conduzir uma metanálise sobre a influência sazonal e variações da Vit‐D associadas no vitiligo.
Quando uma metanálise separada foi realizada com base em estudos com ELISA (n=15) e estudos não ELISA (n=9), a significância estatística foi mantida apenas em um grupo utilizando ELISA, enquanto a metodologia não ELISA (particularmente, quimioluminescência) é um fator importante que contribui para a heterogeneidade entre os estudos. Entretanto, na metarregressão (n=24), o “método” usado como covariável não mostrou um valor estatisticamente significativo. Considerando que os artigos indexados na base de dados PubMed/MEDLINE são de boa qualidade, com informações confiáveis, repetimos uma metanálise separada no PubMed (18 artigos) e estudos não PubMed (13 artigos), e os resultados mantiveram significância estatística em ambos os casos (tabela 2).
Considerando o risco aumentado de vitiligo e o risco de comorbidades autoimunes associadas à diminuição dos níveis de Vit‐D, nossa metanálise e estudos anteriores apontam para a necessidade de manter níveis suficientes de Vit‐D por fototerapia com NB‐UVB e/ou suplementação de Vit‐D.39–41 Além disso, a suplementação com antioxidantes em combinação com fototerapia também foi estudada no vitiligo.42,43 Um estudo recente fornece uma nova evidência sobre uma associação positiva significativa de níveis suficientes de Vit‐D com a estabilidade da doença e um processo de repigmentação satisfatório em pacientes adultos com vitiligo.41 Essa evidência anterior e essa metanálise também reforçam a necessidade de avaliar o nível da Vit‐D no vitiligo. Considerando que a eficácia terapêutica da suplementação de Vit‐D e uma correlação relatada entre níveis suficientes de Vit‐D e o curso do vitiligo são promissoras, mais ensaios clínicos randomizados são necessários sobre o papel da suplementação da Vit‐D.40,41 Isso também abre o escopo para uma futura metanálise de ECR sobre a eficácia da suplementação de Vit‐D no vitiligo.
As limitações do nosso estudo incluem a heterogeneidade entre os estudos, que pode ser atribuída a populações de estudo heterogêneas de diferentes países, diferentes tamanhos de amostra e diferenças em metodologias, diversos fatores ambientais, genéticos, dietéticos e hábitos de estilo de vida e outras limitações inerentes a desenhos de estudos de caso‐controle/observacionais. Entretanto, como a heterogeneidade não pode ser completamente eliminada em uma metanálise, isso foi abordado aplicando o modelo de efeitos aleatórios para estimar o tamanho do efeito geral e por meio de uma análise de sensibilidade cumulativa e com exclusão de um estudo a cada vez (one‐study leave‐out) para avaliar se algum estudo individual afetaria significativamente o tamanho de efeito geral obtido. A análise de sensibilidade com exclusão de um estudo a cada vez (one‐study leave‐out) revelou que nenhum estudo/observação individual tinha influenciado significativamente o tamanho de efeito geral agrupado. Portanto, nossos resultados foram considerados robustos. Além disso, todos os estudos incluídos foram pareados para fatores de confusão como idade e sexo.
Em conclusão, nossa metanálise indica diminuição do nível de Vit‐D em pacientes com vitiligo em comparação com os controles. Esses resultados de nossa metanálise destacam a necessidade de avaliar a Vit‐D para melhorar seu nível no vitiligo. Mais estudos sobre o papel da Vit‐D em relação à patogênese e gravidade do vitiligo são necessários no futuro.
Suporte financeiroNenhum.
Contribuições dos autoresSeshadri Reddy Varikasuvu: Concepção do estudo; realização da pesquisa bibliográfica; análise dos dados; elaboração do manuscrito; leitura e aprovação da versão final do manuscrito.
Sowjanya Aloori: Realização da pesquisa bibliográfica; critérios de seleção; coleta de dados e revisões; leitura e aprovação da versão final do manuscrito.
Saurabh Varshney: Realização da pesquisa bibliográfica; critérios de seleção; coleta de dados e revisões; leitura e aprovação da versão final do manuscrito.
Aparna Varma Bhongir: Auxiliou na realização da pesquisa bibliográfica; revisão do manuscrito; leitura e aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Varikasuvu SR, Aloori S, Varshney S, Bhongir AV. Decreased circulatory levels of Vitamin D in Vitiligo: a meta‐analysis. An Bras Dermatol. 2021;96:284–94.
Trabalho realizado no All India Institute of Medical Sciences, Deoghar, Jharkhand, Índia.