Neste artigo são abordados os principais aspectos das manifestações cutâneas associadas à COVID‐19, baseados em revisão da literatura publicada até a presente data. Desde o início da pandemia, já são mais de 1.500 artigos sobre o tema. Com relação à fisiopatologia, acredita‐se que os mesmos mecanismos responsáveis pela doença nos principais órgãos‐alvo atuem também na pele, embora ainda não estejam totalmente elucidados. A real frequência das manifestações dermatológicas ainda é incerta‐pode variar de 0,2 a 45%; nas revisões sistemáticas, o valor é próximo a 6%. Estudos pioneiros com grandes séries de casos conduzidos em países europeus e os EUA trazem as primeiras informações sobre quais seriam as principais manifestações cutâneas associadas à COVID‐19 e propõem classificações quanto à apresentação clínica e fisiopatologia, bem como a frequência das manifestações. Embora não haja consenso, as erupções maculopapulares são tidas como os quadros mais frequentes, seguidos das lesões do tipo eritema pérnio (EP) símile. Manifestações como urticária, quadros vesiculares e livedo/púrpura/necrose são raras. O tempo de surgimento, a gravidade, a necessidade de tratamento específico e o prognóstico são variáveis conforme o padrão de apresentação clinica. A crescente descrição histopatológica dos quadros cutâneos pode contribuir para o diagnóstico, bem como para a compreensão da fisiopatologia. Ainda no campo dermatológico, a relação entre COVID‐19 e andrógenos tem sido cada vez mais estudada. Apesar de todo conhecimento gerado, o significado biológico real das manifestações cutâneas ainda é incerto. Assim, a exclusão dos principais diagnósticos diferenciais é fundamental para a correlação entre manifestação cutânea e COVID‐19.
No início da pandemia de COVID‐19, a dermatologia já parecia ter um papel importante dentre as manifestações clínicas dessa nova doença. Desde março de 2020, mais de 1.500 artigos correlacionando “dermatologia” e “COVID‐19” foram publicados. Nunca uma quantidade tão grande de informações foi gerada em tão pouco tempo na comunidade científica, inclusive dermatológica. Embora os primeiros relatos sejam escassos, possivelmente em razão da incapacidade de se realizarem exame dermatológico completo, registro fotográfico, análise histopatológica e/ou imuno‐histoquímica e também pela baixa presença do especialista na assistência direta a esses pacientes, pesquisas subsequentes trouxeram importantes contribuições sobre o envolvimento cutâneo na COVID‐19.1 Neste documento são revisadas as principais publicações até o momento (30/04/21) sobre diferentes aspectos das manifestações dermatológicas da COVID‐19, segundo as metodologias adotadas nessas pesquisas. Utilizamos como base de dados o Pubmed, segundo as seguintes palavras chaves: COVID‐19, SARS‐CoV‐2, “dermatology”, “skin”. As informações iniciais estão reunidas na tabela 1.
Cápsula com os principais pontos‐chave
| Pontos‐chave |
|---|
| O primeiro relato na literatura de manifestação cutânea associada à COVID‐19 ocorreu em 23/03/20. Desde então, há mais de 1.500 publicações sobre o tema |
| A frequência das manifestações cutâneas varia entre 0,2% a 45%, sendo próxima a 6% no estudos de revisão sistemática |
| As manifestações mais descritas são as erupções máculo‐papulares, seguidas das lesões eritema pérnio (EP) símile |
| Quadros urticariformes, vesiculares e do espectro livedo‐púrpura‐necrose são menos frequentes |
| As lesões de pele habitualmente são concomitantes aos sintomas gerais. No entanto, urticárias e vesículas podem precedê‐los, enquanto EP‐símile e livedo‐púrpura‐necrose surgem tardiamente |
| Os principais diagnósticos diferenciais são reações medicamentosas e outras infecções virais, que devem ser excluídos |
Embora o primeiro relato de um quadro dermatológico possivelmente associado a COVID‐19 na literatura tenha sido publicado em 22/03/2020 por Joob e Wiwanitkit2 no Journal of the American Academy of Dermatology (JAAD), já no final de 2019 Guan et al.3 fizeram a primeira citação sobre a frequência de manifestações cutâneas. Dentre os 1.099 pacientes com infecção por SARS‐CoV‐2 descritos, 0,2% apresentaram rash.
O primeiro artigo com foco principal na frequência das manifestações cutâneas, publicado por Recalcati4 em 26/03/20, relatou que entre 88 casos avaliados por dermatologistas, 20,4% apresentaram lesões de pele. Desde então, a estimativa de tal frequência tem sido amplamente variável, em diferentes países, com dados obtidos por diferentes metodologias. Matar et al.5 na França, Reknimitr et al.6 na Tailândia e Solak et al.7 na Turquia mostraram frequências de 1% (n=756), 15% (n=183) e 18,3% (n=382), respectivamente, por meio da coleta a distância em entrevista telefônica após avaliação realizada pelo próprio paciente (autoexame). Frequências mais baixas foram registradas por Gaspari et al.8 na Itália (1,4%), Tammaro et al.9 também na Itália (1,5% n=130) e Tamai et al.10 no Japão (4,3% n=69) em avaliação presencial dos pacientes realizada por dermatologista – fator fundamental para maior sensibilidade na detecção de lesões de pele e acurácia em atribuí‐las à COVID‐19. Pela metodologia mais adequada, acredita‐se que a real frequência esteja próxima às relatadas por esses últimos estudos. As principais críticas aos trabalhos iniciais são a avaliação a distância, avaliação pelo próprio paciente ou por profissionais de saúde não dermatologistas, inclusão de casos suspeitos de COVID‐19 (não confirmados) e a não exclusão de afecções cutâneas comuns, como outras infecções virais e reações adversas a medicamentos. O significado biológico real de tais manifestações ainda parece incerto. Mais dados sobre frequência serão citados adiante, nos tópicos “Estudos prospectivos” e “Revisões sistemáticas” e resumidos na tabela 2.
Frequência das manifestações dermatológicas na COVID‐19
| Autor | País | Frequência | n | Forma de avaliação |
|---|---|---|---|---|
| Guan et al.3 | China | 0,2% | 1099 | Não presencial (banco de dados) |
| Recalcati et al.4 | Itália | 20,4% | 88 | Presencial por dermatologista |
| Matar et al.5 | França | 1% | 756 | Autoexame por entrevista telefônica |
| Rerknimitr et al.6 | Tailândia | 15% | 183 | Autoexame por entrevista telefônica |
| Solak et al.7 | Turquia | 18,3% | 382 | Autoexame por entrevista telefônica |
| Gaspari et al.8 | Itália | 1,4% | Nd | Presencial por dermatologista |
| Tammaro et al.9 | Itália | 1,5% | 130 | Presencial por dermatologista |
| Tamai et al.10 | Japão | 4,3% | 69 | Presencial por dermatologista |
| De Giorgi et al.31 | Itália/China | 7,8% | 678 | Presencial (não especifica avaliador) |
| Rehktman et al.32 | EUA | 11,8% | 296 | Presencial por estudantes de medicina |
| Méndez‐Maestro et al.30 | Espanha | 18,7% | 75 | Presencial por dermatologista |
| Nuno‐Gonzales et al.34 | Espanha | 45,65% | 666 | Presencial por dermatologista |
| Jamshindi et al.36 | a | 5,95% | 1847 | a |
Nd, dado não disponível.
Curiosamente, um estudo espanhol mostrou que a frequência de manifestações dermatológicas foi ainda menor na segunda onda da epidemia naquele país.11 Possíveis explicações são: melhor conhecimento sobre a doença propiciou tratamento precoce e com medicações mais assertivas, o que reduziu a proporção de casos graves e reações adversas a medicamentos (um dos principais diagnósticos diferenciais); maior aplicação de medidas preventivas e testes diagnósticos para exclusão de outras infecções virais; novas mutações com maior diversidade de virulência e antigenicidade. Além disso, a aparente baixa frequência de lesões dermatológicas em comparação às manifestações clínicas “clássicas” podem ser explicadas pela menor expressão de receptores virais na pele em relação a outros órgãos‐alvo e pela presença de proteases de membrana com ação protetora à pele.12
Por fim, um recente estudo austríaco com metodologia caso‐controle não mostrou significância estatística entre a presença de lesões de pele no grupo dos pacientes com COVID‐19 confirmados (casos) e no grupo não COVID (controles).13 Sugere‐se que as lesões de pele são menos específicas do que outros sinais clínicos, não são boas pistas diagnósticas, devem ser avaliadas com critério e ser atribuídas à COVID‐19 apenas depois de excluídos outros diagnósticos diferenciais, como reações adversas a medicamentos e outras infecções virais.
FisiopatologiaOs mecanismos pelos quais o SARS‐CoV‐2 causa doença nos diversos órgãos, incluindo a pele, são bastante complexos e não totalmente elucidados.
O risco de um órgão desenvolver infecção por SARS‐CoV‐2 é determinado pela presença dos receptores funcionais virais da enzima conversora de angiotensina‐2 (ACE2) e transmembrana protease serine 2 (TMPRSS2) expressos nas células locais. A ACE2 é encontrada principalmente em células epiteliais alveolares, o que explica a alta vulnerabilidade dos pulmões à COVID‐19. Alguns estudos mostraram que a ACE2 é detectável na camada basal da epiderme, bem como nos folículos capilares. No entanto, a presença de SARS‐CoV‐2 em amostras de pele foi relacionada com a expressão da ACE2 nas células endoteliais de capilares cutâneos, não em queratinócitos e melanócitos,14 o que faz com que o vírus não consiga penetrar e infectar direta e primariamente a pele. O acometimento cutâneo é indireto, ou seja, ocorre por infecção das células endoteliais dos vasos dérmicos. A presença do SARS‐CoV‐2 nas lesões de pele já foi confirmada por técnica de reação em cadeia da polimerase (PCR) em tecido com baixa replicação, mesmo em paciente com PCR no swab nasal e sorologias negativas, mostrando que a pele pode ser um órgão infectado, eventualmente até diagnóstico.15
A primeira e maior evidência sobre a fisiopatologia das lesões cutâneas na COVID‐19 foi publicada por Magro et al.,16 ainda no início da pandemia (15/04/20). Por meio de técnicas de histopatologia e imuno‐histoquímica de componentes do complemento e da proteína spike viral, o trabalho de Magro mostra que o processo fisiopatológico responsável pelo acometimento pulmonar pode ocorrer também na pele, tanto sã como lesada, além de comprovar a presença viral nesses órgãos. Da mesma maneira, Colmenero et al.17 também identificaram partículas virais no endotélio de lesões do tipo eritema pérnio em crianças, o que sustenta a relação causal entre o acometimento cutâneo e a presença viral. O dano endotelial induzido pelo SARS‐CoV‐2 na pele pode ser um dos mecanismos‐chave na patogênese.
Sabe‐se que a fisiopatologia da COVID‐19 é multifatorial e envolve resposta imune inata, humoral, hipercoagulabilidade, ativação monocítica/macrofágica, aumento expressivo de citocinas (“tempestade de citocinas”), entre outros.18 De maneira bastante simplificada, as manifestações cutâneas têm sido divididas em duas formas quanto à fisiopatologia: (1) inflamatória, como resposta imune aos nucleotídios virais, e (2) vascular, secundária aos fenômenos de vasculite, vasculopatia e trombose.19 Sobre a resposta inflamatória, as infecções virais estão relacionadas com o desencadear de respostas imunes inatas e adaptativas. O sistema monocítico‐macrófago produz uma resposta imune exacerbada, gerando processo inflamatório sistêmico intenso. A ativação viral de mastócitos e basófilos poderia justificar lesões como urticária e exantemas.20 Com relação aos mecanismos vasculares, as lesões mais estudadas são do tipo eritema pérnio, em analogia à fisiopatologia de doenças já conhecidas, como eritema pérnio “clássico” (desencadeado pelo frio), “lúpico” e outras entidades vasculares, como a vasculopatia livedoide.21 Acredita‐se que o eritema pérnio associado à COVID‐19 decorra também de uma reação imune exagerada com sinalização via interferon tipo I, importante para a erradicação viral, porém com resposta generalizada altamente inflamatória. Já nos quadros de púrpura retiforme dos pacientes graves, a trombose vascular na pele e em outros órgãos estaria associada a uma resposta mínima de interferon, possibilitando a replicação viral excessiva com liberação de proteínas virais que se localizam no endotélio extrapulmonar e desencadeiam extensa ativação do complemento.22,23
Controvérsias quanto à fisiopatologia e à presença de partículas virais desencadeando lesões cutâneas baseiam‐se em estudos que constatam a ausência dessas partículas em pesquisa, por técnica de PCR nos fragmentos obtidos por biópsia de lesões de pele.24 Além disso, recentemente, sugere‐se que o SARS‐CoV‐2 poderia causar a reativação de outros vírus latentes, como o HHV‐6, e que este seria o real responsável por algumas manifestações cutâneas inicialmente atribuídas à COVID‐19,25 como os exantemas e quadros pitiríase rósea símile.
Grandes séries nacionais e internacionaisLogo após os primeiros relatos de casos isolados de manifestações cutâneas em pacientes com COVID‐19, principalmente com a chegada da pandemia na Europa, alguns países realizaram estudos com colaboração nacional e internacional sob liderança de suas respectivas sociedades acadêmicas. Surgem, então, os primeiros estudos com grandes séries de casos sobre as manifestações cutâneas mais prevalentes, incluindo sugestões de classificações em grupos, conforme o padrão clínico e mecanismos fisiopatológicos. Tais estudos foram fundamentais na compreensão inicial da relação entre dermatologia e COVID‐19, e são referências importantes até o presente momento. Os principais dados desses estudos estão reunidos na tabela 3.
Grandes séries nacionais e internacionais sobre as manifestações cutâneas
| Autor | País | n | Casos confirmados | Erupção maculopapular | Urticari‐forme | EP‐símile | Vesiculo‐bolhosa | Livedo‐púpura‐necrose |
|---|---|---|---|---|---|---|---|---|
| Galvan‐Casas et al.26 | Espanha | 375 | 234 (62,4%) | 47% | 19% | 19% | 9% | 6% |
| Masson et al.27 | França | 277 | 25 (9%) | 9% | 9% | 75% | 15% | 4% |
| Freeman et al.28 | EUA +31 países | 716 | 171 (23,8%) | 45%a | 16% | 18% | 11% | 6,4% |
| Manzano et al.29 | Itália | 200 | 120 (62%) | 25,7% | 10,2% | 24,6% | 15,5% | 9%b |
| Visconti et al.30 | Reino Unido | 11544 | 694 (6%) | 41,2%c | 30% | 23,1% | c | – |
EP‐símile, eritema pérnio símile.
A primeira grande série retrospectiva foi publicada em 29/04/20 por Galván‐Casas et al.,26 amplamente divulgada, contendo um atlas dermatológico. Com o apoio da Academia Española de Dermatología y Venereología, dermatologistas de toda a Espanha incluíram imagens de lesões de pele de 375 pacientes com COVID‐19 (suspeitos ou confirmados), agrupados em cinco padrões principais: erupções maculopapulares (47%), urticariformes (19%), EP‐símile (19%), vesico‐bolhosas (9%), e livedo/necrose (6%).
O padrão mais encontrado foi de erupções maculopapulares, com início concomitante aos sintomas gerais e duração média de 8,6 dias, em semelhança aos quadros urticariformes. Ambos não foram considerados úteis para o diagnóstico da COVID‐19 por serem manifestações inespecíficas, comuns a outras afecções frequentes, como reações adversas a medicamentos e outras infecções virais.
As lesões EP‐símile ocorreram em pacientes mais jovens com quadros sistêmicos leves, de surgimento tardio (média 12,7 dias do início dos sintomas gerais) e duração prolongada. Apenas 1 dos 71 casos relatava EP prévio. Teriam valor como marcador epidemiológico e não diagnóstico.
As lesões vesiculares surgiram antes dos sintomas gerais em 15% dos casos dessa série, com duração média de 10,4 dias e relativa especificidade diagnóstica, já que são manifestações cutâneas não relatadas nos exantemas virais.
Livedo/necrose incluem uma gama variável de apresentações relacionadas com a COVID‐19 ou às suas complicações, como estado de hipercoagulabilidade e dano vascular. Estão associadas com faixa etária elevada e maior mortalidade.
Embora haja grande mérito pelo pioneirismo e expressivo número de casos, a inclusão de pacientes não confirmados para COVID‐19 (suspeitos), em sua maioria ambulatoriais, avaliados por registro fotográfico, sem análise histológica ou exclusão dos principais diagnósticos diferenciais é uma limitação do estudo.
FrançaEm 04/05/20, de Masson et al.,27 com apoio da Société Française de Dermatologie, publicaram um estudo retrospectivo observacional em forma de carta que incluiu imagens de manifestações cutâneas de 277 pacientes com COVID‐19 (252 suspeitos e 25 confirmados) de clínicas privadas de toda a França. Surpreendentemente, as lesões EP‐símile corresponderam à grande maioria dos casos (75%), relatadas inclusive como manifestação única da doença. Estudo histológico realizado em três casos mostrou dermatite de interface liquenoide com a presença de microtrombos. Outros padrões cutâneos encontrados foram: vesicular (15%), urticariforme (9%), morbiliforme (9%), petequial (3%), livedo reticular (1%), outros (15%). Alguns pacientes foram contabilizados em mais de uma categoria. Vale lembrar que os franceses foram os primeiros a descrever as lesões EP‐símile relacionadas com a COVID‐19, o que poderia ser um viés para a alta frequência apresentada nesse estudo, não reprodutível nos demais trabalhos semelhantes. Além disso, a elevada prevalência das lesões EP‐símile provavelmente reflete‐se na grande porcentagem de casos não confirmados incluídos na análise, uma vez que tais lesões predominam em quadros oligo ou assintomáticos da COVID‐19, que habitualmente são pouco testados quanto à confirmação laboratorial da infecção por SARS‐CoV‐2.
EUA/internacional (31 países)Em colaboração com a American Academy of Dermatology e com a International League of Dermatological Societies, Freeman et al.28 coletaram dados de 716 casos de 31 países por meio de registro eletrônico, resultados publicados em 02/07/20. Dermatologistas forneceram dados de 54% dos casos (89% de todos os registros eram provenientes dos EUA). Apenas 34 pacientes hispânicos/latinos e 13 afro‐americanos foram incluídos, comprometendo a diversidade racial necessária para a compreensão das manifestações cutâneas. Apenas 171 pacientes eram COVID‐19 confirmados, com as seguintes manifestações e suas frequências: morbiliforme (22%), EP‐símile (18%), urticariforme (16%), eritema macular (13%), vesicular (11%), papuloescamoso (9,9%) e púrpura retiforme (6,4%). A maioria das manifestações cutâneas teve início concomitante aos sintomas gerais. No entanto, em 12% as lesões de pele foram os primeiros sintomas da doença, mostrando a possível importância das lesões cutâneas como marcador para o diagnóstico precoce da COVID‐19. Com relação à gravidade, as lesões EP‐símile associaram‐se a quadros sistêmicos mais leves e os casos com púrpura retiforme estavam 100% hospitalizados. Estudo histopatológico foi realizado em 14 casos confirmados. As limitações apresentadas pelo próprio estudo foram: viés do avaliador, impossibilidade de estimar frequência/prevalência das manifestações cutâneas, baixa taxa de casos COVID‐19 confirmados (25%) e pouca diversidade étnica, apesar da aparente alta representatividade por 31 países.
ItáliaEm semelhança à Espanha e França, em 18/01/21 a Società Italiana di Dermatologia medica, chirurgica, estetica e delle Malattie Sessualmente Trasmesse também coordenou um estudo nacional que reuniu dados de 200 pacientes com manifestações cutâneas. Um dos critérios de inclusão para Marzano et al.29 foi a presença de lesões de pele relacionada com a COVID‐19, confirmada por um dermatologista experiente; 62% apresentavam diagnóstico confirmado de COVID‐19. Os principais padrões identificados foram: erupção maculopapular/exantema morbiliforme (25,7%), EP‐símile (24,6%), erupção papulovesicular (15,5%), urticariforme (10,2%), púrpura/vasculite (6,9%), livedo reticular/racemoso (2,1%) e outros (15%), que incluíram pitiríase rósea símile, eritema multiforme símile, eritema nodoso símile, paniculite e angioedema. Não foram identificadas lesões mucosas. O quadro cutâneo surgiu, em média, 14 dias após o início dos sintomas sistêmicos e durou, em média, 12 dias. As lesões EP‐símile apresentaram duração maior em relação aos demais padrões, ocorreram em faixa etária mais jovem e representaram menor risco de desenvolver doença sistêmica grave – todos fatores com significância estatística. A idade média dos grupos livedo reticular/racemoso e erupção maculopapular/exantema morbiliforme também foi maior (p<0,01). Uma limitação do estudo é a ausência de confirmação diagnóstica da infecção por SARS‐CoV‐2 em 36,5% da amostra, por fatores econômicos que limitaram a ampla testagem diagnóstica na Itália e em diversos outros países.
Reino UnidoPor fim, o estudo populacional mais recente, com números bastante expressivos, cujos resultados geraram muita repercussão, foi publicado em 14/01/21 por Visconti et al.,30 com dados de todo o Reino Unido e desenho distinto das publicações citadas anteriormente.
O primeiro braço do estudo coletou dados de 336.847 usuários do aplicativo “COVID Symptom Study”, em que indivíduos forneceram informações epidemiológicas, laboratoriais e clínicas, dentre elas acerca da presença ou não de lesões de pele identificadas pelo próprio usuário. Apenas 2.021 (7,4%) usuários apresentavam confirmação laboratorial de COVID‐19; desses, 178 (8,8%) relataram lesões cutâneas. A prevalência foi ligeiramente maior entre as mulheres. Além disso, a prevalência de lesões na pele foi significativamente maior entre os que testaram positivo para SARS‐CoV‐2 em comparação aos que testaram negativo, o que justificaria a inclusão do acometimento cutâneo na lista dos sintomas de suspeição da COVID‐19, por seu fator preditivo diagnóstico, independentemente da frequência com que ocorra.
O segundo braço do estudo procurou investigar com detalhes as manifestações cutâneas por meio de questionário dirigido aos usuários que as relataram e o compartilhamento de fotos. Dentre os 11.544 questionários respondidos, apenas 694 (6%) apresentavam diagnóstico confirmado de COVID‐19. Nesse grupo, embora a maioria tenha referido início das lesões cutâneas juntamente ou logo após os sintomas gerais, 17% relataram que as lesões de pele surgiram antes dos sintomas sistêmicos, e em 21% o quadro cutâneo foi o único sintoma. No entanto, o estudo não trouxe informações adicionais detalhadas sobre tais constatações. Não houve descrição sobre quais foram as manifestações cutâneas ocorridas previamente aos sintomas gerais e quanto tempo antes elas surgiram. Tampouco especificou quais foram as lesões de pele consideradas pelo próprio indivíduo como manifestação única da COVID‐19 ou esclareceu o motivo pelo qual foi realizada a confirmação laboratorial da doença na ausência de qualquer sintoma suspeito.
Nesse mesmo braço do estudo, 2.328 usuários compartilharam fotos das lesões cutâneas, 260 imagens foram selecionadas de modo randomizado para análise por dermatologistas e, dessas, 30 foram descartadas por não serem atribuíveis à infecção pelo SARS‐CoV‐2 – p. ex., acne, molusco contagioso, herpes‐zóster, eczema, dermatite perioral, impetigo, dermatofitose –, o que mostra a limitação do próprio usuário como avaliador das lesões de pele. As imagens finais foram avaliadas por quatro dermatologistas experientes. A apresentação dermatológica mais frequente foi erupções papulosas (41,2% incluindo eritemato‐papulosas e eritemato‐vesiculosas), urticariformes (30%) e acrais (23,1%).
Até o momento, essa é a primeira e única publicação de impacto que afirma a frequência e a relevância das lesões cutâneas como única manifestação da infecção por SARS‐CoV‐2. Portanto, são necessários cautela e estudos mais aprofundados sobre o tema para compreendermos sua real importância e impacto no diagnóstico da COVID‐19.
A natureza do estudo apresenta quatro principais limitações: dados baseados na autoavaliação, não representativos da população geral, desconsiderou manifestações dermatológicas raras e a impossibilidade de excluir diagnóstico diferenciais importantes, como reação adversa a medicamentos.
Estudos prospectivosSão poucos estudos prospectivos sobre manifestações cutâneas associadas à COVID‐19 publicados até o momento. Tal metodologia ofereceria informações mais fidedignas sobre a real prevalência das lesões cutâneas e os padrões identificados, especialmente por meio da busca ativa de lesões cutâneas pelo especialista.
Ainda assim, diferentes prevalências, proporções e classificações de manifestações cutâneas diagnosticadas por dermatologistas em pacientes com infecção confirmada por SARS‐CoV‐2 de maneira prospectiva foram relatadas. De Giorgi et at.31 avaliaram 678 pacientes em hospitais na Itália e na China com frequência de 7,8% de presença de lesões cutâneas – 44% identificadas ao diagnóstico de COVID‐19 e 56% nos dias subsequentes, em média após 11,7 dias. O achado mais frequente foi o exantema (70%), seguido de lesões urticariformes (26%) e vesiculares (4%). Todos os casos de exantema melhoraram espontaneamente em dois a cinco dias. Rehktman et al.32 avaliaram 296 pacientes em dois hospitais em Nova York, com frequência de 11,8% de lesões cutâneas nas seguintes proporções: úlceras (37,1%), púrpura (25,7%), necrose (14,3%), eritema inespecífico (11,4%), erupção morbiliforme (11,4%), EP‐símile (11,4%) e vesículas (2,9%). Já Méndez‐Maestro et al.33 avaliaram 75 pacientes em hospital espanhol, dos quais 14 (18,7%) apresentavam lesões de pele possivelmente associada à COVID‐19: EP‐símile (42,8%), erupção maculopapular (28,6%), urticariforme (14,3%), livedo reticular símile (7,15%) e vesicular (7,15%). Por fim, Nuno‐Gonzales et al.34 avaliaram 666 pacientes, também em ambiente hospitalar na Espanha, e relataram a altíssima frequência de 45,65% de lesões mucocutâneas. No entanto, o estudo incluiu alterações bastante inespecíficas tanto mucosas (p. ex., papilite, glossite, estomatite, despapilação, mucosite) como cutâneas (p. ex., descamação e máculas eritemato‐acastanhada palmoplantares).
No Brasil, até o momento não há dados sobre a prevalência de lesões cutâneas. Avancini et al.35 relataram que dentre os 86 pacientes internados em um centro de referência com infecção confirmada por SARS‐CoV‐2 para os quais foi solicitada avaliação da equipe de dermatologia, em nenhum foi possível atribuir correlação direta entre as lesões de pele e a COVID‐19, uma vez que o perfil de dermatoses encontrado se assemelhou ao período pré‐pandemia. Cinco pacientes apresentaram exantema indistinguível de reação medicamentosa e um apresentou lesões EP‐símile, porém com antecedente pessoal de lúpus eritematoso sistêmico.
Revisões sistemáticasA grande quantidade de publicações em um curto período de tempo tornou possível que já no final de 2020 surgissem os primeiros estudos de revisões sistemáticas sobre as manifestações cutâneas da COVID‐19, com o intuito de reunir e compilar os resultados até então, produzindo dados com maior evidência cientifica. Ainda assim, as conclusões são divergentes.
Em dois artigos de revisão sistemática, a prevalência de lesões de pele em pacientes com COVID‐19 foi bastante semelhante: 5,69 e 5,95%.36 No entanto, mesmo os estudos de metanálise ainda diferem sobre quais seriam as manifestações cutâneas mais frequentes. A maioria das revisões sistemáticas encontrou maior frequência das erupções maculopapulares: 37,1%36 e 48%, seguida das lesões vasculares (incluindo EP‐símile): 23% e 33%.37 No entanto, outros afirmam que o padrão mais comum seria o de lesões EP‐símile (51,5%).38 Os quadros urticariformes, vesiculares e livedo/necrose são tidos como mais raros.36–38
Em sua revisão sistemática, Jamshidi et al.36 concentraram‐se nos fatores prognósticos associados aos diferentes padrões de manifestações cutâneas. As erupções maculopapulares associam‐se a quadros leves de COVID‐19 em 48% dos casos, assim como os padrões urticariforme e EP‐símile. Pacientes com lesões vasculares do espectro livedo, púrpura e necrose apresentaram a maior mortalidade (18,2%) e aqueles com lesões urticariformes, a menor (2,2%). Sobre o tempo de surgimento das manifestações cutâneas, em sua grande maioria (92%) ocorrem em até quatro semanas do início dos sintomas gerais da COVID‐19, especialmente nos primeiros dias e até duas semanas nos casos dos exantemas e urticárias. Já as lesões EP‐símile são mais tardias e surgem entre a segunda e quarta semanas, assim como as púrpuras e a necrose. Em 8 a 10%37 dos casos as manifestações cutâneas podem preceder, em média, por três dias os sintomas clínicos – são, portanto, possivelmente úteis como indicadores para o diagnóstico precoce da COVID‐19. É importante ressaltar que quase a totalidade dos estudos incluídos nas revisões sistemáticas é originária da Europa e dos EUA, com raros relatos da Ásia e América Latina (pela escassez de dados publicados), o que poderia gerar um viés.
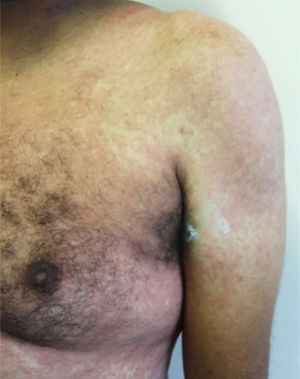
Principais manifestações cutâneas associadas à COVID‐19Erupção maculopapularNa maioria dos estudos é considerada a manifestação cutânea mais frequente na COVID‐19. Engloba quadros de exantema (fig. 1), rash, pápulas difusas, pitiríase rósea símile, eritema multiforme símile, entre outros. Habitualmente, surge nos primeiros dias de sintomas gerais da infecção viral ou em até duas semanas, embora haja relatos esporádicos de surgimento tardio (após um mês). Correlaciona‐se com quadros sistêmicos leves e tem melhora espontânea em sete a dez dias,26 sem necessidade de tratamento específico.
Embora sejam manifestações frequentes, são altamente inespecíficas uma vez que outras infecções virais são causas comuns de exantemas, bem como as reações adversas a medicamentos. Discute‐se na literatura a necessidade de excluir tais diagnósticos diferenciais antes de atribuirmos o quadro cutâneo unicamente à COVID‐19, mesmo em casos confirmados da doença. Outro fator de confusão é a reativação viral que ocorre nos casos de farmacodermia, como a ativação de HHV‐6 nos quadros drug reaction with eosinofilia and systemic symptoms (DRESS). Uma hipótese seria que a infecção por SARS‐CoV‐2 levaria a uma reativação de vírus latentes, como o HHV‐6, e assim predisporia a um quadro de reação adversa a medicamentos.25,39
Eritema pérnio (EP) símileSem dúvida, são as manifestações mais relatadas em grandes séries de casos na literatura.40,41 Com a chegada da pandemia de COVID‐19 na Europa, observou‐se uma explosão de casos semelhantes ao eritema pérnio “clássico”, porém com características peculiares, distintas da forma clássica: predomínio em crianças e jovens, em época de temperaturas amenas (primavera), sem antecedente pessoal de eritema pérnio, colagenoses ou outras condições predisponentes. Foi descrito, então, o EP‐símile associado à COVID‐19. Desde então, há inúmeras publicações sobre o tema, inclusive mostrando a presença do spike viral nas lesões cutâneas,17 mesmo em pacientes com PCR negativo (swab). O EP‐símile é mais frequente em crianças e adultos jovens, saudáveis, oligo ou assintomáticos para COVID‐19, e pode ser a única manifestação da doença. Portanto, na presença dessas lesões, sugere‐se que a infecção por SARS‐CoV‐2 seja investigada. Surge em média após 10 a 14 dias dos sintomas gerais, duram em média 14 dias, com melhora espontânea.41 A maioria dos pacientes (em algumas séries, até a totalidade) apresentam pesquisa viral por PCR (swab) negativa. Tal fato poderia ser explicado pela baixa carga viral encontrada habitualmente nos quadros oligo ou assintomáticos de COVID‐19 nas crianças e nos estágios mais tardios da doença (após 10 a 14 dias do início dos sintomas). Por outro lado, a ausência de positividade de PCR, portanto, da confirmação laboratorial da infecção por SARS‐CoV‐2, levanta a dúvida se esses pacientes realmente foram infectados. Estudos de imuno‐histoquímica e imunofluorescência podem contribuir para elucidar a relação entre o EP‐símile e a COVID‐19.42
Recentemente, a relação entre o EP‐símile e a infecção por SARS‐CoV‐2 tem sido bastante questionada na literatura. Uma das principais controvérsias é justamente a ausência de comprovação de infecção pelo SARS‐CoV‐2 nesses pacientes. Foram publicadas séries de casos de EP‐símile em que não havia nenhuma evidência epidemiológica, clínica ou laboratorial que corroborasse para o diagnóstico de COVID‐19,43 ou mesmo sorológica, que poderia contribuir para a fisiopatologia do EP‐símile.44 Embora a presença do spike viral nas lesões de EP‐símile já tenha sido mostrada por técnicas de imuno‐histoquímica, e inclusive a estrutura viral completa identificada por microscopia eletrônica, esses foram relatos pontuais na literatura – a grande maioria das publicações sobre EP‐símile não conta com essa evidência. Sobre a fisiopatologia, no início da pandemia as lesões EP‐símile, livedo, púrpura e necrose foram interpretadas como fases de um mesmo espectro de acometimento cutâneo. Atualmente, acredita‐se que elas tenham mecanismos fisiopatológicos distintos.45
Lesões urticariformesAs infecções, inclusive virais, são fatores desencadeantes já conhecidos de lesões urticariformes. Nesse sentido, a infecção por SARS‐CoV‐2 poderia ser um novo fator desencadeante. São relatados quadros de urticária associados à COVID‐19 em pacientes sem relatos prévios da doença. Um estudo em uma clínica privada relatou aumento da incidência dos casos de urticária diagnosticados durante a pandemia, porém não foi realizada investigação quanto à presença de COVID‐19 nesses pacientes. Clinicamente, as lesões são disseminadas, indistintas das demais causas, e o angioedema é raro. Estima‐se que em 10% dos pacientes o quadro cutâneo possa preceder em alguns dias os sintomas gerais de COVID‐19 e que, portanto, a detecção das lesões de pele poderia favorecer o diagnóstico precoce da infecção. Porém, em sua grande maioria, as lesões urticariformes surgem concomitantemente aos demais sintomas. Não há predileção por faixa etária e associa‐se a quadros sistêmicos leves, com baixa mortalidade. É relatada melhora espontânea em sete dias, ou com uso de anti‐histamínicos e/ou corticoide sistêmico em baixa dose.46
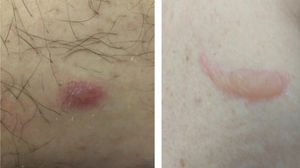
Erupções vésico‐bolhosasEmbora raras, as erupções vesico‐bolhosas são consideradas padrão específico de lesão cutânea associada à COVID‐19, uma vez que não são comumente observadas nos exantemas virais e por farmacodemia (principais diagnósticos diferenciais). São quadros de vesículas ou bolhas localizadas (fig. 2) ou disseminadas, que podem acometer região palmoplantar, poupando mucosas. Têm início cerca de três dias após os sintomas gerais e perduram por 7 a 14 dias, com melhora espontânea. Associam‐se a quadro sistêmico leve a moderado. Em uma série de casos, tentou‐se isolar o agente viral por técnica de PCR do conteúdo da bolha, sem sucesso. É fundamental excluir outras infecções virais, especialmente a herpética, uma vez que já foi relatado um caso de herpes disseminado com pneumonia em paciente com COVID‐19, mostrando a importância do diagnóstico diferencial.47
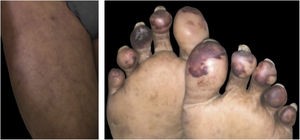
Livedo, púrpura, necroseAs manifestações cutâneas vasculares associadas à COVID‐19 compreendem um amplo espectro, que varia desde livedo reticular transitório a fixo, livedo racemoso, púrpuras e necrose de extremidades (fig. 3). São manifestações raras associadas a quadros sistêmicos graves, que ocorrem de maneira tardia em pacientes idosos, internados em ambiente de terapia intensiva, com múltiplas comorbidades e alterações laboratoriais (exemplo: coagulopatias, elevação de D‐dímero). Frequentemente, associam‐se a outros eventos trombóticos como trombose venosa profunda, acidente vascular encefálico (AVE) isquêmico e coagulação intravascular disseminada, que são responsáveis pela elevada mortalidade nesae grupo. Assim, os achados cutâneos em pacientes com doença potencialmente fatal são bastante específicos e distintos do perfil ambulatorial. Isso acontece pois provavelmente os mesmos mecanismos microangiopáticos e trombóticos ocorrem simultaneamente nos principais órgãos‐alvo, como pulmão e rim e na pele. Desse modo, o tratamento das lesões cutâneas consiste no tratamento da própria doença de base.16,22,26 Um resumo das principais características das manifestações dermatológicas acima descritas encontra‐se na tabela 4.
Principais características das manifestações cutâneas associadas à COVID‐19
| Quadro dermatológico | Frequência | Faixa etária | Quadro sistêmico | Surgimento das lesõesa | |
|---|---|---|---|---|---|
| Erupção maculopapular | Exantema, rash, pápulo‐escamoso, pitiríase rósea símile, eritema multiforme símile | 9%–47%26‐30 | Adultos | Leve | 0–14 dias |
| Pseudo eritema pérnio | Máculas violáceas nas extremidades em temperaturas amenas | 18%–75%26‐30 | Crianças e jovens | Leve ou assintomático | Após 10–14 dias |
| Urticária | Indistinto das demais formas de urticária, angioedema é raro | 9%–30%26‐30 | Adultos | Leve | Pré ou 0–14 dias |
| Vésico‐bolhosas | Varicela símile | 9%–15%26‐30 | Adultos | Leve a moderado | Pré ou 0–7 dias |
| Livedo, púrpura, necrose | Livedo reticular fixo, racemoso; púrpura, vasculite; necrose de extremidades | 4%–9%26‐30 | Idosos | Grave | Após 10–14 dias |
Lesões orais durante o curso da COVID‐19 também foram descritas e reunidas em artigos de revisão. Sabe‐se que o SARS‐CoV‐2 pode ser detectado na saliva por técnica de PCR – inclusive, atualmente, para fins diagnósticos. Além disso, o ACE2 (receptor funcional viral no organismo) está presente na mucosa oral, com maior densidade no dorso da língua e glândulas salivares menores, o que justificaria a presença de lesões mucosas. Disgeusia foi o primeiro sintoma oral reconhecido na COVID‐19, com frequência amplamente variável de 5 a 88%. Posteriormente, foram também descritas inúmeras lesões orais, das quais as mais frequentes foram: enantema, petéquias, lesões aftoides ou úlceras, herpetiformes, candidíase e lesões orais associadas a doença de Kawasaki. Geralmente são sintomáticas (dor, queimação ou prurido) e surgem quatro dias antes ou até 12 semanas após os sintomas gerais. O tratamento depende do padrão de lesão encontrado. Higiene oral inadequada, imunossupressão, reativação de vírus latentes (p. ex., herpes‐vírus), infecções oportunistas, estresse, trauma secundário a intubação, resposta hiperinflamatória da COVID‐19 são fatores predisponentes. São necessários mais estudos para definir quais manifestações orais estão diretamente ligadas à infecção pelo SARS‐CoV‐2 e quais são indiretas, devido à presença de outras afecções mucosas que, nestes casos, ocorrem no contexto da COVID‐19. Nesse sentido, é fundamental a investigação para excluir tais condições. Sugere‐se que manifestações induzidas pelas alterações vasculares e microtrombos, como petéquias e úlceras, e o enantema (em semelhança ao exantema viral) possam estar associadas diretamente à fisiopatologia do SARS‐CoV‐2.34–48
Eflúvio telógeno e COVID‐19Amplamente e há muito tempo conhecido na Dermatologia, o eflúvio telógeno (ET) pode ser desencadeado por alterações metabólicas, nutricionais, medicamentosas e inúmeras condições sistêmicas, entre elas as infecções. Na COVID‐19, cogita‐se que as citocinas inflamatórias liberadas e o uso de medicações, como a heparina, possam estar envolvidas no mecanismo do ET. Há relato de aumento da incidência do ET em quase três vezes durante a pandemia. Estima‐se que 10% dos pacientes com COVID‐19 evoluam com ET nas semanas e meses subsequentes à infecção, especialmente nos pacientes com comorbidades, mas podem ocorrer inclusive nos quadros subclínicos. Até o momento, as informações sobre o início, evolução e prognóstico do ET associado a COVID‐19 são indistintas do ET por outras causas já conhecidas. Não há nenhuma peculiaridade ou característica específica no ET induzido pela infecção por SARS‐CoV‐2. Portanto, a abordagem, o tratamento e o seguimento desses pacientes devem ser os mesmas adotados para o ET na prática dermatológica.49,50
Relatos dos casosAlém das manifestações mais descritas e agrupadas em “padrões” nas grandes séries de casos, estudos prospectivos e de revisão sistemática, existem inúmeros relatos de casos isolados na literatura sobre diversos quadros cutâneos possivelmente associados à COVID‐19. Em função da limitação metodológica inerente às publicações do tipo relato de casos, não se pode afirmar o real papel da infecção pelo SARS‐CoV‐2 nessas entidades – ou seja, se são de fato atribuíveis à COVID‐19 ou não. As condições isoladamente associadas à COVID‐19 publicadas em relatos de casos encontram‐se reunidas na tabela 5.
Condições dermatológicas associadas à COVID‐19 – Relatos de casos
| Urticariformes | Vasculites e púrpuras | Farmacodermias símile | Topografias específicas | Outras |
|---|---|---|---|---|
| Urticária | Vasculite leucocitoclástica | Eritema multiforme | Ungueal (red half‐moon sign) | Pitiríase rósea símile |
| Urticária vasculite | Vasculite por IgA | SDRIFE | Eritrodisestesia palmoplantar | Doença de Grover |
| Angioedema | Granulomatose eosinofílica com poliangeíte | NET | Erupção folicular | Síndrome de Melkersson‐Rosenthal |
| Granulomatose com poliangeíte | PEGA | Exantema unilateral | Síndrome de Gianotti‐Crosti | |
| Púrpura de Schamberg | Livedo Unilateral | Eritema anular centrífugo | ||
| Púrpura fulminans | Eritema nodoso | |||
| Liquen plano anular | ||||
| Lesão sarcoídea | ||||
| Granuloma anular | ||||
| Alopécia areata |
SDRIFE, symmetrical drug‐related intertriginous and flexural exanthema; NET, necrólise epidérmica tóxica; PEGA, pustulose exantemática generalizada aguda.
Os primeiros relatos foram de casos de urticária, inclusive precedendo os sintomas clínicos,51 urticária vasculite52 e angioedema.53 Casos de pitiríase rósea ou lesões pitiríase rósea símile54, sendo que um relato mostrou a presença do SARS‐CoV‐2 por técnicas imuno‐histoquímicas,55 e outro apontou para o possível papel da reativação do HHV‐6 e outros vírus nesses quadros.56
Há também relatos de vasculites de pequenos vasos associadas à COVID‐19,57 vasculite leucocitoclástica,58 vasculite por IgA,59 granulomatose com poliangeíte (antes chamada de doença de Wegener),60 granulomatose eosinofílica com poliangeíte (antes chamada de síndrome de Churg‐Strauss),61 púrpura de Schamberg62 e púrpura fulminans.63
Sobre os quadros que se assemelham a farmacodermias, foram descritos pacientes com COVID‐19 e eritema multiforme,64 série de casos de pustulose exantemática generalizada aguda (PEGA),65 relatos de necrólise epidérmica tóxica (NET)66 e SDRIFE (symmetrical drug‐related intertriginous and flexural exanthema).67
Há também relatos de caso em topografias específicas – acometimento ungueal, com descrição do “red half‐moon sign”;68 acometimento palmoplantar com eritrodisestesia;69 erupção folicular,70 exantema unilateral,71 livedo reticular unilateral72 e úlceras de pressão em localizações não usuais (como esterno, joelhos) por pronação prolongada.73 Foram publicadas descrições dermatoscópicas de erupção papular purpúrica74 e lesões EP‐símile.75
Há ainda relatos de herpes‐zóster76 e relatos isolados de quadros semelhantes a doença de Grover,77 síndrome de Melkersson‐Rosenthal,78 eritema nodoso,79 lesão sarcoídea,80 síndrome de Gianotti‐Crosti,81 dermatite seborreica,82 líquen plano anular,83 eritema anular centrífugo,84 granuloma anular85 e alopecia areata rapidamente progressiva.86
Histopatologia das manifestações cutâneas da COVID‐19Alguns estudos trazem as primeiras descrições sobre as alterações histopatológicas e imuno‐histoquímicas das lesões de pele associadas à COVID‐19, com o intuito de colaborar para a compreensão dos mecanismos fisiopatológicos das manifestações. A seguir, serão brevemente citadas as principais alterações histológicas dos padrões cutâneos mais descritos.87
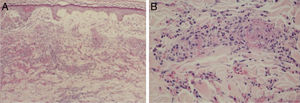
Erupções máculo‐papularesDermatite perivascular superficial com discreta linfocitose, vasos trombosados com debris neutrofílicos e eosinofílicos; dermatite de interface, infiltrado linfocítico perivascular superficial e profundo, com ou sem vasculite (fig. 4).
Achados histopatológicos de exantema em paciente com COVID‐19. (A), Presença de vasculite leucocitoclástica dos vasos capilares da derme superficial e eritrodiapedese (Hematoxilina & eosina, 100×). (B), Em detalhe vasos capilares contendo neutrófilos íntegros e degenerados destruindo parcialmente a parede, hemácias extravasadas e a presença de material amorfo eosinofílico no lúmen vascular sugestivo de trombo de fibrina (Hematoxilina & eosina, 400×).
Na epiderme, presença de paraqueratose e hiperqueratose, com queratinócitos apoptóticos e, eventualmente, necrose epidérmica. Infiltrado linfocítico denso na derme superficial e profunda, também na hipoderme, com padrão perivascular e sinais de ativação endotelial. Por vezes, infiltrado linfocítico écrino semelhante ao observado na hidradenite écrina linfocítica. Outros achados frequentes são: eritrodiapedese, edema na derme papilar com formação de bolha subepidérmica e aumento do depósito de mucina intersticial. Raramente há presença de microtrombos vasculares nos capilares da derme superficial e vênulas dérmicas.
Erupções urticariformesInfiltrado linfocítico perivascular com alguns eosinófilos e edema na derme superficial, eventualmente com dermatite de interface vacuolar e necrose de queratinócitos, com padrão semelhante ao do eritema multiforme. Na urticária vasculite há extravasamento de hemácias com infiltrado neutrofílico perivascular, macrófagos, necrose e depósito de fibrina.
Erupções vesicularesAcantose, vesículas por degeneração vacuolar da camada basal com células disqueratóticas, multinucleadas (sugestivas de inclusão viral) sem infiltrado inflamatório. Nesses casos, é fundamental o diagnóstico diferencial com as dermatoviroses herpéticas.
Livedo, púrpuraVasculopatia trombótica com extensa deposição de C5b‐9 e C4d (técnica imuno‐histoquímica) na microvasculatura.
Andrógenos e COVID‐19Durante toda a pandemia observou‐se que a infecção por SARS‐CoV‐2 afetava mais homens do que mulheres. Os homens têm duas vezes mais chance de serem admitidos em unidades de terapia intensiva (UTI). A associação entre a via dos andrógenos e a infectividade do SARS‐CoV‐2 já foi descrita. Portanto, tal predisposição à infecção mediada pelos andrógenos poderia justificar as altas taxas de internação e mortalidade concentradas nos homens. Assim, a expressão androgênica em forma de alopecia (alopécia androgenética – AGA) poderia, por si só, ser um fator de risco para a COVID‐19, e já foi relatada alta frequência de AGA entre homens internados. Além disso, o uso de anti‐andrógenos poderia ser um fator protetor e/ou terapêutico na evolução desses pacientes. Nesse sentido, estudo publicado mostrou que homens com AGA ou hiperplasia prostática benigna em uso sistêmico de inibidor de 5‐alfa‐redutase que contraíram COVID‐19 apresentaram redução importante dos sintomas no contexto ambulatorial. Em estudo caso‐controle em ambiente hospitalar, homens em uso de inibidor de 5‐alfa‐redutase tiveram menor chance de serem admitidos em UTI, sugerindo tal efeito protetor. No entanto, ainda é incerto se a introdução de antiandrógenos após a infecção por SARS‐CoV‐2 teria algum benefício. Aparentemente, os dermatologistas deveriam encorajar seus pacientes com AGA a manterem o uso de antiandrógenos durante a pandemia. Esse é, sem dúvida, um campo de pesquisa bastante promissor.88–90
Considerações finaisEmbora o número de publicações em um curto intervalo de tempo seja expressivo e crescente, ainda há muitas perguntas desafiadoras sobre as manifestações cutâneas associadas à COVID‐19. A verdadeira frequência dos achados cutâneos é amplamente variável (0,2 a 45%) na literatura; os estudos de revisão sistemática apontam para frequência próxima a 6%. As manifestações dermatológicas mais encontradas foram as erupções maculopapulares, seguidas das lesões EP‐símile. No entanto, há publicações que trazem as lesões EP‐símile como as manifestações mais prevalentes. Os quadros de erupções urticariforme, vesicular e livedo, além de púrpura e necrose são menos descritos. Quanto ao tempo de surgimento, as lesões cutâneas são habitualmente concomitantes aos sintomas gerais e raramente podem precedê‐los, como nos casos de urticária e lesões vesiculares. O EP‐símile pode surgir tardiamente ou, inclusive, ser a única manifestação clínica de COVID‐19. Os quadros vasculares como livedo, púrpura e necrose são igualmente tardios, porém associados a maior gravidade e pior prognóstico. Estudos histopatológicos e de imuno‐histoquímica dos diferentes padrões de lesões cutâneas em pacientes com COVID‐19 são fundamentais para melhor compreensão do seu significado fisiopatológico em relação à doença (causadas diretamente pela infecção viral decorrentes de complicações da doença sistêmica).
Vale ressaltar a importância da exclusão dos possíveis diagnósticos diferenciais diante de um paciente com COVID‐19 que apresente lesões de pele, antes que se atribua o quadro cutâneo exclusivamente à infecção viral. Quadros de urticária espontânea, demais infecções virais, farmacodermias, entre outros, devem ser considerados na investigação desses pacientes.
A contribuição da dermatologia à pandemia de COVID‐19 parece ir além das manifestações cutâneas. A estreita relação entre andrógenos e o curso da infecção por SARS‐CoV‐2 abre um promissor campo de pesquisa sobre seus fatores prognósticos e protetores, especialmente no tocante ao uso sistêmico dos antiandrógenos, amplamente prescritos na dermatologia.
A pandemia tem proporcionado uma excelente oportunidade para os dermatologistas aprenderem e contribuírem. Infelizmente, ela ainda não acabou. Como a ciência é um processo dinâmico, há a esperança de que mais estudos sejam desenvolvidos para que respostas possam ser encontradas e as incertezas resolvidas.
Suporte financeiroNenhum.
Contribuição dos autoresCamila Arai Seque: Concepção e desenho do estudo; análise e interpretação dos dados; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão do manuscrito.
Milvia Maria Simões e Silva Enokihara: Concepção e desenho do estudo; análise e interpretação dos dados; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; participação na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão do manuscrito.
Adriana Maria Porro: Concepção e desenho do estudo; análise e interpretação dos dados; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; participação na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão do manuscrito.
Jane Tomimori: Concepção e desenho do estudo; análise e interpretação dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; participação na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Seque CA, Enokihara MMSS, Porro AM, Tomimori J. Skin manifestations associated with COVID‐19. An Bras Dermatol. 2022;97:75–88.
Trabalho realizado no Departamento de Dermatologia da Universidade Federal de São Paulo, São Paulo, SP, Brasil.