O vitiligo é uma doença mucocutânea adquirida e progressiva, resultante da perda de melanócitos epidérmicos ativos. A síndrome metabólica (SM) afeta cerca de 25% da população mundial e está ligada a doenças inflamatórias da pele, incluindo o vitiligo. A proteína de ligação a ácidos graxos tipo 4 (FABP4) é uma chaperona lipídica intracelular e está intimamente associada à SM.
ObjetivosAvaliar o nível sérico de FABP4 em pacientes com vitiligo e sua relação com a SM nos casos investigados.
MétodosO presente estudo tipo caso‐controle foi conduzido em 45 pacientes com vitiligo não segmentar e 45 controles pareados. O perfil lipídico, a glicose no sangue e os níveis séricos de FABP4 foram medidos nesses indivíduos.
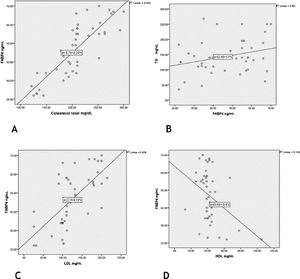
ResultadosHouve elevações significativas nos níveis de FABP4 (p < 0,001), colesterol (p < 0,001), triglicérides (p = 0,005) e glicose (em jejum [p = 0,001] e 2 horas pós‐prandial [p < 0,001]) em pacientes comparados aos controles. A SM foi significantemente mais prevalente em pacientes com vitiligo (p < 0,001) e associada a níveis séricos elevados de FABP4 (p = 0,037). Em pacientes com vitiligo, houve correlações positivas significativas entre os níveis séricos de FABP4 e triglicerídeos (p = 0,047), colesterol (p = 0,001) e LDL (p = 0,001) e correlação negativa em relação aos níveis de HDL (p = 0,009). O nível de FABP4 mostrou ser um bom teste diagnóstico para a detecção precoce de vitiligo (p < 0,001).
Limitações do estudoPequeno número de indivíduos estudados.
ConclusõesA FABP4 pode desempenhar um papel ativo no processo da doença vitiligo, que pode ser mediado por dislipidemia e hiperglicemia associadas. A FABP4 pode ser um marcador de vitiligo ajudando no diagnóstico precoce, mas não parece ser útil para determinar a gravidade e atividade do vitiligo, ou SM associada.
O vitiligo é uma doença mucocutânea progressiva adquirida e idiopática, caracterizada por dano aos melanócitos epidérmicos funcionantes. Em quase metade dos pacientes, o vitiligo se desenvolve antes dos 20 anos; entretanto, também pode ser observado em qualquer idade, com uma diferença não significativa entre os sexos.1
O vitiligo foi classificado como vitiligo segmentar (VS) e vitiligo não segmentar (VNS). No VNS, fatores genéticos de risco aumentado para autoimunidade foram descobertos por meio de estudo de genômica ampla.2 A regulação da resposta imune inata mais a diferenciação de células B, bem como sua ativação, foram demonstradas em VNS,3 e foram relatadas como sendo mais proeminentes no VNS do que no VS.4
A Fatty Acid‐Binding Protein 4 (FABP 4) é um membro de uma família de proteínas de 14‐15 kDa conhecidas como chaperonas lipídicas intracelulares. Elas regulam o tráfego de lipídios nas células.5 A FABP4, também chamada de proteína 2 de adipócitos, é formada por 132 aminoácidos. Ela representa cerca de 1% de todas as proteínas solúveis no tecido adiposo.6
A FABP4 tem a capacidade de se ligar reversivelmente a ligantes hidrofóbicos, como ácidos graxos de cadeia longa insaturados e saturados, bem como eicosanoides e outros lipídeos que protegem os organismos contra seu acúmulo prejudicial.7 A FABP4 é secretada por adipócitos e macrófagos e está intimamente associada à obesidade e à síndrome metabólica (SM).8
A SM é uma condição na qual a resistência à insulina é desenvolvida e, eventualmente, leva a problemas cardiovasculares.9 Cerca de 25% da população em todo o mundo é afetada pela SM, com uma subpopulação substancial ligada a muitas doenças inflamatórias da pele,10 incluindo vitiligo.11
Zhang et al.12 descobriram a existência de altos níveis de FABP4 sistêmica e local em pacientes com osteoartrite. No campo da dermatologia, Baran et al.13 relataram que os níveis séricos de FABP4 estavam significantemente aumentados em pacientes com psoríase. Como o vitiligo é considerado uma doença inflamatória, a proposta deste estudo é que, no vitiligo, a FABP4 pode atuar na interface das vias inflamatórias e metabólicas. Portanto, o objetivo deste estudo foi avaliar o nível sérico de FABP4 em pacientes com vitiligo e sua relação com SM.
Pacientes e métodosEste é um estudo caso‐controle realizado em 90 indivíduos. Eles incluíam 45 pacientes com diferentes tipos clínicos de VNS e 45 indivíduos saudáveis pareados por idade e gênero (grupo controle), selecionados do Ambulatório de Dermatologia. O diagnóstico de vitiligo foi feito com base na história do paciente e nas características clínicas típicas (máculas e manchas discretas, bem circunscritas, despigmentadas).
O estudo foi aprovado pelo Comitê de Direitos Humanos em Pesquisa da Universidade. Um termo de consentimento livre e informado por escrito foi obtido de cada participante ou de seus responsáveis (se < 18 anos) antes do início deste estudo.
Casos de VNS de ambos os sexos foram incluídos. Todo paciente incluído precisou interromper qualquer tipo de tratamento sistêmico (seis semanas) ou tópico (duas semanas) para vitiligo.
Indivíduos com doenças cutâneas imunoinflamatórias (por exemplo, psoríase, dermatite atópica) e/ou sistêmicas (por exemplo, da tireoide e do tecido conjuntivo) e aqueles que tinham recebido corticosteroides sistêmicos e/ou outros imunossupressores no último mês foram excluídos deste estudo.
Os pacientes estudados foram submetidos à anamnese. O índice de massa corporal (IMC) foi calculado dividindo‐se a massa corporal (quilogramas) pelo quadrado da altura corporal (metros).14 A medida da pressão arterial (PA) foi feita utilizando‐se um esfigmomanômetro de mercúrio padrão após os indivíduos terem descansado por pelo menos 10 minutos com o braço na altura do coração.
Exame dermatológico foi realizado para garantir o diagnóstico de vitiligo NS, determinar sua localização e identificar seu tipo (acrofacial, da mucosa, generalizado, universal ou misto). A gravidade e a atividade da doença foram avaliadas utilizando o índice de pontuação da área de vitiligo (VASI, do inglês Vitiligo Area Scoring Index) e a atividade da doença do vitiligo (VIDA, do inglês Vitiligo Disease Activity).
Para calcular o escore VASI, o corpo foi dividido em cinco regiões: mãos, extremidades superiores (excluindo as mãos), tronco, extremidades inferiores (excluindo os pés) e pés. As axilas foram incluídas nas extremidades superiores, enquanto as nádegas e as regiões inguinais foram incluídas nas extremidades inferiores. Uma unidade‐mão (a palma da mão mais a superfície volar de todos os dedos) foi usada como guia para estimar a porcentagem de acometimento de vitiligo (1%) em cada região corporal. A despigmentação dentro de cada área foi estimada em relação às seguintes porcentagens: 0 (pele pigmentada normal), 10% (pontos de despigmentação), 25% (área pigmentada excede a área despigmentada), 50% (áreas despigmentadas e pigmentadas são iguais), 75% (área despigmentada excede a área pigmentada), 90% (pontos de pigmento) e 100% (sem pigmento). O VASI foi calculado utilizando‐se esta fórmula: VASI = Σ (todas as partes do corpo) (unidades‐mão) × (despigmentação).15
O escore VIDA baseou‐se na opinião do próprio paciente sobre a atividade da doença ao longo do tempo. O vitiligo ativo inclui a extensão de lesões cutâneas existentes ou o aparecimento de novas. O escore foi classificado de +4 (ativo nas últimas seis semanas), +3 (ativo nos últimos três meses), +2 (ativo nos últimos seis meses), +1 (ativo no último ano), 0 (estável por pelo menos um ano) a −1 (estável por pelo menos um ano e repigmentação espontânea).16
Após jejum noturno, a pele sobre uma veia foi esterilizada com álcool 70% e, em seguida, 5mL de sangue venoso foram coletados de todos os indivíduos; 3mL de sangue venoso foram transferidos para um tubo simples, deixados em repouso por meia hora e, em seguida, centrifugados por 10min a 4.000rpm. O soro foi obtido para a determinação do perfil lipídico e o nível de FABP4, enquanto 2mL de sangue foram transferidos para tubos contendo fluoreto de sódio, centrifugados por 10min a 4.000rpm. O plasma foi obtido para a determinação da glicose em jejum. Outra amostra de sangue foi obtida para determinar a glicose 2 horas pós‐prandial. As amostras foram mantidas congeladas a −20°C até a análise.
O perfil lipídico incluindo triglicerídeos (TG), nível de colesterol e lipoproteínas como lipoproteínas de alta densidade (HDL) e lipoproteínas de baixa densidade (LDL), além de glicemia de jejum e 2 horas pós‐prandial no sangue foram medidos por um analisador químico automático (sistema AU480 de Beckman Coulter, EUA).
O diagnóstico de SM foi feito de acordo com a avaliação de TG, LDL, glicemia de jejum e pressão arterial como segue: TG ≥ 150mg/dL, nível de HDL‐C < 40mg/dL em homens ou < 50mg/dL em mulheres, pressão arterial ≥ 130/85mmHg e hiperglicemia de jejum (nível de glicose > 100mg/dL.17
O nível de FABP4 sérico foi analisado utilizando o kit Enzyme‐Linked Immunosorbent Assay (ELISA) (Quantikine® ELISA, R&D Systems, Inc., EUA e Canadá).
ResultadosDados clínicos dos indivíduos estudadosDos 45 pacientes incluídos no estudo, 20 (44,4%) eram do sexo feminino e 25 (55,6%) do masculino. A idade variou de 11 a 65 anos. O IMC variou de 19 a 37kg/m2. PA sistólica e diastólica variaram de 100 a 150 e de 60 a 90mmHg, respectivamente. Os pacientes e o grupo controle foram pareados quanto a idade, sexo, PA sistólica e diastólica (p > 0,05 para todos). Entretanto, o IMC foi significantemente maior nos pacientes do que nos controles (p < 0,001; tabela 1).
Dados clínicos dos indivíduos estudados
| Dados demográficos | Pacientes(n = 45) | Controles(n = 45) | Teste de significância | p‐valor |
|---|---|---|---|---|
| Sexo | ||||
| Masculino | 25 (55,6) | 27 (60,0) | χ2 = 0,18 | 0,670 |
| Feminino | 20 (44,4) | 18 (40,0) | ||
| Idade (anos) | ||||
| Média ± DP | 35,51 ± 15,98 | 32,89 ± 13,56 | U = 0,84 | 0,404 |
| Mediana | 34 | 30 | ||
| Variação | 11‐65 | 14‐65 | ||
| IMC (kg/m2) | ||||
| Média ± DP | 29,53 ± 5,02 | 23,89 ± 2,40 | t =6,80 | < 0,001a |
| Mediana | 29 | 24 | ||
| Variação | 19‐37 | 20–28 | ||
| PAS (mmHg) | ||||
| Média ± DP | 119,78 ± 15,15 | 117,56 ± 14,79 | t = 0,70 | 0,483 |
| Mediana | 120 | 120 | ||
| Variação | 100‐150 | 100–150 | ||
| PAD (mmHg) | ||||
| Média ± DP | 75,33 ± 8,69 | 77,11 ± 8,43 | t = 0,99 | 0,327 |
| Mediana | 70 | 80 | ||
| Variação | 60‐90 | 60–90 | ||
| Idade de início da doença (anos) | ||||
| Média ± DP | 30,96 ± 15,35 | |||
| Mediana | 29 | |||
| Variação | 7‐63 | |||
| Duração da doença (anos) | ||||
| Média ± DP | 4,69 ± 4,89 | |||
| Mediana | 4 | |||
| Variação | 1‐30 | |||
| Escore VASI | ||||
| Média ± DP | 26,42 ± 25,44 | |||
| Mediana | 18 | |||
| Variação | 1‐90 | |||
| Tipo | n (%) | |||
| Acrofacial | 7 (15,6) | |||
| Focal | 15 (33,3) | |||
| Universal | 4 (8,9) | |||
| Vulgar | 19 (42,2) | |||
| Escore VIDA | ||||
| 0 | 13 (28,9) | |||
| 1 | 4 (8,9) | |||
| 2 | 7 (15,6) | |||
| 3 | 10 (22,2) | |||
| 4 | 11 (24,4) | |||
| Escore VASI | ||||
| Média ± DP | 26,42 ± 25,44 | |||
| Mediana | 18 | |||
| Variação | 1‐90 | |||
| Leucotríquia | ||||
| Positiva | 3 (6,7) | |||
| Negativa | 42 (93,3) | |||
| Koebnerização | ||||
| Positiva | 6 (13,3) | |||
| Negativa | 39 (86,7) | |||
| História familiar | ||||
| Positiva | 10 (22,2) | |||
| Negativa | 35 (77,8) | |||
U, teste de Mann‐Whitney; χ2, teste do qui‐quadrado; DP, desvio padrão; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; t, teste t de Student; VIDA, Vitiligo Disease Activity; VASI, Vitiligo Area Severity Index.
Os dados clínicos dos pacientes com vitiligo neste estudo estão apresentados na tabela 1.
Perfil lipídico e níveis de glicemia nos grupos estudadosHavia níveis significantemente elevados de colesterol (207,16 ± 64,51 vs. 171,36 ± 38,05) e TG (143,84 ± 55,80 vs. 117,44 ± 27,44), bem como glicemia de jejum (89,44 ± 15,93 vs. 80,11 ± 8,36) e 2 horas pós‐prandial no sangue (122,89 ± 27,10 vs. 106,00 ± 11,56) dos pacientes com vitiligo do que nos controles (p < 0,001, p = 0,005, p = 0,001 e p < 0,001, respectivamente; tabela 2).
Comparação entre pacientes com vitiligo e grupo controle quanto ao perfil lipídico sérico e níveis glicêmicos
| Variáveis | Pacientes(n = 45) | Controles(n = 45) | Teste de significância | p‐valor |
|---|---|---|---|---|
| Colesterol (mg/dL) | ||||
| Média ± DP | 207,16 ± 46,51 | 171,36 ± 38,05 | t = 4,00 | < 0,001a |
| Mediana | 208 | 165,7 | ||
| Variação | 121‐300 | 114,0‐270,9 | ||
| TG (mg/dL) | ||||
| Média ± DP | 143,84 ± 55,80 | 117,44 ± 27,44 | U = 2,85a | 0,005a |
| Mediana | 140 | 117 | ||
| Variação | 35‐268 | 70,9‐111,0 | ||
| LDL (mg/dL) | ||||
| Média ± DP | 125,24 ± 49,40 | 110,18 ± 36,89 | U = 1,64 | 0,105 |
| Mediana | 111 | 113 | ||
| Variação | 26‐214 | 35,5‐203,0 | ||
| HDL (mg/dL) | ||||
| Média ± DP | 42,27 ± 14,06 | 45,53 ± 4,90 | t = 1,47 | 0,145 |
| Mediana | 40 | 45 | ||
| Variação | 13‐105 | 32‐57 | ||
| Glicemia de jejum (mg/dL) | ||||
| Média ± DP | 89,44 ± 15,93 | 80,11 ± 8,36 | t = 3,48 | 0,001a |
| Mediana | 90 | 80 | ||
| Variação | 65‐120 | 70‐95 | ||
| Glicemia 2 horas pós‐prandial (mg/dL) | ||||
| Média ±DP | 122,89 ± 27,10 | 106,00 ± 11,56 | t = 3,85 | < 0,001a |
| Mediana | 120 | 100 | ||
| Variação | 90‐190 | 90‐130 | ||
DP, desvio padrão; t, teste t de Student; U, teste de Mann‐Whitney; TG, triglicerídeos; LDL, lipoproteína de baixa densidade; HDL, lipoproteína de alta densidade.
A SM foi significantemente mais prevalente nos pacientes do estudo com vitiligo (13; 28,9%) do que no grupo controle (0%; p < 0,001 – tabela 3).
Prevalência de síndrome metabólica entre pacientes com vitiligo e o grupo controle
| Variáveis | Pacientes (n = 45)n (%) | Controles (n = 4)n (%) | χ2 | p‐valor |
|---|---|---|---|---|
| MetS | ||||
| Positivo | 13 (28,9) | 0 | 15,20 | < 0,001a |
| Negativo | 32 (71,1) | 45 (100,0) | ||
χ2, teste do qui‐quadrado.
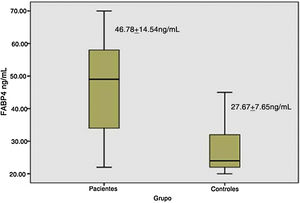
Os níveis séricos de FABP4 foram mais elevados nos pacientes com vitiligo (46,78 ± 14,54 ng/mL) em comparação aos controles (27,67 ± 7,65 ng/mL; p < 0,001 ‐ fig. 1).
Papel da FABP4 no diagnóstico precoce de vitiligoA curva ROC (receiver operating characteristic) mostrou que o nível de FABP4 foi um bom teste diagnóstico significativo para a detecção precoce de vitiligo com melhor ponto de corte de 33,0 ng/mL, sensibilidade de 82%, especificidade de 76% e área sob a curva de 0,863 (p < 0,001; fig. 2A).
Curva ROC dos níveis de FABP4 para (A), diagnóstico precoce de vitiligo [melhor ponto de corte 33,0 ng/mL, sensibilidade de 82%, especificidade de 76% e área sob a curva de 0,863 (p < 0,001)] e (B), detecção de SM em pacientes com vitiligo [sensibilidade de 77%, especificidade de 28% e área sob a curva de 0,590 (p = 0,348)].
A curva ROC mostrou que FABP4 foi um teste diagnóstico ruim para detectar síndrome metabólica em pacientes com vitiligo, com área sob a curva de 0,590 (p = 0,34; fig. 2B).
Relação entre os níveis de FABP4 e os parâmetros estudados em pacientes com vitiligoEm pacientes com vitiligo, os níveis séricos elevados de FABP4 foram significantemente associados à presença de SM (p = 0,037). No entanto, a FABP4 não foi diferente de acordo com a gravidade do vitiligo, pois o nível sérico de FABP4 não foi significantemente correlacionado com o escore VASI (r = −0,21; p = 0,162; tabela 4).
Níveis de FABP4 em relação ao escore VASI e síndrome metabólica (SM) nos pacientes com vitiligo estudados
| Variáveis | FABP4 (ng/mL) em pacientes (n = 45) | teste t | p‐valor |
|---|---|---|---|
| SM | Média ± DP | ||
| Positiva | 55,85 ± 15,87 | ||
| Negativa | 45,53 ± 14,04 | 2,15 | 0,037a |
| Escore VASI | r | p‐valor | |
| −0,21 | 0,162 | ||
FABP4, proteína de ligação a ácidos graxos tipo 4; DP, desvio padrão; t, teste t de Student; r, correlação de Spearman; VASI, Vitiligo Area Severity Index.
Houve correlações positivas significativas dos níveis séricos de FABP4 com os níveis de TG, colesterol e LDL (r = 0,39, p = 0,047; r = 0,83, p = 0,001; r = 0,66, p = 0,001, respectivamente) e uma correlação negativa significativa em relação ao nível de HDL (r = −0,39, p = 0,009; fig. 3).
DiscussãoNo presente estudo investigamos, pela primeira vez, o possível papel da FABP4 no desenvolvimento do vitiligo por meio da avaliação de seu nível sérico em pacientes com VNS versus controles. Relatamos um aumento significativo nos níveis circulantes de FABP4 em pacientes com vitiligo em relação aos seus pares, e essas altas concentrações foram significantemente associadas à SM nos casos estudados, confirmando que a patogênese do vitiligo tem um fundo imunometabólico.18
Tanacan e Atkan19 revelaram que o risco de desenvolver SM é aumentado em pacientes com VNS. A patogênese do vitiligo não é bem conhecida, mas a autoimunidade associada ao estresse oxidativo representam dois mecanismos importantes responsáveis pelo vitiligo e sua etiopatogênese.20 O estresse oxidativo é uma das principais razões para o desenvolvimento de SM e pode estar relacionado com a patogênese de algumas doenças, como psoríase e vitiligo.11 Além disso, um nível elevado de homocisteína, que é um inibidor da tirosinase, pode também ser um fator que contribui para o desenvolvimento de SM em pacientes com vitiligo.21
A SM aumenta o risco de desenvolver diabetes mellitus tipo 2 e doenças cardiovasculares em cerca de cinco e duas vezes, respectivamente.22 Portanto, é essencial prevenir essas complicações graves associadas à SM, mudando o estilo de vida dos pacientes. Além disso, o manejo ideal da SM pode melhorar o curso clínico do vitiligo.
A função da FABP4 foi associada à sensibilidade à insulina, metabolismo lipídico e inflamação,23 bem como à produção de glicose, que contribui para a patogênese de doenças imunometabólicas.24 Em concordância com esses dados, relatamos um estado significativo de hiperglicemia e dislipidemia em casos de vitiligo, que foi significantemente associado a níveis séricos elevados de FABP4 (correlações positivas significativas com os níveis de TG, colesterol e LDL, e uma correlação negativa significativa com o nível de HDL).
Portanto, sugerimos que a FABP4 pode ter um papel ativo durante o processo da doença vitiligo, que pode ser mediado por dislipidemia e hiperglicemia associadas.
Como o vitiligo é considerado uma doença inflamatória, a FABP4 pode atuar na interface das vias inflamatórias e metabólicas.25
Ela induz respostas inflamatórias por meio da ativação das vias IκB Quinase‐Fator Nuclear‐kabba B (IKK‐NF‐κB) e c‐jun N‐terminal Quinase‐Ativador Proteína‐1 (JNK‐AP‐1),26 bem como pelo fator de necrose tumoral alfa (TNF‐α).27 O efeito do TNF‐α na cultura de melanócitos de pele humana desempenha papéis importantes no vitiligo por meio da ativação do NF‐κB.28
A ativação aberrante de células imunes inatas na pele de pacientes com vitiligo inclui células dendríticas inflamatórias que migram da pele para os linfonodos de drenagem, apresentando antígenos de melanócitos para células T e os ativam. Essas células também secretam citocinas que recrutam e estimulam células T autorreativas e, em seguida, matam os melanócitos diretamente.29 Foi demonstrado que a FABP4 em células dendríticas regula o priming das células T.30
As células T autorreativas de memória residentes nos tecidos inibem a produção de melanina e afetam a regeneração dos melanócitos ao bloquear as células T reguladoras localmente.31 Resultados recentes confirmam a presença de células CD8 + autorreativas com fenótipo CD103+CD69+CD49a+ TRM na pele de pacientes com vitiligo. As células CD8+ autorreativas de memória residentes nos tecidos exibem superexpressão em estudos da FABP4 in vitro.32
Com relação ao papel das células endoteliais no vitiligo, as células endoteliais dérmicas microvasculares humanas secretam grandes quantidades de clusterina. A clusterina, por meio de um crosstalk (interação) parácrino entre as células endoteliais e os melanócitos, pode inibir a melanogênese.33 A FABP4 tem um papel potencial no crescimento das células endoteliais, promovendo a proliferação, migração, sobrevivência e morfogênese das células.34
Com base nos dados mencionados, postulamos que o papel da FABP4 na patogênese do vitiligo pode ser mediado não apenas através de sua função metabólica (hiperglicemia e dislipidemia demonstradas), mas também através de seus mecanismos imunomediados, incluindo citocinas inflamatórias upreguladas,27 células T autorreativas de memória residentes nos tecidos com superexpressão32 e células endoteliais estimuladas.34
A FABP4 atua como um importante mediador no crosstalk entre adipócitos e macrófagos no tecido adiposo. Camundongos knockout para FABP4 foram protegidos do desenvolvimento de obesidade, resistência à insulina e tolerância diminuída à glicose, e seus adipócitos mostraram redução da lipólise.35 Em consonância com esses achados, o presente estudo observou uma associação significativa entre os níveis elevados de FABP4 e a presença de SM nos pacientes com vitiligo. Além disso, Terra et al.36 encontraram uma relação entre os níveis circulantes de FABP4 e a presença de obesidade e SM.
Embora o presente estudo tenha demonstrado que a FABP4 não foi capaz de prever o desenvolvimento de SM nos pacientes com vitiligo estudados (o que pode ser atribuído ao pequeno tamanho da amostra nesta pesquisa), é demonstrado que o nível de FABP4 foi um bom teste diagnóstico para a detecção precoce de vitiligo que poderia ajudar no diagnóstico de vitiligo em casos ambíguos. Estudos em larga escala são necessários para confirmar esse resultado.
ConclusõesA FABP4 pode desempenhar um papel ativo no desenvolvimento do vitiligo, e sua utilização como alvo pode ser útil na avaliação clínica para o tratamento do vitiligo. O papel da FABP4 no processo da doença vitiligo pode ser mediado por dislipidemia e hiperglicemia associadas. A FABP4 pode ser um marcador de vitiligo, ajudando no diagnóstico precoce, mas não parece ser útil para determinar a gravidade e atividade da doença ou SM associada.
Limitações do estudoO pequeno número de indivíduos estudados foi a principal limitação do presente estudo.
Suporte financeiroNenhum.
Contribuição dos autoresAzza Gaber Antar Farag: Revisão crítica da literatura; concepção e planejamento do estudo; aprovação da versão final do manuscrito.
Eman Abdelfatah Bader: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Asmaa El‐Shafey Soliman El‐Shafey: Obtenção dos dados; aprovação da versão final do manuscrito.
Mustafa Elsayed Elshaib: Análise estatística; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Farag AGA, Badr EAE, El‐Shafey AES, Elshaib ME. Fatty acid‐binding protein 4 circulating levels in non‐segmental vitiligo. An Bras Dermatol. 2022;97:28–36.
Trabalho realizado no Departamento de Dermatologia, Andrologia e ISTs e Departamento de Bioquímica Médica e Biologia Molecular, Faculdade de Medicina, Menoufia University, Menoufia, Egito.












![Curva ROC dos níveis de FABP4 para (A), diagnóstico precoce de vitiligo [melhor ponto de corte 33,0 ng/mL, sensibilidade de 82%, especificidade de 76% e área sob a curva de 0,863 (p < 0,001)] e (B), detecção de SM em pacientes com vitiligo [sensibilidade de 77%, especificidade de 28% e área sob a curva de 0,590 (p = 0,348)].](https://static.elsevier.es/multimedia/26662752/0000009700000001/v1_202202030913/S2666275221002745/v1_202202030913/pt/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)