A dermoabrasão está relacionada com traumas mecânicos e cirúrgicos na pele e, geralmente, antisséptico tópico e/ou soro fisiológico têm sido usados para a cicatrização. Os produtos naturais para cicatrização de feridas também podem ser usados para abrasões, como o látex da Hevea brasiliensis.
ObjetivoAvaliar a viabilidade in vitro e os efeitos migratórios/proliferativos do soro de látex da Hevea brasiliensis e comparar com solução antisséptica padrão e solução fisiológica comercialmente disponíveis em dermoabrasão experimental em ratos.
MétodosPara avaliação in vitro foram usados os testes MTT e scratch assay. O teste in vivo foi feito em 72 ratos submetidos à dermoabrasão, tratados com solução salina, solução antisséptica ou com soro de látex. Foram avaliados a reepitelização, o infiltrado neutrofílico e a quantificação de crosta e epiderme.
ResultadosO látex mostrou viabilidade nas concentrações de 1% e 0,1% e atividade migratória/proliferativa em concentrações de 0,01%. A reepitelização foi maior no grupo látex no sétimo dia. O grupo látex apresentou menor espessura das crostas e mais camadas epidérmicas. Os grupos látex e antisséptico apresentaram aumento dos níveis de mieloperoxidase no segundo dia e mostraram importante redução a partir do sétimo dia.
Limitações do estudoModelo de ferida aguda superficial em ratos e não uso do gel‐creme (veículo) sem o látex.
ConclusãoO látex atóxico estimulou a migração/proliferação de queratinócitos in vitro e acelerou significativamente a cicatrização de feridas em modelos de escoriação animal, em comparação com clorexidina ou solução salina.
Feridas cutâneas são definidas como o rompimento da continuidade celular e anatômica da pele e sua funcionalidade. Podem envolver as camadas da epiderme e/ou da derme e até músculos e ossos.1–3 Perdas teciduais agudas podem surgir após procedimentos dermatológicos, como dermoabrasão e peelings químicos, ou podem ser causadas por trauma físico, atingem essencialmente a epiderme e a superfície da derme. Nesse caso, a reparação tecidual ocorre apenas pela reepitelização, seguida do processo de reparo anatômico e funcional da pele, resulta em uma cicatriz quase imperceptível. O tempo de cicatrização pode variar entre cinco a dez dias, mas também pode atingir até 30 dias.4,5 Normalmente, as áreas da pele lesada são tratadas com produtos tópicos (como soluções antissépticas) para proteger e limpar a pele, quando a lesão é causada por acidentes domésticos, ou apenas solução salina, a fim de manter a umidade da pele após procedimentos dermatológicos, evita a crosta.
Produtos oriundos de plantas medicinais são usados para a recuperação da saúde, em especial para acelerar a cicatrização de feridas cutâneas. Extratos e óleos de plantas demonstraram efeito cicatrizante, antimicrobiano, anti‐inflamatório e antioxidante. A literatura mostra várias plantas, como Calendula officinalis, Copaifera langsdorffii, Curcuma longa, Chamaemelum nobile L, entre outras.6–9 No entanto, as plantas medicinais são muitas vezes usadas sem evidências científicas, por isso são necessários mais estudos para comprovar sua eficácia e segurança.10–13
Entre as substâncias oriundas de plantas medicinais investigadas por suas propriedades e contribuições para os processos de cicatrização, o látex natural da seringueira Hevea brasiliensis tem sido reportado. Frade14 relatou sinais clinicamente evidentes de estimulação da granulação e acentuada redução da dor, confirmados por estudos histopatológicos após 15 dias de tratamento com a biomembrana de látex natural (BLN). Verificou‐se que a BLN atua como um curativo econômico, de fácil manuseio e altamente eficaz, principalmente devido ao seu potencial de desbridamento e angiogênese, torna possível um processo de cicatrização mais rápido e dinâmico, essencial para a cicatrização de feridas.15
Diversos estudos demonstraram o papel da proteína do látex com atividade na cicatrização de feridas tanto in natura quanto no soro em comparação com grupos controle.15,16 Assim, considerando os resultados prévios que usaram a BLN para a cicatrização de feridas e a importância clínica relacionada ao desenvolvimento de tratamentos opcionais e eficazes para trauma e/ou escoriação cirúrgica, buscou‐se comparar a eficácia dos tratamentos usuais, como solução salina e solução antisséptica, com soro de látex da seringueira Hevea brasiliensis em modelo experimental de escoriação cutânea em ratos, uma vez que não há outros estudos na literatura que mostrem o efeito cicatrizante nesse modelo de escoriação.
MétodosPreparação da formulação do látex e controlesA solução estéril de cloreto de sódio a 0,9% (S) e a solução antisséptica (AS) de digluconato de clorexidina 10mg/mL foram adquiridas em uma farmácia local (Farmácia São Paulo ‐ Ribeirão Preto/SP). O soro de látex Hevea brasiliensis (SLX) foi obtido da empresa Pelenova Biotecnologia S/A (Distrito Industrial ‐ Ribeirão Preto/SP) e descrito por Mendonça.16 Resumidamente, o látex foi obtido da seringueira (Hevea brasiliensis) do clone RRhim 600. Ao látex natural foi adicionado hidróxido de amônio (2%) quando coletado, para que sua coagulação fosse evitada. Adicionou‐se uma solução de ácido acético a 2,2% (1:2 v/v) sob agitação suave. Em uma próxima etapa, separou‐se o soro puro da borracha e submeteu‐se a diálise e a liofilização. A purificação e a caracterização do soro foram feitas conforme previamente descrito por Mendonça,17 com eletroforese bidimensional e espectrometria de massas. Três frações principais foram obtidas e designadas como FrHB1, FrHB2 e FrHB3. Além disso, de acordo com o fabricante do produto final (gel‐creme) usado em experimentos pré‐clínicos e também em uso clínico, para eliminar a proteína causadora do maior número de reações alérgicas, heveína e seus derivados, o processo de filtração tangencial foi feito para considerar apenas substâncias abaixo de 10 kDa. O soro de látex puro foi diluído em meio de cultura Dulbecco's Modified Eagle Medium (DMEM) em concentrações de 0,1% a 1% para o ensaio de viabilidade e de 0,00001% a 1% para o ensaio de migração/proliferação. Para experimentos in vivo usou‐se soro de látex em gel‐creme (Valeant Pharmaceuticals International Inc. ? São Paulo, SP, Brasil).
Linhagens celularesAs células NIH‐3T3 (linhagem celular de fibroblastos de camundongo) foram adquiridas da American Type Culture Collection (ATCC CRL‐1658, Manassas, Virgínia, EUA). Queratinócitos humanos foram isolados de fragmentos saudáveis de pele humana com o consentimento de pacientes submetidos à cirurgia plástica de mama ou abdome na Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo. Todos os protocolos foram aprovados pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Ribeirão Preto ‐ processo 5606/2008.
Fibroblastos foram cultivados em meio de cultura DMEM alta glicose (4,5 g/L) (GIBCO --‐ Invitrogen Corporation ‐ Grand Island, NY) e queratinócitos em meio de cultura Defined Keratinocyte Medium (GIBCO ‐ Invitrogen Corporation ‐ Grand Island, NY, EUA) e foram suplementados com 10% de soro bovino fetal e 1% de antibiótico e antimicótico (GIBCO ‐ Invitrogen Corporation ‐ Grand Island, NY, EUA), a 37°C, em atmosfera úmida e 5% de CO2.
Avaliação da viabilidade in vitroA viabilidade dos fibroblastos NIH‐3T3 e dos queratinócitos humanos foi determinada pelo ensaio colorimétrico MTT de tetrazólio 3‐[4,5‐dimetiltiazol‐2‐il]‐2,5‐difenil.18 Fibroblastos e queratinócitos foram semeados em microplacas de 96 poços na concentração de 2×104 células/mL. As placas foram incubadas durante a noite para adesão celular. Após esse tempo, o sobrenadante foi aspirado e 200μL de soluções teste que continham soro de látex foram adicionados de acordo com as seguintes concentrações: apenas meio de cultura basal (controle positivo), 0,1% e 1% (concentração de SLX foram diluídos em meio de cultura) e 50%/50% de meio de cultura e dimetilsulfóxido (DMSO) (DMSO como controle negativo). As placas foram incubadas por 24 e 48 horas. Após a incubação, o sobrenadante foi aspirado e as células foram lavadas com solução tampão fosfato‐salino (PBS). Em seguida, 20μL da solução estoque de MTT (Sigma‐Aldrich Co. LLC) (5mg/mL em PBS) com 180μL de meio de cultura DMEM (sem vermelho de fenol) foram adicionados a cada poço e as placas foram incubadas sob as mesmas condições por 3 horas. Depois, a solução de MTT foi removida e 200μl de DMSO foram adicionados para dissolver os cristais de formazan. A absorbância foi lida em 570nm. O experimento foi feito em triplicata, consideraram‐se três experimentos independentes. Os resultados foram expressos como uma porcentagem da viabilidade celular.18–20
Ensaio de migração/proliferação celular in vitro – scratch assayPara analisar as propriedades do soro de látex (SLX) que estimulam a migração/proliferação de queratinócitos, foi feito um ensaio de “arranhão” (scratch assay) in vitro.21,22 Os queratinócitos humanos foram semeados em placas de cultura de 24 poços a uma concentração de 3×104 células/poço e foram cultivados com meio que continha 10% de soro bovino fetal até atingir uma confluência de aproximadamente 80%. Em seguida, um arranhão linear, que imitava uma ferida artificial, foi criado na monocamada celular com uma ponteira de plástico de 200μL. O meio foi removido e as células foram lavadas com PBS. Meio com 50% de DMSO (controlo negativo), meio de cultura com 10% de soro fetal de bovino (basal), definido para 0 no eixo X e meio que continha concentrações de SLX de 1%, 0,1%, 0,01%, 0,001%, 0,0001% e 0,00001% foram adicionados em três poços por grupo e foram incubados por 24 horas a 5% de CO2 a 37°C. Após 24 horas, os poços foram lavados com PBS e fixados com paraformaldeído 4% durante 15 minutos. As células foram lavadas mais uma vez e coradas com 4’,6‐diamino‐2‐fenil‐indole (DAPI) durante 5 minutos. Imagens de áreas foram adquiridas com um microscópio de fluorescência acoplado a uma câmera (Carl Zeiss®, Oberkochen, GE). A proliferação/migração de células para a região com o arranhão foi quantificada com o programa ImageJ (National Institutes of Health, Bethesda, MD, EUA). Os resultados foram expressos em porcentagem de células que migraram e/ou proliferaram para a área após o tratamento com SLX, em comparação com o número de células que migraram e/ou proliferaram no grupo controle. Os experimentos também foram feitos em triplicata, consideraram‐se três experimentos independentes.
AnimaisOs estudos foram conduzidos e aprovados pelos princípios éticos em pesquisa animal adotados pelo Colégio Brasileiro de Experimentação Animal (Cobea) e aprovados pela Comissão de Ética em Pesquisa Animal (Cetea) – Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, registro n° 072/2012.
Foram alojados 72 ratos Wistar machos adultos (Rattus norvegicus, 180‐200g) do Biotério Central da Faculdade de Medicina de Ribeirão Preto por sete dias antes do experimento. Durante todo o período experimental, os ratos foram mantidos em gaiolas individuais de policarbonato a uma temperatura constante (23±2°C) e umidade (55%) sob um ciclo claro/escuro de 12/12 horas. Os animais tiveram livre acesso a uma dieta padrão e água.
Procedimento cirúrgico e gruposOs ratos foram anestesiados intraperitonealmente com cetamina (70mg/kg) e xilazina (12mg/kg). A região do dorso de cada rato foi tricotomizada e feita assepsia com álcool 70%. Dermoabrasor LB‐100 (Beltec Indústria e Comércio de Equipamentos Odontológicos, Araraquara/SP) foi usado para fazer as escoriações com uma lixa diamantada RH14633 (RHOSSE Instrumentos Cirúrgicos, Ribeirão Preto/SP) no dorso do animal, uma lesão cutânea de aproximadamente 2cm2. A administração intraperitoneal de dipirona, 50mg/kg de peso corporal, foi diluída em solução salina e administrada duas vezes ao dia (12/12 horas) durante as primeiras 48 horas para prevenir a dor. Em seguida, os animais foram colocados em gaiolas individuais até o fim do experimento. Os animais foram divididos em três grupos, com 24 ratos cada, e tratados diariamente com soro de látex em gel‐cream (SLX 1%), solução antisséptica (AS) padrão (digluconato de clorexidina 10mg/mL) (veículo) como controle positivo e solução salina (S) por 10 dias, sem curativo oclusivo.
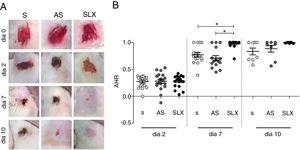
Avaliação da reepitelização das escoriaçõesAs imagens das feridas foram obtidas nos dias 0, 2, 7 e 10 após o tratamento com uma câmera digital de 14 megapixels (Kodak EasyShare M575) fixada em um suporte padronizado para imagens, apresentava uma régua como referência de medição; o cálculo do índice de cicatrização das escoriações (ICE) foi feito pela seguinte fórmula: [(área inicial−área final)/área inicial], conforme descrito e feito por Leite23 para feridas cutâneas.
Coleta do materialOito animais de cada grupo foram eutanasiados com uma dose excessiva de anestésico nos dias 2, 7 e 10. Em cada dia de acompanhamento, um fragmento foi retirado com uma tesoura. Uma metade da amostra foi embebida em solução de formaldeído tamponado a 10% (v/v) para estudo histológico (hematoxilina‐eosina); a outra metade da amostra foi condicionada a−80°C para ensaios bioquímicos.
Medição da crosta e epidermeAs biópsias foram embebidas em parafina, conforme descrito anteriormente por Andrade.24 Um microscópio óptico Leica DM 4000B equipado com uma câmera Leica DFC 280 (Leica Microsystems®, Alemanha) foi usado para capturar as imagens histológicas com aumento de 400×por meio do programa Leica Application Suite (LAS) versão 3.2.0. Foi feita uma seção de corte completa das áreas lesionadas por animal (seção transversal) e foram fotografadas três imagens de cada lâmina e três medidas foram feitas por cada imagem. Para as medições da crosta e da epiderme foram feitas de uma ponta a outra com base principalmente no infiltrado inflamatório neutrofílico na borda da epiderme. A imagem foi aberta e uma linha foi desenhada a partir da camada granular da epiderme até a transição com a derme (espessura da epiderme) e espessura da crosta. No fim da medição, o programa forneceu a distância em μm.25
Dosagem de mieloperoxidase (MPO)As biópsias coletadas foram acondicionadas em tubos plásticos de 2mL com 200μL de tampão NaCl 0,1M, NaPO4 0,02M, NaEDTA 0,05M pH 4,7 e permaneceram a−70°C até o uso. Os fragmentos foram homogeneizados por um homogeneizador Tissue Omni (TH) (Kennesaw, GA, EUA) a 13.000rpm. Após a centrifugação, ressuspendeu‐se em tampão NaPO4 (Ph 5,4) que continha 0,5% de brometo de hexadeciltrimetilamónio (HTAB). Em seguida, 5μL do sobrenadante das amostras foram colocados em uma placa de 96 poços para o ensaio. Uma curva‐padrão de neutrófilos foi obtida com neutrófilos isolados de camundongos após 6 horas de inoculação de 0,25mL de carragenina a 1% (Sigma Aldrich) na cavidade peritoneal. Vinte e cinco microlitros de TMB – “3,3’, 5,5’‐tetrametilbenzidina” (Sigma Chemical Company ? St. Louis, MO, EUA) foram adicionados a cada poço da placa (amostras e curva‐padrão de neutrófilos), seguido por 100μL de H2O2. A reação foi então interrompida com ácido sulfúrico 4M e lida em um leitor de placas a 450nm.26
Análise estatísticaOs dados foram expressos com o valor médio±EPM (erro‐padrão das médias). A análise estatística foi feita com o programa GraphPad (San Diego, CA, 176 USA). As variações estatísticas entre os grupos foram determinadas com análise one‐way Anova (variância para múltiplas comparações), seguida de um pós‐teste Bonferroni. Valores de p <0,05 foram considerados significativos.
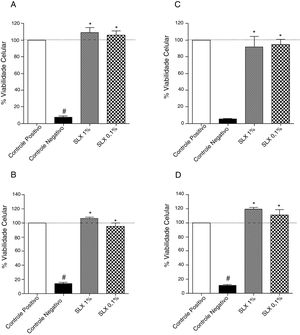
ResultadosViabilidade celular in vitroInicialmente, a viabilidade in vitro de SLX foi avaliada pelo método colorimétrico de MTT com a linhagem de fibroblastos NIH‐3T3 e queratinócitos humanos. Após 24 horas de incubação, SLX 1% e 0,1% não apresentaram efeitos citotóxicos contra fibroblastos em relação ao controle basal (apenas meio de cultura celular, considerando‐se 100% de viabilidade), apresentaram viabilidade de 109% e 105%, respectivamente (fig. 1A). Resultados semelhantes foram observados com queratinócitos humanos que exibiram 106% e 95% de células viáveis após exposição à SLX 1% e 0,1%, respectivamente (fig. 1B).
Viabilidade celular. Porcentagem de viabilidade de fibroblastos NIH‐3T3 (A‐C) e queratinócitos humanos (B‐D) em cultura com 24 horas (A‐B) e 48 horas (C‐D) em relação à cultura controle (correspondendo a 100% de células viáveis) pelo MTT método, distribuído em concentrações de soro de látex: 1% e 0,1%. Valores representam médias±EPM de resultados em triplicata. Teste estatístico Anova, pós‐teste Bonferroni.
* Diferença significativa (p <0,05) em relação ao controle positivo.
# Diferença significativa (p <0,05) em relação ao controle negativo.
Após 48 horas de incubação, resultados semelhantes foram observados. Os fibroblastos mostraram porcentagens de viabilidade de 91% e 94% para 1% e 0,1% de SLX, respectivamente (fig. 1C), e 119% e 111% para queratinócitos, respectivamente (fig. 1D).
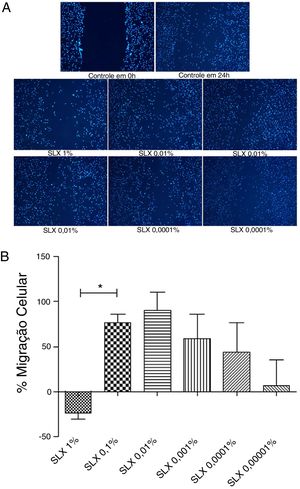
Migração/proliferação celular in vitro ‐ scratch assayPara avaliar a migração/proliferação celular in vitro, o ensaio de arranhão foi feito com queratinócitos humanos. Após 24 horas, o SLX estimulou a proliferação/migração de queratinócitos humanos numa relação dose dependente. Os maiores efeitos estimuladores foram observados com concentrações de 0,1% e 0,01% e aumento do número de células em até 70%. O grupo SLX a 1% exibiu efeito antiproliferativo (p <0,05) em comparação com o número de células no grupo controle (figs. 2 A e B).
Migração celular. (A), imagem microscópica fluorescente (DAPI) do ensaio de “arranhão” com queratinócitos humanos. A migração/proliferação celular no ensaio de “arranhão” foi observada em resposta a uma “lesão artificial” tratada com diferentes concentrações de soro de látex. (B), porcentagem de migração/proliferação de queratinócitos humanos em relação ao meio de cultura basal, definido como 0 no eixo X, distribuído em várias concentrações do soro do látex (SLX) tratado por 24 horas em cultura. Valores representam médias±EPM de resultados em triplicado. Teste estatístico Anova, pós‐teste Bonferroni.
*Corresponde à diferença significativa (p <0,05) entre os grupos (aumento: 50×).
O processo de reepitelização foi avaliado por meio do índice de cicatrização das escoriações. No segundo dia de acompanhamento, todos os grupos estudados apresentaram reepitelização semelhante (p >0,05). No entanto, no sétimo dia, o grupo SLX apresentou maior taxa de reepitelização em relação aos grupos S e AS (p <0,05). No décimo dia, as escoriações apresentaram‐se quase reepitelizadas, alcançaram médias percentuais de reepitelização de 83% no grupo S, 88% no AS, e 99% no grupo SLX (p >0,05) (figs. 3 A e B).
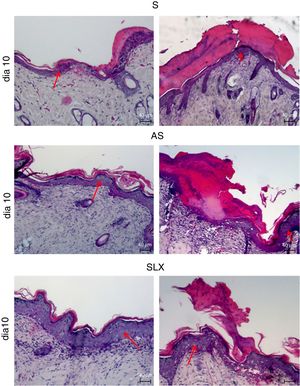
Análise histológicaA coloração com hematoxilina e eosina foi usada para análise histológica. A figura 4 apresenta imagens representativas (foram escolhidas as imagens com menores e maiores quantidades de crosta e epiderme) durante diferentes aspectos da reepitelização dos grupos no décimo dia. O grupo SLX destacou a menor quantidade de crosta e uma epiderme mais espessa com maior número de camadas de queratinócitos, em contraste com outros grupos que ainda apresentavam uma crosta mais espessa e uma epiderme mais fina.
Fotomicrografia das áreas escoriadas. Fotomicrografia das áreas escoriadas tratadas topicamente com S, AS e SLX no décimo dia de seguimento; as amostras foram coradas com hematoxilina‐eosina (HE), destacam‐se a quantidade de crosta e espessura da epiderme com uma fotomicrografia melhor e pior em cada grupo e tratamento. As setas vermelhas indicam a espessura da epiderme (aumento: 100×).
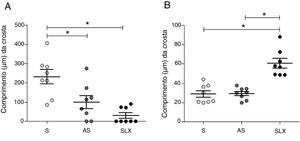
Em relação à espessura da crosta, o grupo SLX apresentou espessura menor do que a do grupo S. O grupo AS também apresentou menor espessura de crosta que o grupo S (p <0,05) (fig. 5A). O grupo SLX apresentou a epiderme mais espessa entre os grupos (p <0,05) (fig. 5B).
Distribuição da média da espessura (μm) da crosta da epiderme. (A), distribuição da média da espessura (μm) da crosta e (B), distribuição da média da espessura (μm) da epiderme dos grupos tratados com S, AS e SLX no décimo dia do segmento. Valores representam médias±EPM. Teste estatístico Anova, pós‐teste Bonferroni.
*Corresponde à diferença significativa (p <0,05) entre os grupos.
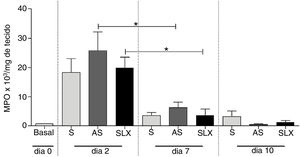
A avaliação do infiltrado neutrofílico durante o processo inflamatório foi estimada pelo conteúdo de mieloperoxidase (MPO) nas biópsias (n=8 por grupo/dia). Alta concentração de MPO foi observada em todos os grupos no segundo dia. Após sete dias pós‐lesão, uma diminuição no conteúdo de MPO foi observada em todos os grupos, mesmo em SLX e AS (p <0,05). No décimo dia, mostrou o mesmo perfil do sétimo dia. Não houve diferença significativa entre os grupos nos tempos estudados (p >0,05) (fig. 6).
Quantificação da enzima mieloperoxidase (MPO). Quantificação da enzima mieloperoxidase (MPO) de escoriações cutâneas tratadas topicamente com S, AS e SLX para o segundo, sétimo e décimo dias de seguimento. Valores representam médias±EPM. Teste estatístico ANOVA, pós‐teste Bonferroni.
*Corresponde à diferença significativa (p <0,05) entre os dias no mesmo grupo.
O principal objetivo no tratamento de feridas é alcançar sua cura de maneira rápida, com recuperação de suas propriedades funcionais e estéticas. Feridas superficiais, como escoriações, são frequentes em acidentes domésticos e os tratamentos domiciliares buscam reduzir rapidamente a dor e propiciar a secagem das feridas. Além disso, consideraram‐se os procedimentos estéticos que envolvam abrasão (dermoabrasão, roller etc.), requerem tratamentos que diminuam a dor e que mantenham a ferida úmida para evitar cicatrizes inestéticas.27–29
No presente estudo procurou‐se comparar a eficácia cicatrizante do produto derivado do soro de látex e outro produto antisséptico usado com frequência para tratar áreas de pele de escoriação e salina como um controle natural. Uma limitação deste estudo foi o não uso do controle com o gel‐creme (veículo), mas já existe um grande número de referências sobre as propriedades do soro de látex na cicatrização de feridas. Por outro lado, considerando o objetivo do estudo de comparar diferentes tratamentos, deve‐se considerar também o grupo de veículos de solução antisséptica comercial, uma dificuldade de obter durante este trabalho. Considerando não haver trabalhos descritos sobre segurança de diferentes concentrações de látex, foram feitos estudos in vitro.
De acordo com a WHO/IUIS,30 o látex contém proteínas que são alergênicas e estão bem descritas na literatura – no total, 15 alérgenos publicados, 13 deles maiores do que 10 kDa.30–32 Assim, os autores do presente estudo fizeram uma filtração tangencial para processar o soro de látex, eliminar proteínas de até 10 kDa, quase deixar o soro praticamente livre dos alérgenos, mas manter suas propriedades cicatrizantes, como demonstram nossos resultados pré‐clínicos. Por outro lado, para fins comerciais, uma notificação da presença de látex deve ser fornecida no rótulo e nas instruções de uso do produto, para garantir a segurança dos pacientes.
No teste de viabilidade celular, SLX 1% e SLX 0,1% apresentaram alta viabilidade em 24 e 48 horas (figs. 1A‐D). Mendonça17 avaliou a viabilidade do soro de látex da seringueira Hevea brasiliensis nas concentrações de 0,1 e 0,01mg/mL em fibroblastos HEK293T por 48 horas e concluiu que o látex não era citotóxico. Andrade33 também verificou a viabilidade de fibroblastos 3T3‐NIH e queratinócitos humanos por 24 horas com fração proteica de látex (F1) da seringueira Hevea brasiliensis com concentração de 0,01%. Corroborando achados do presente trabalho, esses autores concluíram que a fração proteica do látex se torna viável para uso na reparação tecidual in vivo.
Os queratinócitos são amplamente reconhecidos por desempenhar um papel essencial na cicatrização de feridas cutâneas e são considerados essenciais durante a fase proliferativa, porque são responsáveis pelo fechamento da ferida e reepitelização.34–37 Após o SLX 0,01% estar em cultura por 24 horas, observou‐se aumento na proliferação/migração de queratinócitos em relação a outras concentrações (figs. 2 A e B). Esses resultados mostraram um importante estímulo do SLX para a proliferação/migração in vitro.
Confirmadas as doses ideais, segurança e eficácia de estudos in vitro do SLX, foram feitos experimentos in vivo para comparar com outros produtos para escoriações de pele, solução antisséptica (AS) e solução salina (S). Na análise da reepitelização das escoriações, os animais que receberam tratamento com gel‐creme com látex (SLX) no sétimo dia apresentaram reepitelização mais rápida quando comparados aos grupos AS e S (p <0,05) (fig. 3B). No décimo dia, praticamente todos os animais que receberam SLX como tratamento estavam homogeneamente reepitelizados, em contraste com outros grupos que demonstraram um atraso clínico, reepitelização heterogênea e uma crosta maior, embora não tenha sido observada diferença significativa (p >0,05) (fig. 3A). Mendonça16 usou 0,01% de soro de látex incorporado em carboximetilcelulose como veículo para tratamento de feridas em orelhas de coelhos. Andrade33 usou 0,01% de uma fração proteica sérica do látex (F1) da seringueira Hevea brasiliensis também em carboximetilcelulose para o tratamento de feridas cutâneas em ratos diabéticos. Ambos os estudos mostraram propriedades curativas, sugeriram que o soro de látex é capaz de acelerar a cicatrização de feridas; esses achados corroboram nossos resultados no modelo de escoriação cutânea, também com envolvimento de sinais inflamatórios no início e aceleração da cicatrização de feridas.
A espessura da crosta está relacionada com a exsudação e a fase inflamatória. Verificou‐se que os animais tratados com látex estavam praticamente sem crosta no décimo dia em relação aos demais grupos (fig. 4). A maioria dos animais tratados com SLX não apresentou crostas a partir do quinto dia de acompanhamento, enquanto os animais dos grupos AS e S apresentaram crostas espessas que poderiam implicar diretamente um retardo na reepitelização. Não há modelos de escoriação com uso de ratos; entretanto, Gupta38 usou um modelo semelhante de escoriação, mas a lesão foi feita com uma lâmina de bisturi estéril de 1,2cm2 durante 0, 1, 2, 4 e 8 dias de acompanhamento em camundongos BALB/c. Animais não tratados ainda tinham uma crosta no oitavo dia, semelhantemente aos nossos resultados descritos, exceto aqueles submetidos ao tratamento com SLX.
Além disso, Gupta38 observou camadas mais finas de queratinócitos no grupo não tratado, corroborou nossos dados, que apresentaram maior número de camadas de queratinócitos no Grupo SLX.
Nossa hipótese é que as proteínas do látex atuaram de maneira mais eficiente e rápida para cicatrizar a ferida.
A resposta inflamatória é um passo importante no processo de cicatrização, pois prepara o ambiente da lesão para o reparo. No entanto, essa fase não deve ser persistente, pois pode retardar a reepitelização.39 Diversos estudos mostraram o potencial inflamatório do látex da seringueira Hevea brasiliensis nos primeiros dias após o tratamento, mostraram ser importante para o desbridamento via recrutamento de células inflamatórias, tais como neutrófilos e macrófagos. Os autores também mostraram que um efeito anti‐inflamatório após 7 a 15 dias é importante nos estágios subsequentes da cicatrização.15,40
Além disso, mostraram que todos os três grupos atingiram alto nível de MPO na lesão no segundo dia, o que está relacionado ao recrutamento de neutrófilos, mas não persistentemente. No sétimo dia, o nível de MPO diminuiu significativamente nos grupos AS e SLX (p <0,05) (fig. 6). No entanto, no décimo dia, todos os grupos apresentaram níveis de MPO semelhantes aos valores basais.
ConclusãoO soro do látex da Hevea brasiliensis a 1% apresentou resultados favoráveis na cicatrização/reepitelização de lesões em pele de ratos submetidos a escoriações, em comparação com solução antisséptica (digluconato de clorexidina 10mg/mL) e solução salina.
Suporte financeiroConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapes) e Fundação de Apoio ao Ensino, Pesquisa e Assistência (Faepa) do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
Contribuição dos autoresMarcel Nani Leite: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Saulo Nani Leite: Análise estatística, aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Guilherme Ferreira Caetano: Análise estatística; aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Thiago Antônio Moretti de Andrade: Análise estatística; aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Márcio Fronza: Análise estatística; aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Marco Andrey Cipriani Frade: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
AgradecimentosAo Dr. Joaquim Coutinho Netto (in memoriam), do Departamento de Bioquímica e Imunologia da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Brasil, e à Empresa Pele Nova Biotecnologia S/A, Ribeirão Preto, São Paulo, Brasil por fornecer soro de látex. Agradecemos também à Dra. Claudia Ferreira da Rosa Sobreira e a Antonio Renato Meirelles e Silva, do Departamento de Neurociências e Ciências do Comportamento da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Brasil, pela captura e análise de imagens.
Como citar este artigo: Leite MN, Leite SN, Caetano GF, Andrade TAM, Fronza M, Frade MAC. Healing effects of natural latex serum 1% from Hevea brasiliensis in an experimental skin abrasion wound model. An Bras Dermatol. 2020;95:418–27.
Trabalho realizado na Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Ribeirão Preto, SP, Brasil.