Manifestações cutâneas ocorrem no curso das neoplasias hematológicas e precedem, acompanham ou são tardias em relação ao diagnóstico. Decorrem de fenômenos paraneoplásicos, de infiltrações tumorais, da imunossupressão decorrente da própria doença hematológica ou do seu tratamento. Cabe ao dermatologista ter conhecimento dessas manifestações que podem auxiliar tanto no diagnóstico da doença de base quanto na diminuição da morbidade. Esta revisão (parte I), aborda as lesões cutâneas associadas à infiltração direta por neoplasias hematológicas sistêmicas.
As malignidades hematológicas são um grupo de neoplasias de comportamento e clínica extremamente heterogêneos que levam a quadros agressivos ou indolentes, agudos ou crônicos, com diferentes prognósticos e acometimentos de diversos órgãos.1 A pele pode estar envolvida de maneira específica, por meio de infiltrações por células malignas, ou inespecífica, como nas doenças cutâneas paraneoplásicas, nas alterações comuns às disfunções hematológicas, como palidez, equimoses, entre outros, e nas relacionadas ao tratamento e infecções oportunistas.1,2 O acometimento cutâneo impacta substancialmente a qualidade de vida do doente hematológico, além de poder comprometer o prognóstico em diferentes casos.1
As lesões cutâneas específicas secundárias à infiltração de malignidade hematológica sistêmica (parte I) e as doenças cutâneas paraneoplásicas mais comuns associadas a essas neoplasias sistêmicas (parte II) serão discutidas. Os linfomas cutâneos primários não serão abordados. A tabela 1 descreve resumidamente as afecções revisadas e seu tratamento, e a tabela 2, os dados epidemiológicos das mesmas segundo a literatura.
Manifestações cutâneas específicas das neoplasias hematológicas: associações e manejo
| Diagnóstico dermatológico | Alteração hematológica mais frequentemente encontrada | Manifestação dermatológica típica | Manejo |
|---|---|---|---|
| Leucemia cútis | LMA | Nódulos, placas e pápulas firmes, lisas, acastanhada, eritematosa e/ou violácea | Tratamento farmacológico antileucemia |
| Outras: LLC, LMMA, SMD, LLA, linfoma/leucemia de células T | |||
| Erosões, ulcerações, descamação eventual | TMO alogênico | ||
| Tronco, extremidades, face | Resgate com DLI (infusão de linfócitos do doador) na recidiva pós TMO alogênico | ||
| Mucosa: hiperplasia gengival | |||
| Radioterapia | |||
| Plasmocitoma cutâneo | MM | Nódulos eritemato‐violáceos, isolados, lisos, arredondados | Tratamento da doença de base +/‐ Radioterapia |
| Primário cutâneo: Radioterapia; Cirurgia seguida de radioterapia ou quimioterapia | |||
| Linfomas cutâneos secundários | Linhagem T/NK | Nódulos (60% dos casos) | Tratamento do linfoma de base |
| Outras: linhagem B madura, neoplasias hematológicas imaturas, linfoma de Hodgkin | Máculas, patches e placas | ||
| Ulceração (9% dos casos) | |||
| Linhagem T/NK: lesões múltiplas/disseminadas; mau prognóstico |
Dados epidemiológicos das manifestações cutâneas específicas das neoplasias hematológicas
| Diagnóstico Dermatológico | Dados epidemiológicos |
|---|---|
| Leucemia cútis (prevalência) | LMA ‐ 10%‐15% |
| LLC ‐ 4%‐27% | |
| LLA ‐ 1%‐3% | |
| LMC ‐ 2% | |
| Plasmocitoma cutâneo (prevalência)Linfomas cutâneos secundários (frequência relativa) | MM ‐ 4% |
| Linhagem T/NK ‐ 48%‐72% | |
| Linhagem B madura ‐ 21%‐25% | |
| Neoplasias hematológicas imaturas ‐ 4%‐8% | |
| Linfoma de Hodgkin ‐ 0%‐4% |
Leucemias são proliferações neoplásicas de leucócitos e seus precursores na medula óssea e sangue periférico.3,4 São de origem mieloide ou linfoide e, de acordo com a maturação celular, aguda ou crônica.5,6 Leucemia cútis (LC) é a manifestação cutânea extramedular pela infiltração das células leucêmicas na epiderme, derme ou subcutâneo.3,7 Surge antes, durante ou após a manifestação da forma sistêmica como ocorrência extramedular da doença inicial, como a primeira manifestação da doença hematológica ou, raramente, como doença primária.7,8 Denomina‐se leucemia aleucêmica os infrequentes casos que surgem antes do envolvimento da medula óssea ou sangue periférico, cujo envolvimento sistêmico pode demorar meses a anos para aparecer.9,10
A LC acomete mais frequentemente indivíduos com leucemia mieloide aguda (LMA), contudo é vista ainda na leucemia mieloide crônica (LMC), leucemia linfoide aguda (LLA), leucemia linfocítica crônica (LLC), síndrome mielodisplásica (SMD), linfoma/leucemia de célula T (ATLL) e raramente na leucemia das células cabeludas (LCP) e leucemia de células plasmáticas.3,4,6,8,11
A frequência reportada na literatura varia de 2,1% a 30%, dependendo do tipo da leucemia primária, porém carecem dados exatos e robustos.3,4 Existe ainda, nos diversos estudos, uma problemática na definição da terminologia em relação aos termos leucemia cútis, sarcoma mieloide, sarcoma granulocítico e cloroma que interfere nos dados epidemiológicos. O sarcoma mieloide/granulocítico é descrito no sistema nervoso central, trato gastrintestinal, linfonodos, testículos, ovários, ossos e peritônio, além da pele. Sua ocorrência é ligada a doenças leucêmicas da linhagem celular mieloide, principalmente a LMA, mas ocorre também na LMC, SMD e outras doenças mieloproliferativas.6,12 A palavra “cloroma”, historicamente descrita no século XIX, vem da palavra grega chloros, que significa verde, pela aparência esverdeada do tumor em razão da oxidação da mieloperoxidase.13 Os termos sarcoma granulocítico/mieloide surgiram ao redor de 1965, porém não contemplam a origem real do tumor que ocorre no tecido hematopoiético;3 assim, a OMS, em 2016, definiu sarcoma mieloide como massa tumoral de blastos mieloides com ou sem maturação, que ocorre em qualquer local anatômico além da medula óssea. O termo cloroma permanece em uso apesar de nem todos os casos apresentarem grânulos contendo mieloperoxidase.13 Esta revisão acata o direcionamento dado por Vega et al. em que LC é um termo amplo que engloba as infiltrações cutâneas de qualquer tipo de leucemia, incluindo sarcoma mieloide, sarcoma granulocítico ou cloroma.14
Considerando os diversos tipos de leucemias, observa‐se na LMA a prevalência de LC de 10%‐15%,2,3,8,9 dos quais os subtipos mielomonocítico (LMMA) e monocítico (LMMo) são os mais afetados, em até metade dos casos.2,5,6 Na LLC, forma de apresentação mais comum das leucemias sistêmicas, a LC é relatada em 4%‐27% destas,3,15,16 mais frequentemente observada na síndrome de Richter, que é a rara transformação da LLC em linfoma de grandes células.15 Em relação aos outros tipos de leucemia, dados mostram envolvimento de 1%‐3% na LLA e 2% na LMC.9
O mecanismo patogenético da invasão da pele por células leucêmicas não está bem elucidado, aventando‐se que os receptores de quimiocinas e moléculas de adesão têm papel fundamental. Estuda‐se também o papel das alterações citogenéticas relacionadas a esse tipo de tumor.2,6,11
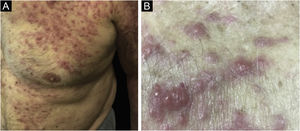
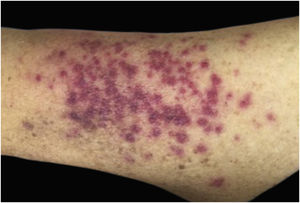
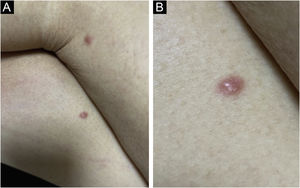
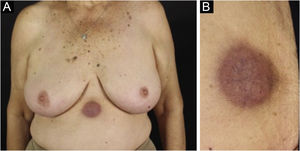
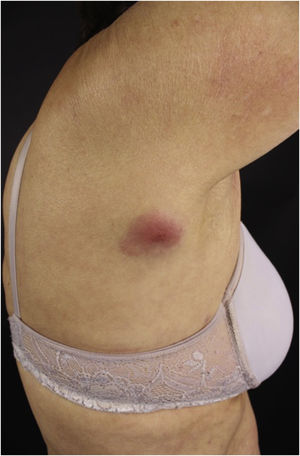
Clinicamente, as lesões não são patognomônicas, pois são polimórficas, únicas ou, principalmente, múltiplas (fig. 1).7,10 Não existe localização preferencial para o aparecimento da doença, apesar de ser mais descrita no tronco, extremidades e face,6,8 mas raramente é vista na região palmoplantar.3 Alguns autores mencionam que a infiltração ocorre preferencialmente em locais com inflamação ou infecção cutânea prévia.8,14,16 A morfologia das lesões não colabora para o diagnóstico da linhagem celular envolvida.2,3,6 Apresentam‐se como nódulos, placas e pápulas de consistência variadas, normalmente são firmes, de diversos tamanhos e coloração acastanhada, eritematosa e/ou violácea, muitas vezes purpúricas (fig. 2) pela trombocitopenia que acompanha o quadro.2,4 A superfície normalmente é lisa (fig. 3), mas erosões, ulcerações e presença de descamação eventualmente são vistas.3 Outras formas de apresentação clínica da LC são muito raras como os exantemas maculopapulares, eritrodermia esfoliativa e úlceras únicas, raramente múltiplas.3,4,7 Apresentações atípicas foram descritas em casos isolados como lesões psoriasiformes, face leonina, máculas figuradas, papulovesículas.3,17 A forma aleucêmica é descrita como difusa e papulonodular.6 Mais de 80% das lesões cutâneas são assintomáticas; poucos doentes relatam dor ou prurido.4 A localização e distribuição também não se correlacionam a qualquer tipo celular específico da LC,10,12 entretanto alguns autores associam os quadros generalizados a formas agudas de leucemia, enquanto lesões solitárias, agrupadas ou dispersas a crônicas ou agudas.3 A dinâmica de aparecimento da infiltração também é relacionada ao tipo de leucemia ‐ a de aparecimento rápido, em surtos, associa‐se a formas agudas, enquanto a de aparecimento gradual, à crônica. Na LLC, as lesões específicas cutâneas aparecem nos estágios tardios da doença, cerca de 40 meses após as primeiras manifestações sistêmicas.15,16
A mucosa oral pode ser afetada, e a hiperplasia gengival é a condição clínica mais vista, frequentemente hemorrágica com evolução para necrose.3,4 Esse tipo de acometimento mucoso é visto especialmente na LMA e LMMA. Raramente, na LLC e outras leucemias são observados úlceras, pápulas e nódulos orais.3
Na infância, observa‐se a LC em 1/3 dos casos de leucemia sistêmica, principalmente nas formas congênitas.4,18,19 A LMA é o tipo de leucemia mais associada a LC nessa faixa etária.18 Na leucemia congênita, as lesões, em 30% dos casos, assumem aparência de “blueberry muffin”.14
Correlacionando a temporalidade do aparecimento do acometimento cutâneo em relação ao sistêmico, 55%‐77% dos casos as lesões de LC aparecem em casos já diagnosticados com leucemia,4 e somente em 23%‐38% aparecem concomitantemente às manifestações sistêmicas.3,7,8 Em estudo recente, Yook et al. (2022) relatam que 71%‐100% dos casos de LC aparecem no momento ou após o diagnóstico da leucemia sistêmica.9
A biópsia de pele é o padrão ouro para diagnóstico, feito com base na avaliação histopatológica, considerando o padrão de distribuição, achados citológicos e características imuno‐histoquímicas.3,10,12 A característica citológica varia de acordo com o tipo de leucemia de base.10 O infiltrado é perivascular e/ou perianexial, nodular ou difuso, ocupando principalmente a derme profunda e subcutâneo, com células necróticas, figuras de mitose e pleomorfismo nuclear.3,14,17 A imuno‐histoquímica ajuda a diferenciar a linhagem celular, especialmente em caso de dúvida diagnóstica em relação a linfoma cutâneo. As alterações mieloides são diagnosticadas pela ausência de marcadores específicos de células T e B e pela expressão de marcadores mielomonocíticos como CD68, CD43, CD33, lisozima, mieloperoxidade, CD117 e CD15.16 Já a LC da LLC é caracterizada pela coexpressão de CD19, CD5, CD20, CD79 e CD23.16 O resultado dessas alterações sempre deve ser correlacionado com os achados da medula óssea e sangue periférico, além de estudos genéticos moleculares.6,10 Em casos de ausência de história de leucemia, o diagnóstico pode ser difícil, já que existe a possibilidade de que as células sejam pouco diferenciadas e ocorra dificuldade diagnóstica, confundindo com linfoma não Hodgkin.6,12 Exames de imagem colaboram nos casos de nódulos subcutâneos contribuindo para localização, contagem do número de lesões e diagnóstico diferencial.20
Não existe consenso para o tratamento da LC. O tratamento sistêmico é o direcionado para tratar a doença de base, e existem poucos estudos randomizados que avaliem especificamente a resposta. A escolha do protocolo depende da linhagem celular envolvida, das características imuno‐histoquímicas e do tempo de aparecimento em relação à doença sistêmica e de alterações citogenéticas.10 O tempo de evolução é fundamental nessa escolha e deve‐se considerar inclusive se o caso é ou não uma recidiva. Frente a esse conhecimento, opta‐se pelo tratamento quimioterápico tradicional antileucemia, consolidação com transplante de medula óssea (TMO) alogênico ou resgate com infusão de linfócitos do doador (DLI) nos pós‐TMO alogênico.4,12 A radioterapia que aborda a lesão localmente também pode ser usada, principalmente em lesão isolada, em recorrência após o TMO ou nos casos em que sintomas causados pela tumoração, por compressão, precisam ser rapidamente aliviados.4,6
Vários estudos associam a presença da LC a prognóstico desfavorável quando comparado à taxa de sobrevida geral da doença sistêmica.2,7,12 Considerando a doença crônica, o aparecimento da LC demonstra a presença da fase blástica, que sugere progressão para forma aguda.14,21 As possíveis anormalidades citogenéticas detectadas por meio dos estudos do cariótipo e hibridização in situ por fluorescência (FISH) demonstram o comportamento agressivo.17 Os dados existentes indicam que a sobrevida após um ano é muito baixa, com base em estudos com casuística pequena.6,17 No estudo de Chang et al., 74,3% dos casos de LC faleceram em até um ano, e a sobrevida média foi de 7,2 meses.4 Yook et al. (2022) demonstraram que 84% dos pacientes morreram após o diagnóstico da LC, dos quais 93% desses em 10 meses.9 A sobrevida associada a LC nos casos de LMA e LMMA chegam a apenas quatro meses.3 Uma coorte de 2019 mostra que pacientes com LMA e LC têm 2,06 mais chances de morrer do que pacientes sem infiltração cutânea.21 Na LLC, existem dados que demostram que o prognóstico é ligado à característica histológica, sendo ruim ‐ sobrevida de 49% em dois anos ‐ quando existem mais de 5% de grandes linfócitos B no infiltrado cutâneo e favorável – sobrevida de 97% em dois anos ‐ quando existe mais de 95% de linfócitos B pequenos.16 Estudos recentes demonstram que na ausência de uma progressão da doença sistêmica, como para a síndrome de Richter, a LC da LLC não leva a piora do prognóstico.15 Contudo, a literatura ainda é escassa e conflitante na avaliação da presença da LC e prognóstico da doença de base.6
Plasmocitoma cutâneoAs discrasias de células plasmáticas são caracterizadas pela expansão neoplásica clonal de células que secretam imunoglobulinas monoclonais. O espectro clínico é diverso e agrupa entidades de diferentes gravidades, desde gamopatia monoclonal assintomática de significado incerto (MGUS) a malignidades de maior gravidade clínica, como o mieloma múltiplo (MM).22
É chamado plasmocitoma cutâneo a rara neoplasia de células plasmáticas que infiltra a pele, seja por envolvimento direto, por contiguidade de um foco próximo, ou a distância, via hematogênica ou linfática.22,23 Os plasmocitomas cutâneos mais descritos surgem no contexto do MM, geralmente como complicação tardia.24 Poucos casos são relatados na literatura, ocorrendo em menos de 4% dos casos, porém alguns autores acreditam que exista subdiagnóstico, já que nos dados de autópsias de pacientes com MM o número de acometimento extramedular cutâneo é muito maior.24–26 Existe uma forma muito mais rara, o plasmocitoma primário cutâneo, que ocorre sem a evidência de outra doença plasmocitária medular ou extramedular, atualmente classificado no grupo dos linfomas da zona marginal. Os plasmocitomas cutâneos são associados a todas as classes de imunoglobulinas, excetuando‐se a IgE; os relacionados a IgG são os mais observados.23
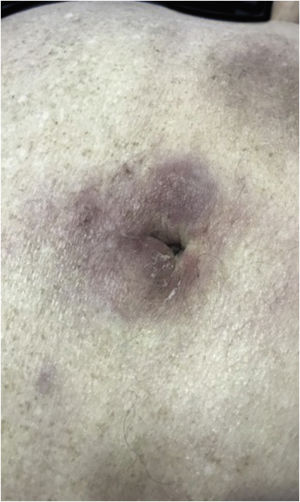
A forma clínica mais representativa são nódulos eritemato‐violáceos (fig. 4), isolados, lisos, arredondados, porém existe descrição de casos infrequentes de nódulos cor da pele.26 Não é observada diferença no quadro clínico de acordo com a imunoglobulina envolvida.
Estudos demonstram que o microambiente do tumor é o maior regulador do processo metastático no envolvimento extramedular das neoplasias plasmáticas, porém o mecanismo exato não é compreendido.26
A biópsia seguida de exame histopatológico e imuno‐histoquímica confirma o diagnóstico. O infiltrado plasmocitário nodular é o principal padrão encontrado, seguido pelo intersticial. Presença de imunorreatividade para CD138 é constante, além da frequente ausência de expressão para CD45 e CD20.24,26
O prognóstico é ruim, e a média de sobrevida é 8,5 meses.24,25 É descrito que a deleção do gene RB1 é associada a pior prognóstico.24
O tratamento para os plasmocitomas com envolvimento sistêmico é o da doença de base, com ou sem radioterapia associada. Os plasmocitomas primários cutâneos são tratados isoladamente com radioterapia ou cirurgia seguido por radioterapia localizada e/ou quimioterapia.25
Linfomas cutâneos secundáriosLinfomas cutâneos podem ser subdivididos em dois grandes grupos: os primários, nos quais não há evidência de doença extracutânea no momento do diagnóstico, e aqueles que são secundários a um linfoma sistêmico.27 Os linfomas cutâneos primários (LCP) representam um grupo heterogêneo de entidades e não serão abordados nessa revisão.
Os linfomas cutâneos secundários (LCS) representam 20% a 50% dos linfomas cutâneos.28 Podem ser classificados, de acordo com a linhagem celular que os originou, em linfoma T/NK ou linfoma B.28 Entre os casos relatados de LCS na literatura, a frequência relativa da linhagem T/NK madura variou de 48% a 72% em diferentes estudos, da linhagem B madura de 21% a 45%, enquanto as neoplasias hematológicas imaturas corresponderam a 4% a 8% dos casos e o linfoma de Hodgkin correspondeu a 0% a 4% dos casos.28–32
As manifestações clínicas dos LCS são polimórficas. Nódulos estão presentes frequentemente (fig. 5), em até 60% dos casos, mas máculas, patches e placas também podem ocorrer. Ulceração ocorre em até 9% dos casos. A morfologia das lesões não se correlacionou com a sobrevida em uma casuística.28
Pacientes com LCS de linhagem T/NK manifestam mais frequentemente lesões múltiplas ou disseminadas. A presença de lesões disseminadas é um fator de mau prognóstico.28 Linfomas de células T periféricas podem se manifestar clinicamente por nódulos ou tumorações, mas há descrição de erupções generalizadas maculopapulares ou urticariformes, com variação da morfologia das lesões no mesmo paciente ao longo do tempo.33
Para o linfoma anaplásico CD30+, há também diferenças significativas entre a forma cutânea primária e a forma secundária. O linfoma cutâneo anaplásico CD30+ secundário (fig. 6) é mais frequentemente caracterizado por pápulas e nódulos, tem maior frequência de sintomas B e tem pior prognóstico, com maior mortalidade e menor sobrevida em 5 anos.34
O linfoma de Hodgkin é associado a manifestações cutâneas específicas em menos de 1% dos casos, geralmente em doença avançada refratária.35 O modo de disseminação é por extensão direta de células neoplásicas para a pele.36 Envolvimento cutâneo por extensão direta também foi descrito em linfomas B nodais de alto grau.37
O diagnóstico dos LCS depende do diagnóstico do linfoma nodal associado. O diagnóstico dos linfomas é complexo e engloba fatores clínicos, morfológicos, histopatológicos, imuno‐histoquímicos e moleculares.38 O imunofenótipo caracterizado por expressão de CD20 e CD79a identifica linfomas de linhagem celular B, enquanto o marcador CD3, assim como os marcadores CD2, CD7 e LAT, identificam a linhagem celular T. Outros marcadores utilizados para o diagnóstico e classificação de linfomas são o marcador panlinfocitário CD45, o marcador de células NK CD56 e outros marcadores citotóxicos para células T e NK. Muitas vezes, apenas fatores clínicos, histopatológicos e imuno‐histoquímicos não são suficientes para estabelecer o diagnóstico de linfoma. Nesses casos, são utilizados também métodos moleculares para pesquisa de clonalidade e identificação da linhagem celular envolvida.38 Para diferenciar entre LCP e LCS, é necessário estadiar o paciente com exames de imagem, biópsia de medula óssea, citometria de fluxo do sangue periférico ou outros métodos, a fim de avaliar a presença de comprometimento nodal ou de outros órgãos no momento do diagnóstico, que caracteriza os LCS.
Quando o envolvimento cutâneo ocorre nos primeiros seis meses do diagnóstico, o prognóstico é pior do que nos casos em que lesões cutâneas secundárias ocorrem após seis meses do diagnóstico.28 Quando comparados aos LCP, os LCS têm pior sobrevida em cinco anos. A sobrevida em cinco anos dos LCS é de 31%, enquanto para os LCP varia de 87% a 92,5%.39
O tratamento do LCS é o tratamento do linfoma nodal que o originou. Opta‐se por radioterapia isolada para formas localizadas, ou combinada à quimioterapia para doença agressiva. Para os linfomas B, o anticorpo anti‐CD20 rituximabe é frequentemente utilizado, em conjunção ou não à poliquimioterapia. Outros tratamentos utilizados nos linfomas refratários incluem brentuximabe vedotina, ibrutinibe, acalabrutinibe e idelalisibe. Imunoterapia com inibidores de checkpoint também foi associada nos últimos anos ao arsenal terapêutico dos linfomas.40 O transplante de medula óssea é uma alternativa para casos refratários. Células CAR‐T (Chimeric Antigen Receptor T) também demonstraram resultados promissores em neoplasias hematológicas refratárias.41
ConclusãoNesta revisão/parte I, demonstramos aos dermatologistas, hematologistas e clínicos a importância do exame dermatológico completo e da familiaridade com as alterações cutâneas, que podem representar infiltração neoplásica de um quadro já conhecido ou mesmo lesão que anteceda o diagnóstico sistêmico. A elucidação etiológica sempre precisa ser confirmada por biópsia de pele seguida pelo exame anatomopatológico e imuno‐histoquímico. A identificação desse tipo de lesão extramedular auxilia na tomada de decisões em relação ao tratamento, que, se precoce, tem chance de alterar o prognóstico.
Observa‐se a necessidade de mais trabalhos epidemiológicos nessa área de conhecimento, para que haja dados estatísticos robustos e confiáveis. Evidencia‐se, ainda a importância de uma equipe multidisciplinar trabalhando de modo conjunto a esse doente tão complexo, no qual o dermatologista é o especialista responsável em avaliar e diagnosticar as alterações cutâneas.
Suporte financeiroNenhum.
Contribuição dos autoresPatricia Karla de Souza: Concepção do estudo; redação do artigo e revisão crítica do conteúdo intelectual importante; desenho do estudo em conjunto com coautores; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Rafael Oliveira Amorim: Redação do artigo e revisão crítica do conteúdo intelectual importante; desenho do estudo em conjunto com coautores; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Letícia Siqueira Sousa: Redação do artigo e revisão crítica do conteúdo intelectual importante; desenho do estudo em conjunto com coautores; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Mariana Dias Batista: Redação do artigo e revisão crítica do conteúdo intelectual importante; desenho do estudo em conjunto com coautores; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Souza PK, Amorim RO, Sousa LS, Batista MD. Dermatological manifestations of hematologic neoplasms. Part I: secondary specific skin lesions. An Bras Dermatol. 2023;98:5–12.
Trabalho realizado no Hospital Israelita Albert Einstein, São Paulo, SP, Brasil e no Departamento de Dermatologia, Universidade Federal de São Paulo, São Paulo, SP, Brasil.