O vitiligo é doença adquirida caracterizada por despigmentação da pele, que tem fundo genético e autoimune. A beta‐defensina‐1 humana (HBD‐1) e seu polimorfismo gênico foram associados a alguns distúrbios autoimunes.
ObjetivoElucidar o possível papel da HBD‐1 na patogênese do vitiligo não segmentar (VNS) por meio da avaliação dos níveis séricos da HBD‐1 e seu polimorfismo de nucleotídeo único (SNP) em pacientes com VNS, além de correlacionar os resultados com a extensão do vitiligo nesses pacientes.
MétodosUm estudo de caso‐controle com inclusão de 50 pacientes com VNS e 50 controles. O escore Vitiligo Area Scoring Index (VASI) foi utilizado para avaliar a gravidade da doença e investigações laboratoriais foram realizadas para avaliar os níveis séricos de HBD‐1 utilizando ELISA e o SNP da defensina‐beta1 (DEFB1) por análise de polimorfismo de fragmentos de restrição utilizando a reação em cadeia da polimerase (PCR‐RFLP).
ResultadosNíveis séricos de HBD‐1 significantemente mais baixos foram observados nos casos de VNS do que nos controles (p<0,001). Houve predominância significante do genótipo GG DEFB1 e do alelo G nos pacientes com VNS em relação aos controles (p <0,001). Os níveis séricos dos genótipos HBD‐1 e DEFB1 não foram associados ou correlacionados de maneira significante com nenhum dos parâmetros pessoais e clínicos dos pacientes com vitiligo.
Limitações do estudoO pequeno tamanho da amostra.
ConclusõesO polimorfismo do gene DEFB1 (genótipo GG e alelo G) pode modular o risco de vitiligo e contribuir para o desenvolvimento de vitiligo em populações egípcias. A diminuição dos níveis circulantes de HBD‐1 pode ter papel ativo na etiopatogenia do vitiligo, que pode ser mediada por seus possíveis efeitos anti‐inflamatórios.
O vitiligo é doença adquirida da pigmentação da pele. Sua principal característica é a perda de melanócitos da epiderme e/ou a perda de sua função. O vitiligo é queixa bastante comum, com prevalência mundial de 0,2%–1,8%.1 Sua etiologia exata permanece imprecisa; entretanto, supõe‐se que autoimunidade desempenhe papel fundamental em sua patogênese.2
Beta‐defensinas humanas (HBDs) são pequenos peptídeos catiônicos expressos em tecidos epiteliais em todo o corpo.3 Onze HBDs já foram identificadas.4 A primeira HBD identificada foi a beta‐defensina humana (HBD‐1), reconhecida em 1995.5 As HBDs ativam as respostas imunes inatas, tendo efeito antimicrobiano (peptídeos antimicrobianos) contra infecções. Além disso, as defensinas têm sido associadas ao desenvolvimento, à modulação imunológica e à fertilidade, bem como à cicatrização de feridas.6
Em relação às suas funções reguladoras imunológicas, as defensinas englobam propriedades pró e anti‐inflamatórias.7 Os efeitos pró‐inflamatórios ocorrem por meio da ligação com o receptor da defensina. Com base em sua natureza catiônica, as beta‐defensinas interagem com uma diversidade de receptores que surgem da ligação eletrostática.8 A função contraditória das beta‐defensinas (como anti‐inflamatórias) foi demonstrada por meio de sua capacidade de atenuar uma resposta pró‐inflamatória.9
O mecanismo pelo qual as beta‐defensinas podem neutralizar a reação pró‐inflamatória não está bem identificado, porém alguns mecanismos foram considerados. A ligação das defensinas (com carga positiva) a ligantes de carga negativa, como os lipopolissacarídeos (LPS), é mecanismo que possivelmente interfere na ligação com o ligante. Ainda, as defensinas podem atuar como antagonistas dos receptores utilizados por provocações pró‐inflamatórias. Além disso, as beta‐defensinas podem induzir a expressão de alguns mediadores anti‐inflamatórios. Além disso, as defensinas (p. ex., LL‐37) podem romper as membranas celulares, induzindo efeitos imunossupressores.10
A HBD‐1 é um peptídeo de 3928,6 kDa.5 É expressa principalmente no epitélio e tem papel antimicrobiano contra vírus e bactérias gram‐negativas e positivas.11 Além dessa função antimicrobiana ativa, a HBD‐1 tem efeitos imunomoduladores, pois é regulada positivamente em diferentes condições inflamatórias.12 A HBD‐1 é programada pelo gene DEFB1,13 que foi mapeado no cromossomo 8p22.14
Tendo em vista a autoimunidade, os polimorfismos dos genes HBD‐1 e DEFB1 foram estudados em algumas doenças sistêmicas e dermatológicas com graus variáveis de associação.15–18 Entretanto, a associação entre esse polimorfismo gênico e o vitiligo não foi suficientemente estudada em diferentes populações.19
Portanto, o objetivo do presente estudo foi elucidar o possível papel da HBD‐1 na patogênese do VNS por meio da avaliação dos níveis séricos de HBD‐1 e seu polimorfismo gênico em pacientes egípcios portadores de VNS, além de correlacionar os resultados com os aspectos clínicos do vitiligo nesses pacientes.
Pacientes e métodosO presente trabalho é um estudo de caso‐controle e incluiu 50 pacientes com VNS atendidos no Ambulatório de Dermatologia da Faculdade de Medicina, Menoufia University, durante o período de dezembro de 2019 a outubro de 2020. O diagnóstico definitivo de vitiligo foi estabelecido com base na apresentação clínica típica da doença por dois dermatologistas especialistas. O grupo controle incluiu 50 pessoas aparentemente saudáveis, pareadas por gênero e idade, sem histórico familiar de vitiligo.
O presente estudo foi aprovado pelo Comitê de Ética em Direitos Humanos em Pesquisa da Faculdade de Medicina, Menoufia University, e estava de acordo com a Declaração de Helsinque de 1975 (revisada em 2000). O estudo tem registro de aprovação do comitê de ética (1202/2/4/20120).
Cada participante recebeu uma explicação completa sobre a natureza e o objetivo do estudo. Um termo de consentimento por escrito foi obtido de cada participante ou de seus pais (< 18 anos) antes do início do estudo.
Foram incluídos pacientes com VNS de ambos os sexos. Indivíduos com qualquer uma das seguintes doenças foram excluídos: 1) doenças sistêmicas (p. ex., diabetes mellitus, cirrose, infecção e insuficiência renal; 2) doenças autoimunes (sistêmicas ou cutâneas; p. ex., artrite reumatoide e psoríase).
Os casos estudados foram submetidos a anamnese e exame clínico. Foi realizado exame dermatológico para identificar o tipo de VNS e sua distribuição. O escore VASI foi utilizado para determinar a gravidade do vitiligo.20
Foram obtidos 5mL de sangue venoso de cada participante estudado (pacientes e controles). Desses 5mL, 2mL foram deixados para coagular e depois centrifugados para separar o soro. Os soros separados foram armazenados em recipiente de plástico estéril a ‐20°C até o momento da análise dos níveis séricos de HBD‐1. A segunda parte (3mL) foi armazenada a ‐20°C em tubos contendo ácido etileno diamina tetra acético (EDTA) para posterior análise do polimorfismo do gene da beta‐defensina por análise de polimorfismo de fragmentos de restrição utilizando a reação em cadeia da polimerase (PCR‐RFLP).
Ensaio ELISA para os níveis séricos de beta‐defensina‐1Os níveis séricos de beta‐defensina‐1 foram medidos por kits ELISA (NeoBioscience Technology Co., Ltd, Shenzhen, República Popular da China) de acordo com as instruções do fabricante.
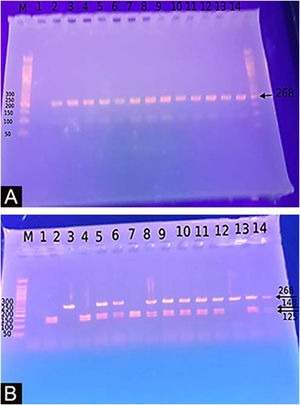
Genotipagem para o polimorfismo do gene DEFB1‐20G/A (rs11362)A extração do DNA foi feita em uma amostra de sangue utilizando o Mini Kit Gene JET® Whole Blood Genomic DNA Purification (THERMO SCIENTIFIC, EU/Lituânia), seguindo as instruções do fabricante. O SNP para o gene DEFB1 −20G/A (rs11362) foi realizado por PCR‐RFLP. As sequências dos primers foram: F: CTT GAC TGT GGC ACC TCC CTT CAG‐(sense) e R: ‐CAG CCC TGG GGA TGG GAA ACT C‐ (antisense). As reações de PCR foram realizadas em um volume total de 30 uL contendo 60 ng de DNA, 3μL 10× PCR Gold Buffer, 2,5mM MgCl2, 200 uM de cada desoxinucleotídeo trifosfato, 0,4mM de cada primer e 1 U de Ampli Taq Gold polimerase. As amostras foram desnaturadas a 95°C por 10 minutos, seguido por 30 ciclos de 95°C por 60 segundos, temperatura de hibridização de 66°C por 60 segundos e 72°C por 60 segundos, e uma extensão final por 10 minutos a 72°C. Após a PCR, os produtos foram digeridos com uma enzima de restrição específica, ScrFI (para G‐20A) (Jingmei Biotech, Xangai). A genotipagem foi realizada às cegas. O produto de PCR de 268 pb foi digerido por ScrFI durante uma noite a 37°C.21
Análise estatísticaOs dados foram avaliados com os programas Statistical Package for Social Sciences (SPSS) versão 23 e Epicalc 2000. As estatísticas foram divididas em duas partes: a) estatísticas descritivas: ex. média (X̄), mediana, desvio padrão (DP), intervalo, números (N) e porcentagens (%); e b) estatística analítica utilizando o teste do qui‐quadrado (χ2), teste t de Student (t), teste de Mann‐Whitney (U) e teste de Kruskal‐Wallis. O valor de p foi considerado significante se ≤ 0,05.
ResultadosDos 50 pacientes com VNS incluídos, 23 (46%) eram do sexo feminino e 27 (54%) do sexo masculino, com idade variando de 7 a 60 anos. Não houve diferenças significantes entre os pacientes com vitiligo e os controles em relação à idade (p=0,335) e gênero (p=0,070) (tabela 1).
Dados pessoais e clínicos dos pacientes com vitiligo e controles estudados
| Características pessoais | Pacientes com vitiligo | Controles | Teste de significância | p‐valor | ||
|---|---|---|---|---|---|---|
| (n = 50) | (n = 50) | |||||
| Idade (anos) | U = 0,97 | 0,335 | ||||
| Média± DP | 30,08 ± 14,46 | 32,30 ± 7,27 | ||||
| Mediana | 30 | 33 | ||||
| Variação | 7‐60 | 18‐46 | ||||
| n | % | n | % | χ2 | p‐valor | |
| Sexo | 3,27 | 0,070 | ||||
| Masculino | 27 | 54,0 | 18 | 36,0 | ||
| Feminino | 23 | 46,0 | 32 | 64,0 | ||
| História familiar de vitiligo | ||||||
| Positiva | 6 | 12,0 | ||||
| Negativa | 44 | 88,0 | ‐ | ‐ | ‐ | |
| Duração da doença/meses | ||||||
| Média ± DP | 17,28 ± 17,78 | ‐ | ‐ | ‐ | ||
| Mediana | 12 | |||||
| Variação | 3‐120 | |||||
| Escore VASI | ||||||
| Média ±DP | 3,72 ± 2,38 | ‐ | ‐ | ‐ | ||
| Mediana | 3,50 | |||||
| Variação | 0,1‐10 | |||||
| Tipos de vitiligo | ||||||
| Acrofacial | 18 | 36,0 | ‐ | ‐ | ‐ | |
| Generalizado | 10 | 20,0 | ||||
| Focal | 22 | 44,0 | ||||
| Acometimento capilar | ||||||
| Não | 46 | 92,0 | ‐ | ‐ | ‐ | |
| Sim | 4 | 8,0 | ||||
| Acometimento da membrana mucosa | ||||||
| Não | 46 | 92,0 | ||||
| Sim | 4 | 8,0 | ‐ | ‐ | ‐ | |
U, teste U de Mann‐Whitney; χ2, teste do qui‐quadrado; n, número; VASI, Vitiligo Area Severity Index.
Desses pacientes com VNS, seis casos tinham história familiar positiva para vitiligo (6/50,12%). A duração da doença variou de três a 120 meses. O escore VASI calculado variou de 0,1 a 10. Em relação ao tipo de vitiligo, 18 (36%) pacientes apresentavam vitiligo acrofacial, dez (20%) pacientes tinham vitiligo generalizado e 22 (44%) pacientes tinham vitiligo em placa única focal. Somente quatro casos (8%) apresentavam leucotríquia e quatro casos (8%) apresentavam acometimento de mucosa (tabela 1).
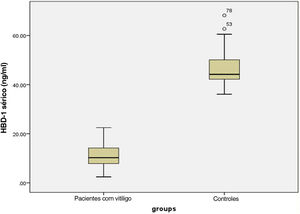
Níveis séricos de HBD‐1Os níveis séricos de HBD‐1 investigados foram significantemente mais baixos nos pacientes com vitiligo (11,14± 4,72 ng/mL) do que nos controles (46,53±6,77 ng/mL; p <0,001) – figura 1.
Relação entre os níveis séricos de HBD‐1 e os parâmetros estudados de pacientes com vitiligoOs níveis séricos de HBD‐1 não foram associados ou correlacionados significantemente com nenhum dos dados pessoais ou clínicos dos pacientes com vitiligo (p> 0,05 para todos; dados não apresentados).
Análise do equilíbrio de Hardy‐Weinberg (EHW)A aplicação do EHW para os genótipos de DEFB‐1 revelou que tanto os casos quanto o grupo controle apresentaram diferenças não significantes entre os valores observados e esperados (p=0,290 e p=0,432 respectivamente) – tabela 2.
Equilíbrio de Hardy‐Weinberg para genótipos DEFB‐1 de pacientes com vitiligo e grupo controle
| Genótipos de DEFB‐1 | Pacientes (n=50) | Controles (n=50) | ||
|---|---|---|---|---|
| Observados | Esperados | Observados | Esperados | |
| GG | 37 | 37,8 | 0 | 0,5 |
| AG | 13 | 11,3 | 10 | 9 |
| AA | 0 | 0,8 | 40 | 40,5 |
| p‐valor | 0,290 | 0,432 | ||
EHW, Equilíbrio de Hardy‐Weinberg; n, número; DEFB1, gene da defensina humana‐1.
O estudo do polimorfismo de nucleotídeo único de DEFB1 (fig. 2) mostrou que houve predomínio significante do genótipo GG em pacientes com vitiligo em 37 (74%) e predomínio do genótipo AA nos controles (p <0,001). Além disso, a presença do alelo G foi demonstrada de maneira significante em 87 casos estudados (87%) em relação aos 10 controles (10%), aumentando o risco de vitiligo em 60 vezes (p <0,001; OR=60,23) – tabela 3.
Distribuição percentual de genótipos e alelos de DEFB‐1 em pacientes com vitiligo e grupo controle
| Genótipos de DEFB‐1 | Pacientes | Controles | χ2 | p‐valor | OR (IC95%) |
|---|---|---|---|---|---|
| (n=50) | (n=50) | ||||
| n (%) | n (%) | ||||
| GG | 37 (74,0) | 0 | 77,39 | <0,001a | ‐ |
| AG | 13 (26,0) | 10 (20,0) | |||
| AA | 0 | 40 (80,0) | |||
| Alelos | (n=100) | (n=100) | 118,69 | <0,001a | 60,23 (25,10‐144,56) |
| G | 87 (87,0) | 10 (10,0) | |||
| A | 13 (13,0) | 90 (90,0) |
DEFB‐1, defensina humana‐1; OR, odds ratio; IC, intervalo de confiança; χ2, teste do qui‐quadrado; n, número.
aSignificante.
O nível sérico de HBD‐1 mostrou associação não significante com os genótipos de DEFB‐1 em pacientes com vitiligo (p=0,611) e no grupo controle (p=0,716) – tabela 4.
Nível sérico de HBD‐1 em relação aos genótipos de beta‐defensina humana‐1 em pacientes com vitiligo e grupo controle
| Genótipos de DEFB‐1 | Níveis séricos de HBD‐1 (ng/mL) | |
|---|---|---|
| Pacientes (n=50) | Controles (n=50) | |
| Média±DP | Média±DP | |
| GG | 10,82±4,47 | ‐ |
| AG | 12,08±5,44 | 45,23±5,88 |
| AA | ‐ | 46,85±7,00 |
| Teste de Mann‐Whitney | 0,51 | 0,36 |
| p‐valor | 0,611 | 0,716 |
HBD‐1, beta‐defensina humana‐1; n, número; DEFB‐1, gene da defensina humana‐1.
Os genótipos DEFB‐1 mostraram associação não significante com os dados pessoais e clínicos estudados de pacientes com vitiligo (p> 0,05 para todos; dados não mostrados).
DiscussãoA reação Th17 é descrita pela elicitação de AMPs por meio da sinalização de IL‐17A, IL‐22 e IL‐17F, resultando em inflamação localizada. Os AMPs que incluem HBD‐1, são capazes de exercer quimioatração de células dendríticas imaturas, células T e neutrófilos diretamente via sinalização de CCR6 e indiretamente por meio da indução de HBD‐3.22 Na existência de sinais de ameaça (como estresse oxidativo e níveis extraordinários de IL‐6, IL‐8, bem como proteína de choque térmico 70), essa quimioatração pode promover a apresentação de autoantígenos, resultando em despigmentação.23,24
Portanto, era esperada regulação positiva da concentração de HBD‐1 circulante em pacientes com vitiligo em comparação com seus pares. No entanto, no presente estudo, foram observados níveis séricos de HBD‐1 significantemente mais baixos em casos de vitiligo em comparação aos controles.
Confirmando esse resultado inesperado, Ochoa‐Ramírez et al.25 investigaram 171 pacientes mexicanos com VNS. Eles notaram que a HBD‐1 tinha concentrações estimadas mais baixas em pacientes com VNS do que nos controles. Além disso, os autores descobriram que os casos com vitiligo ativo tinham concentrações de HBD‐1 mais baixas do que aqueles com doença estável, propondo que os níveis baixos de HBD‐1 circulante estejam ligados à atividade do vitiligo. Além disso, no diabetes tipo 1 (DM1), doença mediada por CD8+ CTLs, os níveis circulantes de HBD‐1 foram relatados como significantemente mais baixos do que no grupo controle.16–18
Em relação ao DM1, um possível esclarecimento para esse resultado é que a ativação extrema do subgrupo de células T citotóxicas CD8+, característica do DM1, afeta negativamente a HBD‐1.26 Além disso, a sinalização da insulina é importante para a expressão ideal de HBD‐1 por meio do aumento das concentrações intracelulares da glicose e da mediação da expressão gênica.27
No entanto, no vitiligo, é sugerido que a subpopulação de células CTL CD8+ dérmicas possa ser responsável pela produção local e regulação positiva local de HBD‐1 que participa do processo inflamatório e despigmentação localizada da pele, sem qualquer efeito sistêmico nos níveis de HBD‐1. Além disso, é sugerido que a HBD‐1 possa ser transferida da corrente sanguínea para a pele com vitiligo induzindo a despigmentação, e que essa transferência tenha resultado em seus níveis séricos mais baixos.
Confirmando a presente hipótese sobre os efeitos inflamatórios locais da HBD‐1, Polesello et al.18 e Ozlu et al.19 demonstraram aumento de HBD‐1 na saliva e em biópsias de pele em pacientes com líquen plano oral e psoríase, respectivamente. Portanto, estudos para avaliar simultaneamente os níveis sistêmicos e teciduais de HBD‐1 são recomendados.
Outra explicação para os baixos níveis de HBD‐1 demonstrados atualmente em casos de vitiligo pode ser o fato de que a HBD tem função anti‐inflamatória sistêmica.10 Recentemente, foi levantada a hipótese de que a HBD‐2 poderia suprimir as secreções, mediadas por células dendríticas, de citocinas pró‐inflamatórias, como IL‐1β, IL‐12 e TNF‐α na doença inflamatória intestinal (DII),28 bem como diminuir IL‐6 e TNF‐α em tecidos pulmonares.29 Além disso, a HBD‐3 reduz a secreção de IL‐6 e IL‐8, mostrando potencial promissor como terapia adjuvante para o tratamento de periodontite inflamatória.9
Assim, é possível que no vitiligo, a HBD‐1 poderia atuar como peptídeo anti‐inflamatório, e os baixos níveis séricos de HBD‐1 demonstrados em pacientes com vitiligo podem ser traduzidos em atividade anti‐inflamatória reprimida. Portanto, mais estudos sobre a HBD‐1 são necessários para verificar essa hipótese.
No presente estudo, foi observado que os níveis séricos de HBD‐1 não foram afetados por nenhuma característica pessoal ou clínica avaliada nos pacientes com vitiligo. Esse resultado está de acordo com os de Ochoa‐Ramírez et al.,25 que observaram associação não significante entre os níveis séricos de HBD‐1 e as características clínicas do vitiligo.
O gene DEFB1 (localizado no cromossomo 8p22) consiste em dois éxons. O primeiro codifica a pró‐sequência e o sinal, ricos em leucina. O segundo éxon, no entanto, codifica o peptídeo maduro.7 Os SNPs desse gene podem ocorrer em diferentes locais das 50 regiões não codificadoras do primeiro éxon,26 incluindo −52G> A (rs1799946), −44C> G (rs1800972) e −20G> A (rs11362).18
O presente trabalho analisou o polimorfismo dos genótipos −20G/A (rs11362) da DEFB1. Foi observada predominância significante do genótipo GG DEFB1 (−20G/A) em pacientes com vitiligo em comparação com os controles, bem como do alelo G, o que aumentou a possibilidade de ocorrência de vitiligo em cerca de 60 vezes. Entretanto, nos controles foi demonstrado que o genótipo DEFB1 (−20G/A) AA e o alelo A eram significantemente frequentes e considerados de valor protetivo.
Em consonância com esse resultado, Ochoa‐Ramírez et al.25 observaram que houve predominância do genótipo GG na posição 20 em pacientes com vitiligo em relação aos controles. Além disso, Salem et al.30 estudaram 50 pacientes egípcios com VNS e demonstraram que o genótipo AA do gene DEFB1 (−20G/A) e o alelo A tinham frequências significantemente mais baixas em pacientes com vitiligo e exerciam um efeito protetor contra o desenvolvimento da doença.
Além disso, na dermatite atópica (uma doença inflamatória mediada por células T), de Oca et al.31 descobriram que o genótipo −20 GG representa fator de risco genético para o desenvolvimento de dermatite atópica. Por outro lado, na DII (doença imuno‐inflamatória), Zanin et al.32 relataram que os pacientes com DII apresentavam alelo G mais frequentemente do que os controles. Entretanto, no lúpus eritematoso sistêmico (LES), que é uma doença autoimune, Sandrin et al.33 relataram que o genótipo AA e seu alelo A apresentaram frequências menos significantes no grupo de pacientes em relação ao grupo controle, mostrando efeitos protetores.
Certos polimorfismos do gene da DEFB1 podem afetar a atividade de transcrição da DEFB1 e consequentemente a expressão da proteína HBD‐1. De fato, polimorfismos na região 50 não traduzida do gene da DEFB1 alteram o sítio de ligação do fator de transcrição putativo para a subunidade p105 do fator nuclear‐KB, resultando na expressão da proteína HBD1.18
No presente estudo, os níveis séricos de HBD‐1 não foram significantemente afetados pelo SNP do gene da DEFB1, tanto em pacientes com vitiligo quanto no grupo controle. Em apoio a esse resultado, Ochoa‐Ramírez et al.25 observaram associação não significante entre as concentrações séricas de HBD‐1 e os genótipos de DEFB1.
Entretanto, na DII, Zanin et al.33 relataram que a localização da doença de Crohn colônica estava ligada à expressão deficiente de HBD‐1, pois o alelo (c.−20G/A) A parece estar relacionado a níveis reduzidos de expressão local de HBD‐1. Os autores concluíram que o polimorfismo do gene da DEFB1 pode causar menor expressão de HBD‐1 em células epiteliais do cólon. O mecanismo patogênico diferente do vitiligo e da doença de Crohn, bem como o tamanho da amostra diferente entre aquele estudo (n=145) e o presente estudo (n=50) podem explicar a diferença.
No presente estudo foi observado que os genótipos de DEFB1 não tiveram efeitos significantes em nenhuma das características pessoais estudadas ou dados clínicos dos pacientes com vitiligo estudados (idade, sexo, duração da doença e escore VASI). Confirmando esse estudo, Ochoa‐Ramírez et al.25 observaram associação não significante entre os genótipos de DEFB1 e os dados clínicos estudados de casos de VNS.
Entretanto, o estudo de Salem et al.30 estava parcialmente de acordo com esses resultados. Eles demonstraram diferença não significante na distribuição dos genótipos de DEFB1 (−20G/A) em relação à história e achados clínicos diferentes, exceto para o escore VASI médio. Eles descobriram que os portadores do genótipo AA estavam associados a escores VASI significantemente mais baixos. Essa diferença pode ser decorrente do pequeno tamanho da amostra em cada estudo (n=50 pacientes com VNS) e/ou diferentes critérios de seleção dos casos investigados, pois eles estudaram apenas pacientes com VNS ativo, enquanto o presente estudo avaliou pacientes com VNS independentemente da atividade da doença.
As limitações do presente estudo foram a) o pequeno número de casos investigados, b) sua estrutura (estudo de caso controle) e c) avaliação de apenas um único marcador inflamatório em vez de múltiplos marcadores.
ConclusõesParece que o polimorfismo do gene da DEFB1 em −20 pode modular o risco de desenvolvimento de vitiligo, pois o genótipo GG DEFB1 (−20G/A) e o alelo G contribuem para o desenvolvimento de vitiligo em populações egípcias. A diminuição dos níveis circulantes de HBD‐1 pode ter papel ativo na etiopatogenia do vitiligo, que pode ser mediada por seus possíveis efeitos anti‐inflamatórios.
Suporte financeiroNenhum.
Contribuição dos autoresTodos os autores devem ter feito contribuições substanciais para todos os itens a seguir.
Azza Gaber Antar Farag: Revisão crítica da literatura; concepção e planejamento do estudo; aprovação da versão final do manuscrito.
Mohamed Abd Al Moneam Shoaib: Concepção e planejamento do estudo; aprovação da versão final do manuscrito.
Azza Zagloul labeeb: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Asmaa Shaaban Sleem: Interpretação dos dados; aprovação da versão final do manuscrito.
Hagar Mahmoud AbdElkader Khallaf: Obtenção de dados; aprovação da versão final do manuscrito.
Amany Salah Khalaf: Análise e interpretação dos dados; aprovação da versão final do manuscrito.
Mustafa Elsayed Elshaib: Análise estatística; aprovação da versão final do manuscrito.
Nada Farag Elnaidany: Análise estatística; aprovação da versão final do manuscrito.
Hayam Mohamed Aboelnasr Hanout: Planejamento do estudo; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Todos os autores agradecem às equipes administrativas e técnicas do Ambulatório de Dermatologia e do Departamento de Patologia da Faculdade de Medicina, Menoufia University, que gentilmente ajudaram ao longo deste estudo.
Como citar este artigo: Farag AGA, Shoeib MAA, labeeb AZ, Sleem AS, Khallaf HMA, Khalifa AS, et al. Human beta‐defensin 1 circulating level and gene polymorphism in non‐segmental vitiligo Egyptian patients. An Bras Dermatol. 2023;98:181–8.
Trabalho realizado no Departamento de Dermatologia, Andrologia e ISTs e Departamento de Biologia Molecular, Faculdade de Medicina, Menoufia University, Egito.