O vitiligo é uma doença cutânea comum em que os melanócitos são destruídos por respostas imunes autorreativas. A perda de melanócitos resulta no aparecimento de áreas despigmentadas em diferentes partes do corpo. As citocinas, como IL‐1, IL‐6 e TNF‐α, têm um papel importante na patogênese do vitiligo. A interleucina 27 (IL‐27) é um novo membro da família IL‐6/IL‐12, liberada principalmente por células apresentadoras de antígeno ativadas. Foi sugerido que a IL‐27 atue como citocina pró‐inflamatória e anti‐inflamatória. Concentrações alteradas de IL‐27 foram observadas em várias doenças autoimunes, como esclerose múltipla, artrite reumatoide e psoríase. Ainda não foram realizados estudos para determinar a expressão dessa citocina em pacientes com vitiligo.
ObjetivoDeterminar a concentração sérica de IL‐27 em pacientes com vitiligo e compará‐la com a de indivíduos normais.
MétodosA concentração sérica de IL‐27 em 79 pacientes com vitiligo foi avaliada em comparação com 45 controles saudáveis com o teste ELISA.
ResultadosOs resultados mostraram diminuição da concentração de IL‐27 em pacientes com vitiligo em comparação com indivíduos saudáveis (p = 0,026). Além disso, não foi observada correlação entre as concentrações de IL‐27 e os parâmetros da doença, como a gravidade do vitiligo e a extensão da área despigmentada.
Limitação do estudoUm tamanho de amostra maior seria mais recomendável para esse estudo.
ConclusãoA redução nos níveis séricos de IL‐27 em pacientes com vitiligo em comparação com indivíduos normais sugere que essa citocina possa ter um papel anti‐inflamatório no vitiligo. Assim, a IL‐27 pode ser considerada como um novo alvo para a manipulação do sistema imunológico em pacientes com vitiligo.
O vitiligo é uma doença despigmentante adquirida comum, caracterizada por manchas brancas distribuídas em várias partes do corpo e que afetam significativamente a qualidade de vida e a saúde mental dos pacientes.1,2 A prevalência do vitiligo em diferentes sociedades foi relatada como de 0,5% a 1%.3 Segundo uma metanálise recente, a prevalência de vitiligo entre diferentes comunidades foi de 0,2% e em estudos hospitalares, de 1,8%.4 O vitiligo surge com um padrão notável de despigmentação macular, com aparência variável em forma ou tamanho. Essa doença é classificada em dois subgrupos, vitiligo generalizado e localizado, nos quais se observa ausência de melanócitos funcionantes.5
As principais causas de vitiligo são complexas e podem ser o resultado de distúrbios genéticos, que podem apresentar herança poligênica e multifatorial.6 Sua principal causa ainda não está clara; no entanto, algumas evidências indicam que uma mudança nas funções imunológicas contribui para esse tipo de ação.7 Presume‐se que o vitiligo resulte de reações autoimunes que destroem gradualmente os melanócitos. Apesar da detecção de autoanticorpos autorreagentes em pacientes com vitiligo, um conjunto cada vez maior de evidências respalda a teoria de imunidade celular alterada como a principal causa dessa doença desfigurante.8 As citocinas têm um papel central na mediação das reações imunes celulares e humorais. O desequilíbrio entre citocinas pró‐ e anti‐inflamatórias, que favorece a predominância de uma resposta Th1/Th17, em vez de uma resposta Th2/Treg, foi proposto como um possível mecanismo subjacente do vitiligo. No entanto, um conjunto considerável de evidências respalda o papel das células T CD8 tipo 1 na destruição de melanócitos.9,10 O aumento da expressão de citocinas pró‐inflamatórias em pacientes com vitiligo (inclusive IL‐1, IL‐6 e TNF‐α) foi demonstrado em vários estudos.11–13
A IL‐27, um membro bastante novo da família IL‐6/IL‐12, é principalmente liberada por células apresentadoras de antígeno ativadas, incluindo células dendríticas (CDs), monócitos e macrófagos.14,15 Ela é composta por duas subunidades, a molécula 3 induzida por EBV(EBI3), um homólogo de IL‐12 p40, e a p28, um homólogo de IL‐6 p35. O receptor de IL‐27 (IL‐27R) é um heterodímero composto por uma cadeia alfa específica de IL‐27R (WSX‐1) e uma subunidade gp130.16 A IL‐27R é expressa por vários tipos de células, inclusive, mas não limitadas a células T, B e NK, CDs, macrófagos, queratinócitos, células T CD8 tipo 1 e células endoteliais.17–19 A sinalização de IL‐27R resulta na ativação das vias JAK‐STAT e p38 MAPK.20,21 A IL‐27 aumenta a diferenciação das células Th1 e Tr1 por meio da ativação de STAT1/3 enquanto inibe a diferenciação de células T reguladoras e células Th2.21–26 Além da diferenciação Th1, também foi demonstrado que a sinalização de IL‐27 por meio do STAT‐1 ativa células NK, que foram consideradas como tendo um papel na patogênese do vitiligo.27
Embora estudos anteriores tenham identificado o papel inflamatório da IL‐27, as evidências mais recentes sugerem um efeito imunomodulador dessa citocina.28 A IL‐27 induz Tr1 e inibe as respostas Th2 e Th17, limitando, portanto, a gravidade das doenças autoimunes pela supressão das células Th17.29–31 Ela também desempenha funções imunorregulatórias devido à regulação positiva de PD‐L1, IDO e IL‐10.32 Assim, sugere‐se que essa citocina pode ser considerada como um possível agente terapêutico para algumas doenças inflamatórias ou autoimunes.
Em relação à natureza complexa pró‐ e anti‐inflamatória da IL‐27, vários estudos avaliaram as concentrações locais ou sistêmicas da IL‐27 em diferentes doenças. Alterações na concentração de IL‐27 e sua correlação com parâmetros autoimunes também foram relatadas em várias doenças inflamatórias mediadas por Th1/Th17, como esclerose múltipla, lúpus eritematoso sistêmico, doença inflamatória intestinal e artrite reumatoide.33–36
As concentrações de IL‐27 em pacientes com vitiligo ainda não foram investigadas. O presente estudo teve como objetivo avaliar os níveis séricos de IL‐27 em pacientes com vitiligo.
MétodosPopulação do estudoForam incluídos no estudo 79 pacientes com vitiligo, dos quais 32 (41%) eram do sexo masculino e 47 (59%) do feminino, bem como 45 controles saudáveis sem sinais de doenças autoimunes e pareados por idade e sexo. A população do estudo incluiu 72 pacientes com vitiligo generalizado e sete com vitiligo localizado. Os pacientes concordaram em participar do estudo, que foi aprovado pelo Comitê de Ética da Faculdade de Medicina da Universidade de Ciências Médicas de Shiraz (IR.sums.med.rec.1397.400).
Coleta de amostrasDe toda a população do estudo, foram coletados 5mL de sangue periférico. Após centrifugação a 3.000rpm por 10 minutos, os soros foram separados e mantidos a ‐70°C até o uso.
Medição da IL‐27 séricaAs concentrações séricas de IL‐27 foram determinadas pelo ensaio imunoenzimático (ELISA) em pacientes com vitiligo e em indivíduos saudáveis. As concentrações de IL‐27 foram quantificadas de acordo com as instruções dos fabricantes do kit ELISA (DY2526‐05, R&D Systems ‐ Estados Unidos). A sensibilidade dos testes foi de 12,8 pg/mL. Em resumo, 100μL de anticorpo de captura foram colocados em cada micropoço de uma placa com 96 micropoços durante a noite em temperatura ambiente. Após lavagem e bloqueio, 100μL de soro de pacientes e controles foram adicionadas por duas horas em temperatura ambiente. As placas foram lavadas novamente e 100μL do anticorpo de detecção e, em seguida, 100μL da diluição de estreptavidina com peroxidase de rábano foram adicionados por 20 minutos. Em seguida, foi adicionada solução de substrato (100μL) por 20 minutos; finalmente, a reação foi interrompida adicionando a solução de parada a cada poço. A densidade óptica das amostras foi lida com um leitor de microplacas a 450nm. Os níveis de citocina foram extrapolados a partir da curva padrão relacionada.
Análise estatísticaTodos os dados foram analisados pelo software SPSS v. 16 (SPSS Inc. ‐ Chicago, IL, Estados Unidos) e de acordo com o teste de normalidade (teste de Kolmogorov‐Smirnov). Os testes não paramétricos U de Mann‐Whitney e Kruskal‐Wallis foram usados e valores‐p < 0,05 foram considerados significativos. Os gráficos foram elaborados com Graph Pad Prism (v. 6 ‐ La Jolla, CA, Estados Unidos). Todos os dados foram apresentados como média ± erro padrão da média (SEM), a menos que especificado de outra forma.
ResultadosAnálise demográficaA tabela 1 apresenta uma visão geral das características demográficas e clínicas de pacientes com vitiligo e indivíduos saudáveis participantes do estudo.
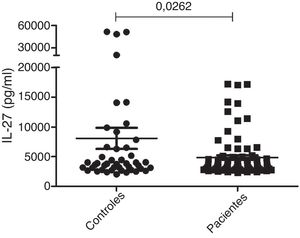
Medição da IL‐27 séricaAs concentrações séricas de IL‐27 em 79 pacientes com vitiligo generalizado (72 casos) ou localizado (sete casos) foram mensuradas pela técnica ELISA. O grupo controle incluiu 45 indivíduos saudáveis e pareados por sexo. Como apresentado na figura 1, os resultados mostraram uma diferença significativa nas concentrações séricas de IL‐27 entre pacientes com vitiligo (5.267,8 ± 399 pg/mL) e indivíduos saudáveis (7.097,7 ± 1.502 pg/mL; p = 0,0262).
Correlações entre IL‐27 e características demográficas e manifestações clínicasForam avaliadas as correlações entre as concentrações séricas de IL‐27 e sexo, gravidade da doença, dois tipos de vitiligo (localizado/generalizado), formas segmentar/não segmentar da doença e resposta ao tratamento em pacientes com vitiligo. Não foi observada uma correlação significativa entre os níveis de IL‐27 e esses parâmetros no presente estudo (tabela 2).
Comparação das concentrações séricas de IL‐27 com base em dados demográficos e manifestações clínicas em pacientes com vitiligo
| n | Média (pg/mL) | valor‐p | |
|---|---|---|---|
| Sexo | |||
| Masculino | 32 | 4.623,8 ± 544,2 | 0,681 |
| Feminino | 47 | 4.961,5 ± 564,5 | |
| Total | 79 | ||
| Gravidade (disseminação das lesões) | |||
| Área corporal < 20% | 49 | 4.793,9 ± 486,6 | 0,071 |
| Área corporal 20%–50% | 24 | 4.132,7 ± 435,1 | |
| Área corporal > 50% | 6 | 7.844,7 ± 2.928,6 | |
| Total | 79 | ||
| Tipo: localizado ou generalizado | |||
| Generalizado | 72 | 4.925,9 ± 434,3 | 0,421 |
| Localizado | 7 | 3.784,3 ± 541,5 | |
| Total | 79 | ||
| Tipo: segmentar ou não segmentar | |||
| Segmentar | 8 | 3.668,8 ± 483,0 | 0,335 |
| Não segmentar | 71 | 4.955,0 ± 439,5 | |
| Total | 79 | ||
| Resposta ao tratamento | |||
| Sim | 57 | 4.492,8 ± 380,9 | 0,154 |
| Não | 21 | 5.797,1 ± 1.083,9 | |
| Total | 78 | ||
A principal causa do vitiligo ainda não foi bem estabelecida. Recentemente, estudos em humanos e experimentais apresentaram evidências consideráveis sobre o padrão de autoimunidade na patogênese do vitiligo. Foi demonstrado que a imunidade humoral e celular está envolvida na etiologia da doença.37–39 As evidências sugerem um papel primário dos mecanismos mediados por células, inclusive as células Th1/Th17 e Tc1, na patogênese do vitiligo.40 Várias citocinas inflamatórias (IL‐1, IL‐6, TNF‐α, IL‐6 e IL‐17) desempenham um papel fundamental na despigmentação da pele, enquanto o nível de TGF‐β indicava um estado reversível.6,41
Foi sugerido que a IL‐27 atue como citocina pró‐inflamatória e anti‐inflamatória. Concentrações alteradas de IL‐27 foram observadas em várias doenças autoimunes e dermatológicas. Apesar de os estudos iniciais terem identificado o papel pró‐inflamatório da IL‐27, as evidências mais recentes sugerem que ela suprime a proliferação de células imunes e a produção de citocinas.28 Essas aplicações das citocinas estão relacionadas a sua atividade pró‐ ou anti‐inflamatória. O duplo papel da IL‐27 está relacionado aos diferentes tecidos envolvidos, ao mecanismo subjacente ou ao tipo e estágio das doenças autoimunes.29 Estudos anteriores revelaram que a concentração sanguínea de IL‐27 estava aumentada em pacientes com pênfigo e psoríase. Eles indicaram que os níveis de IL‐27 estavam fortemente correlacionados com os títulos de autoanticorpos IgG no pênfigo e também com o início e a gravidade da psoríase.42,43 A literatura também apresenta relatos de expressão de IL‐27 na pele com eczema.43 Essa evidência respalda a função pró‐inflamatória da IL‐27. Embora as concentrações plasmáticas de IL‐27 sejam elevadas em algumas doenças cutâneas, o nível sérico dessa citocina é reduzido em algumas doenças autoimunes, como a sindrome de Vogt‐Koyanagi‐Harada (VKH), doença de Behçet (DB) e LES. Wang et al. descreveram que a expressão do mRNA de p28da IL‐27 por células mononucleares do sangue periférico e a concentração sérica de IL‐27 nos soros e sobrenadantes de culturas dessas células foram visivelmente reduzidas em pacientes com DB e VKH ativas. Além disso, Gaber et al. observaram que o nível de IL‐27 em pacientes com LES é significativamente mais baixo do que em controles saudáveis.44–46
Com base nessas explicações e nos resultados de vários estudos sobre a expressão alterada de IL‐27 em doenças autoimunes e doenças cutâneas, foi levantada a hipótese de que a concentração de IL‐27 em pacientes com vitiligo poderia estar alterada. Consistentemente com estudos anteriores em pacientes com LES e DB, o presente estudo observou que as concentrações séricas de IL‐27 foram reduzidas em pacientes com vitiligo, o que pode ser justificado por alguns mecanismos prováveis. Em primeiro lugar, a IL‐27 atua contra o desenvolvimento de Th17 de maneira direta, por meio da modulação de CDs, e induz a produção de IL‐10 por células T CD4 + primitivas.45 A Th17 contribui para a patogênese do vitiligo pela produção de IL‐17. A IL‐27 inibe a diferenciação e geração de células Th17 via IL‐6 e a supressão do fator de crescimento transformador‐β (TGF‐β), que depende da molécula de sinalização intracelular STAT1.44
ConclusãoA IL‐27 desempenha um papel imunomodulador no vitiligo. De acordo com as observações do presente estudo, não foi identificada uma associação entre o nível sérico de IL‐27 e dados demográficos, gravidade da doença, tipos de vitiligo e resposta ao tratamento. Mais estudos com maior número de pacientes, inclusive todos os tipos de vitiligo, são necessários para revelar as possíveis alterações na concentração de IL‐27 nesses pacientes e sua correlação com as características da doença, inclusive gravidade e extensão da área da pele afetada. A IL‐27 desempenha dois papéis e deve ser considerada como um novo alvo para a manipulação do sistema imunológico em várias doenças imunomediadas.
Suporte financeiroUniversidade de Ciências Médicas de Shiraz (bolsa n° 17684).
Contribuição dos autoresSaeed Malek Hosseini: Redação e edição do manuscrito.
Naser Gholijani: Coleta, análise e interpretação de dados; participação no desenho do estudo.
Nooshafarin Chenari: Coleta, análise e interpretação de dados; participação no desenho do estudo; redação e edição do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Hosseini SM, Gholijani N, Chenari N, Kalantar K. Decreased levels of interleukin 27 in the serum of vitiligo patients. An Bras Dermatol. 2020;95:570–4.
Trabalho realizado na Universidade de Ciências Médicas de Shiraz, Shiraz, Irã.