Bartoneloses o termo utilizado para descrever doenças causadas por qualquer espécie de Bartonella. A infecção pode manifestar‐se como bacteremia assintomática a quadros potencialmente fatais. Muitas espécies são patogênicas ao homem, mas três são responsáveis pela maioria das manifestações clínicas em seres humanos: Bartonella bacilliformis, Bartonella quintana e Bartonella henselae. A verruga peruana, causada pela B. bacilliformis, pode ser indistinguível da angiomatose bacilar causada pelas outras duas espécies. Outras manifestações cutâneas são: exantema maculopapular na febre das trincheiras, pápulas ou nódulos na doença da arranhadura do gato, vasculites (muitas vezes associadas às endocardites). Além dessas, pode ocorrer exantema morbiliforme febril, púrpura, urticária, eritema nodoso, eritema multiforme, eritema marginado, granuloma anular, vasculites leucocitoclásticas, reações granulomatosas e reações angioproliferativas. Considerando o amplo espectro da infecção e as potenciais complicações associadas às Bartonella spp., a infecção deveria ser considerada pelos médicos com mais frequência entre diagnósticos diferenciais de condições idiopáticas. Estas doenças são frequentemente negligenciadas por profissionais da saúde e pesquisadores.
Bartoneloses é o termo utilizado para descrever doenças causadas por qualquer espécie de Bartonella.1 Elas são negligenciadas, reemergentes e mundialmente distribuídas, afetando principalmente populações em situação de pobreza, com sanitização precária e que tenham contato direto com artrópodes e animais domésticos.2,3 A maioria das espécies causa doença zoonótica.1,3
Bartonella spp. são bacilos Gram‐negativos, fastidiosos e bem adaptados a uma grande variedade de animais reservatórios, particularmente mamíferos. Essas bactérias são capazes de infectar e sobreviver dentro de eritrócitos. A fase intraeritrocítica proporciona um nicho de proteção para o agente, resultando em infecção prolongada e recorrente.4 As bactérias podem também infectar células endoteliais.5
A principal forma de transmissão das Bartonella spp. é de humanos ou animais infectados para novos hospedeiros por meio de vetores artrópodes sugadores de sangue. A transmissão por meio de arranhaduras de animais tem sido relatada, mas não é garantida, uma vez que pulgas são necessárias para que haja a transmissão entre gatos.1,6 Estudos recentes reforçam a hipótese de que essas bactérias possam ser transmitidas por transfusão sanguínea, preocupando pessoas ao redor do mundo, uma vez que atualmente nenhuma ação preventiva é feita contra essa possibilidade.3,7–9 Além disso, a infecção assintomática por Bartonella sp. já foi detectada em doadores de sangue.3,8–18
As Bartonella spp. são responsáveis por um amplo espectro clínico, desde bacteremia assintomática a quadros potencialmente fatais. Embora as manifestações associadas às bartoneloses tenham aumentado bastante nas últimas décadas, os médicos normalmente não consideram a possibilidade de infecção por essas bactérias entre os diagnósticos diferenciais, exceto nos casos de linfonodomegalia localizada ou endocardites com cultura negativa,19,20 o que sugere que as bartoneloses têm sido negligenciadas pela comunidade médica e muitos dos casos não são, desse modo, diagnosticados.
Aspectos clínicosDentre as 16 espécies de Bartonella que são patogênicas aos seres humanos, três são responsáveis pela maioria das manifestações clínicas: Bartonella bacilliformis, Bartonella quintana e Bartonella henselae.5,21
Até 1993, a B. bacilliformis foi considerada a única espécie desse gênero. É o agente etiológico da doença de Carrión, anteriormente conhecida como a única bartonelose. A B. bacilliformis é transmitida por fêmeas de Lutzomyia verrucarum, endêmicas nas regiões de grandes altitudes dos Andes peruanos e regiões do Equador e Colômbia.
Relatos nas últimas décadas de surtos em regiões de altitude atípica sugerem fortemente potencial de expansão da área epidemiológica. As mudanças climáticas atuais associadas a atividades humanas têm contribuído para o ressurgimento da infecção e sua expansão para novas áreas. Alterações do clima afetam a distribuição dos vetores e, além disso, fenômenos como o El Niño tem provocado o aumento dos níveis de umidade, favorecendo a reprodução dos vetores e a ocorrência de surtos.22,23 Alguns estudos realizados com animais para a busca de potenciais novos hospedeiros mostraram que algumas espécies de macacos presentes nas selvas da América do Sul, como o macaco‐da‐noite (Aotus infulatus) são suscetíveis a infecção por B. bacilliformis. Esses dados alertam para o risco da expansão doença de Carrión pela possível adaptação de vetores em áreas habitadas por estes animais, que podem atuar como facilitadores para a dispersão em áreas vizinhas às regiões endêmicas, inclusive no Brasil.24
Bifásica, a doença tem uma fase aguda (febre de Oroya) caracterizada por febre, anemia hemolítica e imunodeficiência transitória, e uma fase crônica (verruga peruana) expressa por lesões cutâneas vasoproliferativas.1,25
A fase aguda da doença tem duração de uma a quatro semanas e a gravidade pode variar de leve a fatal. A ausência de tratamento com antibióticos pode levar a uma taxa de mortalidade de até 88%. É decorrente da invasão massiva de eritrócitos e conduz inicialmente a sintomas não específicos como mal‐estar, sonolência, cefaleia, calafrios, febre, anorexia e mialgia, que vão tornando o paciente cada vez mais ictérico e confuso. Na medida em que a doença progride, um grave quadro hemolítico acompanhado de linfadenopatia e hepatoesplenomegalia se estabelece. O agravamento do caso pode acarretar desconforto respiratório agudo, derrame pericárdico, miocardite, endocardite, delírio, convulsões, coma e falência múltipla de órgãos.1,9,25
Após cerca de dois meses da fase febril aguda (que pode não ocorrer, sobretudo em nativos da região endêmica), aparece a verruga peruana, uma manifestação cutânea eruptiva constituída de lesões angiomatosas, na maioria das vezes muito semelhantes clínica e histologicamente às lesões de angiomatose bacilar (AB). Essas lesões são papulosas, papulotumorais ou nodulares. Aparecem em surtos, predominantemente na face e nas extremidades, e têm de 0,2 a 4cm de diâmetro. Podem persistir por meses ou até anos e ser acompanhadas de febre, dores ósseas e/ou articulares. A gravidade da erupção é variável e parece não estar relacionada ao tratamento antibiótico prévio. Essa é a fase tecidual da doença de Carrión e é autolimitada.26 Embora não seja fatal, se não tratada, estas lesões persistem como reservatórios do patógeno e como fonte de contágio via vetor. Geralmente é tratada com rifampicina, embora a estreptomicina também seja eficaz e tenha sido a droga de escolha antes de 1975. A verruga peruana não responde ao tratamento com cloranfenicol ou penicilina. Alternativas de tratamento são ciprofloxacina e azitromicina, combinadas com deflazacorte.27 Não deixa cicatrizes, exceto quando as lesões se infectam secundariamente.28,29
Histologicamente, as lesões da verruga peruana mostram proliferação de células endoteliais da vasculatura terminal da derme e subcutâneo. Importante achado é o infiltrado inflamatório, agudo e crônico, mesmo em lesões não ulceradas, que acompanha a presença de B. bacilliformis no interstício e no interior das células endoteliais. As lesões podem ter vasos mais diferenciados e ectásicos, clínica e histologicamente semelhantes ao granuloma piogênico. Atipias celulares podem ser encontradas, especialmente em lesões mais sólidas, com luzes inaparentes e células fusiformes que lembram o sarcoma de Kaposi.30
A B. quintana foi primeiramente associada à febre das trincheiras (FT), caracterizada por episódios febris recorrentes. Atualmente, relatada em andarilhos, alcoólicos e pacientes com AIDS nos Estados Unidos e na Europa, a doença tem sido considerada reemergente e responsável por quadros de bacteremia crônica, endocardite e angiomatose bacilar. Os humanos são os únicos reservatórios conhecidos, e a transmissão entre eles se dá pelo piolho do corpo, razão pela qual esse patógeno está fortemente associado a más condições sanitárias e de higiene pessoal.31 A doença, também conhecida como febre quintana ou dos cinco dias, tem período de incubação de 15 a 25 dias. A FT pode ser desde assintomática até doença grave. Aproximadamente metade dos infectados tem um quadro gripal de instalação abrupta, sem sintomas respiratórios e de curta duração. Pode ocorrer febre alta e prolongada por semanas. Os sintomas sofrem remissão por vários dias e, após esse período assintomático, pode haver exacerbação clínica paroxística três a cinco vezes, ou mais, em aproximadamente um ano.30 Lesões eritematosas, maculopapulares, de até 1cm no tronco ocorremem 80% a 90% dos pacientes.32 Língua saburrosa, enantema conjuntival e dor no aparelho locomotor frequentemente acompanham o quadro.33
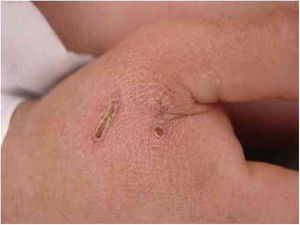
A B. henselae é um agente zoonótico que tem nos gatos domésticos o reservatório principal. A transmissão entre os gatos não se dá na ausência de pulgas, embora a transmissão a humanos seja frequentemente associada à arranhadura dos gatos. A figura 1 mostra a arranhadura de gato apresentada por um homem de 28 anos, diabético Tipo I, há 3 dias com náuseas e vômitos e há um dia com rebaixamento do nível de consciência. Foi recebido com Glasgow 3 e com sepse de origem desconhecida. Havia duas lesões que sugeriam arranhaduras. A infecção por Bartonella sp. foi detectada por Reação em Cadeia da Polimerase (PCR) convencional para região do Espaço Interno Transcrito (ITS) a partir de amostra sanguínea.
O contato com gatos é relatado como fator de risco para infecção por B. henselae.34 Gatos que vivem em regiões geográficas quentes e úmidas têm um número maior de potenciais vetores e maiores níveis de bacteremia (7%–43%) e de soroprevalência anti‐B. henselae (4%–81%).25,35 Isso sugere que a infecção por Bartonella sp. deva ser mais prevalente em países tropicais em desenvolvimento. Em Campinas, SP, Brasil, 90,2% dos gatos envolvidos no estudo apresentou positividade no teste para presença de DNA da B. henselae no sangue.36
Além dos gatos, outros animais de estimação que já foram descritos como reservatórios são porquinhos da índia, coelhos e cães.37
Os carrapatos foram comprovados como potenciais vetores,37 e o contato com esses artrópodes foi associado à infecção por Bartonella sp. nos doadores de sangue do Hemocentro da Unicamp (Campinas, SP).34
Pacientes imunocompetentes infectados com B. henselae podem desenvolver a doença da arranhadura do gato (DAG), que é caracterizada por uma linfadenite regional autolimitada associada à febre.
Para Bass et al.,38 em sua revisão, a incidência da DAG é proporcional à densidade da população de gatos, à idade deles e à exposição dos humanos a esses animais. Os autores também relacionam a incidência da doença à prevalência e ao grau da infestação por pulgas, Ctenocephalides felis, a climas quentes e úmidos, relacionados com posição geográfica e sazonalidade, reforçando que a doença seja mais prevalente em regiões tropicais.
A linfadenite é precedida da lesão primária, de poucos dias até várias semanas após a arranhadura ou mordedura do gato, supostamente pela exposição dérmica às bactérias presentes nas fezes das pulgas dos felinos. Esta se caracteriza por uma pápula eritematosa, não pruriginosa, no local do trauma ou numa extremidade deste, quando se trata de arranhadura. Em dois a três dias torna‐se vesiculosa e crostosa, permanecendo por alguns dias, involuindo para uma mácula que pode ter de dois a três meses de duração. A lesão persiste por 7–21 dias ou mesmo permanece durante a linfonodomegalia. Raras vezes, a lesão cutânea é a única expressão clínica, mesmo havendo antecedente da arranhadura ou mordedura. A presença da lesão de inoculação deve ser exaustivamente procurada na história e no exame físico, pois o índice de encontro da lesão primária pode chegar a mais de 90%.25 Após esse período pode haver uma cicatriz superficial, lembrando a cicatriz deixada pela varicela. Seu tamanho é de poucos milímetros a 1 cm de diâmetro.30
A histopatologia das lesões cutâneas simula a dos linfonodos, constituindo‐se de formação de granulomas com área necrótica central, circundadas por linfócitos e histiócitos e com infiltrado neutrofílico. O pus pode estar loculado, o que tem importância durante a aspiração. Difere das demais doenças granulomatosas porque nessas não é comum o encontro de microabcessos e granulomas concomitantemente.39 Os achados histopatológicos em linfonodos podem ser confundidos com aqueles encontrados na doença de Hodgkin, inclusive com células semelhantes às de Reed‐Stenberg.40 Podem ser observados microabscessos onde clusters bacterianos podem ser identificados pela coloração de Warthin‐Starry, sobretudo nas lesões mais novas.26
Púrpura, embora rara, pode ser grave.41 Exantema maculopapular, eritema multiforme e eritema nodoso são para Warwick42 as expressões cutâneas que acompanham a DAG. Para esse autor, o eritema nodoso é o mais frequente deles, no que concorda Carithers,43 que não considera uma surpresa essa associação, já que o eritema nodoso aparece no curso de outras doenças granulomatosas, como tuberculose e sarcoidose. Eritema nodoso pode acontecer associado a quadros típicos, mas usualmente acontece acompanhando linfonodomegalia difusa e não regional.44
A B. henselae também causa um amplo espectro de condições clínicas, como febre de origem indeterminada, manifestações esplênicas e hepáticas, encefalopatias, doenças oculares, endocardites, dentre outras.1
Pacientes infectados por B. quintana ou B. henselae, especialmente aqueles imunodeficientes, podem desenvolver angiomatose bacilar, que é caracterizada por lesões angioproliferativas.21 Especificamente nos casos de infecção por B. henselae, estas lesões podem também ser associadas à peliose, uma rara condição caracterizada por pequenos espaços císticos preenchidos com sangue presentes no fígado, frequentemente diagnosticada apenas por biópsia, podendo causar insuficiência ou ruptura hepática e até mesmo ser fatal.21,45 A peliose bacilar pode acometer também outros órgãos.46
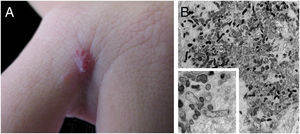
Lesões cutâneas são a principal manifestação da angiomatose bacilar, mas a doença pode acontecer sem comprometer a pele em até 45% dos casos.47 Podem ser lesões solitárias; no entanto, mais frequentemente, são múltiplas e dispersas pelo corpo. Podem ser pápulas, placas, tumores angiomatosos, raramente hiperqueratóticos, ou nódulos com superfície normocrômica. Colarete descamativo da base da lesão é característico. São semelhantes ao granuloma piogênico. Friáveis, podem sangrar fácil e abundantemente. A apresentação como placas enduradas e hiperpigmentadas é menos frequente. Há descrições de comprometimento de mucosa oral, anal, conjuntival, gastrintestinal, genital feminina e de vias aéreas. A AB pode ser acompanhada por doença visceral disseminada tanto em imunodeficientes quanto em imunocompetentes.38,48,49 A figura 2 mostra o caso de lesão angiomatosa única no terceiro interdígito da mão direita de uma mulher de 26 anos, com febre, candidíase oral e emagrecimento há 2 meses. A sorologia anti‐HIV foi reagente. O exame anátomo‐patológico foi compatível com angiomatose bacilar e à coloração de Warthin‐Starry observaram‐se clumps bacterianos. Bacilos Gram‐negativos foram observados por microscopia eletrônica de transmissão de fragmento cutâneo.
O diagnóstico diferencial com sarcoma de Kaposi pode ser clinicamente impossível, sobretudo com lesões sarcomatosas recentes. As duas doenças podem coexistir. Quaisquer outras lesões angiomatosas fazem diagnóstico diferencial.26,30
Histologicamente são expressas por três características principais: 1) Angioproliferação disposta em lóbulos, com vasos formados por células endoteliais proeminentes; em áreas de celularidade mais densa, podem ser observadas atipias e mitoses; 2) Predomínio de neutrófilos no infiltrado celular e ocasional leucocitoclasia; 3) Presença de clumps bacterianos intersticial ou intracelular encontrados à coloração de Warthin‐Starry, imuno‐histoquímica, à microscopia eletrônica de transmissão ou microscopia confocal.26,30,50
Foi aventado que a diferença entre a resposta angiogênica e granulomatosa, observadas na AB e na DAG, respectivamente, parece ser determinada pelo grau de imunocompetência do hospedeiro.51,52 A concomitância de lesões com características clínico‐patológicas da DAG e da AB, também relatada após o uso de corticosteroides, com a demonstração de um mesmo agente, colabora com a essa interpretação.53
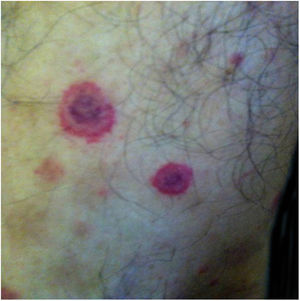
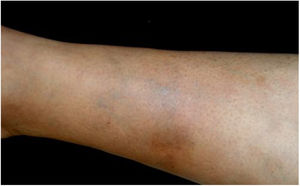
As Bartonella spp. podem causar bacteremia cíclica assintomática em humanos e animais. Essa infecção crônica pode resultar potencialmente em endocardite e ser fatal.1 Cerca de 31% das endocardites são cultura‐negativa e, dessas, até 30% são causadas por Bartonella spp.20 Seis espécies de Bartonella foram associadas à endocardite, mas 95% das endocardites por esses agentes são causadas por B. quintana ou B. henselae.54 Vasculites podem acontecer e, inclusive, simular quadros de vasculite sistêmica com positividade de ANCA (anticorpo anticitoplasma de neutrófilos) (fig. 3).55 A figura 3 mostra um caso de vasculite cutânea apresentada por um homem branco de 42 anos, com antecedente de arranhadura de gato e febre há 2 meses. As lesões cutâneas apareceram nas pernas duas semanas antes. O diagnóstico de endocardite por Bartonella henselae foi confirmado por sorologia, PCR e cultura.
A B. henselae pode causar inflamação hepática inespecífica e crônica em adultos e crianças. Também pode ser responsável por angiomatose e peliose bacilar no fígado, além de hepatite granulomatosa, com ou sem necrose. As Bartonella spp. não são incluídas em diretrizes para triagem de hepatites criptogênicas e é possível que parte dos 40% de casos de hepatite de novo que ocorrem depois de transplante hepático estejam relacionados a infecção por essas bactérias.56
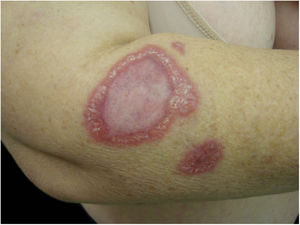
Muitas vezes identificadas como expressão clínica de DAG atípica, formas não clássicas da doença devem ser consideradas separadamente. Exantema morbiliforme, urticária, eritema marginado, granuloma anular, vasculite leucocitoclástica32,41 são descritos. A figura 4 mostra um caso de granuloma anular apresentado por mulher de 52 anos que referia lesão semelhante à da imagem no local de uma arranhadura de gato no antebraço esquerdo sete anos antes. As lesões se disseminaram. Apresentava mialgia e artralgia intensas que dificultavam a deambulação. Na tomografia torácica e abdominal havia linfonodomegalia múltipla mediastinal e retroperitoneal. Estava em uso de deflazacorte 7,5 mg/d, metotrexato 15 mg/semana e hidroxicloroquina 400 mg/d há 2 anos com diagnóstico de sarcoidose. O exame anatomopatológico da pele era compatível com granuloma anular. O DNA de B. henselae foi amplificado em fragmento de linfonodo mediastinal e no sangue da paciente.
Paniculite piogranulomatosa foi descrita em um cão cujo dono tinha lesões semelhantes. Ambos melhoraram com tratamento para infecção por Bartonella sp.57 Os autores acompanharam uma mulher de 32 anos, com paniculite esclerosante com reação granulomatosa à histologia na perna direita e história de anemia recorrente de origem desconhecida, dependente de corticosteroide há 4 anos. Apresentou microscopia eletrônica com bactérias Gram‐negativas dentro de um eritrócito. Teve boa evolução com tratamento com eritromicina. Com a suspensão do antibiótico após seis semanas, as lesões recorreram e não responderam mais à antibioterapia. A paciente teve posteriormente pesquisa do DNA de B. henselae positiva em amostra sanguínea (fig. 5).
As manifestações cutâneas podem aparecer associadas ou não à manifestação granulomatosa do fígado, baço, coração, ossos e linfonodos mesentéricos e/ou mediastinais.30
Um crescente número de possíveis manifestações parainfecciosas ou pós‐infecciosas imunes têm sido descritas em associação com a infecção por Bartonella spp.41 Considerando o amplo espectro da infecção e as potenciais complicações associadas às Bartonella spp., a infecção deveria ser considerada pelos médicos com mais frequência entre diagnósticos diferenciais de condições idiopáticas. Na tabela 1 estão são listadas condições que deveriam incluir a infecção por Bartonella sp. como diagnóstico diferencial.
Manifestações idiopáticas potencialmente associadas à infecção por Bartonella spp
| Febre prolongada |
| Anemia recorrente ou grave |
| Hepatite |
| Serosite |
| Linfonodopatia crônica |
| Fadiga crônica |
| Uveíte |
| Retinite |
| Neurite |
| Exantema maculopapuloso febril |
| Púrpura |
| Urticária |
| Eritema nodoso |
| Eritema multiforme |
| Eritema marginado |
| Granuloma anular |
| Vasculites leucocitoclásticas |
| Reações granulomatosas |
| Reações angioproliferativas |
Uma vez que as Bartonella spp. podem causar infecção assintomática, a extensão da infecção pode estar sendo subestimada. A soroprevalência global para Bartonella sp. em humanos varia de 1,5% a 77,5%.58 Em estudo com 437 pacientes saudáveis da zona rural do Brasil, em Piau (MG), a soroprevalência foi de 12,8% para B. quintana e 13,7% para B. henselae.59 Em outro estudo, realizado com 125 doadores de sangue no Rio de Janeiro (RJ), 43 (34,4%) foram soropositivos para B. henselae.13
Hospedeiros assintomáticos com infecção eritrocitária podem doar sangue. Em um estudo recente com 500 doadores de sangue de Campinas (SP), anticorpos anti‐B. quintana e B. henselae foram detectados em 32,0% (136/500) e 16,2% (78/500) dos doadores, respectivamente. O mesmo estudo encontrou 3,2% dos doadores de sangue com infecção sanguínea para Bartonella spp. e em 1,2% deles a bacteremia por B. henselae foi documentada com isolados obtidos a partir do sangue doado.3
A transfusão de sangue representa um risco potencial para transmitir essas bactérias. Gatos foram experimentalmente infectados com B. henselae e Bartonella clarridgeiae por inoculação intravenosa e intramuscular com sangue de gatos conhecidamente infectados.60 Além da transmissão em gatos, a transmissão transfusional foi documentada em camundongos imunocompetentes.7 Um estudo que usou microscopia eletrônica de transmissão e cultura documentou a capacidade de a B. henselae sobreviver em sangue estocado a 4°C por 35 dias.61 Existem dois relatos de transmissão da infecção a humanos por punctura percutânea acidental com sangue contaminado.62,63 A real prevalência global entre doadores de sangue não é conhecida, e uma triagem do sangue doado não é rotineiramente feito para esses patógenos.
Diagnóstico laboratorialNão existe um diagnóstico laboratorial padrão ouro para as infecções causadas por Bartonella spp. É cada vez mais claro que nenhum método diagnóstico disponível atualmente confirmará a infecção com Bartonella sp. em todos os pacientes imunocompetentes infectados, uma vez que esse grupo apresenta baixa bacteremia, o que dificulta ainda mais a detecção.19 Essa dificuldade do diagnóstico laboratorial é outro fator que contribui para a negligência em relação a esse patógeno. Hoje é evidente a necessidade de combinação de várias técnicas para diminuir resultados falso‐negativos.3,64 Os diagnósticos laboratoriais mais utilizados são sorologia por imunofluorescência indireta (IFI), cultura ou PCR.65–67
A IFI é o método diagnóstico mais utilizado por causa de sua simplicidade. Entretanto, os métodos imunológicos apresentam algumas limitações, como a reação cruzada entre as espécies e com diversos patógenos, o que acarretaria falso‐positivos. A possibilidade de falso‐negativos também existe, uma vez que os antígenos de kits comerciais são restritos a poucas espécies.68,69 Outros fatores que devem ser considerados são a heterogeneidade entre as cepas e genótipos de Bartonella spp., as diferenças de parâmetros de análise entre laboratórios e a subjetividade das leituras dos resultados de IFA. Vários trabalhos demonstram que não há correlação entre PCR e sorologia positiva.64 Em geral, o teste sorológico não deve ser utilizado como única ferramenta diagnóstica e, em caso de positividade, deve ser interpretado apenas como uma exposição anterior à Bartonella sp. O teste sorológico deve ser utilizado em conjunto com outras técnicas, como cultura e PCR, para garantir a fidelidade do diagnóstico.70
O uso de técnicas microbiológicas convencionais para detectar e isolar as Bartonella spp. é pouco eficiente devido à natureza fastidiosa dessas bactérias, ao baixo número de bactérias circulantes em organismos infectados e à bacteremia cíclica. O isolamento requer um longo tempo de incubação (de seis a oito semanas) e condições especiais de crescimento (meios de cultura especiais, enriquecidos com sangue além de 35°C, em atmosfera saturada de água e contendo 5% de CO2).35,71,72 Raramente se obtém sucesso no isolamento primário em hospedeiros não reservatórios e/ou imunocompetentes, assim como em humanos com DAG.71–74 A cultura líquida de Bartonella spp. aumenta a sensibilidade de detecção da infecção por essas bactérias por métodos moleculares.72,73,75
Não existe um consenso sobre os melhores primers e condições a serem usadas na PCR para detecção de DNA de Bartonella. Além dos primers que determinam a região a ser amplificada e, portanto, a sensibilidade da reação, a técnica da PCR escolhida também influencia no sucesso do diagnóstico. A PCR de dupla amplificação pode aumentar muito a sensibilidade da detecção, assim como a PCR em tempo real.35,67,75,76 As vantagens dos métodos diagnósticos moleculares, como a PCR, são a rapidez do resultado e a possibilidade de identificação da espécie causadora da infecção.77 Por outro lado, existem limitações como a possibilidade de resultados falso‐positivos (por contaminação de amostras anteriormente positivas) ou resultados falso‐negativos (por terem quantidade de DNA inferior ao limite de detecção). Além disso, encontrar o DNA do patógeno na amostra não prediz, com garantia total, uma infecção ativa.78,79
A histologia não é frequentemente utilizada como método diagnóstico, mas pode ter grande utilidade para casos de angiomatose bacilar, verruga peruana e DAG ou quando há comprometimento tecidual, mesmo que extracutâneo. Os achados histopatológicos cutâneos foram descritos anteriormente.
TerapêuticaNão existe esquema terapêutico que garanta a erradicação das bartonelas do organismo. Isso pode ser mais facilmente demonstrado pelo aparecimento de verruga peruana mesmo em pacientes tratados com antibióticos durante a febre de Oroya. Por outro lado, o tratamento antimicrobiano não altera a taxa de cura em pacientes com linfadenomegalia causada por Bartonella spp.80
Como não existem revisões sistemáticas sobre o assunto, as decisões de tratamento são baseadas em relatos de casos que testam um número limitado de pacientes. Pacientes com doença sistêmica causada por Bartonella spp. devem ser tratados com gentamicina e doxiciclina, mas cloranfenicol tem sido proposto para o tratamento no caso de bacteremia causada por B. bacilliformis (doença de Carrión). A gentamicina em combinação com doxiciclina é considerada o melhor tratamento para endocardite e FT, e a rifampicina ou a estreptomicina podem ser também usadas para tratar a verruga peruana.5 A eritromicina é o antibiótico de escolha nos casos de AB e peliose hepática e deve ser administrado por no mínimo dois meses.1
PrevençãoComo mencionado previamente, o contato com gatos é o maior fator de risco para a transmissão da DAG e outras bartoneloses. Infestações por pulgas, livre acesso à rua e ambientes com muitos gatos são fatores que aumentam a possibilidade de infecção dos felinos. Os proprietários de gatos devem, portanto, evitar a infestação por pulgas, mantê‐los dentro de casa e afastados de gatos sem domicílio. O Conselho Consultivo Europeu sobre Doenças do Gato sugere que pessoas imunodeficientes adotem gatos com mais de um ano, sem pulgas, em boa saúde, e que não sejam provenientes de abrigos ou casas com múltiplos gatos.81 Para prevenir a FT, as pessoas devem evitar o contato com piolhos do corpo e melhorar os hábitos de higiene pessoal. A doença de Carrión pode ser prevenida pelo uso de repelentes e de roupas que protejam da picada de flebótomos nas áreas onde a doença é endêmica.82
Além desses métodos preventivos relevantes, a divulgação de informação sobre a infecção por Bartonella sp. à população médica e à comunidade em geral é necessária para evitar a ocorrência de bartoneloses. Negligenciar a doença certamente contribui para a disseminação da infecção e de casos não tratados adequadamente ao redor do mundo.
ConclusãoAs bartoneloses são associadas a um amplo espectro de sintomas, condições debilitantes e desfecho potencialmente fatal. Ectoparasitas são envolvidos na transmissão das Bartonella sp. Essas doenças são frequentemente negligenciadas por profissionais da saúde e pesquisadores. A infecção pode ser assintomática e pode ter um potencial impacto na morbidade, por exemplo, em pacientes com hanseníase (como desencadeantes de reações hansênicas do tipo 2), pacientes com anemia falciforme (associado a crises dolorosas por vaso‐oclusão) e hepatite ou cirrose criptogênica. O diagnóstico é desafiador porque os médicos não consideram a possibilidade de bartoneloses e, quando isso acontece, há limitações técnico‐laboratoriais para um diagnóstico conclusivo. Deveria haver incentivo para mais pesquisas relacionadas à infecção por Bartonella spp. Há limitados recursos para a pesquisa por esses agentes, uma vez que as bartoneloses não constam nem mesmo da lista de doenças negligenciadas da Organização Mundial da Saúde.83 Mas essas doenças possivelmente podem ser controladas, prevenidas e até mesmo erradicadas usando medidas factíveis e efetivas.
Suporte financeiroBolsa de doutorado CNPq 159717/2013‐2 (Drummond, MR); Bolsa produtividade CNPq 301900/2015‐9 (Velho, PENF).
Contribuição dos autoresKarina de Almeida Lins: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Marina Rovani Drummond: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Paulo Eduardo Neves Ferreira Velho: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Lins KA, Drummond MR, Velho PENF. Cutaneous manifestations of bartonellosis. An Bras Dermatol. 2019;94:594–602.
Trabalho realizado no Laboratório de Pesquisa Aplicada em Dermatologia e Infecção por Bartonella, Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.